淀粉酶变体的制作方法
本发明涉及淀粉酶领域,特别是α-淀粉酶,以及包含该淀粉酶的组合物。本发明还描述了用于生产该淀粉酶的手段和方法,以及淀粉酶和含淀粉酶组合物的用途,例如用于清洁含淀粉污渍、纺织品脱浆、淀粉液化和糖化、烘焙和酿造。本发明还公开了用于在发酵、淀粉酶或含淀粉酶制剂的配制和储存期间增加淀粉酶纯度的手段。
背景技术:
淀粉是直链淀粉和支链淀粉的混合物,其中直链淀粉由α-1-4连接的葡萄糖组成,支链淀粉包含α-1-4连接的葡萄糖和α-1-6连接的葡萄糖。淀粉酶催化直链淀粉、支链淀粉、糖原和相关多糖中的糖苷键的断裂。具体地,α-淀粉酶催化随机(1-4)-α-D-葡萄糖苷键的水解断裂。它们属于CAZY分类的糖基羟化酶家族13。
淀粉酶,特别是α-淀粉酶,已经用于不同的目的,包括清洁含淀粉污渍(特别是在衣服洗涤和餐具洗涤中)、纺织品脱浆、淀粉改性、液化和糖化(特别是,用于纸浆和造纸工业中,用于糖浆生产,和用于饲料工业中)、烘焙和酿造。
对于酶的工业应用,产品批次的同质性是重要的。特别是对于其中使酶和酶组合物与人或动物直接接触的那些应用,例如,在清洁组合物和食品或饲料生产中,必须采用严格的质量控制标准。这种质量控制的一个目的是确定组合物中没有意外包含有害物质。理想地,酶组合物不应包含相应酶的降解形式,该降解形式例如可影响酶的底物特异性或导致沉淀。另一个目的是,确定在质量控制中分析的酶制剂可以代表待出售的整个批次。此外,必须确立酶组合物中的酶从质量控制采样到销售给客户和/或最终使用的这段时间中是否改变以及如何改变。
现在已经发现,市售淀粉酶的同质性在很大范围上是不足的。特别地,已意外地发现,作为仅包含一种酶(即通过SDS-PAGE确定的一种淀粉酶)的商业组合物出售的产品(例如或),通常包含几种可通过等电聚焦或离子交换色谱法分离的多肽(本文也称为“亲本淀粉酶”和“幽灵(ghost)”/“幽灵(ghosts)”)。
考虑到蛋白质测序是麻烦且昂贵的,通常仅基于编码待产生的多肽的核酸序列预测多肽(包括酶)的确切氨基酸序列。然而,从上述发现——声称的纯酶组合物(即仅包含一种多肽的组合物)实际上包含几种多肽,必然得出结论:所出售的组合物包含了显著量的具有未知的一级、二级和三级结构的多肽。因此,除非对组合物中的所有淀粉酶种类进行完全的蛋白质测序(通常这是不进行的),否则目前不可能提供足够的信息以使淀粉酶制造商或其客户完成适当的自由实施(FTO)分析。
技术实现要素:
本发明的一个总体目的是,缓解、减少或消除上述问题。特别地,本发明的一个目的是,提供用于改善包含一种或多种淀粉酶、特别是一种或多种α-淀粉酶的组合物(本文也称为“淀粉酶组合物”)的同质性的手段和方法。此外,本发明的一个目的是,提供具有改善的多肽同质性的组合物。
根据本发明,提供淀粉酶变体,其中,与使用相应的野生型淀粉酶(或更一般地,不包含如本文所述的两个或更多个取代的相应淀粉酶)制备的组合物相比,所述变体促进具有增加的同质性的淀粉酶组合物的产生。
特别地,根据本发明,淀粉酶变体优选与SEQ ID NO:1具有至少65%的序列同一性,并且与SEQ ID NO:1相比具有两个或更多个取代的不同,其中所述两个或更多个取代独立地选自以下组:
i)根据SEQ ID NO:1的编号中位置:
3,475,314,
6,95,195,
423,
150,226,255,418,
22,106,285,484,
ii)4,476,315,
7,96,196,
424,
151,227,256,419,
23,107,286,485,
其中,组i)的取代选自A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中的任何取代,优选选自A,G,K,R,S,T中的任何取代,且
其中,组ii)的取代选自F,Y,L,I,W,R,E,M中的任何取代。
本发明还提供淀粉酶组合物,其与包含如本文所定义的相应亲本淀粉酶的相应淀粉酶组合物相比,具有减少的形成本文定义的幽灵多肽的倾向。
此外,本发明提供淀粉酶组合物,其与包含如本文所定义的相应亲本淀粉酶的相应淀粉酶组合物相比,具有减少的形成异天冬氨酸(下文中“isoAsp”或“J”)和/或异谷氨酸的倾向。
根据本发明提供的淀粉酶组合物优选选自清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物和纸浆处理组合物。
此外,本发明提供制备淀粉酶组合物的方法,所述淀粉酶组合物与包含相应亲本淀粉酶的相应淀粉酶组合物相比具有增加的同质性。
此外,本发明提供用于分析淀粉酶组合物质量的方法,优选用于确定淀粉酶组合物批次的同质性的方法。
在发明详述部分、实施例、附图、序列和权利要求中描述了本发明的其它方面。
序列简述
SEQ ID NO:1 芽孢杆菌属物种(Bacillus sp.)A 7-7(DSM 12368)的α-淀粉酶的成熟部分。
SEQ ID NO:2 S707(成熟部分)Uniprot ID P19571
SEQ ID NO:3 LAMY(成熟部分)Uniprot ID O82839
SEQ ID NO:4 US8017351的序列SEQ ID NO:3
SEQ ID NO:5 US7713723的序列SEQ ID NO:8
SEQ ID NO:6 US7629158的序列SEQ ID NO:1
附图说明
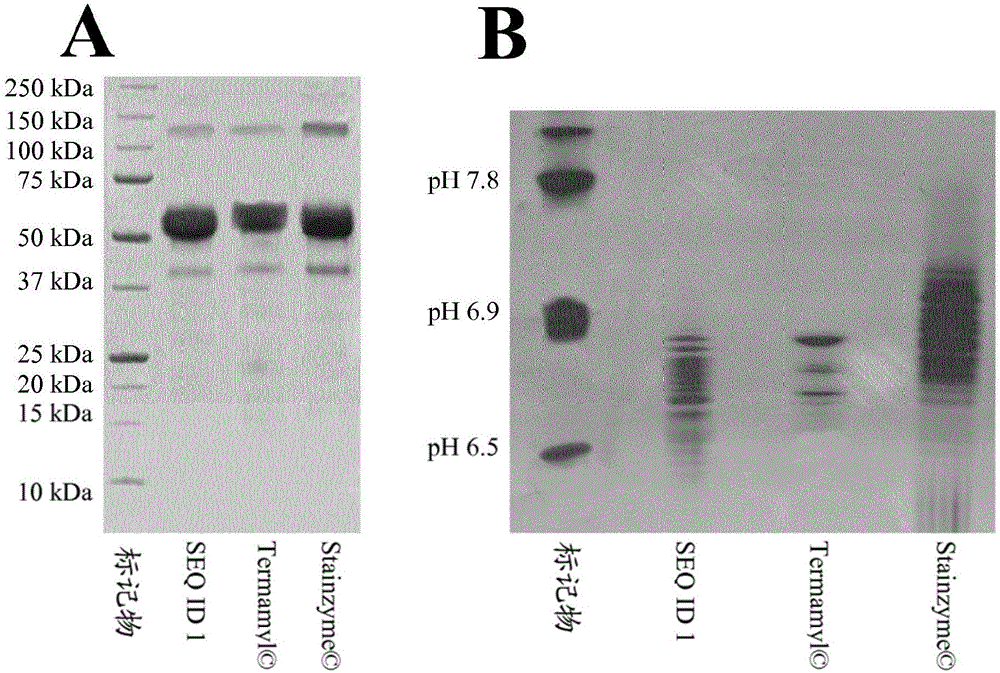
图1α-淀粉酶的SDS-PAGE(A)和等电聚焦(B)。总蛋白质上样量在SDS-PAGE上为每种α-淀粉酶各约40μg,在等电聚焦凝胶上为每种α-淀粉酶各约65μg。
图2通过阳离子交换色谱法(Protein-Pak Hi Res CM,Waters)对纯化的α-淀粉酶进行色谱分离。A:SEQ ID NO:1;B,C:上述商业淀粉酶。在发明详述的“方法”部分中描述的α-淀粉酶储备溶液用缓冲液A按1:5稀释。注射体积为50μl(等于约25-100μg的总蛋白质注射量)。起始缓冲液(A):MES 25mM pH 5.4;洗脱缓冲液(B):MES 25mM pH 5.4+0.5M NaCl。用线性梯度5-32%B在22分钟内以1ml/分钟的流速进行洗脱。
图3通过阳离子交换色谱法(Protein Pak SP 8HR,waters)制备性分离α-淀粉酶SEQ ID NO:1。如橙色所示,收集五个级分F1-F5。将总量为3mg的蛋白质上样到柱上。起始缓冲液(A):25mM MES pH 5.4;洗脱缓冲液:25mM MES pH 5.4+0.5M NaCl。用线性梯度0-40%B在40分钟内进行洗脱。
图4离子交换色谱上制备性分离获得的SEQ ID NO:1级分(如图3所示)的等电聚焦。所有样品调整至相同的蛋白质浓度(Bradford)。将含有35μg总蛋白的25μl上样到泳道A上,将含有12.5μg总蛋白的25μl上样到所有其它泳道上。F1-F5=来自图3的级分1-5,A=未处理的SEQ ID NO:1,M=标记物。SEQ ID NO:1的理论pI计算为6.61。
图5离子交换色谱上制备性分离获得的SEQ ID NO:1级分的α-淀粉酶比活性,通过发明详述的“方法”部分中描述的EPS测定法测定。测量的活性除以相应样品的浓度(通过280nm吸光度估算)以获得比活性。将样品活性相对于级分5的活性标准化。进行五次重复。误差条显示标准偏差。
图6在阳离子交换物(Protein-Pak Hi Res CM,Waters)上观察到的,由强制降解诱导的α-淀粉酶SEQ ID NO:1的保留时间迁移。来自图2的级分5在37℃在25mM磷酸盐缓冲液pH 8.0中孵育。在不同时间点进行色谱。将20μl孵育的样品用80μl缓冲液A稀释。注射体积为50μl。用线性梯度5-32%B在22分钟内以1ml/分钟的流速进行洗脱。
图7强制降解诱导的SEQ ID NO:1在等电聚焦中的电荷迁移。将所有样品调整至相同的蛋白质浓度(Bradford)。将含有50μg总蛋白质的15μl上样至泳道A上,将含有25μg总蛋白质的15μl上样至所有其它泳道上。A=未处理的SEQ ID NO:1,M=标记物。
图8强制降解诱导的在等电聚焦中的电荷迁移。将所有样品调整至相同的蛋白质浓度(Bradford)。将含有50μg总蛋白质的15μl上样至样品泳道上。M=标记物。
图9胰蛋白酶消化后α-淀粉酶SEQ ID NO:1的总离子计数色谱图。显示了未处理的级分5(红色)和在20mM磷酸盐缓冲液中在pH 8/37℃孵育145小时后的级分5(蓝色)。除了受胁迫样品中N-末端肽(m=3220.29Da)的完全缺失和降解样品中m+1N-末端肽(m=3221.28Da)的增加之外,两个样品的色谱图看起来相同。
图10描述可根据本发明被取代的SEQ ID NO:1中的位置。
图11 SEQ ID NO:1-4的比对。
图11a SEQ ID NO:1-6的比对。
图12-15优选的淀粉酶序列的比对,其中每个X根据相应的上组i)或ii)彼此独立地选择。即,当X替代根据SEQ ID NO:1的N时,X选自A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中的任何,优选选自A,G,K,R,S,T中的任何,当X替代对应于组ii)的根据SEQ ID NO:1的位置上的氨基酸时,X选自F,Y,L,I,W,R,E,M中的任何。
发明详述
现已发现,淀粉酶的自发性脱酰胺化是造成淀粉酶组合物非同质性的原因之一或主要原因,其在发酵和发酵后纯化加工及淀粉酶的配制中已经发生。
该发现是令人惊讶的,因为迄今为止脱酰胺化仅被认为是在高于60℃的温度下影响淀粉酶稳定性的因素;迄今为止脱酰胺化未被认为对淀粉酶组合物的批次同质性有影响,也没有设想过在通常的发酵和发酵后加工条件期间脱酰胺化可能显著发生。例如,Tomazic等人(J Biol.Chem 1988,3093-3096)在比较60℃和95℃下解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和地衣芽孢杆菌(Bacillus licheniformis)淀粉酶的稳定性后,得出结论:脱酰胺化很可能导致淀粉酶不可逆的热失活。同样,Declerck等人(J Mol.Biol.2000,1041-1057)讨论了通过单氨基酸取代增加地衣芽孢杆菌淀粉酶的热稳定性,即其在80℃、pH 5.6在0.1mM CaCl 2中的半衰期。这些作者发现,增加淀粉酶与野生型形式(RS大于或等于3)相比的热稳定性的三个取代,所述取代在SEQ ID NO:1的编号中在位置135、195和214,其中在位置195的天冬酰胺被苯丙氨酸替代可以增加热稳定性。再次,这些作者没有讨论过淀粉酶批次的同质性,也没有讨论过在低于60℃温度下脱酰胺化的发生。芽孢杆菌属物种KR-8104α-淀粉酶的热稳定性已经被Rahimzadeh等人(Int J Biol Macromol 2012,1175-1182)讨论过;作者分析了所述淀粉酶及其变体在65℃和70℃的稳定性。作者没有调查或讨论过淀粉酶批次同质性,也没有调查或讨论过在低于60℃的温度下脱酰胺化的发生。因此,上述文献没有向技术人员提供如何改善淀粉酶批次同质性的教导。它们也没有提示过,脱氨作用可能有助于批次的非同质性,或者在低于60℃的温度下脱氨作用也会显著发生。相反,这些文献导致本领域技术人员相信脱酰胺化是仅在高于60℃的温度下相关的问题。由于典型的发酵和发酵后纯化和配制工艺在37℃的温度下进行,并且由于本领域技术人员通常会避免较高的温度以最小化随机变性和由此的热失活,故本领域技术人员没有理由担心在发酵、纯化和/或淀粉酶配制期间的脱酰胺化可能是比随机变性过程具更大影响的翻译后淀粉酶修饰因素。因此,上述文献有效地导致了本领域技术人员自本发明的偏离。重要的是注意,脱酰胺化不一定与淀粉酶活性的总体丧失相关。
此外,专利文献似乎也没有改善淀粉酶批次同质性的任何提示。相反,专利文献描述了,为改善期望性状,主要是洗涤性能和抑制聚集物形成,针对特定淀粉酶的各取代、插入或缺失,如WO2006037483和WO2013063460所示例。这些文献没有讨论过脱酰胺过程(特别是在低于60℃的温度下的脱酰胺过程),使得无法推断对其中公开的各个突变应该或甚至可能如何组合来防止在淀粉酶的发酵、纯化和配制期间的脱酰胺化。尤其是,本领域技术人员不得不考虑,在淀粉酶的一级结构中的一个位置上的突变可能意想不到地降低在一级结构中的其他位置上的突变的自由度。因此,本领域技术人员通常不愿意随意组合各个突变,因为他通常将不得不在体外检查组合突变的结果是否确实具有期望的效果并且不导致不期望的作用,特别是酶活性的丧失或降低。
根据本发明,因此提供了淀粉酶变体,与使用相应的亲本淀粉酶制备的组合物相比,所述变体有利于产生具有增加的淀粉酶同质性的淀粉酶组合物。
对于本发明的目的,淀粉酶被认为是催化淀粉水解成糖的酶,而α-淀粉酶被认为是能够水解随机(1-4)-α-D-葡萄糖苷键的酶。除非特别说明,术语“淀粉酶”和“α-淀粉酶”在本文中可互换使用。根据本发明,不能进行这种催化的多肽不被认为是淀粉酶和/或α-淀粉酶。特别地,不能进行上述催化的淀粉酶和α-淀粉酶的降解产物不被认为是淀粉酶或α-淀粉酶。
在本发明的上下文中,组合物的“幽灵”或“幽灵多肽”是由最初添加到组合物中的相应“亲本”淀粉酶或α-淀粉酶在脱酰胺后产生的多肽。特别地,掺入isoAsp的多肽在本发明的上下文中被认为是幽灵。应当注意,将一个多肽称为“幽灵”与其淀粉酶或α-淀粉酶催化活性无关。
根据本发明,淀粉酶组合物同质性(也称为淀粉酶批次同质性)测量为幽灵与其相应亲本淀粉酶的摩尔比。
为本发明目的,当提及氨基酸序列同一性、氨基酸序列的比对或编号时,是指Needleman-Wunsch的比对和评分算法。该比对和评分使用BLOSUM50矩阵、空位开放罚分12、空位延伸罚分2进行。氨基酸序列同一性的百分比优选计算为,成对比对后相同氨基酸的数目除以通过比对获得的氨基酸对的总数;氨基酸序列相似性优选计算为,具有大于0的BLOSUM50矩阵得分的比对后氨基酸对的数目除以通过该比对获得的氨基酸对的总数。优选,使用由Campanella等人,BMC Bioinformatics 2003,doi:10.1186/1471-2105-4-29描述的MatGAT v2.0程序,计算比对和得分(同一性和相似性)。在图11、11a、12-15中显示了不同的成熟淀粉酶序列的比对。顶部序列总是SEQ ID NO:1,并且根据SEQ ID NO:1中的氨基酸位置进行位置编号。在每个比对中,只明确指出SEQ ID NO:1以外的序列中与SEQ ID NO:1的相应氨基酸不同的那些氨基酸;当氨基酸与SEQ ID NO:1中相应位置上的氨基酸相同时,以点“.”表示该氨基酸相同。相对于SEQ ID NO:1的缺失,每个缺失的氨基酸用“-”表示;相对于SEQ ID NO:1的插入用“-”表示在SEQ ID NO:1的序列中。因此,当例如根据附图SEQ ID NO:1包括字母“YGI---PTH”时,在该位置处根据SEQ ID NO:1的淀粉酶的实际氨基酸序列是“YGIPTH”,而短线“---”表示在该图中至少一个其他序列与SEQ ID NO:1相比在该位置具有三个氨基酸的插入。再有,对于序列SEQ ID NO:5,在图中给出字母“..TKGDSQ”的位置处,SEQ ID NO:5在该位置处的实际淀粉酶序列是“YGTKGDSQ”,这是因为点“..”可以替为SEQ ID NO:1的相应氨基酸“YG”,而SEQ ID NO:5在该实例中的所有其余氨基酸在图中被明确示出;因此这些其余氨基酸不同于图中针对SEQ ID NO:1给出的序列。根据SEQ ID NO:1-4的氨基酸序列也在优先权文件的图11中给出,为了描述与这些序列有关的发明的目的,所述图11和优先权文件的相应描述在此处并入本文。
本发明的淀粉酶通常由核酸编码,所述核酸编码两个或三个蛋白质结构域:负责淀粉酶外排的信号结构域、用于淀粉酶暂时失活的前结构域、和淀粉酶本身。在(信号和)前结构域裂解后,获得生成的成熟淀粉酶(“淀粉酶本身”)。对于本发明的目的,术语淀粉酶或α-淀粉酶是指多肽的成熟形式。在包含前-和/或信号-前-结构域的氨基酸序列与根据本发明的序列给出的成熟淀粉酶比对时,前-和信号-前-结构域的氨基酸用负整数递减编号,如在例如WO2006037484的序列方案部分中举例说明的。
在本发明的框架内,氨基酸和核苷酸通常用其3-字母或1-字母代码表示。
特别地,根据本发明,优选与SEQ ID NO:1具有至少65%序列同一性、并且与SEQ ID NO:1相比具有两个或更多个取代的差异的淀粉酶变体,其中所述两个或更多个取代独立地选自以下组:
i)根据SEQ ID NO:1的编号中的位置:
3,475,314,
6,95,195,
423,
150,226,255,418,
22,106,285,484,
ii)4,476,315,
7,96,196,
424,
151,227,256,419,
23,107,286,485,
其中组i)的每个取代独立地选自A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中的任何取代,优选地选自A,G,K,R,S,T中的任何取代,且
其中组ii)的每个取代独立地选自F,Y,L,I,W,R,E,M中的任何取代。
如上所述,现在已经发现,淀粉酶的脱酰胺化在发酵、纯化和配制过程中也自发地以显著程度发生,在该发酵、纯化和配制过程中含淀粉酶的组合物被避免加热至>45℃的温度,并且通常地加热不超过30分钟,优选小于15分钟,甚至更优选小于8分钟,甚至更优选小于4分钟,最优选完全不发生。因此,本发明提供了手段,特别是淀粉酶,其可以减少在加热含淀粉酶的组合物至40℃温度的4分钟加热期间、优选在8分钟加热期间、更优选在至多15分钟的加热期间、甚至更优选在至多30分钟的加热期间,“幽灵”(脱酰胺化产物)的形成。热处理期间组合物的pH不小于5,优选至多9、更优选至多8.5、甚至更优选至多8、甚至更优选至多7.5、甚至更优选至多7、甚至更优选至多6.5、甚至更优选至多6。
根据本发明还发现,与SEQ ID NO:1具有至少65%序列同一性的淀粉酶,特别易于在SEQ ID NO:1的位置3脱酰胺化。在pH 8和37℃下在20mM水性磷酸盐缓冲液中储存的24小时内,SEQ ID NO:1的纯化淀粉酶以>50%有效地转化为其幽灵(即,位置3脱酰胺)。脱酰胺的幽灵在脱酰胺位置包含isoAsp或天冬氨酸。将isoAsp并入淀粉酶是特别不利的,因为该β氨基酸强烈扭曲淀粉酶的三级结构。在野生型β-片层结构域中,isoAsp可以在脱氨位点处阻止支持β-片层形成所需的直接氢键合,从而改变脱酰胺多肽的表面性质,促进幽灵的聚集和/或幽灵淀粉酶聚集物的形成,以及也在未脱氨的“亲本”淀粉酶中促进构象变化。此外,isoAsp的存在通常牵涉神经退行性疾病和白内障形成中蛋白质聚集体的形成。因此,isoAsp并入多肽是不期望的,特别是对于人或动物与多肽直接接触的应用,特别是在清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物、纸浆处理组合物及其相应的用途中。本发明有利地允许降低淀粉酶中isoAsp和异谷氨酸形成的速率或避免其形成,从而减轻或避免上述问题。
组i)的取代被设计为除去根据SEQ ID NO:1的潜在脱酰胺化位点。在组i)中,第一行潜在取代位置中的取代优于仅涉及第二或以下行中提到位置的取代,第二行中的取代优于仅涉及第三或以下行中提到位置的取代,等等。因此,根据本发明,在位置3、475、314之任何上的取代将优于其中仅组i)的第二或以下行中列出的位置被取代的淀粉酶。
在位置3、475和314的取代组中,在位置3上的根据本发明取代是最优选的。因此,与SEQ ID NO:1相比,根据本发明的淀粉酶变体优选包含如上定义的位置3的取代和至少一个在如上组i)和/或ii)中定义的其它位置上的其它取代。
本发明的淀粉酶优选在其N-末端包含XXXNGTXMQ基序。该基序与SEQ ID NO:1的位置3开始的寡肽对应。因此,所述基序的第4个氨基酸“N”对应于SEQ ID NO:1的第6个氨基酸。优选地,第一个X被A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中的任意替代,优选被A,G,K,R,S,T中的任意替代。因此,优选的基序是:AGTNGTMMQ,DGTNGTMMQ,EGTNGTMMQ,FGTNGTMMQ,GGTNGTMMQ,HGTNGTMMQ,IGTNGTMMQ,KGTNGTMMQ,LGTNGTMMQ,PGTNGTMMQ,RGTNGTMMQ,SGTNGTMMQ,TGTNGTMMQ,VGTNGTMMQ,WGTNGTMMQ,YGTNGTMMQ,其中,AGTNGTMMQ,GGTNGTMMQ,KGTNGTMMQ,RGTNGTMMQ,SGTNGTMMQ,TGTNGTMMQ是特别优选的。由于后述的原因,下面的基序更优选:AGTNGTLMQ,DGTNGTLMQ,EGTNGTLMQ,FGTNGTLMQ,GGTNGTLMQ,HGTNGTLMQ,IGTNGTLMQ,KGTNGTLMQ,LGTNGTLMQ,PGTNGTLMQ,RGTNGTLMQ,SGTNGTLMQ,TGTNGTLMQ,VGTNGTLMQ,WGTNGTLMQ,YGTNGTLMQ,其中,AGTNGTLMQ,GGTNGTLMQ,KGTNGTLMQ,RGTNGTLMQ,SGTNGTLMQ,TGTNGTLMQ甚至更优选。在所有这些基序中,三肽“TNG”可以与“VNG”和“LNG”中的任何交换。
如上所定义的组ii)取代被特别设计以减少位于组ii)所列位置紧前面的任何Asn的脱酰胺化。技术人员理解,根据本发明,通过将组ii)所示位置处SEQ ID NO:1中所遇到的小氨基酸交换为以上针对组ii)描述的氨基酸,可以在空间上阻碍前方Asn的脱酰胺化。因此,在希望保留落入组i)定义中的特定Asn的情况下,应当将相邻的C端氨基酸替代为上文针对组ii)述及的氨基酸之一。
技术人员理解,根据本发明,通过根据组i)的Asn的取代,可以避免脱酰胺化。因此,通常不推荐取代彼此紧邻的两个氨基酸,例如通过根据组i)相关规则的替代实施的氨基酸位置3取代和另外地通过根据组ii)相关规则的替代实施的氨基酸位置4取代。
除了位置3之外,SEQ ID NO:1的另一脱酰胺热点位于SEQ ID NO:1的位置475。因为该Asn通常在α-淀粉酶中是保守的,特别是在与SEQ ID NO:1具有至少80%序列同一性的淀粉酶中是保守的,所以在该位置的Asn可以被取代是特别令人惊讶的。例如,甚至在商业可得淀粉酶或根据Uniprot ID P06278的地衣芽孢杆菌α淀粉酶(“BLA”)中,在SEQ ID NO:1的编号中位置475上的Asn(成熟淀粉酶的位置473)是保守的。然而,通过防止位置3和475的脱酰胺,例如,通过在SEQ ID NO:1的位置3和475、位置4和475、位置3和476、或位置4和476取代,可以消除淀粉酶批次同质性降低的两个最重要的原因。优选地,根据上面给出的组i)的规则,取代位置3和475。还优选与SEQ ID NO:1具有至少80%序列同一性的根据本发明的成熟淀粉酶,其中(a)SEQ ID NO:1位置475上的氨基酸根据组i)的规则取代,即取代为选自A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中任何的氨基酸,优选取代为选自A,G,K,R,S,T中任何的氨基酸,其中优选根据(a)的取代是根据组i)规则的唯一取代,或(b)SEQ ID NO:1位置476上的氨基酸根据组ii)规则取代,即取代为选自F,Y,L,I,W,R,E,M中任何的氨基酸,其中优选根据(b)的取代是根据组ii)规则的唯一取代。因此,本发明允许提供组合物,其包含与SEQ ID NO:1具有至少80%氨基酸序列同一性的成熟淀粉酶,其中所述成熟淀粉酶(即,在根据SEQ ID NO:1的位置475上没有脱酰胺)与包含在根据SEQ ID NO:1的位置475上的脱酰胺化的总淀粉酶的摩尔比是
-至多1:1,
-优选<1:2,
-更优选<1:5,
-最优选地,所述组合物不包含与SEQ ID NO:1具有至少80%序列同一性的成熟淀粉酶的任何幽灵,
其中所述比率是在pH 8和37℃下20mM水性磷酸盐缓冲液中储存24小时后测定的。
较小程度优选,通过根据组i)的位置314上的取代和/或根据组ii)的位置315上的取代,防止SEQ ID NO:1的位置314上的脱酰胺化。再有,位置314上的Asn在α-淀粉酶中通常是保守的,特别是在与SEQ ID NO:1具有至少80%序列同一性的淀粉酶中是保守的,因此,该位置可能易于发生显著的脱酰胺化或可以被取代而通常不干扰淀粉酶活性,是令人惊讶的。然而,通过防止根据SEQ ID NO:1的位置3和315上的脱酰胺化,优选还有根据SEQ ID NO:1的位置475上的脱酰胺化,脱酰胺化的两个主要贡献位点可以被去除。因此,优选根据组i和/或ii)的相应规则,取代SEQ ID NO:1编号中的位置3和314、3和315、4和314、或4和315上的氨基酸。
特别优选的是,去除根据SEQ ID NO:1的位置3、475和314上的所有上述脱氨热点的取代。因此,优选根据组i和/或ii)的相应规则,取代位置3和314和475、4和314和475、3和315和475、4和315和475、3和314和476、4和314和476、3和315和476、或4和315和476上的氨基酸。特别优选的是在位置3和314和475上的三重取代。
其它有益的突变描述于DE102012209289A1中;将该文献以其整体并入本文。根据本发明,除了上述任何取代之外,特别优选地还通过一个或多个以下取代来提供与相应的亲本淀粉酶不同的淀粉酶变体:
根据SEQ ID NO:1的位置5的氨基酸被A取代,和/或
根据SEQ ID NO:1的位置167的氨基酸被R取代,和/或
根据SEQ ID NO:1的位置170的氨基酸被P取代,和/或
根据SEQ ID NO:1的位置177的氨基酸被L取代,和/或
根据SEQ ID NO:1的位置202的氨基酸被L取代,和/或
根据SEQ ID NO:1的位置204的氨基酸被V取代,和/或
根据SEQ ID NO:1的位置271的氨基酸被D取代,和/或
根据SEQ ID NO:1的位置330的氨基酸被D取代,和/或
根据SEQ ID NO:1的位置377的氨基酸被R取代,和/或
根据SEQ ID NO:1的位置385的氨基酸被S取代,和/或
根据SEQ ID NO:1的位置445的氨基酸被Q取代。
优选地,根据DE 10 2012 209 289 A1的第[0028]段中描述的模式(1)至(39)中的任意,进行该进一步的取代,甚至更优选该进一步的取代符合DE 10 2012 209 289 A1的模式(10)、(28)、(31)、(35)、(38)或(39),甚至更优选该进一步的取代符合DE 10 2012 209 289 A1的模式(31)。
进一步有益的突变是:
根据SEQ ID NO:1的位置183和184上的缺失,和
根据SEQ ID NO:1的位置118的氨基酸被K取代,和/或
根据SEQ ID NO:1的位置195的氨基酸被F取代,和/或
根据SEQ ID NO:1的位置320的氨基酸被K取代,和/或
根据SEQ ID NO:1的位置458的氨基酸被K取代。
优选地,该进一步的突变包括根据SEQ ID NO:1的位置183和184上的缺失,和根据SEQ ID NO:1的位置118的氨基酸被K取代,以及根据SEQ ID NO:1的位置195的氨基酸被F取代,和根据SEQ ID NO:1的位置320的氨基酸被K取代,和根据SEQ ID NO:1的位置458的氨基酸被K取代。
在脱酰胺化期间,Asn被Asp和/或isoAsp替代,其中Asp与isoAsp的比率通常约为至少1:2或甚至1:3。因此,除非如本文中所指出的根据本发明去除脱酰胺热点,否则最终的含淀粉酶组合物将含有显著量的不期望的β-氨基酸,特别是isoAsp。根据本发明的上述教导,现在可以提供含有一种或多种淀粉酶的组合物,所述组合物比包含相应的野生型淀粉酶的组合物具有改善的同质性,特别是具有降低的β-氨基酸(特别是isoAs)含量。
根据本发明进行取代的淀粉酶优选与SEQ ID NO:1具有至少67%序列同一性,优选与SEQ ID NO:1具有至少68%序列同一性、更优选与SEQ ID NO:1具有至少74%序列同一性、更优选与SEQ ID NO:1具有至少80%序列同一性、更优选与SEQ ID NO:1具有至少85%序列同一性、更优选与SEQ ID NO:1具有至少87%序列同一性、更优选与SEQ ID NO:1具有至少90%序列同一性、更优选与SEQ ID NO:1具有至少92%序列同一性、更优选与SEQ ID NO:1具有至少94%序列同一性、更优选与SEQ ID NO:1具有至少95%序列同一性、更优选与SEQ ID NO:1具有至少97%序列同一性、更优选与SEQ ID NO:1具有至少99%序列同一性。
优选地,根据本发明的取代的淀粉酶,与根据实施例优选的任何氨基酸序列,具有至少80%序列同一性、优选至少85%序列同一性、更优选至少87%序列同一性、更优选至少90%序列同一性、更优选至少92%序列同一性、更优选至少94%序列同一性、更优选至少95%序列同一性、更优选至少97%序列同一性、更优选至少99%序列同一性。应当理解,对于这些序列,根据本发明的有益取代是保守的。
本发明还提供包含编码根据前述权利要求中任一项的淀粉酶的序列的核酸,并且还提供包含编码根据本发明的淀粉酶的序列的表达盒,其中所述序列可操作地连接于启动子。
本发明还提供包含本文所述的根据本发明的核酸和/或表达盒的重组宿主细胞。
本发明还提供包含一种或多种淀粉酶的酶组合物,其中根据本发明取代的淀粉酶的总量与非根据本发明的淀粉酶的总量的摩尔比是
-至多1:1,
-优选<1:2,
-更优选<1:5,
-最优选地,所述组合物不包含任何非根据本发明的淀粉酶,
其中该比率是在pH 8和37℃下20mM水性磷酸盐缓冲液中储存24小时后测定的。
因此,本发明还提供包含一种或多种淀粉酶的酶组合物,其中总的脱酰胺基淀粉酶与总的未脱酰胺基淀粉酶的摩尔比为
-至多1:1,
-优选<1:2,
-更优选<1:5,
-最优选地,所述组合物不包含任何脱酰胺基淀粉酶,
其中该比率是在pH 8和37℃下20mM水性磷酸盐缓冲液中储存24小时后测定的。
相应地,本发明提供包含一种或多种淀粉酶的酶组合物,其中包含L-isoAsp和D-isoAsp中任何的淀粉酶与不包含L-isoAsp和D-isoAsp中任何的淀粉酶的摩尔比是
-至多1:1,
-优选<1:2,
-更优选<1:5,
-最优选地,所述组合物不包含任何包含L-isoAsp和D-isoAsp中任何的淀粉酶,
其中所述比率是在pH 8和37℃下20mM水性磷酸盐缓冲液中储存24小时后测定的。
如上所述的酶组合物优选是清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物或纸浆处理组合物。
本发明还提供用于改善淀粉酶批次同质性的方法,包括以下步骤:
a)提供与SEQ ID NO:1具有至少65%序列同一性的亲本淀粉酶氨基酸序列,和
b)取代亲本淀粉酶氨基酸序列的至少2个位置,其中所述位置和取代独立地选自以下组:
i)根据SEQ ID NO:1编号中的位置:
3,475,314,
6,95,195,
423,
150,226,255,418,
22,106,285,484,
ii)4,476,315,
7,96,196,
424,
151,227,256,419,
23,107,286,485,
其中组i)的各取代独立地选自A,D,E,F,G,H,I,K,L,P,R,S,T,V,W,Y中的任何,优选地选自A,G,K,R,S,T中的任何,且其中组ii)的各取代独立地选自F,Y,L,I,W,R,E,M中的任何,
c)提供表达具有步骤b)中获得的氨基酸序列的淀粉酶的宿主微生物,
d)使用根据步骤c)的宿主微生物发酵,以表达淀粉酶,和
e)纯化步骤d)中获得的淀粉酶,以及任选地
f)将步骤e)中获得的淀粉酶配制成清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物或纸浆处理组合物。
如上所述,根据步骤a)的亲本淀粉酶氨基酸序列可以包含额外的信号、前或信号前结构域,而不影响根据SEQ ID NO:1的编号。而且,任何这样的额外结构域的存在不影响根据本发明的教导,因为额外结构域在发酵和/或纯化和/或最终淀粉酶组合物配制期间会被除去,因此额外结构域在纯化和配制后获得的淀粉酶组合物中不造成“幽灵”。
根据步骤a)的亲本淀粉酶氨基酸序列可以包含如DE102012209289A1中所述的其他有益突变;将该文献完整并入本文。根据本发明,特别优选,除了上述任何取代之外,还通过一个或多个以下取代,提供与相应亲本淀粉酶不同的淀粉酶变体:
根据SEQ ID NO:1的位置5的氨基酸被A取代,和/或
根据SEQ ID NO:1的位置167的氨基酸被R取代,和/或
根据SEQ ID NO:1的位置170的氨基酸被P取代,和/或
根据SEQ ID NO:1的位置177的氨基酸被L取代,和/或
根据SEQ ID NO:1的位置202的氨基酸被L取代,和/或
根据SEQ ID NO:1的位置204的氨基酸被V取代,和/或
根据SEQ ID NO:1的位置271的氨基酸被D取代,和/或
根据SEQ ID NO:1的位置330的氨基酸被D取代,和/或
根据SEQ ID NO:1的位置377的氨基酸被R取代,和/或
根据SEQ ID NO:1的位置385的氨基酸被S取代,和/或
根据SEQ ID NO:1的位置445的氨基酸被Q取代。
优选地,该进一步的取代符合DE 10 2012 209 289 A1的第[0028]段中描述的模式(1)至(39)中的任何,甚至更优选该进一步的取代符合DE 10 2012 209 289 A1的模式(10)、(28)、(31)、(35)、(38)或(39),甚至更优选进一步的取代符合DE 10 2012 209 289 A1的模式(31)。
根据步骤a)的亲本淀粉酶氨基酸序列可包含进一步的有益突变:
根据SEQ ID NO:1的位置183和184上的缺失,和
根据SEQ ID NO:1的位置118的氨基酸被K取代,和/或
根据SEQ ID NO:1的位置195的氨基酸被F取代,和/或
根据SEQ ID NO:1的位置320的氨基酸被K取代,和/或
根据SEQ ID NO:1的位置458的氨基酸被K取代。
优选地,该进一步的突变包括根据SEQ ID NO:1的位置183和184上的缺失,和根据SEQ ID NO:1的位置118的氨基酸被K取代,和根据SEQ ID NO:1的位置195的氨基酸被F取代,和根据SEQ ID NO:1的位置320的氨基酸被K取代,和根据SEQ ID NO:1的位置458的氨基酸被K取代。
本发明还提供,与包含相应亲本淀粉酶的相应组合物相比,降低清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物或纸浆处理组合物中β-氨基酸(特别是isoAsp)含量的方法。该方法的步骤是如上所述的步骤a)-f),其中,如上所述,步骤f)是任选的。
根据本发明,还提供清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物或纸浆处理组合物,在所述组合物中包含一个或多个β氨基酸的多肽(优选淀粉酶多肽,任选地还有其它多肽)的含量、优选包含一个或多个isoAsp部分的多肽的含量为组合物中总多肽的至多20mol%、优选组合物中总多肽的至多10mol%、更优选组合物中总多肽的至多5mol%、更优选组合物中总多肽的至多2mol%、和优选不含β氨基酸,优选不含isoAsp部分。在上句中“多肽”是与SEQ ID NO:1的氨基酸序列具有至少65%序列同一性的多肽,并且β氨基酸、优选isoAsp的含量是在pH 8和37℃下20mM水性磷酸盐缓冲液中储存24小时后测定的。技术人员理解,通过将根据本发明的淀粉酶组合物配制成相应的清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物或纸浆处理组合物,可以容易地制备所述组合物。因此,本发明提供了上述组合物,从而实现了上述本发明的益处。技术人员理解,在这些组合物中,除本发明的淀粉酶之外,应避免β氨基酸、特别是isoAsp的其它来源。
特别优选的清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物和纸浆处理组合物描述于DE 10 2012 209 289 A1和WO2013063460中,其整体并入本文。技术人员理解,根据本发明的清洁组合物、食品组合物、饲料组合物、纺织品脱浆组合物和纸浆处理组合物,与上句中引用的文献中描述的相应组合物,区别在于相应文献的淀粉酶被本发明的淀粉酶替代。
根据本发明的其它方法、实施方案和实例在以下部分中描述:
方法
淀粉酶纯化和分析性离子交换色谱
对于下面部分描述的纯化,使用了GE Akta系统。纯化和puffer调节在室温下进行。如果没有其他说明,所有化学品都是分析级。
为了从发酵肉汤或配制产物中纯化淀粉酶,通过使用含有1mM CaCl2的TRIS缓冲液作为上样缓冲液,进行初始阴离子交换色谱(Q-Sepharose)。如果需要,通过使用上样缓冲液作为蓄池缓冲液(reservoir buffer)进行透析,将样品脱盐。阴离子交换色谱的洗脱通过至500mM NaCl的线性盐梯度进行。为了使用上样缓冲液能够结合,用于纯化的pH取决于相应的淀粉酶。为了避免不想要的脱酰胺化,避免高于pH 8的pH。使用来自Roche Costum Biotech的基于EPS的淀粉酶测定法、根据制造商的方案,监测在该步骤期间以及自其它步骤得到的级分的α-淀粉酶活性。
作为第二纯化步骤,进行疏水相互作用色谱(Butyl-Sepharose)。因此,向含有α-淀粉酶的级分补加硫酸铵至终浓度35%,用于上样。通过含有50mM MOPS(pH7.2)和1mM CaCl 2的洗脱缓冲液进行蛋白质洗脱。通过SDS-PAGE分析判断后含有α-淀粉酶的级分含有90%+成熟α-淀粉酶蛋白的α-淀粉酶含量。将含有α-淀粉酶的样品合并,并使用50mM MES(pH5,4)和1mM CaCl 2作为蓄池缓冲液进行透析。
为了进一步分析和分离电荷变体,进行分析性离子交换色谱。因此,使用Mono S阳离子交换物以及50mM MES(pH5,4)和1mM CaCl 2作为上样缓冲液。通过含有50mM MES(pH 5,4)、500mM NaCl和1mM CaCl 2的洗脱缓冲液进行洗脱。调节梯度以实现各电荷变体的清楚分离。由此,出现对应于纯化的α-淀粉酶的电荷变体的各峰。
强制脱酰胺条件
对于强制降解研究,将α-淀粉酶在有利于脱酰胺化的特定条件下孵育。为了诱导强制脱酰胺化,将α-淀粉酶在升高的温度(37℃)下在弱碱性pH(8.0)和基于磷酸盐的缓冲系统中孵育。这些条件经实验验证以诱导脱酰胺化过程。用于强制降解研究的缓冲液的pH值在室温(23.5℃)下调节,但也在37℃下检查。将样品以1-5ml体积的等分试样在15ml管中孵育给定的时间,无振荡。
用于MS分析的α-淀粉酶的消化
通过α-淀粉酶样品与50%TCA混合至12.5%TCA(v/v)的终浓度,沉淀α-淀粉酶样品。依据实际的α-淀粉酶浓度选择样品体积,以获得至少100μg的蛋白质沉淀(通过280nm吸光度测量的蛋白质浓度)。将样品在4℃以14.000rpm离心5分钟。弃去上清液,将蛋白质沉淀物用1ml乙醇/乙醚1:1(v/v)溶液洗涤两次。
为了消化,所有蛋白酶以测序等级质量购自Roche。
为了用内切蛋白酶胰蛋白酶消化,将25μg胰蛋白酶(测序等级)溶解在2ml磷酸盐缓冲液20mM,pH 8.0中并温和混合。将150μl该胰蛋白酶溶液加入到α-淀粉酶沉淀物(等于1.875μg胰蛋白酶/150μg蛋白质)。在37℃下消化4小时,无振荡。
为了用内切蛋白酶Lys-C消化,将5μg Lys-C(测序等级)溶于1.5ml磷酸盐缓冲液20mM,pH 8.0中,并温和混合。将150μl该Lys-C溶液加入到α-淀粉酶沉淀物(等于0.5μg Lys-C/150μg蛋白质)。在37℃下消化4小时,无振荡。
为了用内切蛋白酶Asp-N消化,将2μg Asp-N(测序等级)溶于1.5ml磷酸盐缓冲液20mM,pH 8.0中,并温和混合。将150μl的该Asp-N溶液加入到α-淀粉酶沉淀物(等于0.2μg Asp-N/150μg蛋白质)。在37℃下消化4小时,无振荡。
在进行LC-MS分析之前,将样品在4℃下储存最多两天。
SDS-PAGE
α-淀粉酶样品用50%TCA沉淀,至终体积12.5%TCA(v/v)。依据实际的α-淀粉酶浓度选择样品体积,但具有至少50μg总蛋白(通过280nm吸光度测量的蛋白质浓度)。将样品在4℃以14.000rpm离心5分钟。弃去上清液,将蛋白质沉淀用1mL乙醇/乙醚1:1(v/v)溶液洗涤两次。干燥后,将蛋白质沉淀溶解在至少50μL SDS样品缓冲液(4%SDS,2%DTT,80mM Tris,0.1%溴酚蓝,pH 6.8)中,并在95℃加热15分钟。
SDS-PAGE在与Pharmacia Biotech EPS 3501 XL电源供应器连接的Novex XCellmini cell电泳室中、在Novex4-12%Bis-Tris凝胶上进行。使用MES SDS运行缓冲液。SDS-PAGE的设置为150V、90mA、15W、40分钟,温度未调节。将15μL蛋白质样品与45μl SDS样品缓冲液(4%SDS,2%DTT,80mM Tris,0.1%溴酚蓝,pH 6.8)混合,并在95℃加热15分钟。每个泳道的蛋白质浓度和蛋白质上样量在20-40μg蛋白质的范围内。通过使用5μl BioRad Precision Plus ProteinTM标记物作为参照来估计蛋白质分子量。
等电聚焦在与Pharmacia Biotech EPS 3500 XL电泳电源供应器连接的Pharmacia Biotech Multiphor II水平电泳室上进行。电泳室的温度通过Huber Ministate 230冷却循环器调节。使用1cm2Pharmacia Biotech样品施加片,将样品施加到SERVA垂直聚焦凝胶pH 3-10(目录号:43327.01)的阳极侧。将15μl SERVA IEF-标记物液体混合物pH 3-10(目录号:39212)用水1:5稀释,用作所有凝胶上的pI标记物。聚焦过程的电源供应设置为
实施例
根据本发明,优选以下成熟α-淀粉酶,其在如上所述的正常储存条件期间具有降低或消除的脱酰胺化倾向:包含或由根据图12-16的序列SEQ-A.1至SEQ-A.16、序列SEQ-B.1至SEQ-B.16、序列SEQ-C.1至SEQ-C.16、和序列SEQ-D.1至SEQ-D.33组成的淀粉酶,其中在相同序列中每个X独立于任何其它X如上附图说明中所解释的那样进行定义。还优选,与SEQ ID NO:6具有至少80%氨基酸序列同一性、并且在根据SEQ ID NO:1的位置475和314上包含根据组i)的取代的淀粉酶。
如上所述,根据本发明,除了包含本“实施例”部分的任何序列外,还包含一个或多个其它结构域(例如前肽和/或信号肽)的淀粉酶,也是优选的。
涉及根据本发明的组合物和淀粉酶的制备和用途的实施例:
具有下列配方的复配洗衣洗涤剂组合物:
在本发明的一个实施方案中,(A)根据本发明的淀粉酶(优选具有以上在本实施例部分中述及的序列),是洗衣护理组合物的成分,所述组合物还包含至少一种阴离子表面活性剂(B)和至少一种助洗剂(C)。
合适的阴离子表面活性剂(B)的实例是以下化合物的碱金属盐和铵盐:C8-C12烷基硫酸酯、C12-C18脂肪醇醚硫酸酯、C12-C18脂肪醇聚醚硫酸酯、乙氧基化C4-C12-烷基酚的硫酸半酯(乙氧基化:3至50mol环氧乙烷/mol)、C12-C18-烷基磺酸、C12-C18磺基脂肪酸烷基酯,例如C12-C18磺基脂肪酸甲基酯、C10-C18烷基芳基磺酸,优选n-C10-C18烷基苯磺酸、C10-C18烷基烷氧基羧酸酯、和皂,例如C8-C24羧酸。优选上述化合物的碱金属盐,特别优选钠盐。
在本发明的一个实施方案中,阴离子表面活性剂(B)选自n-C10-C18烷基苯磺酸和脂肪醇聚醚硫酸酯,其在本发明的上下文中特别可以是乙氧基化C12-C18链烷醇(乙氧基化:1至50mol环氧乙烷/mol),优选n-C12-C18链烷醇的硫酸半酯。
助洗剂(C)的实例是络合剂(以下也称为络合剂(C))、离子交换化合物和沉淀剂(C)。助洗剂(C)的实例是柠檬酸盐、磷酸盐、硅酸盐、碳酸盐、膦酸盐、氨基羧酸盐和聚羧酸盐。
络合剂(C)(“螯合剂”)的实例选自络合剂,例如但不限于柠檬酸盐、磷酸盐、膦酸盐、硅酸盐和乙烯胺衍生物,其选自乙二胺四乙酸盐、二亚乙基五胺五乙酸盐,甲基甘氨酸二乙酸盐和谷氨酰胺二乙酸盐。络合剂(C)将在下面更详细地描述。
沉淀剂(C)的实例是碳酸钠和碳酸钾。
在本发明的一个实施方案中,根据本发明的用途包括淀粉酶(A)与至少一种其它酶(D)的用途。有用的酶是例如一种或多种脂肪酶、水解酶、蛋白酶、纤维素酶、半纤维素酶、磷脂酶、酯酶、果胶酶、乳糖酶和过氧化物酶,以及前述类型中至少两种的组合。
根据本发明的组合物可以包含一种或多种漂白剂(E)(漂白剂)。
优选的漂白剂(E)选自过硼酸钠(无水的或例如一水合物或四水合物或所谓的二水合物)、过碳酸钠(无水的或例如一水合物)和过硫酸钠,其中在每种情况下术语“过硫酸(盐)”包括过酸H2SO5的盐和过氧二硫酸盐。
根据本发明的制剂可以包含一种或多种漂白催化剂。漂白催化剂可以选自基于氧杂吖丙啶鎓(oxaziridinium)的漂白催化剂,促进漂白的过渡金属盐或过渡金属络合物,例如锰-,铁-,钴-,钌-或钼-salen络合物或羰基络合物。与含氮三足配体(tripod ligand)的锰,铁,钴,钌,钼,钛,钒和铜络合物以及钴,铁,铜和钌-胺络合物也可用作漂白催化剂。
根据本发明的制剂可以包含一种或多种漂白活化剂,例如四乙酰基乙二胺、四乙酰基亚甲基二胺、四乙酰基甘脲、四乙酰基己二胺、酰化的酚磺酸盐,例如n-壬酰基-或异壬酰基氧基苯磺酸盐、N-甲基吗啉鎓-乙腈盐(“MMA盐”)、三甲基铵乙腈盐、N-酰基酰亚胺,例如N-壬酰基琥珀酰亚胺、1,5-二乙酰基-2,2-二氧代六氢-1,3,5-三嗪(“DADHT”)或腈季铵盐(三甲基铵乙腈盐)。
根据本发明的制剂可以包含一种或多种腐蚀抑制剂。在该情况中,这应理解为包括抑制金属腐蚀的那些化合物。合适的腐蚀抑制剂的实例是三唑类,特别是苯并三唑类、双苯并三唑类、氨基三唑类、烷基氨基三唑类、以及酚衍生物,例如氢醌、邻苯二酚、羟基氢醌、没食子酸、间苯三酚或连苯三酚。
根据本发明的制剂可以包含至少一种选自非离子表面活性剂和两性表面活性剂的额外的表面活性剂。
非离子表面活性剂
特别地,表面活性剂的实例是非离子表面活性剂。优选的非离子表面活性剂是烷氧基化醇和烷氧基化脂肪醇、环氧乙烷和环氧丙烷的二和多嵌段共聚物、以及脱水山梨醇与环氧乙烷或环氧丙烷的反应产物、以及烷基酚乙氧基化物、烷基糖苷、多羟基脂肪酸酰胺(葡糖酰胺)和所谓的氧化胺。
其它合适的非离子表面活性剂选自由环氧乙烷和环氧丙烷组成的二和多嵌段共聚物。其它合适的非离子表面活性剂选自乙氧基化或丙氧基化的脱水山梨糖醇酯。氧化胺如月桂基二甲基氧化胺(“月桂基胺氧化物”)或烷基酚乙氧基化物或烷基多糖苷或多羟基脂肪酸酰胺(葡糖酰胺)同样是合适的。合适的其它非离子表面活性剂的概述可以在EP-A 0 851 023和DE-A 198 19 187中找到。
也可以存在两种或更多种不同非离子表面活性剂的混合物。两性表面活性剂的实例是C12–C18烷基甜菜碱和磺基甜菜碱。其它任选的成分可以是但不限于粘度调节剂、阳离子表面活性剂、泡沫促进剂或泡沫减少剂、香料、染料、荧光增白剂、染料转移抑制剂和防腐剂。
- 还没有人留言评论。精彩留言会获得点赞!