达沙替尼盐的制作方法
本发明属于药物领域,更具体地,本发明属于蛋白激酶抑制剂领域。甚至更具体地,本发明涉及N-(2-氯-6-甲基苯基)-2-[6-[4-(2-羟基乙基)哌嗪-1-基]-2-甲基嘧啶-4-基氨基]-1,3-噻唑-5-甲酰胺的新盐、其无水形式、水合物和溶剂合物;其制备方法;包含它们的药物组合物;和所述盐在疗法中的用途。
式(1)的N-(2-氯-6-甲基苯基)-2-[6-[4-(2-羟基乙基)哌嗪-1-基]-2-甲基嘧啶-4-基氨基]-1,3-噻唑-5-甲酰胺(INN:达沙替尼)的结构为:
背景技术:
本领域中已知,达沙替尼是蛋白激酶抑制剂,其因Bcr-Abl酪氨酸激酶抑制作用而起作用。该酶由白血病细胞产生并且能够使该细胞在不受细胞因子调节的情况下增殖。白血病细胞的增殖可以通过抑制Bcr-Abl酶或其它酶来阻断。达沙替尼显示出用于如下形式的白血病的疗法:
a)最新诊断的慢性期中的费城染色体阳性(Ph+)慢性髓性白血病(CML)。
b)对在先疗法(包括甲磺酸伊马替尼)产生抗性或不耐受的慢性期、加速期或胚细胞期CML。
c)对在先疗法产生抗性或不耐受的Ph+急性成淋巴细胞性白血病(ALL)和淋巴样胚细胞期CML。
式1的达沙替尼首先公开在WO 2000/062778 A1中。
达沙替尼HC1盐及其抗肿瘤活性由Lombardo等人(Lombardo,L.J.等人,J.Med.Chem.2004,47,6658-6661)公开。
达沙替尼的结晶正丁醇溶剂合物(BU-2)和结晶一水合物(H1-7)公开在WO2005/077945中。该申请的实施例8描述了以达沙替尼的乙酸盐水溶液为原料制备达沙替尼一水合物。
另外的达沙替尼盐公开在WO 2007/035874中。示例了达沙替尼的几种有机和无机酸加成盐。主要通过使用高通量结晶筛选技术得到的这些盐大部分包含吸附在表面上的溶剂或溶剂合物形式的溶剂。这种形式的这些盐不适合于药物产品研发。
发明目的
制药工业中对于可再现地制造形态均匀和适当纯的产品存在严格要求。这对于满足药物制剂、质量保证和负责销售认可的管理当局的要求所需的活性成分而言是基本要求。本领域状态中众所周知,不同的盐和多晶型物在重要性方面彼此不同,例如溶解度、化学稳定性、多晶型物稳定性、溶出速率、生物利用度、对于过滤或干燥的依从性和压片特性。此外,从经济学观点来看,极为重要的是该方法适合于工业化规模应用,易于再生产并得到具有适当纯度的形态均匀的产品。
达沙替尼一水合物碱难溶于含水性质,因此其生物利用度受限。差的溶解度还限制了活性成分的施用途径和将其制备成固体药物组合物。本发明共同的发明构思在于制备式(1)的达沙替尼的新盐,它们比达沙替尼(一水合物)碱更易溶于含水介质。
本发明的目的在于提供形态均匀的高纯度的新达沙替尼盐,它们具有比已知盐更有利的理化性质,并且具有至少与达沙替尼一水合物或已知盐一样高的化学稳定性,并且可以以适于工业化规模制造的可再现的方式制备。
附图说明
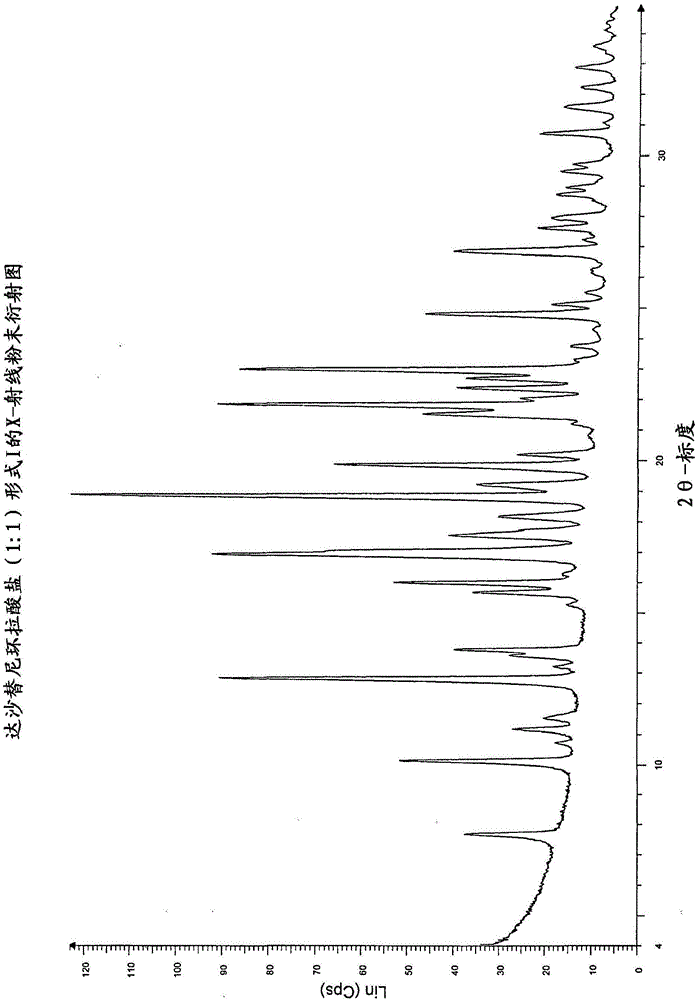
图1:达沙替尼环拉酸盐(1:1)形式I的X-射线粉末衍射图
图2:达沙替尼环拉酸盐(1:1)形式II的X-射线粉末衍射图
图3:达沙替尼氢溴酸(1:2)盐的X-射线粉末衍射图
图4:达沙替尼甲磺酸盐(1:2)的X-射线粉末衍射图
图5:达沙替尼对甲苯磺酸盐(1:1)二水合物的X-射线粉末衍射图
图6:无水达沙替尼对甲苯磺酸盐(1:1)形式I的X-射线粉末衍射图
图7:无水达沙替尼对甲苯磺酸盐(1:1)形式II的X-射线粉末衍射图
图8:达沙替尼对甲苯磺酸盐(1:1)甲醇溶剂合物的X-射线粉末衍射图
y轴表示坐标系统中线性标度[Lin(Cps)]上每秒的计数(Cps)。
技术实现要素:
令人惊奇地发现,上述目的根据本发明、通过制备达沙替尼的新盐及其新的多晶型得到解决,所述新盐及其多晶型即与环拉酸、氢溴酸、甲磺酸和对甲苯磺酸形成的盐。
现有技术中尚未公开达沙替尼的N-环己基氨基磺酸(环拉酸)加成盐。
本发明涉及达沙替尼的正盐或酸式盐及其水合物和溶剂合物。更具体地,本发明涉及:
-达沙替尼环拉酸盐;
-达沙替尼环拉酸(1:1)盐形式I;
-达沙替尼环拉酸(1:1)盐形式II;
-达沙替尼氢溴酸(1:2)盐;
-达沙替尼甲磺酸(1:2)盐;
-达沙替尼对甲苯磺酸(1:1)二水合物盐;
-无水达沙替尼对甲苯磺酸(1:1)盐形式I;
-无水达沙替尼对甲苯磺酸(1:1)盐形式II;
-达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物。
具体实施方式
更具体地,本发明涉及结晶达沙替尼环拉酸(1:1)盐形式I,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):10.11;18.81;19.83。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):7.64;10.11;13.74;18.81;19.83;21.49;21.78;22.94;24.79;31.59。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):7.64;10.11;10.72;11.15;11.50;12.78;13.19;13.56;13.74;15.25;15.66;15.97;16.29;16.89;17.53;18.15;18.81;19.20;19.83;20.18;21.18;21.49;21.78;22.02;22.35;22.68;22.94;23.30;23.74;24.31;24.79;25.12;25.50;26.83;27.23;27.63;27.96;28.73;28.95;29.50;29.73;30.72;31.59;32.23;32.89;33.60。该产品的X-射线粉末衍射图的特征显示在图1上。将具有大于1%的强度的信号汇总在下表1中。
表1:达沙替尼环拉酸(1:1)盐形式I
(相对强度>1%)
本发明还涉及结晶达沙替尼环拉酸(1:1)盐形式II,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.24;8.43;14.80。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.24;8.43;8.73;12.34;14.80;17.25;20.81;21.12;25.91;26.54。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.24;8.43;8.73;10.70;12.34;12.87;14.80;15.29;16.09;16.80;17.25;17.54;17.97;18.36;19.13;20.81;21.12;22.20;22.59;23.02;24.00;24.41;25.16;25.91;26.54;27.15;27.56;28.64;29.76;31.13;32.39;33.96;34.74。该产品的X-射线粉末衍射图的特征显示在图2上。将具有等于或大于1%的强度的信号汇总在下表2中。
表2:达沙替尼环拉酸(1:1)盐形式II
(相对强度≥1%)
本发明还涉及结晶达沙替尼氢溴酸(1:2)盐,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):19.75;24.39;29.82。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):10.98;11.51;12.32;16.07;19.75;21.67;24.39;24.78;29.82;32.20。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):10.11;10.63;10.98;11.51;11.91;12.32;14.19;14.63;15.46;16.07;16.50;17.81;19.75;20.39;21.07;21.67;22.14;22.49;23.55;23.86;24.39;24.78;26.30;26.73;28.76;29.22;29.82;30.31;31.51;32.20;33.34;33.99。该产品的X-射线粉末衍射图的特征显示在图3上。将具有大于2%的强度的信号汇总在下表3中。
表3:达沙替尼氢溴酸(1:2)盐
(相对强度>2%)
本发明还涉及结晶达沙替尼甲磺酸(1:2)盐,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.26;17.52;22.66。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.26;9.86;10.16;13.66;17.52;18.13;20.33;22.66;28.45;30.97。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):4.26;8.46;9.86;10.16;11.00;11.78;12.89;13.66;14.70;15.13;16.37;16.90;17.52;18.13;18.80;19.33;19.70;20.33;20.90;21.27;21.56;22.07;22.66;23.22;23.59;24.15;24.88;25.22;25.80;26.28;26.53;27.39;28.45;29.57;30.21;30.97;31.46;32.57;33.25;33.96。该产品的X-射线粉末衍射图的特征显示在图4上。将具有大于2%的强度的信号汇总在下表4中。
表4:达沙替尼甲磺酸(1:2)盐
(相对强度>2%)
本发明还涉及结晶达沙替尼对甲苯磺酸(1:1)二水合物盐,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.41;17.68;19.41。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.41;11.79;13.05;13.80;17.68;18.55;19.41;20.73;22.51;23.96。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.41;8.25;9.60;10.44;11.79;12.11;12.65;13.05;13.42;13.80;14.17;15.11;16.18;16.50;17.33;17.68;18.55;18.84;19.11;19.41;19.79;20.22;20.73;21.43;21.84;22.20;22.51;23.20;23.96;24.33;24.78;25.36;25.92;26.95;27.19;28.01;29.67;30.36;30.71;31.49;31.85;32.64;33.33;33.87;34.67。该产品的X-射线粉末衍射图的特征显示在图5上。将具有大于3%的强度的信号汇总在下表5中。
表5:达沙替尼对甲苯磺酸(1:1)二水合物盐
(相对强度>3%)
本发明还涉及无水达沙替尼对甲苯磺酸(1:1)盐形式I,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):10.21;12.77;16.74。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):10.21;11.09;12.77;13.75;16.74;17.76;18.68;19.95;21.32;29.04。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):7.68;10.21;11.09;11.70;12.77;13.75;15.62;15.92;16.33;16.74;17.15;17.47;17.76;18.31;18.68;19.10;19.49;19.95;20.18;21.32;21.74;22.22;22.67;23.05;23.66;24.88;25.30;26.01;26.57;26.78;27.33;27.72;28.73;29.04;29.31;29.69;29.99;30.88;31.70;33.13;34.03;34.60。该产品的X-射线粉末衍射图的特征显示在图6上。将具有大于2%的强度的信号汇总在下表6中。
表6:无水达沙替尼对甲苯磺酸(1:1)盐形式I
(相对强度>2%)
本发明还涉及无水达沙替尼对甲苯磺酸(1:1)盐形式II,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):12.17;14.57;24.42。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.37;9.54;11.90;12.17;14.22;14.57;18.39;19.78;24.42;25.46。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.37;9.54;11.90;12.17;12.47;13.66;14.22;14.57;16.42;17.25;17.54;17.90;18.39;18.74;19.01;19.54;19.78;20.08;20.54;21.08;21.74;22.28;22.89;23.58;24.42;24.67;25.04;25.46;26.06;26.79;27.40;28.62;29.46;30.19;31.01;31.39;32.82;33.14;33.65;34.28。该产品的X-射线粉末衍射图的特征显示在图7上。将具有大于3%的强度的信号汇总在下表7中。
表7:无水达沙替尼对甲苯磺酸(1:1)盐形式II
(相对强度>3%)
本发明还涉及达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物,其具有如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):18.36;19.50;22.52。更具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.35;9.25;13.83;18.36;19.50;21.48;22.52;24.02;24.94;27.16。最具体地,该产品的特征可以在于如下特征性X-射线粉末衍射峰:2θ(±0.2°2θ):6.35;9.25;9.51;11.66;11.84;12.15;12.66;13.46;13.83;14.16;14.35;15.09;15.85;16.15;16.61;17.23;17.72;18.36;19.11;19.50;19.80;20.20;20.86;21.20;21.48;21.89;22.52;23.59;24.02;24.39;24.94;25.42;25.91;26.59;27.16;28.80;29.51;30.50;30.88;32.31;33.14;34.77。该产品的X-射线粉末衍射图的特征显示在图8上。将具有大于6%的强度的信号汇总在下表8中。
表8:达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物
(相对强度>6%)
本发明的另一个方面提供用于制备达沙替尼盐的方法,其包括使达沙替尼(1)或其水合物或溶剂合物的无水晶型在适合的有机溶剂中与期望的有机酸或无机酸反应并且分离所形成的达沙替尼盐。
本发明的盐可以通过下列步骤制备:使达沙替尼游离碱(1)在有机溶剂中与期望的酸在适合的温度下反应,分离结晶的盐,且如果期望,则用有机溶剂洗涤,并且在适合的温度下干燥。
本发明的盐可以通过下列步骤制备:得到作为溶剂合物的固态的达沙替尼碱,并且将这种固体达沙替尼溶剂合物溶于有机溶剂,且与期望的酸反应,分离结晶的盐,且如果期望,则用有机溶剂洗涤,并且在适合的温度下干燥。
本发明的盐还可以通过在适合的条件下干燥适合的盐来制备,同时存在形态上转化成另一种晶型的固相。
本发明的盐的水合形式也可以通过在适合的条件下干燥适合的盐并且在空气中储存以使吸水率达到化学计量数量来制备。
本发明的盐的水合形式也可以通过在水和与水易溶混的溶剂的混合物中成盐并且分离沉淀的结晶盐的水合形式来制备。
所述盐可以通过已知的适合于分离固相和液体的制药工业的方法来分离,例如过滤,其任选地在大气压或真空或压力下或通过使用离心机进行。
为了形成本发明的盐,可以使用有机酸或无机酸,例如氢溴酸、环拉酸、甲磺酸或对甲苯磺酸。
该方法可以在有机溶剂中进行,例如C1-6脂族醇类、C1-5直链或环醚类、C1-6酯类、直链或支链对称或不对称酮类、偶极非质子溶剂或其混合物或其含水混合物。
优选将C1-4醚、酯、醇、直链酮或偶极非质子溶剂用作有机溶剂,特别是四氢呋喃、乙醚、乙酸乙酯、乙腈、丙酮、甲醇、乙醇、2-丙醇、甲乙酮或其混合物或其含水混合物。
达沙替尼(1)具有一个以上碱性中心,因此,本发明的盐可以使用不同的化学计量制备。在本说明书的上下文中,'一'盐是指1:1之比的达沙替尼与相应的盐;'二'盐是指1:2之比的达沙替尼与相应的盐。
成盐的酸优选相对于达沙替尼的用量以0.3-3.0、优选0.5-2.5摩尔当量来应用。可以优选通过使用有机酸的溶液并且在0℃-溶剂的沸点之间或在溶剂的沸点之间的温度下反应来进行。
特别优选地可以通过使达沙替尼的醇溶液或混悬液与包含0.3-3.0摩尔当量的酸的溶液在接近溶剂沸点的温度下反应来进行。优选通过过滤分离沉淀的产物。
还可以通过使用固体晶型的酸并且在0℃-混合物沸点之间或在溶剂沸点的温度下进行反应来进行。
特别优选地,可以通过使达沙替尼的醇溶液或混悬液与0.3-3.0摩尔当量的固体晶型的酸在接近溶剂沸点的温度下反应来进行。优选通过过滤分离沉淀的产物。
可以通过下列步骤制备本发明的新达沙替尼盐:在0℃-溶剂的回流温度之间的温度下将达沙替尼碱溶于或混悬于适合的溶剂,优选C1-6直链或支链醇,特别是乙醇、甲醇或2-丙醇,并且添加0.3-3.0、优选0.5-2.5摩尔当量的固体形式的或作为溶液的酸。如果所述盐在添加温度或冷却下沉淀,则过滤、洗涤并干燥。如果沉淀无法自发进行,则加入晶种并且过滤沉淀的结晶。特别优选地可以通过真空除去溶剂且通过添加适合的溶剂或溶剂混合物使残余物结晶且最终过滤、洗涤和干燥来进行。
本发明新的达沙替尼盐可以通过下列步骤制备:在0℃-溶剂的回流温度之间的温度下、优选在室温下将达沙替尼碱溶于或混悬于适合的溶剂,优选C1-6直链或支链醇、直链对称或不对称酮,特别优选乙醇、甲醇、2-丙醇或丙酮或其含水混合物,并且添加固体形式或作为溶液的0.3-3.0、优选0.5-2.5摩尔当量的酸。如果所述盐沉淀,则过滤、洗涤并且干燥。
达沙替尼环拉酸(1:1)盐形式I优选通过下列步骤制备:搅拌达沙替尼游离碱与直链醇类溶剂,优选甲醇,并且在0℃-溶剂的沸点之间的温度下、优选在室温-80℃之间的温度下、更优选在70℃下添加固体形式的环拉酸。然后,在冷却后,真空除去溶剂,并且优选通过添加乙醇使残余物结晶。过滤沉淀的结晶,任选地洗涤并且干燥。
达沙替尼环拉酸(1:1)盐形式II优选通过下列步骤制备:优选在丙酮水溶液中、优选在室温下将达沙替尼游离碱或环拉酸与水性直链脂族酮类溶剂搅拌4天。如果期望,则将该反应混合物冷却至5-25℃,过滤沉淀的结晶,任选地洗涤并且干燥。
达沙替尼氢溴酸(1:2)盐优选通过下列步骤制备:搅拌达沙替尼游离碱与醇类溶剂(优选乙醇),并且在0℃-溶剂的沸点之间的温度下、优选在室温-80℃之间的温度下、更优选在70℃下添加氢溴酸47%水溶液。然后,在冷却后,将该反应混合物在室温下搅拌4小时。过滤沉淀的结晶,任选地洗涤并且干燥。
达沙替尼甲磺酸(1:2)盐优选通过下列步骤制备:搅拌达沙替尼游离碱与直链脂族酮类溶剂(优选甲乙酮),并且在0℃-溶剂的沸点之间的温度下、优选在室温-80℃的温度下、更优选在60℃下添加甲磺酸,且优选在室温下将该反应混合物搅拌24小时。过滤沉淀的结晶,任选地洗涤并且干燥。
达沙替尼对甲苯磺酸(1:1)二水合物盐优选通过下列步骤制备:在水性直链醇类溶剂、优选甲醇水溶液中搅拌达沙替尼游离碱,并且在0℃-溶剂的沸点之间的温度下、优选在室温下添加固体形式的对甲苯磺酸,且优选在室温下将该反应混合物搅拌24小时。如果期望,则将该反应混合物冷却至5-25℃,过滤沉淀的结晶并且干燥。
无水达沙替尼对甲苯磺酸(1:1)盐形式I优选通过下列步骤制备:在支链醇类溶剂、优选在2-丙醇中搅拌达沙替尼游离碱,并且在0℃-溶剂的沸点之间的温度下、优选在室温-80℃之间的温度下、更优选在70℃下添加固体形式的对甲苯磺酸一水合物,且优选在室温下将该反应混合物搅拌72小时。过滤沉淀的结晶,任选地洗涤并且干燥。
无水达沙替尼对甲苯磺酸(1:1)盐形式II优选通过下列步骤制备:在40℃-60℃、优选在50℃的温度下、在5-10mbar的压力、优选在8mbar的压力下将对甲苯磺酸(1:1)二水合物盐干燥16小时。
达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物优选通过下列步骤制备:在水性直链醇类溶剂、优选甲醇中搅拌达沙替尼游离碱,并且在0℃-溶剂的沸点之间的温度下、优选在室温-80℃的温度下、更优选在70℃下添加固体形式的对甲苯磺酸一水合物,且优选在室温下将该反应混合物搅拌20小时。过滤沉淀的结晶。
在热应力试验和压力稳定性试验过程中,储存过程中发生的药物组合物的分解基本上按照加速方式构建。这些试验的结果预示:在压力储存条件下,本发明的新达沙替尼盐比现有技术中已知的盐更稳定。本发明的新达沙替尼盐的有利特性从药物组合物的配制、储存和在人体中突出的有害作用最小化的观点来看是显著的。
正如WO2007/035874的第[0096]段中公开的,达沙替尼一盐酸盐包括腔体或通道,其可以部分或全部被溶剂或溶剂混合物占据。我们的结果还证实,这种达沙替尼一盐酸盐的吸水特性是可变的,尤其是在干燥后。根据我们的DVS(动态水蒸气吸附)分析,同一申请中公开的达沙替尼二盐酸盐还倾向于吸水,因此,不将其视为稳定形式。现有技术中公开的另外的盐还包含吸附在表面的溶剂或溶剂合物形式的溶剂。这些形式不适合于制药应用。根据我们的实验,现有技术中公开的最稳定和适合的形式是达沙替尼一水合物碱。因此,我们在达沙替尼一水合物碱与本发明的新盐之间进行了对比实验。
对本发明的新达沙替尼盐的稳定性进行详细试验。令人惊奇地发现,本发明的一些达沙替尼盐在不同条件下进行的储存试验中显示比现有技术中已知的达沙替尼形式高的稳定性。令人惊奇地发现,经证实,本发明的新盐——达沙替尼环拉酸(1:1)盐形式I、达沙替尼环拉酸(1:1)盐形式II和无水达沙替尼对甲苯磺酸(1:1)盐形式I特别稳定。
有关杂质量及其改变的结果如下表中所示(以百分比表示)。
测定条件与如下纯度特性的测定相同。
本发明的盐特别地用于制备药物组合物。
当口服施用时,活性成分应当在适合的窄间隔中为生物可利用的,并且这种生物利用度依赖于几个条件,例如药物产品在胃肠道中的溶解度、稳定性和吸收。
达沙替尼一水合物的水溶解度取决于含水介质的pH。胃肠内容物中的正常pH为1.2-1.8。Remington:The Science and Practice of Pharmacy,第20卷(2000,编辑:A.R.Gennaro);第32章;C.J.Perigard:Clinical Analysis]。为了减少副作用,将另外的药物施用于具有癌症的患者,例如抗酸剂和质子泵抑制剂。它们可以增加胃pH。
考虑到上述举出的事实,我们的溶解度测定使用3种不同的pH值进行(pH 1、pH 4.5和pH 6.8)。
本发明的盐适合于制备药物制剂,其中生物利用度的变化与达沙替尼碱相比减少。因此,包含本发明的新盐的药物制剂提供优于包含达沙替尼一水合物的的生物利用度。
达沙替尼盐的溶解度测定(测定条件)
样品混合物的制备:
将100mg达沙替尼盐称重入20ml锥形瓶,此时,加入10ml介质,将其在37℃温度下以100rpm振荡6小时。在37℃的温度下沉降18小时后,通过具有0.45μm孔的筛过滤沉降的溶液,用介质将该溶液稀释至20ml。
pH=1
pH=4.5
pH=6.8
测定结果
可以观察到,本发明的新达沙替尼盐在最相关的pH1和pH4.5下显示出显著优越于现有技术中已知的达沙替尼一水合物的溶解度。
通过HPLC测定达沙替尼盐的杂质(测定条件)
通过对所述盐的HPLC测定的杂质数据:
可以制备纯度高于现有技术中已知的达沙替尼一水合物的本发明的新达沙替尼盐。可以得到特别纯的形式的达沙替尼环拉酸(1:1)盐形式II、达沙替尼对甲苯磺酸(1:1)二水合物盐、无水达沙替尼对甲苯磺酸(1:1)盐形式I和形式II。
因此,概括地,令人惊奇地发现,本发明的新盐、尤其是达沙替尼环拉酸盐在最相关的酸性范围内提供更好的溶解度特性,且同时在储存期间显示出更好的稳定性,并且可以制备纯度高于现有技术的达沙替尼形式的本发明的新盐。
本发明的另一个方面提供药物组合物,其包含治疗有效量的本发明的达沙替尼盐,且如果期望,则可以包含一种或多种药用活性载体。本发明的另一个方面提供用于制备上述药物组合物的方法,其包括混合达沙替尼盐或其混合物与药学上可接受的固体或液体稀释剂和/或助剂,并且将该混合物制成盖伦组合物。
本发明的药物组合物可优选通过口服施用。这类口服组合物可以是例如片剂、胶囊、锭剂、溶液、酏剂、混悬液或乳剂。
本发明的药物组合物可以包含常规的药用载体和/或助剂。作为载体,可以使用例如碳酸镁、硬脂酸镁、滑石粉、糖、乳糖、果胶、糊精、淀粉、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、PEG、可可脂等。在胶囊的情况下,载体通常作为胶囊壁材料使用,从而无需另外的载体。分包散剂(chartula)和锭剂也是口服药物组合物。特别优选的口服施用形式是粉末、pirules、分包散剂和锭剂。
通过以适当的比例混合活性成分与适合的载体制备片剂,并且由该混合物压制成期望形状和大小的片剂。
通过混合活性成分的细粉与载体来制备粉末。液体组合物可以是溶液、混悬液和乳剂,它们也可以是缓释组合物。经证实,水溶液和丙二醇水溶液是有利的。适合于胃肠外施用的组合物可以优选制备成聚乙二醇水溶液的形式。
本发明的药物组合物可以优选制备成剂量单位形式,其包含期望量的活性成分。该剂量单位可以采用包装形式销售,所述包装包含独立用量的组合物,例如填充片剂、胶囊、包含粉末的小瓶或安瓿。术语“剂量单位”是指胶囊、分包散剂、锭剂,还指包含适量的剂量单位的包装。
本发明的药物组合物可以通过制药工业的常规方法制备。本发明的药物组合物可以包含另外的药学活性成分,它们与达沙替尼的新盐或其混合物相容。
本发明的另一个方面涉及用于药物的本发明的达沙替尼盐。本发明的另一个目的涉及用于制备治疗癌症的药物组合物的本发明的达沙替尼盐。本发明还涉及用于治疗癌症的本发明的达沙替尼盐。我们的发明还涉及治疗患者的癌症的方法,包括对所述患者施用一定量的本发明的达沙替尼盐。癌症优选是慢性髓性白血病(CML),更优选费城染色体阳性(Ph+)急性成淋巴细胞性白血病(ALL)、以及对在先疗法产生抗性或不耐受的淋巴样胚细胞期CML。
本发明的优点在于本发明的化合物是均匀形态的物质并且具有有利的晶型。因此,本发明的盐具有优选的和可再现的特性,例如溶出速度、生物利用度、化学稳定性和加工特征,例如过滤、干燥和压片特性。
本发明的活性成分可通过易于适合于工业化规模制造的方法制备。
本发明通过下列实施例解释,但本发明的范围不限于这些实施例。实施例
用于下列实施例的达沙替尼碱例如可根据WO2005/077945制备。
NMR测定条件:
本发明的新盐的NMR谱通过使用如下仪器登记:VARIAN INOVA 500/500MHz/,BRUKER AVANCE III 400/400MHz/。新盐的NMR测定在溶液相中进行,将氘代二甲亚砜(DMSO-d6)用作溶剂。
X-射线粉末衍射测定:
达沙替尼环拉酸(1:1)盐形式I、达沙替尼环拉酸(1:1)盐形式II、达沙替尼氢溴酸(1:2)盐、达沙替尼甲磺酸(1:2)盐、达沙替尼对甲苯磺酸(1:1)二水合物盐、无水达沙替尼对甲苯磺酸(1:1)盐形式I、无水达沙替尼对甲苯磺酸(1:1)盐形式II、达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物的X-射线粉末衍射数据在如下测定条件下得到:
实施例1
达沙替尼环拉酸(1:1)盐形式I的制备
在剧烈搅拌下将1.000g(2.05mmol)达沙替尼碱和70cm3甲醇称重入仪器,将该混合物加热至70℃的温度。在该温度下在搅拌下向该溶液中加入固体形式的0.367g(2.05mmol)环拉酸,所述酸完全溶解和蒸发后,将该溶液冷却至室温。向油状残余物中加入10cm3甲醇,通过刮取启动结晶。过滤沉淀的结晶,用少量的冷乙醇和叔丁基甲基醚洗涤,在40℃的温度、5.2mbar下真空干燥24小时。
收率:1.129g(93.4%)
熔点:无特征值,在高于200℃观察到热分解
对于式C22H26ClN7O2S·C6H13NO3S的分析(667.25):
计算值C:50.40%H:5.89%N:16.79%Cl:5.31%S:9.61%
实测值C:50.48%H:5.99%N:16.92%Cl:5.26%S:9.86%
IR(KBr,cm-1):3310,3166,2931,2854,1632,1609,1582,1502,1451,1411,1312,1279,1222,1193,1139,1068,1024,996,816,771。
1H-NMR(DMSO-d6,400MHz):10.55(b,1H),9.88(b,1H),8.23(s,1H),7.40(m,1H),7.29(m,1H),7.26(m,1H),6.14(s,1H),5.03(b,1H),3.70(m,6H),3.02(m,1H),3.00(m,1H),2.93(m,2H),2.43(s,3H),2.24(s,3H),1.99(m,2H),1.65(m,2H),1.51(m,1H),1.13(m,5H)。
13C-NMR(DMSO-d6,125MHz):165.48,162.30,160.05,157.29,140.96,138.97,133.66,132.60,129.18,128.33,127.16,126.01,83.29,58.76,56.38,53.28,51.59,41.90,32.41,25.70,25.44,24.65,18.44。
实施例2
达沙替尼环拉酸(1:1)盐形式II的制备
在室温下将1.000g(2.05mmol)达沙替尼碱、0.367g(2.05mmol)环拉酸和20cm3丙酮水溶液(水与丙酮之比为10:1)称重入仪器,搅拌4天。过滤沉淀的结晶,用少量冷乙醇和叔丁基甲基醚洗涤,在45℃温度、11mbar下真空干燥24小时。
收率:1.353g(96.7%)
熔点:无特征值,在高于200℃观察到热分解
对于式C22H26ClN7O2S·C6H13NO3S的分析(667,25):
计算值C:50.40%H:5.89%N:16.79%Cl:5.31%S:9.61%
实测值C:50.65%H:5.97%N:16.93%Cl:5.45%S:9.51%
IR(KBr,cm-1):3364,3249,3012,2930,2852,1625,1612,1574,1527,1498,1452,1430,1414,1396,1338,1303,1190,1029,983,908,794,726,613,530。
实施例3
达沙替尼氢溴酸(1:2)盐的制备
在剧烈搅拌下将1.000g(2.05mmol)达沙替尼碱和20cm3乙醇称重入仪器,将该混合物加热至70℃的温度。在该温度下在搅拌下向该反应混合物中加入0.475cm3(4.11mmol)47%氢溴酸水溶液。所述碱溶解后沉淀即刻开始。通过在搅拌下停止加热,将该混合物冷却至室温,在室温下再搅拌4小时。过滤沉淀的结晶,用少量冷乙醇和叔丁基甲基醚洗涤,干燥。
收率:1.301g(97.7%)
熔点:305-312℃
对于式C22H26ClN7O2S·2HBr的分析(649.85):
计算值C:40.66%H:4.34%N:15.09%Br:24.59%Cl:5.46%S:4.93%
实测值C:40.51%H:4.27%N:14.96%Br:24.47%Cl:5.51%
S:4.86%
IR(KBr,cm-1):3215,2863,1648,1593,1546,1501,1467,1285,1241,1153,1063,1037,991,904,860,809,746,625。
1H-NMR(DMSO-d6,500MHz):11.63(b,1H),9.92(bs,1H),9.81(b,1H),8.27(s,1H),7.40(m,1H),7.29(m,1H),7.26(m,1H),6.20(s,1H),4.33(b,2H),3.78(m,2H),3.61(m,2H),3.36(m,2H),3.25(m,2H),3.14(m,2H),2.46(s,3H),2.24(s,3H)。
实施例4
达沙替尼甲磺酸(1:2)盐的制备
在搅拌下将1.000g(2.05mmol)达沙替尼碱和20cm3甲乙酮称重入仪器,将该混合物加热至60℃的温度。在该温度下在搅拌下向该混悬液中加入0.279cm3(4.31mmol;2.1ekv.)甲磺酸。该混悬液变聚集。通过停止加热将该混合物冷却至室温。聚集的固体可以粉末化。将该混合物在室温下再搅拌24小时。过滤沉淀的结晶,用3x10cm3叔丁基甲基醚洗涤,在50℃的温度、10mbar下真空干燥20小时。
收率:1.306g(93.7%)
熔点:208-218℃
对于式C22H26ClN7O2S·2CH4O3S的分析(680.22):
计算值C:42.38%H:5.04%N:14.41%Cl:5.21%S:14.14%
实测值C:42.09%H:5.13%N:14.26%Cl:5.10%S:13.99%
IR(KBr,cm-1):3278,3013,1671,1626,1540,1511,1485,1406,1325,1288,1210,1163,1042,986,896,865,813,771,712,627,550,524。
1H-NMR(DMSO-d6,400MHz):11.68(b,1H),9.92(bs,1H),9.73(b,1H),8.25(s,1H),7.40(m,1H),7.29(m,1H),7.26(m,1H),6.23(s,1H),4.36(m,2H),3.77(m,2H),3.60(m,2H),3.34(m,2H),3.23(m,2H),3.12(m,2H),2.46(s,3H),2.39(s,6H),2.24(s,3H)。
实施例5
达沙替尼对甲苯磺酸(1:1)二水合物盐的制备
将2.00g(4.1mmol)达沙替尼碱以及30cm3甲醇与10cm3水的混合物称重入仪器,将该混合物保持搅拌2分钟。在搅拌下向该混悬液中加入0.780g(4.1mmol)对甲苯磺酸一水合物。由于二水合物盐开始沉淀,该溶液不澄清。该反应混合物变成浓稠状,但可以将其在室温下以1300rpm再搅拌24小时。过滤沉淀的结晶,干燥。
收率:1.918g(67.3%)
熔点:196-210℃
对于式C22H26ClN7O2S·C7H8O3S·2H2O的分析(696.25):
计算值C:50.02%H:5.50%N:14.08%Cl:5.09%S:9.21%
实测值C:50.37%H:5.07%N:14.18%Cl:5.16%S:9.12%
通过卡尔·费歇尔滴定法,测定含水量为5.3%。这表明与5.18%计算值的良好的对应性。
IR(KBr,cm-1):3385,3205,3013,1609,1584,1496,1416,1318,1291,1167,1122,1031,1008,818,777,683,565。
1H-NMR(DMSO-d6,400MHz):11.64(bs,1H).9.92(bs,1H),9.68(b,1H),8.25(s,1H),7.48(d,J=8Hz,2H),7.40(m,1H),7.29(m,1H),7.26(m,1H),7.11(d,J=7.9Hz,2H),6.17(s,1H),5.42(b,1H),4.33(m,2H),3.77(m,2H),3.58(m,2H),3.35(m,2H),3.23(m,2H),3.10(m,2H),2.45(s,3H),2.29(s,3H),2.24(s,3H)。
实施例6
无水达沙替尼对甲苯磺酸(1:1)盐形式I的制备
将1.00g(2.05mmol)达沙替尼碱和20cm3 2-丙醇称重入仪器,将该混合物在剧烈搅拌下加热至70℃的温度。在该温度下在搅拌下向该反应混合物中加入0.390g(2.05mmol)对甲苯磺酸一水合物。所述碱开始溶解,然后通过停止加热,沉淀出现,将该反应混合物在室温下再搅拌72小时。过滤沉淀的结晶,用少量冷的2-丙醇和叔丁基甲基醚洗涤,干燥。
收率:1.183g(87.4%)
熔点:251-261℃
对于式C22H26ClN7O2S·C7H8O3S的分析(660.22):
计算值C:52.76%H:5.19%N:14.85%Cl:5.37%S:9.71%
实测值C:52.80%H:5.26%N:14.77%Cl:5.44%S:9.63%
1H-NMR(DMSO-d6,400MHz):参见实施例5。
IR(KBr,cm-1):3322,3170,3019,2924,2750,1635,1610,1585,1501,1454,1412,1291,1279,1225,1192,1154,1118,1066,1029,1005,814,769,683,588,571。
实施例7
无水达沙替尼对甲苯磺酸(1:1)盐形式II的制备
将在50℃的温度、8mbar下根据实施例5制备的达沙替尼对甲苯磺酸(1:1)二水合物盐干燥16小时。因此,得到无水达沙替尼对甲苯磺酸(1:1)盐形式II。
IR(KBr,cm-1):3180,3015,2837,1620,1605,1583,1519,1495,1412,1388,1321,1292,1272,1206,1187,1122,1031,1009,963,836,675,563。
实施例8
达沙替尼对甲苯磺酸(1:1)盐甲醇溶剂合物的制备
将1.00g(2.05mmol)达沙替尼碱和20cm3甲醇称重入仪器,将该混合物在剧烈搅拌下加热至70℃的温度。将该混合物在该温度下搅拌5分钟。在搅拌下通过停止加热向该反应混合物中加入0.390g(2.05mmol)对甲苯磺酸一水合物。将该混合物在室温下搅拌20小时,沉淀出现。过滤沉淀的结晶,缓慢地干燥。
TG数据显示,直到120℃的温度,有4.2w/w%的质量缺失,这表明与由甲醇溶剂合物计算的4.6w/w%值的良好的对应性。
- 还没有人留言评论。精彩留言会获得点赞!