爱帕琳类似物的制作方法
爱帕琳(Apelin)是一种由脂肪细胞产生和分泌的循环细胞因子,因此被认为是脂肪因子(Boucher等2005)。爱帕琳最初发现自牛胃提取物,是作为孤儿受体APJ的内源配体(Tatemoto等1998)。爱帕琳是APLN基因的产物并且被翻译成77氨基酸前体肽原。该前体肽原随后裂解形成若干生物活性肽,这些生物活性肽是通过其长度来标示,包括爱帕琳-12、爱帕琳-13、爱帕琳-16、爱帕琳-17、爱帕琳-19和爱帕琳-36。在哺乳动物中,爱帕琳C端的最后23个残基是相同的(Pitkin等2010),这意味着对这些肽的重要生理作用。采用合成肽的研究已揭示爱帕琳-13和爱帕琳-36可为最丰富的生物活性片段(Kawamata等2001)并且结构研究显示APJ与血管紧张素受体I具有31%的结构相似性。此外,爱帕琳-36通过血管紧张素转化酶相关性羧肽酶2-ACE2降解成爱帕琳-13(Vickers等2002)。然而,这种裂解不太可能使肽失活,因为若干研究已显示爱帕琳-12(即,爱帕琳-13减去C端处的苯基丙氨酸(Phe))在APJ受体处与原生爱帕琳-13具有类似的结合亲和力和活性,这表明除了ACE2的失活途径之外还存在其他失活途径。有意思的是,爱帕琳-13的C端Phe的丙氨酸置换不仅阻断ACE2的降解效应,而且还在APJ受体处产生拮抗剂。(Ala13)爱帕琳-13和爱帕琳-13的共同注射在大鼠中完全阻断了爱帕琳-13的血管扩张剂效应(Lee等2005)。迄今为止没有研究测试(Ala13)爱帕琳-13对胰岛素分泌和食物摄取的效应。爱帕琳和APJ表达均位于垂体前叶中的下丘脑内和视上核和室旁核周围,这表明牵涉激素释放以及食物和水摄取的调控。实际上,爱帕琳-13的脑室内(i.c.v.)施用会降低经饲喂的和经受饥饿的大鼠的食物摄取(Sunter等2003)。对于夜间施用爱帕琳-12观察到类似的效应,而白天急性脑室内注射会增加食物摄取(O'Shea等2003)。Valle及其合作者的研究(2008)显示将爱帕琳-13脑室内注射超过10天会增加小鼠的食物摄取、运动活性和体温。相比之下,将爱帕琳-13腹膜内(i.p.)施用10天对大鼠的食物摄取显示出很小的效应,但剂量依赖性会抑制大鼠的体重增量(Higuchi等2007)。因此,爱帕琳可参与动物的食物摄取调控,但需要另外的研究来确定精确机制。
在下丘脑中,爱帕琳通过抑制加压素释放神经元的电活动性而参与流体稳态的调控(Lee等2005)。然而,关于爱帕琳对水摄取的效应的研究已产生可变的结果。爱帕琳的中枢注射和全身性注射会增加贫水大鼠的水摄取(Valle等2008),但在禁水48h的大鼠中已发现对饮水的抑制效应(Pitkin等2010)。Mitra及其合作者(2006)发现在中枢或外周施用药理学剂量的(pGlu)爱帕琳-13之后对水摄取没有可靠的效应。
在CNS之外,已在许多组织中检测到爱帕琳mRNA,所述组织包括啮齿动物和人的血管内皮细胞、胃、肾、肺、乳腺和脂肪组织(Winzell等2005;Quazi等2009)。类似地,已在多个器官中检测到APJ mRNA,所述器官包括肺、心脏、脂肪组织、小肠、直肠粘膜、卵巢、甲状腺和下丘脑(Pitkin等2010),因此,与许多其他肽一样,爱帕琳已被证实具有多种生理作用。在肠中,爱帕琳-13和爱帕琳-36刺激胃细胞增殖。爱帕琳-12、爱帕琳-13和爱帕琳-19诱导从鼠的肠内分泌STC-1细胞的CCK-释放(Winzell等2005)。已在大鼠胃内的泌酸细胞中检测到爱帕琳免疫反应性,这表明爱帕琳可起到腔内CCK-释放因子的作用。由于CCK与局部迷走神经纤维上减少胃排空并增加饱腹感的CCK1R受体结合,因此爱帕琳可调节食后CCK信号传导(Pitkin等2010)。
据认为爱帕琳对进食行为、葡萄糖利用和胰岛素分泌具有许多生物学作用。最近,Ringstrom及其合作者(2010)发现位于胰腺β细胞上的爱帕琳受体在α细胞中具有某种程度的表达。有许多将爱帕琳与葡萄糖稳态相关联的报告,但这些报告具有相冲突的结果。这从Ringstrom及其合作者(2010)的报告可以看出,爱帕琳-36可同时刺激并抑制胰岛素分泌(取决于肽的浓度)。然而,Dray及其合作者(2008)报导急性静脉内(i.v.)注射爱帕琳-13(每45min 2000pmol/kg,持续3.75小时)在胰岛素敏感组织中具有强效的降葡萄糖效应和改善的葡萄糖摄取。Valle及其合作者的食物摄取研究(2008)显示爱帕琳-13(1μg/天)在3-7天显著增加了食物摄取。相反,Sunter及其合作者(2003)报导在经饲喂或禁食的Wistar大鼠中静脉内输注10-10M爱帕琳-13无食物摄取变化。就爱帕琳对葡萄糖稳态的响应而言,还取决于注射部位。因此,假设爱帕琳-13在葡萄糖稳态和进食行为控制中起着核心作用,但精确的作用机制目前尚不知晓。研究表明最有效的爱帕琳同种型为N端焦谷氨酸化的爱帕琳-13形式(pGlu-爱帕琳-13),该形式被认为是主要的生物配体(Zhu等2011)。这些研究人员还得出结论,爱帕琳对于维持体内全身性胰岛素敏感性而言是必需的。另外,爱帕琳在脂肪组织中的产生被胰岛素强烈上调,并且研究显示肥胖和高胰岛素小鼠和人类中的血浆浓度升高(Pitkin等2010)。
许多有益的活性归因于爱帕琳相关肽,包括在心血管疾病中的保护作用(Liu等2013),促进心肌中的葡萄糖摄取(Xu等2012),在糖尿病性肾病中具有保护作用(Pitkin等2010)并且其通过不同的机制来抑制前体脂肪细胞的脂肪生成和成熟脂肪细胞中的脂类分解(Valle等2008)。已报导,爱帕琳具有许多血管方面的益处(Kidoya&Takakura2012),减少ApoE-/-小鼠中粥样硬化病变的程度以及减低腹主动脉瘤的发展(Chun等2008)。先前的研究已显示,爱帕琳肽改变血压、进食行为、垂体激素释放并且可具有神经保护作用(Cheng等2012)。爱帕琳已作为在能量代谢和改善胰岛素敏感性方面具有有效作用的新成员出现(Castan-Laurell等2008)。总体而言,爱帕琳作为具有抗肥胖症和抗糖尿病特性的有益脂肪因子出现,其可改善胰岛素敏感性和葡萄糖利用并因此在对抗这些代谢障碍方面具有有前景的治疗概况。
已合成一系列爱帕琳-13相关肽类似物供抗糖尿病测试,以评估它们的体外和体内抗糖尿病潜力。一系列爱帕琳类似物的活性通过检验它们在小鼠血浆中的稳定性来测试。通过每天两次的腹膜内爱帕琳类似物和选定脂肪酸衍生物的长期慢性效应来检验在高脂肪饲喂的小鼠中最具前景的所选类似物。
发明概述
根据本发明的第一方面,提供一种肽类似物,其包含至少SEQ ID NO:1的残基2-13并且还包含SEQ ID NO:1的残基13处的置换和/或修饰。
任选地,所述肽类似物由SEQ ID NO:1的残基2-13组成。
任选地,残基13处的置换选自Tyr、Thi(β[2-噻吩基]-丙氨酸)、4-叠氮基-Phe、4-氰基-Phe或Trp;任选地,Tyr。
任选地,残基13为C端残基并且残基13处的修饰为末端羧基被酰胺基置换。
任选地,所述肽类似物包含至少SEQ ID NO:1的残基1-13或由SEQ ID NO:1的残基1-13组成。
任选地,所述肽类似物还包含N端添加的pGlu(5-氧代脯氨酸)、乙酰基、酰基或酰化部分;任选pGlu(5-氧代脯氨酸)。
任选地,所述肽类似物还包含SEQ ID NO:1的残基8处的修饰,其中进一步任选地,残基8处的修饰为将脂肪酸基团添加至残基8。进一步任选地,脂肪酸基团为C12至C20脂肪酸,任选C16脂肪酸(棕榈酸),其通过二价接头、任选γ-谷氨酰接头连接至残基8。
任选地,存在于肽类似物的2-7位和9-12位的那些氨基酸相对于SEQ ID NO:1的相应残基是未置换的。
任选地,残基13处的置换选自Val或Ala。
任选地,所述肽类似物为激动剂并且选自包含下列的群组:(Tyr13)爱帕琳-13、爱帕琳-13-酰胺、(pGlu)爱帕琳-13、pGlu(Tyr13)爱帕琳-13、(pGlu)爱帕琳-13-酰胺、Lys8GluPAL(Tyr13)爱帕琳-13、(Lys8GluPAL)爱帕琳-13-酰胺、pGlu(Lys8GluPAL)爱帕琳-13-酰胺;进一步任选地,选自包含下列的群组:(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺。
或者,肽类似物为拮抗剂并且选自包含下列的群组:(Ala13)爱帕琳-13、(Val13)爱帕琳-13、pGlu(Ala13)爱帕琳-13和pGlu(Val13)爱帕琳-13;任选地,选自包含下列的群组:pGlu(Ala13)爱帕琳-13和pGlu(Val13)爱帕琳-13。
为避免疑义,或是残基13处的置换选自Tyr、Thi(β[2-噻吩基]-丙氨酸)、4-叠氮基-Phe、4-氰基-Phe或Trp,或是残基13处的置换选自Val或Ala。另外地或替代地,残基13为C端残基并且残基13处的修饰(当存在时)为酰胺基对末端羧基的置换,前提条件是所述肽类似物不为(Ala13)爱帕琳-13。
根据本发明的第二方面,提供一种药物组合物,其包含本发明的第一方面的肽类似物联合药学上可接受的赋形剂。
根据本发明的第三方面,提供一种治疗糖尿病的方法,所述方法包括向个体施用本发明的第一方面的肽类似物。任选地,糖尿病为2型糖尿病。
根据本发明的第四方面,提供一种刺激胰岛素释放的方法,所述方法包括向个体施用本发明的第一方面的肽类似物。
根据本发明的第五方面,提供一种调节血糖波动的方法,所述方法包括向个体施用本发明的第一方面的肽类似物。
根据本发明的另一方面,提供一种增加食物摄取或增加体重的方法,所述方法包括向个体施用本发明的第一方面的肽类似物。
根据本发明的另一方面,提供一种用于治疗糖尿病的本发明的第一方面的肽类似物。任选地,糖尿病为2型糖尿病。
根据本发明的另一方面,提供一种用于刺激胰岛素释放的本发明的第一方面的肽类似物。
根据本发明的另一方面,提供一种用于调节血糖波动的本发明的第一方面的肽类似物。
如本文所用,pGlu是指:
,其羧酸基团与N端残基的酰胺形成肽键。
爱帕琳-13的类似物与原生GIP相比可具有增强的刺激胰岛素分泌、增强葡萄糖处理、延缓葡萄糖吸收的能力,或可表现出增强的血浆中稳定性。它们还具有增强的降解抵抗性。
这些特性中的任一种都会增强类似物作为治疗剂的效能。
本发明的药物组合物旨在通过透皮、鼻腔吸入、经口或注射途径来递送。本发明的肽类似物可单独施用或通过与利拉鲁肽的原生或衍生类似物(以商标名Victoza市售并且由Novo Nordisk研发)、毒蜥外泌肽-4(exendin-4)(1-39)(艾塞那肽(INN,以Byetta,Bydureon市售))等的联合疗法来进行施用。
不受理论束缚,如下的肽类似物充当激动剂,所述肽类似物包含至少SEQ ID NO:1的残基2-13并且还包含SEQ ID NO:1的残基13处的置换和/或修饰,其中残基13处的置换选自Tyr、Thi(β[2-噻吩基]-丙氨酸)、4-叠氮基-Phe、4-氰基-Phe或Trp;任选地,Tyr。
令人惊讶的是,如下的肽类似物充当拮抗剂,所述肽类似物具有或不具有N端添加的pGlu,包含至少SEQ ID NO:1的残基2-13并且还包含SEQ ID NO:1的残基13处的置换和/或修饰,其中残基13处的置换选自Ala或Val。
附图简述
现将参照附图以举例的方式描述本发明的实施方案,在附图中:
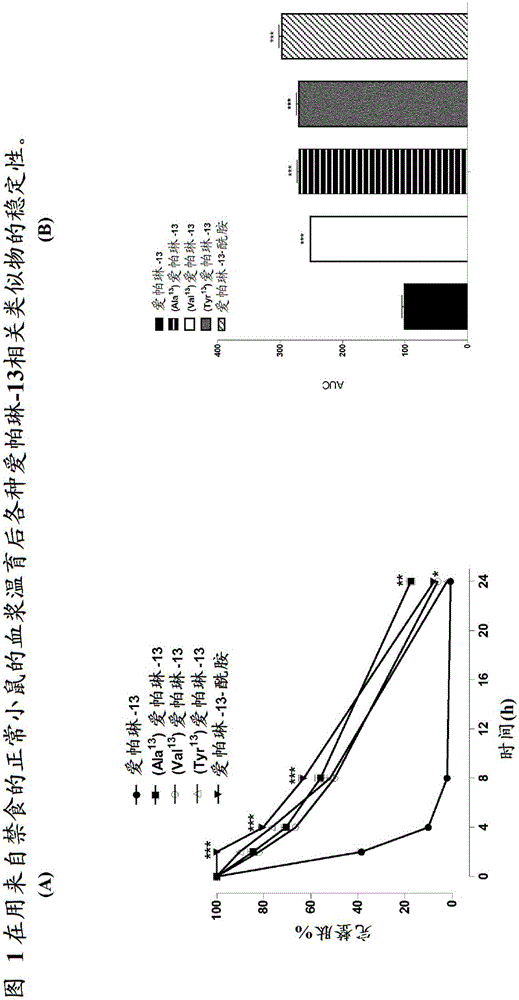
图1示出在用来自禁食的正常小鼠的血浆温育后各种爱帕琳-13相关类似物的稳定性。(A)示出0、2、4、8和24小时后完整肽的百分比(n=2)。值表示平均值±SEM。与每个时间点处的爱帕琳-13相比,*P<0.05、**P<0.01且***P<0.001。(B)示出对每种类似物的曲线下面积(AUC)分析。值表示平均值±SEM。与爱帕琳-13相比,***P<0.001。
图2示出各种爱帕琳-13类似物的序列。箭头指示在暴露于来自禁食的正常NIH Swiss小鼠的血浆之后一级序列上的各肽键断裂的点。
图3示出在用禁食的正常小鼠血浆温育后各种(pGlu)-爱帕琳-13相关类似物的稳定性。(A)示出0、2、4、8和24小时后完整肽的百分比(n=2)。值表示平均值±SEM。与每个时间点处的(pGlu)爱帕琳-13相比,*P<0.05、**P<0.01且***P<0.001。(B)示出对每种类似物的曲线下面积分析。值表示平均值±SEM。与(pGlu)爱帕琳-13相比,***P<0.001。
图4示出各种(pGlu)爱帕琳-13类似物的序列。箭头指示在暴露于来自禁食的正常NIH Swiss小鼠的血浆之后一级序列上的各肽键降解的点。
图5示出(A+B)爱帕琳-13和(C+D)(pGlu)爱帕琳-13相关类似物在患有膳食诱发的糖尿病的高脂肪饲喂的NIH Swiss小鼠中对降葡萄糖和胰岛素释放的急性效应。在饲喂高脂肪饮食150天的禁食18小时的小鼠中,在腹膜内单独施用葡萄糖(18mmol/kg体重)或与爱帕琳类似物(25nmol/kg体重)联合施用之前和之后测量血浆葡萄糖和血浆胰岛素浓度。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05、**P<0.01且***P<0.001。
图6出在饲喂高脂肪饮食150天的禁食18小时的小鼠中,腹膜内单独施用葡萄糖(18mmol/kg体重)、分别与(Ala13)爱帕琳-13、(Tyr13)爱帕琳-13或两者联合施用(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的效应。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**P<0.01;与(Tyr13)爱帕琳-13相比,+P<0.05;与(Ala13)爱帕琳-13相比,且
图7示出在饲喂高脂肪饮食150天的禁食18小时的小鼠中,腹膜内单独施用葡萄糖(18mmol/kg体重)、分别与(Val13)爱帕琳-13、(Tyr13)爱帕琳-13或两者联合施用(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的效应。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**P<0.01;与(Tyr13)爱帕琳-13相比,+P<0.05且++P<0.01;与(Val13)爱帕琳-13相比,
图8示出在饲喂高脂肪饮食150天的禁食18小时的小鼠中,腹膜内单独施用葡萄糖(18mmol/kg体重)、分别与(Ala13)爱帕琳-13、爱帕琳-13-酰胺或两者联合施用(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的效应。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**p<0.01;与爱帕琳-13-酰胺相比,+P<0.05且++P<0.01;与(Ala13)爱帕琳-13相比,且
图9示出在饲喂高脂肪饮食150天的禁食18小时的小鼠中,腹膜内单独施用葡萄糖(18mmol/kg体重)、分别与(Val13)爱帕琳-13、爱帕琳-13-酰胺或两者联合施用(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的效应。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**P<0.01;与爱帕琳-13-酰胺相比,+P<0.05、++P<0.05且+++P<0.001;与(Val13)爱帕琳-13相比,
图10示出在饲喂高脂肪饮食150天的禁食18小时的小鼠中施用爱帕琳相关类似物(25nmol/kg体重)2小时后进行的试验。在腹膜内单独施用葡萄糖(18mmol/kg体重)或与爱帕琳类似物联合施用之前和之后测量(A)血糖和(B)血浆胰岛素。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**P<0.01。
图11示出在饲喂高脂肪饮食150天的禁食18小时的小鼠中施用爱帕琳相关类似物(25nmol/kg体重)8小时后进行的试验。在腹膜内单独施用葡萄糖(18mmol/kg体重)或与爱帕琳类似物联合施用之前和之后测量(A)血糖和(B)血浆胰岛素。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05且**P<0.01。
图12示出在患有膳食诱发的糖尿病的高脂肪饲喂的Swiss NIH小鼠中,脂肪酸改性的爱帕琳类似物对降葡萄糖和胰岛素释放的急性效应。在饲喂高脂肪饮食150天的禁食18小时的小鼠中,在腹膜内单独施用葡萄糖(18mmol/kg体重)或与爱帕琳类似物(25nmol/kg体重)联合施用之前和之后测量(A)血糖和(B)血浆胰岛素。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05。
图13示出在饲喂高脂肪饮食150天的小鼠中施用脂肪酸爱帕琳类似物(25nmol/kg体重)16小时后进行的试验。在腹膜内单独施用葡萄糖(18mmol/kg体重)或与爱帕琳类似物联合施用之前和之后测量(A)血糖和(B)血浆胰岛素。值表示八只小鼠的平均值±SEM(n=8)。与单独的葡萄糖相比,*P<0.05、**P<0.01且***P<0.001。
图14示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天两次施用盐水、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)体重和(B)体重变化(%)的效应。黑色水平条表示治疗期。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05并且***p<0 001;与正常的对照小鼠相比,且
图15示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天两次施用盐水、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)累积食物摄取和(B)能量摄取的慢性效应。值表示累积食物摄取的平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.01且***P<0.001。
图16示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天两次施用盐水、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的慢性效应。黑色水平条表示治疗期。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05、**P<0.01且***p<0 001。
图17示出每天两次腹膜内施用盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后在高脂肪饲喂的NIH Swiss小鼠中进行的ipGTT试验。小鼠先前禁食18小时。在腹膜内单独施用葡萄糖(18mmol/kg体重)之前和之后测量(A)血糖和(B)血浆胰岛素浓度。还包括0-60分钟的葡萄糖和胰岛素AUC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图18示出每天两次腹膜内施用盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后在高脂肪饲喂的NIH Swiss小鼠中进行的OGGT试验。小鼠先前禁食18小时。在经口单独施用葡萄糖(18mmol/kg体重)之前和之后测量(A)血糖和(B)血浆胰岛素浓度。还包括0-60分钟的葡萄糖和胰岛素AUC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图19示出每天两次腹膜内施用盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后对在高脂肪饲喂的NIH Swiss小鼠中进行的饲喂试验的响应。小鼠先前禁食18小时并且可自由获取常饮食15分钟。在t=0、15、30、60和105分钟时测量(A)血糖和(B)血浆胰岛素浓度并且饲喂时间由黑色水平条表示。还示出0-60分钟的葡萄糖和胰岛素AUC数据(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图20示出在28天的盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)施用之后在高脂肪饲喂的NIH Swiss小鼠中进行的胰岛素敏感性试验。在t=0分钟(A+B)时通过腹膜内注射来施用胰岛素(25U/kg体重)。还示出0-60分钟注射后的%血浆葡萄糖曲线上面积(AAC)值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05且**P<0.01;与正常小鼠相比,
图21示出在28天的盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重)施用之后在高脂肪饲喂的NIH Swiss小鼠中进行的糖化血红蛋白试验的结果。从每只小鼠的尾静脉采血并通过Bayer A1CNow+多测试系统记录测量结果。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05且**P<0.01;与正常小鼠相比,且
图22示出在高脂肪饲喂的、对照和治疗的以及瘦型对照小鼠中,每天两次腹膜内施用盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重),施用28天之后对(A)体重(研究结束时)和(B)脂肪量(%)的慢性效应。值表示平均值±S.E.M.(n=6),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05且***p<0 001;与正常小鼠相比,且
图23示出在高脂肪饲喂的NIH Swiss小鼠中,每天两次腹膜内施用盐水((0.9%w/v)NaCl)、毒蜥外泌肽-4(1-39)、爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺(每种25nmol/kg体重),施用28天之后对能量消耗(A+B)的慢性效应。将小鼠在CLAMS代谢室中放置24小时(12小时暗期,如黑色条所示)并且使用RER通过下列公式来计算能量消耗:(3.815+1.232×RER)×VO2。值表示平均值±S.E.M.(n=6),其中与高脂肪饲喂的盐水治疗小鼠相比,*P<0.05。还示出单独的光暗循环AUC值(C+D)。
图24示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天一次施用盐水、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)体重和(B)体重变化(%)的慢性效应。黑色水平条表示治疗期。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图25示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天一次施用盐水、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)累积食物摄取和(B)能量摄取的慢性效应。值表示累积食物摄取和能量摄取的平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001。
图26示出在高脂肪饲喂的NIH Swiss小鼠中,在28天研究期间,每天一次施用盐水、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)对(A)血糖和(B)血浆胰岛素的慢性效应。黑色水平条表示治疗期。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001。
图27示出每天一次腹膜内施用盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后在高脂肪饲喂的NIH Swiss小鼠中进行的ipGTT试验。小鼠先前禁食18小时。在腹膜内单独施用葡萄糖(18mmol/kg体重)之前和之后测量(A)血糖和(B)血浆胰岛素浓度。还包括0-60分钟的葡萄糖和胰岛素AUC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图28示出每天一次腹膜内施用盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后在高脂肪饲喂的NIH Swiss小鼠中进行的OGTT试验。小鼠先前禁食18小时。在经口单独施用葡萄糖(18mmol/kg体重)之前和之后测量(A)血糖和(B)血浆胰岛素浓度。还包括0-60分钟的葡萄糖和胰岛素AUC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图29示出每天一次腹膜内施用盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)并持续28天后对在高脂肪饲喂的NIH Swiss小鼠中进行的饲喂试验的响应。小鼠先前禁食18小时并且可自由获取常饮食15分钟。在t=0、15、30、60和105分钟时测量(A)血糖和(B)血浆胰岛素浓度并且饲喂时间由黑色水平条表示。还示出0-60分钟的葡萄糖和胰岛素AUC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,且
图30示出在28天的盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)(A+B)施用之后在高脂肪饲喂的NIH Swiss小鼠中进行的胰岛素敏感性试验。在t=0分钟时通过腹膜内注射来施用胰岛素(25U/kg体重)。还示出0-60分钟注射后的%血浆葡萄糖AAC值(C+D)。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*p<0.05、**P<0.01且***P<0.001;与正常小鼠相比,
图31示出在28天的盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重)施用之后在高脂肪饲喂的NIH Swiss小鼠中进行的糖化血红蛋白试验的结果。从每只小鼠的尾静脉采血并通过BayerA1CNow+多测试系统记录测量结果。值表示平均值±S.E.M.(n=8),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**p<0.01且***p<0.001;与正常小鼠相比,且
图32示出在高脂肪饲喂的盐水对照、肽治疗的以及瘦型对照小鼠中,在高脂肪饲喂的NIH Swiss小鼠中,每天一次腹膜内施用盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重),施用28天之后对(A)体重(研究结束时)和(B)脂肪量(%)的慢性效应。值表示平均值±S.E.M.(n=6),其中与高脂肪盐水治疗小鼠相比,*P<0.05、**P<0.01且***P<0.001;与正常小鼠相比,
图33示出在高脂肪饲喂的NIH Swiss小鼠中,每天一次腹膜内施用盐水((0.9%w/v)NaCl)、利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺(每种25nmol/kg体重),施用28天之后对能量消耗(A+B)的慢性效应。将小鼠在CLAMS代谢室中放置24小时(12小时暗期,如黑色条所示)并且使用RER通过下列公式来计算平均能量消耗以及暗阶段和光阶段能量消耗:(3.815+1.232×RER)×VO2。值表示平均值±S.E.M.(n=6),其中与高脂肪盐水治疗小鼠相比,*P<0.05且**P<0.01;与正常小鼠相比,还示出单独的光暗循环AUC值(C+D)。
图34示出在高脂肪饲喂的NIH Swiss小鼠中,每天一次施用利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺对(A)总胆固醇和(B)甘油三酯的效应。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的小鼠相比,*P<0.05、**P<0.01且***p<0 001。
图35示出在高脂肪饲喂的NIH Swiss小鼠中,每天一次施用利拉鲁肽、(Lys8gluPAL)爱帕琳-13-酰胺和pGlu(Lys8gluPAL)爱帕琳-13-酰胺对(A)HDL-C和(B)LDL-C的效应。值表示平均值±S.E.M.(n=8),其中与高脂肪饲喂的对照相比,*P<0.05且**P<0.01;与正常小鼠相比,
图36示出在雄性NIH Swiss小鼠中,(A)爱帕琳-13类似物(25nmol/kg)对主动食物摄取的效应和(B)(pGlu)爱帕琳-13类似物(25nmol/kg)对主动食物摄取的效应。通过腹膜内注射施用盐水和肽类似物并且在饲喂后的30、60、90和120分钟对累积食物摄取进行监测。值为平均值±SEM(n=8)。与盐水对照组相比,*P<0.05、**P<0.01且**P<0.001。
图37示出在雄性NIH Swiss小鼠中,(A)爱帕琳-13(1-100nmol/kg)对主动食物摄取的急性剂量响应效应和(B)(pGlu)爱帕琳-13(1-100nmol/kg)对主动食物摄取的急性剂量响应效应。通过腹膜内注射施用盐水和肽类似物并且在饲喂后的30、60、90和120分钟对累积食物摄取进行监测。值为平均值±SEM(n=8)。与盐水对照组相比,*P<0.05且**P<0.01。
图38示出在雄性NIH Swiss小鼠中,(A)爱帕琳-13-酰胺(1-100nmol/kg)对主动食物摄取的急性剂量响应效应和(B)急性剂量响应效应of(pGlu)爱帕琳-13-酰胺(1-100nmol/kg)对主动食物摄取的急性剂量响应效应。通过腹膜内注射施用盐水和肽类似物并且在饲喂后的30、60、90和120分钟对累积食物摄取进行监测。值为平均值±SEM(n=8)。与盐水对照组相比,*P<0.05且**P<0.01。
图39示出在雄性NIH Swiss小鼠中,(Lys8GluPAL)爱帕琳-13-酰胺、pGlu(Lys8GluPAL)爱帕琳-13-酰胺、Lys8GluPAL(Tyr13)爱帕琳-13和Lys8GluPAL(Val13)爱帕琳-13(25nmol/kg)对主动食物摄取的效应。通过腹膜内注射施用盐水和肽类似物并且在饲喂后的30、60、90和120分钟对累积食物摄取进行监测。值为平均值±SEM(n=8)。与盐水对照组相比,*P<0.05且**P<0.01。
图40示出在雄性NIH Swiss小鼠中,(A)各种脂肪酸衍生的爱帕琳-13类似物(1-100nmol/kg)对主动食物摄取的急性剂量响应效应和(B)各种脂肪酸衍生的(pGlu)爱帕琳-13类似物(1-100nmol/kg)对主动食物摄取的急性剂量响应效应。通过腹膜内注射施用盐水和肽类似物并且在饲喂后的30、60、90和120分钟对累积食物摄取进行监测。值为平均值±SEM(n=8)。与盐水对照组相比,*P<0.05且**P<0.01。
材料和方法
来自禁食的正常NIH Swiss小鼠的血浆对爱帕琳肽的降解
在37℃下于轨道式振荡器上,将爱帕琳肽(>95%纯度;100μg)在50mM三乙醇胺缓冲液(370μl;pH 7.4)中用10μl禁食的正常小鼠血浆(从禁食18小时的NIH Swiss小鼠收集)体外温育0、2、4、8和24小时。将酶促反应通过添加50μl 10%TFA(0.1%v/v;Sigma-Aldrich Ltd,(Poole,Dorset,UK)来终止并且在-20℃下冷冻直至分离。然后将终止的反应产物施加至分析型Vydac C-8柱(4.6×150mm;Phenomenex,Macclesfield,Cheshire,UK)上以用于rp-HPLC分析。使用Spectrasystem UV 2000检测器(Thermoquest Limited,Manchester,UK)监测214nm处的吸光度并且通过Thermo Electron ChromQuest数据收集软件(4版)来记录迹线。人工收集HPLC峰级分并且通过MALDI-TOF质谱仪以进行肽鉴定。
使用基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF MS)来表征爱帕琳肽。
通过MALDI-TOF质谱来检查并表征所有购买的肽。将1mg/ml肽样品的等分试样(1.5μl)施加至100孔不锈钢样品板的一个孔中。将另外1.5μl基质溶液(10mg/ml溶液)与肽样品混合并在室温下进行干燥。使用Voyager-DE BioSpectrometry Workstation(PerSeptive Biosystems,Framingham,MA,USA)来记录质谱。将质量记录为相对于相对峰强度的质荷(m/z)比并且与理论值进行比较。
爱帕琳类似物的体内急性和长期效应。
NIH Swiss小鼠(Harlan UK Ltd.,Blackthorne,UK)源于得自美国国立卫生研究院(Bethesda,Maryland)的细胞核克隆。将一组小鼠维持标准啮齿动物饮食(10%脂肪、30%蛋白质、60%碳水化合物;(%)总能量12.99kJ/g,Trouw Nutrition,Cheshire,UK)并且用作正常血糖模型。将其他NIH Swiss小鼠(8周龄)维持高脂肪饮食(45%脂肪、20%蛋白质、35%碳水化合物;(%)总能量26.15kJ/g;Dietex,Essex,UK)达150天以产生饮食诱发的肥胖症-糖尿病模型。与接受标准啮齿动物饮食的小鼠相比,高脂肪饲喂的小鼠表现出增加的体重和升高的非空腹血糖(n=8)。所有小鼠均容纳在维持于22±2℃的12小时光:12小时暗循环(08:00-20:00h)的空调室中,进行单独关笼并根据体重和非空腹血糖来选择用于实验组。饮用水和饮食均可自由获得。所有研究均根据英国动物(科学程序)法案1986(UK Animals(Scientific Procedures)Act 1986)进行。
对于急性体内研究,在腹膜内注射葡萄糖(18mol/kg体重)之前(t=0)和之后的15、30、60和105分钟就立即将来自禁食的清醒小鼠的切去尾尖的尾部静脉的血样收集到氟化物/肝素涂布的葡萄糖微量离心管(Sarstedt,Germany)中。
对于每天施用两次所选爱帕琳类似物的28天长期研究,将正常对照NIH Swiss和高脂肪饲喂的NIH Swiss分组并在4天导入期(run-in period)期间接受每天两次(09:00h和17:00h)腹膜内注射盐水媒介物(0.9%NaCl(w/v))。在导入期后,正常对照(n=8)和高脂肪饲喂的小鼠(n=8)接受每天两次(09:00h和17:00h)腹膜内施用盐水媒介物(0.9%NaCl(w/v))并持续28天。在28天治疗期内,其他组的高脂肪饲喂的小鼠(n=8)接受每天两次腹膜内注射爱帕琳-13-酰胺、(pGlu)爱帕琳-13-酰胺或毒蜥外泌肽-4(1-39)(每种25nmol/kg体重)。
对于每天施用一次所选爱帕琳类似物的另一项28天长期研究,将正常对照NIH Swiss(n=8)和高脂肪饲喂的NIH Swiss(n=8)分组并在4天导入期内接受每天一次(17:00h)腹膜内注射盐水媒介物(0.9%NaCl(w/v))。在导入期后,正常对照(n=8)和高脂肪饲喂的小鼠(n=8)接受每天一次(17:00h)腹膜内施用盐水媒介物(0.9%NaCl(w/v))并持续28天。在28天治疗期内,其他组的高脂肪饲喂的小鼠(n=8)接受每天一次腹膜内注射(Lys8gluPal)爱帕琳-13-酰胺、pGlu(Lys8gluPal)爱帕琳-13-酰胺或利拉鲁肽(每种25nmol/kg体重)。
28天长期研究的代谢效应的测量
在整个导入期和28天治疗期中,以2-3天的间隔监测食物摄取、体重、血糖和血浆胰岛素。在整个研究中以一定的间隔从清醒小鼠的切除的尾静脉收集用于葡萄糖和血浆胰岛素测量的血样。在28天治疗期后,进行经口、腹膜内和膳食试验葡萄糖耐受性(18nmol/kg体重)以及胰岛素敏感性(25U/kg体重)试验。使用Ascensia Contour仪测量葡萄糖并且对血进行收集并处理以通过放射性免疫测定进行血浆胰岛素分析。还使用PIXImus DEXA扫描仪来评估体重和脂肪量,同时使用CLAMS代谢室来评估能量消耗、摄取、食物摄取和取食持续时间(bout)。使用Bayer A1C Now+Multi测试仪28天后分析HbA1c。通过使用iLab分析仪获得脂质特征试验。使用iLab分析仪测量血浆(3μl)中的胆固醇、甘油三酯和HDL-胆固醇水平。使用Friedewald公式来获得LDL-胆固醇水平=总胆固醇-HDL-(甘油三酯/3)。
食物摄取的爱帕琳类似物的急性效应
通过在3周期间逐渐减少每日饲喂时段来使小鼠适应3小时/天的每日饲喂方案。执行这种方案以确保小鼠在3小时内消耗全部的每日食物摄取,从而允许在小鼠的已知的进食时段期间测量“肽”效应。在1至7天,从10:00h至20:00h向小鼠供食;在8至14天,从10:00h至19:00h供食;在15至21天,从10:00h至13:00h以3小时的间隔限食。此方案在整个实验时段中持续。
向适应3小时每日饲喂方案的小鼠施用的是在10:00h以腹膜内注射盐水(0.9%w/v NaCl)或爱帕琳肽(1-100nmol/kg体重)(n=8)。在刚注射后,首先对食物进行称重,然后提供给小鼠,随后以30分钟的间隔称重并持续最多180分钟。
统计分析
结果以平均值±S.E.M示出。通过Prism GraphPad 5.0版使用学生t检验(Student t-test)来比较数据。使用梯形法则通过基线扣除来计算曲线下面积(AUC)分析。将P<0.05视为统计学显著性。
表1.爱帕琳-13相关类似物的降解概况。
各种爱帕琳-13相关类似物的降解概况:在Vydac C-8分析型HPLC柱上分离血浆(4h)温育物并在通过MALDI-TOF质谱仪进行分析之前收集所有峰级分。示出降解片段、实际分子量(Mr)和保留时间(RT)。每个片段的理论分子量在括号中示出。
表2.(pGlu)爱帕琳-13相关类似物的降解概况。
各种(pGlu)爱帕琳-13相关类似物的降解概况:在Vydac C-8分析型HPLC柱上分离血浆(4h)温育物并在通过MALDI-TOF质谱仪进行分析之前收集所有峰级分。示出降解片段、理论分子量(Mr)和保留时间(RT)。每个片段的理论分子量在括号中示出。
表3. 4小时后留下的完整肽的百分比和估计的爱帕琳肽半衰期(t1/2)。
汇总表显示完整肽的百分比和所测试爱帕琳相关肽类似物的半衰期。百分比通过构建完整肽百分比相对于时间的图来计算半衰期。使用线性回归"最佳拟合"分析来计算一半的肽降解的时间。值为两次独立实验的平均值±SEM。与爱帕琳-13相比,***P<0.001。
表4.数据显示在饲喂高脂肪饮食150天的NIH Swiss小鼠中与体内急性降葡萄糖和促胰岛素活性有关的爱帕琳-13相关类似物的等级次序。
注意:^表示肽拮抗剂。分别与单独的血糖组合单独的血浆胰岛素葡萄糖组相比,*P<0.05、**P<0.01且***P<0.001。
表5.数据显示在饲喂高脂肪饮食150天的NIH Swiss小鼠中,单独的和组合的(Tyr13)爱帕琳-13和爱帕琳-13-酰胺对血糖和血浆胰岛素分泌的急性效应,以及单独的和组合的(Ala13)爱帕琳-13和(Val13)爱帕琳-13对血糖和血浆胰岛素分泌的拮抗特性。
分别与单独的血糖组合单独的血浆胰岛素葡萄糖组相比,*P<0.05、**P<0.01且***P<0.001。
表6.数据显示在饲喂高脂肪饮食150天的NIH Swiss小鼠中,在2小时延缓后,各种爱帕琳相关类似物对降葡萄糖和血浆胰岛素分泌的等级次序。
分别与单独的血糖组合单独的血浆胰岛素葡萄糖组相比,**P<0.01且***P<0.001。
表7.数据显示在饲喂高脂肪饮食150天的NIH Swiss小鼠中,在8小时延缓后,各种爱帕琳相关类似物对降葡萄糖和血浆胰岛素分泌的等级次序。
分别与单独的血糖组合单独的血浆胰岛素葡萄糖组相比,*P<0.05。
表8.数据显示在饲喂高脂肪饮食150天的高脂肪饲喂NIH小鼠中,在急性腹膜内葡萄糖耐受性试验后,脂肪酸衍生的爱帕琳激动剂响应于胰岛素分泌和降葡萄糖效应的等级次序。
与单独的血浆胰岛素葡萄糖组相比,*P<0.05。
表9.数据显示在饲喂高脂肪饮食150天的高脂肪饲喂NIH小鼠中,在16小时的延缓腹膜内葡萄糖耐受性试验后,脂肪酸衍生的爱帕琳激动剂响应于胰岛素分泌和降葡萄糖效应的等级次序。
分别与单独的血糖组合单独的血浆胰岛素葡萄糖组相比,*P<0.05、**P<0.01且***P<0.001。
图36示出(A)与盐水治疗对照相比,爱帕琳-13-酰胺(25nmol/kg)在3小时内将食物摄取从21.5%减少至33.7%(P<0.05-P<0.001)。与盐水治疗对照相比,(Val13)爱帕琳-13(25nmol/kg)充当拮抗剂并在3小时内将食物摄取从10.7%增加至16.0%(P<0.05且P<0.01)。(B)与盐水治疗对照相比,(pGlu)爱帕琳-13-酰胺(25nmol/kg)在3小时内将食物摄取从27.0%减少至32.4%(P<0.01且P<0.001)。
与盐水治疗对照相比,pGlu(Val13)爱帕琳-13(25nmol/kg)充当拮抗剂并在3小时内将食物摄取从13.6%增加至15.8%(P<0.05且P<0.01)。
图37示出(A)爱帕琳-13(100nmol/kg)在90分钟时将食物摄取减少16.7%(P<0.01),然而,此效应在3小时内不可持续。(B)(pGlu)爱帕琳-13(100nmol/kg)在90分钟时并将食物摄取从3.8%减少至28.1%(P<0.05且P<0.01)。然而,此效应在3小时内不可持续。
图38示出(A)与盐水治疗对照相比,爱帕琳-13-酰胺(25nmol/kg)在3小时内将食物摄取从23.2%减少至31.3%(P<0.05-P<0.001)。与盐水治疗对照相比,爱帕琳-13-酰胺(100nmol/kg)在3小时内将食物摄取从19.4%减少至34.5%(P<0.05且P<0.01)。(B)与盐水治疗对照相比,(pGlu)爱帕琳-13-酰胺(25nmol/kg)在3小时内将食物摄取从24.1%减少至30.8%(P<0.05-P<0.001)。与盐水治疗对照相比,(pGlu)爱帕琳-13-酰胺(100nmol/kg)在3小时内将食物摄取从减少26.7%至41.1%(P<0.01且P<0.001)。
图39示出与盐水治疗对照相比,(Lys8GluPAL)爱帕琳-13-酰胺(25nmol/kg)将食物摄取从12.0%减少至23.0%(120至180分钟;P<0.01且P<0.001)。与盐水治疗对照相比,pGlu(Lys8GluPAL)爱帕琳-13-酰胺(25nmol/kg)将食物摄取从20.8%减少至30.1%(120至180分钟;P<0.001)。与盐水治疗对照相比,Lys8GluPAL(Val13)爱帕琳-13(25nmol/kg)将食物摄取增加最多9.2%(150分钟;P<0.05且P<0.01)。
图40示出(A)与盐水治疗对照相比,(Lys8GluPAL)爱帕琳-13-酰胺(25nmol/kg)将食物摄取从14.5%减少至25.7%(120至180分钟;P<0.01且P<0.001)。与盐水治疗对照相比,(Lys8GluPAL)爱帕琳-13-酰胺(100nmol/kg)将食物摄取从9.0%减少至40.2%(90至180分钟;P<0.05-P<0.001)。(B)与盐水治疗对照相比,pGlu(Lys8GluPAL)爱帕琳-13-酰胺(25nmol/kg)将食物摄取从19.8%减少至32.1%(120至180分钟;P<0.001)。与盐水治疗对照相比,pGlu(Lys8GluPAL)爱帕琳-13-酰胺(100nmol/kg)将食物摄取从9.6%减少至40.3%(90至180分钟;P<0.05且P<0.001)。
以各种剂量测试某些肽(图36-40)。用于其他生理研究的25nmol/kg剂量在减少食物摄取方面起到有效的作用。25nmol/kg剂量常常与100nmol/kg剂量同样有效。
所述类似物在减少食物摄取方面更优于原生肽(存在于图37中)。脂肪酸肽在后面的时间点起效较慢,但的确具有显著的效应。优于方案的关系,发明人未进行超过3小时的观察,但这些脂肪酸改性的类似物可能具有超过3小时的更长的持续效应。
讨论
研究指示仅爱帕琳类似物的降解途径是经由血管紧张素转化酶(ACE)同系物ACE2(Vickers等2002),其裂解爱帕琳序列上的C端氨基酸(Phe13)。图2示出爱帕琳-13类似物的可能裂解位点,并且图4示出(pGlu)爱帕琳-13类似物基于当前MALDI-MS裂解模式的预测裂解。这在表1和表2中示出。几乎全部的所测试类似物显示出在它们各自的序列内的不止一个肽键处的裂解点。这符合Pitkin及其合作者2010的报告:不含C端苯丙氨酸的(pGlu)爱帕琳-13在体外对人体组织的APJ受体具有相似的亲和力和激动剂活性,这表明在人体中ACE2对爱帕琳的裂解并非唯一的失活步骤。实际上,El Messari及其合作者(2004)的结论是,ACE2裂解不太可能使爱帕琳肽失活,因为体外结构活性研究显示,不含C端苯丙氨酸的爱帕琳在CHO细胞中表达的大鼠爱帕琳受体处显示出类似的结合和功能活性。
尚不存在已公布的关于爱帕琳类似物的体外稳定性的数据。当前数据突出Phe向Ala、Tyr、Val的C端置换以及酰胺化C端的添加(图1和图3)的稳定性和有效性的改善。与原生爱帕琳-13相比,爱帕琳-13类似物(Val13)爱帕琳-13(t1/2 7.7h)、(Tyr13)爱帕琳-13(t1/28.5h)和爱帕琳-13-酰胺(t1/2 11.4h)在用瘦型小鼠血浆温育时均在2、4和8小时显示出显著更大的完整肽(t1/2 2.1h)。实际上,表3指示除了原生(pGlu)爱帕琳-13、爱帕琳-36和爱帕琳-12之外,所有测试的类似物均具有比爱帕琳-13显著更长的半衰期(t1/2),就等级次序而言,pGlu(Tyr13)爱帕琳-13和爱帕琳-13酰胺显示出最高的稳定性(除了此阶段改性的脂肪酸类似物之外)。
为了评估(Ala13)爱帕琳-13和(Val13)爱帕琳-13的拮抗特性,将这些肽在体内单独施用,以及与两种爱帕琳-13相关激动剂(Tyr13)爱帕琳-13和爱帕琳-13-酰胺(图6-10;表5)联合施用。当与表现为最有效拮抗剂的(Val13)爱帕琳-13联合施用时,(Ala13)爱帕琳-13和(Val13)爱帕琳-13两者均阻断(Tyr13)爱帕琳-13和爱帕琳-13-酰胺的降葡萄糖特性。
在高脂肪饲喂的NIH Swiss小鼠中进行急性体内研究后,显示(pGlu)爱帕琳-13-酰胺和爱帕琳-13-酰胺在降血糖和改善葡萄糖耐受性方面为最有前景的APJ受体激动剂(图5)。这些急性体内研究结果汇总于表4中。在高脂肪饲喂的NIH Swiss小鼠中,在腹膜内注射至少4小时后这两种类似物仍保持功效(图11),其中(pGlu)爱帕琳-13-酰胺保持功效最多8小时(图12)。
为了产生更长效作用的肽,合成爱帕琳-13-酰胺、(Tyr13)爱帕琳-13和(pGlu)爱帕琳-13-酰胺的脂肪酸类似物。使用在8位连接至赖氨酸(Lys)的ε-氨基的C16棕榈酸(PAL)基团。已产生GIP和GLP-1的许多酰化化合物,这些酰化化合物均显示出完全的酶稳定性和延长的药动学特征。脂肪酸部分向肽链中的掺入促进与蛋白质如白蛋白的结合,并从而延长作用的持续时间。与原生爱帕琳-13相比,显示这三种脂肪酸类似物Lys8GluPAL(Tyr13)爱帕琳-13、(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺(均含有经由谷氨酸接头(Glu)缀合至Lys8的C16脂肪酸(PAL))在用瘦型小鼠血浆温育时具有显著更大的完整肽(t1/2>24小时)(表3)。在高脂肪饲喂的NIH Swiss小鼠中进行急性体内研究后,显示pGlu(Lys8GluPAL)爱帕琳-13-酰胺和(Lys8GluPAL)爱帕琳-13-酰胺在评估降血糖和改善葡萄糖耐受性(图12)时为最具前景的,并且此类活性被保持并且甚至超过最多16小时(图13)。这些急性体内研究结果汇总于表6-9中。
在急性体内研究后,使用患有饮食诱发的胰岛素抗性和肥胖症的高脂肪饲喂的雄性NIH Swiss小鼠来在两次单独的研究中评估四种最有前景的类似物的慢性降葡萄糖和促胰岛素效应,即,爱帕琳-13-酰胺、(pGlu)爱帕琳-13-酰胺(它们的作用与有效GLP-1激动剂、毒蜥外泌肽-4(1-39)相比)(图14-23)以及(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺(它们的作用与脂肪酸GLP-1激动剂、利拉鲁肽相比)(图24-35)。
与急性测试的早先研究结果符合,高脂肪饲喂的小鼠显示出体重、食物摄取和高胰岛素血症的逐渐增加,这与葡萄糖耐受性异常以及胰岛素分泌和胰岛素敏感性降低相关联(Gault等2007)。每天两次施用爱帕琳-13-酰胺和(pGlu)爱帕琳-13-酰胺在研究的大致第20天显著降低了体重,并且只有(pGlu)爱帕琳-13-酰胺显著减少了食物摄取。(pGlu)爱帕琳-13-酰胺在研究的第10天开始显著减少循环血糖并增加血浆胰岛素浓度,如同毒蜥外泌肽-4(1-39)一样(图14-16)。两者在研究结束时均显著降低了血糖浓度。
(pGlu)爱帕琳-13-酰胺和毒蜥外泌肽-4(1-39)显示出对非空腹血浆胰岛素水平的显著增加,而爱帕琳-13-酰胺没有(图16)。(pGlu)爱帕琳-13-酰胺、爱帕琳-13-酰胺和毒蜥外泌肽-4(1-39)在腹膜内和经口葡萄糖负荷后均显著改善了葡萄糖耐受性和血浆胰岛素波动(28天治疗期后)(图17和图18)。此外,毒蜥外泌肽-4在葡萄糖负荷后对血糖浓度的效应负荷先前利用此肽的研究结果。用(pGlu)爱帕琳-13-酰胺得到的急性研究结果显示出有效的抗高血糖和促胰岛素特性;在利用类似物的28天长期施用后也注意到这种结果,因此巩固了急性研究中所观察到的效应。响应于饲喂(图19),(pGlu)爱帕琳-13-酰胺、毒蜥外泌肽-4(1-39)和爱帕琳-13-酰胺均显示出相似的血糖浓度降低水平和胰岛素分泌增加水平,其中与正常小鼠相比,(pGlu)爱帕琳-13-酰胺未显示出关于血糖的显著性。
(pGlu)爱帕琳-13-酰胺显著改善了胰岛素敏感性(图20)并且此研究结果符合Yue及其合作者(2010)的结论:爱帕琳是维持胰岛素敏感性体内所必需的。实际上,与高脂肪饲喂的盐水治疗对照相比,(pGlu)爱帕琳-13-酰胺还显示出糖化血红蛋白(HbA1c)的减少(图21)。
与高脂肪饲喂的对照(35.8%)相比,(pGlu)爱帕琳-13-酰胺显著降低了脂肪量百分比,而毒蜥外泌肽-4和爱帕琳-13-酰胺未达到显著性(图22B)。此外,与HF治疗的盐水组(10.3kcal/h)相比,(pGlu)爱帕琳-13-酰胺(11.5kcal/小时;P<0.05)增加了能量消耗(图23)。
每天一次施用pGlu(Lys8GluPAL)爱帕琳-13-酰胺在28天研究的第16天诱发显著的体重降低,而(Lys8GluPAL)爱帕琳-13-酰胺和利拉鲁肽在第21天显示出显著性(图24A)。实际上,pGlu(Lys8GluPAL)爱帕琳-13-酰胺将体重减少大约7%,而(Lys8GluPAL)爱帕琳-13-酰胺和利拉鲁肽分别将体重减少大约4%和3%(图24B)。pGlu(Lys8GluPAL)爱帕琳-13-酰胺、(Lys8GluPAL)爱帕琳-13-酰胺和利拉鲁肽在研究的第8天均显著减少了食物摄取(图25)。(Lys8GluPAL)爱帕琳-13-酰胺和利拉鲁肽在研究的第10天开始显著减少循环血糖并增加血浆胰岛素浓度,而pGlu(Lys8GluPAL)爱帕琳-13-酰胺在第13天显示出显著性(图26)。
响应于腹膜内和经口葡萄糖耐量筛查(glucose challenge),利拉鲁肽(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺在28天治疗期后均显著改善了葡萄糖耐受性和血浆胰岛素波动(图27和图28),其中当与正常小鼠相比时,pGlu(Lys8GluPAL)爱帕琳-13-酰胺在腹膜内葡萄糖耐量筛查后在降血糖方面未显示出显著差异。在饲喂试验后治疗期之后观察到相似的模式(图29)。
(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺显著改善了胰岛素敏感性并且此效应大于利用利拉鲁肽所观察到的效应(图30)。另外,在仅28天治疗后,相对于瘦型对照,pGlu(Lys8GluPAL)爱帕琳-13-酰胺显著降低了HbA1c水平,超过(Lys8GluPAL)爱帕琳-13-酰胺和利拉鲁肽。
DEXA分析表明,(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺与高脂肪饲喂的盐水对照小鼠(36.2%)相比显著降低了脂肪量百分比(30.8%;分别为P<0.05且30.1%;P<0.05),并且未观察到与瘦型对照相比的显著性。然而,利拉鲁肽治疗小鼠与瘦型对照相比显示出显著更高的脂肪量百分比(图32)。
与高脂肪饲喂的盐水对照小鼠(13.0kcal/小时)相比,(Lys8GluPAL)爱帕琳-13-酰胺(15.4kcal/小时;p<0.05)和pGlu(Lys8GluPAL)爱帕琳-13-酰胺(16.0kcal/小时;p<0.05)在24小时时段内在CLAMS室中消耗显著更多的能量并且利拉鲁肽未达到显著性(图33)。这可解释利用这些肽观察到的显著体重降低。
这些观察指示,利用(pGlu)爱帕琳-13-酰胺进行的28天长期治疗甚至与用确立的肠降血糖素疗法毒蜥外泌肽-4治疗相比时也显示出增强的治疗特性,毒蜥外泌肽-4为T2D疗法中广泛使用的非常确实的GLP-1拟似物。此外,利用脂肪酸类似物pGlu(Lys8GluPAL)爱帕琳-13-酰胺进行的28天长期治疗与长效作用的GLP-1激动剂、利拉鲁肽进行的治疗相比显示出相似的甚至增强的治疗特性。
利拉鲁肽、(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺均显著降低血浆甘油三酯水平,其中pGlu(Lys8GluPAL)爱帕琳-13-酰胺表现为最有效的。pGlu(Lys8GluPAL)爱帕琳-13-酰胺为经测试可显著降低血浆中的总胆固醇水平的唯一的肽(图34)。与高脂肪饲喂的对照相比,(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺均显著降低了LDL-胆固醇水平,与饲喂正常饮食的瘦型对照小鼠相似。与瘦型对照和高脂肪饲喂的小鼠相比,(Lys8GluPAL)爱帕琳-13-酰胺和pGlu(Lys8GluPAL)爱帕琳-13-酰胺也均显著增加了HDL-胆固醇水平。
参考文献
Boucher J,Masri B,Daviaud D,Gesta S,Guigne C,Mazzucotelli A,Castan-Laurell I,Tack I,Knibiehler B,Carpene C,Audigier Y,Saulnier-Blache JS&Valet P(2005)Apelin,a newly identified adipokine up-regulated by insulin and obesity.Endocrinology 146 1764-71.
Castan-Laurell I,Vitkova M,Daviaud D,Dray C,Kovacikova M,Kovacova Z,Hejnova J,Stich V&Valet P 2008 Effect of hypocaloric diet-induced weight loss in obese women on plasma apelin and adipose tissue expression of apelin and APJ.European Journal of Endocrinology 158 905-10.
Cheng B,Chen J,Bai B&Xin Q 2012 Neuroprotection of apelin and its signalling pathway.Peptides 37 171-173.
Chun HJ,Ali ZA,Kojima Y,Kundu RK,Sheikh AY,Agrawal R,Zheng L,Leeper NJ,Pearl NE,Patterson AJ,Anderson JP,Tsao PS,Lenardo MJ,Ashley EA&Quertermous T 2008 Apelin signalling antagonizes Ang II effects in mouse models of atherosclerosis.Journal of Clinical Investigation 118 3343-3354.
Dray C,Knauf C,Daviaud D,Waget A,Boucher J,Buléon M,Cani PD,Attané C,Guigné C,Carpéné C,Burcelin R,Castan-Laurell I&Valet P 2008 Apelin stimulates glucose utilization in normal and obese insulin-resistant mice.Cell Metabolism 8 437-45.
El Messari S,Iturrioz X,Fassot C,De Mota N,Roesch D&Llorens-Cortes C 2004 Functional dissociation of apelin receptor signaling and endocytosis:implications for the effects of apelin on arterial blood pressure.Journal of Neurochemistry 90 1290-301.
Gault VA,McClean PL,Cassidy RS,Irwin N&Flatt PR 2007 Chemical gastric inhibitory polypeptide receptor antagonism protects against obesity,insulin resistance,glucose intolerance and associated disturbances in mice fed high-fat and cafeteria diets.Diabetologia 50 1752-1762.
Higuchi K,Masaki T,Gotoh K,Chiba S,Katsuragil,Tanaka K,Kakuma T&Yoshimatsu H 2007 Apelin,an APJ receptor ligand,regulates body adiposity and favours the messenger ribonucleic acid expression of uncoupling proteins in mice.Endocrinology 148 2690-7.
Kidoya H&Takakura N 2012 Biology of the apelin-APJ axis in vascular formation.Journal of Biochemistry 152 125-131.
Kawamata Y,Habata Y,Fukusumi S,Hosoya M,Fujii R,Himuma S,Nishizawa N,Kitada C,Onda H,Nishimura O&Fujino M 2001 Molecular properties of apelin:tissue distribution and receptor binding.Biochimica et Biophysica Acta 23 162-71.
Lee DK,Saldivia VR,Nguyen T,Cheng R,George SR&O′Dowd BF 2005 Modification of the terminal residue of apelin-13 antagonizes its hypotensive action.Endocrinology 146 231-236.
Liu QF,Yu HW,You L,Liu MX,Li KY&Tao GZ 2013 Apelin-13-induced proliferation and migration induced of rat vascular smooth muscle cells is mediated by the upregulation of Egr-1.Boichemical and Biophysical Research Communications doi:10.1016/j.bbrc.2013.08.051
Mitra A,Katovich,MJ,Mecca A,Rowland NE 2006 Effects of central and peripheral injections of apelin on fluid intake and cardiovascular parameters in rats.Physiology&Behaviour 89 221-225.
O′Shea M,Hansen MJ,Tatemoto K&Morris MJ 2003 Inhibitory effect of apelin-12 on nocturnal food intake in the rat.Nutritional Neuroscience 3 163-7
Pitkin SL,Maguire JJ,Bonner TI&Davenport AP 2010 International Union of Basic and Clinical Pharmacology.LXXIV.Apelin receptor nomenclature,distribution,pharmacology,and function.Pharmacological Reviews 62 331-42.
Quazi R,Palaniswamy C&Frishman WH 2009 The emerging role of apelin in cardiovascular disease and health.Cardiology Reviews.17 283-286.
C,Nitert MD,Bennet H,Fex M,Valet P,Rehfeld JF,Friis-Hansen L&Wierup N 2010 Apelin is a novel islet peptide.Regulatory Peptides 162 44-51.
Winzell M,Magnusson C&Ahren B 2005 The APJ receptor is expressed in pancreatic islets and its ligand,apelin,inhibits insulin secretion in mice.Regulatory Peptides 131 12-17.
Sunter D,Hewson AK&Dickson SL 2003 Intracerebroventricular injection of apelin-13 reduces food intake in the rat.Neuroscience Letters 353 1-4.
Tatemoto K,Hosoya M,Habata Y,Fujii R,Kakegawa T,Zou MX,Kawamata Y,Fukusumi S,Hinuma S,Kitada C,Kurokawa T,Onda H&Fujino M 1998 Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor.Biochemical and Biophysical Research Communications 251 471-6.
Valle A,Hoggard N,Adams AC,Roca P&Speakman JR 2008 Chronic central administration of apelin-13 over 10 days increases food intake,body weight,locomotor activity and body temperature in C57BL/6mice.Journal of Neuroendocrinology 20 9-84.
Vickers C,Hales P,Kaushik V,Dick L,Gavin J,Tang J,Godbout K,Parsons T,Baronas E,Hsieh F,Acton S,Patane M,Nichols A&Tummino P 2002Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase.The Journal of Biological Chemistry 277 14838-43.
Xu S,Han P,Huang M,Wu JC,Chang C,Tsao PS&Yue P 2010In vivo,ex vivo,and in vitro studies on apelin′s effect on myocardial glucose uptake.Peptides 37 320-6.
Yue P,Jin H,Aillaud M,Deng AC,Azuma J,Asagami T,Kundu RK,Reaven GM,Quertermous T&Tsao PS 2010Apelin is necessary for the maintenance of insulin sensitivity.American Joumal of Physiology,Endocrinology and Metabolism 298 59-6.
Zhu S,Sun F,Li W,Cao Y,Wang C,Wang Y,Liang D,Zhang R,Zhang S,Wang H,Cao F 2011 Apelin stimulates glucose uptake through the PI3K/Akt pathway and improves insulin resistance in 3T3-L1 adipocytes.Molecular and Cellular Biochemistry 353 303-313.
本发明不限于本文所述的实施方案,但在不脱离本发明范围的情况下可进行修正或修改。
- 还没有人留言评论。精彩留言会获得点赞!