低取代的多粘菌素以及它们的组合物的制作方法
本发明涉及新的低取代的多粘菌素以及它们的组合物。
背景技术:
在1947年发现了作为由多粘芽孢杆菌(Bacillus polymyxa)产生的抗生素的多粘菌素。多粘菌素是含有七肽环和N-端酰胺偶联脂肪酸的抗生素十肽。如今,两种商业化的多粘菌素混合物已在临床使用中;多粘菌素B和多粘菌素E(粘菌素)。两种混合物包含在Goevaerts等人的J Chromatogr A.2002 Nov 8;976(1-2):65-78以及在Van den Bossche等人的Talanta 2011 Feb 15;83(5):1521-9中所描述的多种组分。根据欧洲药典(European pharmacopoeia),粘菌素应包含大于77%的多粘菌素E1、E2、E3、E1-i和E1-7MOA,且较少组分多粘菌素E3、E1-i和E1-7MOA的每种小于10%。
由于与粘菌素有关的毒性,在1950年代通过磺甲基化对混合物进行改善。磺甲基化的粘菌素被称为粘菌素甲烷磺酸钠(Colistimethate sodium,CMS),其已经被当作是粘菌素的前体药物。CMS作为用于多重耐药微生物,如绿脓杆菌(Pseudomonas aeruginosa)、鲍氏不动杆菌(Acinetobacter baumannii)、肺炎克雷伯氏菌(Klebsiella pneumonia)以及其他革兰氏阴性病原体(Gram negative pathogen)的最后防线治疗选择仍用于临床应用。多年来,通过雾化至患有囊性纤维化(CF)的患者的肺部,也已经将CMS的溶液进行给药,从而控制由绿脓杆菌引起的定殖或感染。
现今,由耐抗生素的病原体所引起的感染问题的增加已经导致产品如粘菌素的使用增加。
事实上,含有不同多粘菌素的衍生物的复杂混合物的商业CMS产品具有若干不良的后果。这些首要地涉及到任何市售的产品的治疗价值。由于CMS可以被认为是在注入或吸入至身体内之后的抗生素贮存器(antibiotic-reservoir),所以重要的是在肾或代谢的清除之前达到活化化合物的治疗水平。因此,仅含有两个磺基甲基取代基的磺甲基化多粘菌素提供了与分子量和电荷相关的良好限定的产物。
因此,本发明的一个目的是提供改善的多粘菌素化合物和用作为抗菌剂的组合物,以及克服或至少减轻先前技术产品的缺点。
技术实现要素:
本发明涉及包含连接至多粘菌素的多肽部分中的DAB或DAP残基上的γ-氨基基团的总共两个磺基甲基基团的多粘菌素。这些化合物和它们的组合物可以用于细菌感染的治疗。
在一个方面中,本发明提供了比多粘菌素E和多粘菌素B更易溶于水的新的多粘菌素。在又一个方面中,本发明提供了在水溶液中比市售的CMS更稳定的磺甲基化多粘菌素。在又一个方面中,本发明提供了比市售的CMS更均匀的磺甲基化多粘菌素的混合物。最后,与现有技术的多粘菌素组合物相比,本发明化合物或者它们的混合物或组合物提供了目前没有良好限定的改善的多粘菌素剂量和疗法。
因此,本发明提供了由式(I)表示的新的多粘菌素:
其中
R1是脂肪族的直链或支链的C6-C10酰基基团或者
R5是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2C6H5;
R6是–CH(CH3)2、–CH2CH(CH3)2或–CH(CH3)CH2CH3;
R2、R3、R4、R7和R8中的每一个是–(CH2)xCH2NH2或者
–(CH2)xCH2N(CH2SO3M)2;
其中x是0或1;
其中M是阳离子;以及
条件是R2、R3、R4、R7和R8中的一个是–(CH2)xCH2N(CH2SO3M)2。
根据本发明的一个实施方式,提供了由式(I)表示的多粘菌素;其中,将两个磺基甲基基团连接至相同的γ-氨基基团。
根据本发明的另一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2;
R3、R4、R7和R8中的每一个是–CH2CH2NH2;
以及;
R2是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2;
R2、R4、R7和R8中的每一个是–CH2CH2NH2;
以及;
R3是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2;
R2、R3、R7和R8中的每一个是–CH2CH2NH2;
以及;
R4是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2;
R2、R3、R4和R8中的每一个是–CH2CH2NH2;
以及;
R7是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2;
R2、R3、R4和R7中的每一个是–CH2CH2NH2;
以及;
R8是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2或CH2C6H5;
R3、R4、R7和R8中的每一个是–CH2CH2NH2;
以及;
R2是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2或CH2C6H5;
R2、R4、R7和R8中的每一个是–CH2CH2NH2;
以及;
R3是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2或CH2C6H5;
R2、R3、R7和R8中的每一个是–CH2CH2NH2;
以及;
R4是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2或CH2C6H5;
R2、R3、R4和R8中的每一个是–CH2CH2NH2;
以及;
R7是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的又一个实施方式,提供了由式(I)表示的多粘菌素;其中,R1是脂肪族的直链或支链的C6-C10酰基基团;
R5和R6是–CH2CH(CH3)2或CH2C6H5;
R2、R3、R4和R7中的每一个是–CH2CH2NH2;
以及;
R8是–CH2CH2N(CH2SO3M)2。
其中M是一价阳离子。
根据本发明的以上实施方式的另一个方面,R1是6-甲基辛酰基。
根据本发明的以上实施方式的另一个方面,R1是6-甲基庚酰基。
根据本发明的又一个实施方式,提供了式(I)的多粘菌素,其中R1是脂肪族的直链或支链的C6-C10酰基基团或者
R5是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2C6H5;
R6是–CH(CH3)2、–CH2CH(CH3)2或–CH(CH3)CH2CH3;
R2、R3、R4、R7和R8中的每一个是–CH2NH2或–CH2N(CH2SO3M)2;
其中M是阳离子;以及
条件是R2、R3、R4、R7和R8中的一个是CH2N(CH2SO3M)2。
本发明进一步提供了包含根据本发明的一种或多种多粘菌素的药物组合物。
根据本发明的组合物可以进一步包含一种或多种药学上可接受的赋形剂。
根据一个实施方式,根据本发明的药物组合物包含如通过高效液相色谱法(HPLC)测量的大于50%的根据本发明的多粘菌素。
根据又一个实施方式,根据本发明的药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素。
根据又一个实施方式,根据本发明的药物组合物包含如通过HPLC测量的大于80%的由式(I)表示的多粘菌素。
根据又一个实施方式,根据本发明的药物组合物包含如通过HPLC测量的大于90%的由式(I)表示的多粘菌素。
根据又一个实施方式,本发明的组合物包含如通过HPLC测量的大于50%的由图1-5的式表示的一种或多种多粘菌素。
根据又一个实施方式,本发明的组合物包含如通过HPLC测量的大于80%的由图1-5的式表示的一种或多种多粘菌素。
根据又一个实施方式,本发明的组合物包含如通过HPLC测量的大于90%的由图1-5的式表示的一种或多种多粘菌素。
第一实施方式涉及由式(I)表示的多粘菌素:
其中
R1是脂肪族的直链或支链的C6-C10酰基基团或者
R5是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2C6H5;
R6是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2CH2CH3;
R2、R3、R4、R7和R8中的每一个是–(CH2)xCH2NH2或
–(CH2)xCH2N(CH2SO3M)2;
其中x是0或1;
其中M是阳离子;以及
其中R2、R3、R4、R7和R8中的一个是–(CH2)xCH2N(CH2SO3M)2。
在第一实施方式的第一方面中,R1是庚酰基、甲基庚酰基、辛酰基、甲基辛酰基、壬酰基、甲基壬酰基或癸酰基。
在第一实施方式的第二方面中,R1是庚酰基、6-甲基庚酰基、辛酰基、(S)-6-甲基辛酰基、7-甲基辛酰基、3-羟基-6-甲基辛酰基、壬酰基、(8-甲基壬酰基或癸酰基。
在第一实施方式的第三方面中,前文描述的多粘菌素的特征在于M选自由Na+、K+、1/2Mg2+、HmN(C1-4烷基)n+或它们的组合所组成的组,其中m是0-4且n是0-4,条件是m+n=4。
在第一实施方式的第四方面中,x是1且M是H+、Na+或K+。
在第一实施方式的第五方面中,x是1且M是Na+或K+。
第二实施方式涉及一种含有至少一种由式(I)表示的多粘菌素的组合物:
其中
R1是脂肪族的直链或支链的C6-C10酰基基团或
R5是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2C6H5;
R6是–CH(CH3)2、–CH2CH(CH3)2、–CH(CH3)CH2CH3或–CH2CH2CH3;
R2、R3、R4、R7和R8中的每一个是–(CH2)xCH2NH2或
–(CH2)xCH2N(CH2SO3M)2;
其中x是0或1;
其中M是阳离子;以及
其中R2、R3、R4、R7和R8中的一个是–(CH2)xCH2N(CH2SO3M)2。
在第二实施方式的第一方面中,R1是庚酰基、甲基庚酰基、辛酰基、甲基辛酰基、3-羟基-6-甲基辛酰基、壬酰基、甲基壬酰基或癸酰基。
在第二实施方式的第二方面中,R1是庚酰基、6-甲基庚酰基、辛酰基、(S)-6-甲基辛酰基、3-羟基-6-甲基辛酰基、7-甲基辛酰基、壬酰基、8-甲基壬酰基或癸酰基。
在第二实施方式的第三方面中,前文描述的多粘菌素的特征在于M选自由Na+、K+、HmN(C1-4烷基)n+、1/2Mg2+或它们的组合所组成的组,其中m是0-4且n是0-4,条件是m+n=4。
在第二实施方式的第四方面中,x是1且M是H+、Na+或K+。
在第二实施方式的第五方面中,x是1且M是Na+或K+。
在第二实施方式的第六方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素。
在第二实施方式的第七方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素,并且x是1且M是Na+或K+。
第三实施方式涉及由式(I)表示的多粘菌素:
其中
R1是脂肪族的直链或支链的C6-C10酰基基团;
R5是–CH2CH(CH3)2或–CH2C6H5;
R6是–CH2CH(CH3)2;
R2、R3、R4、R7和R8中的每一个是–CH2CH2NH2或–CH2CH2N(CH2SO3M)2;
其中M是阳离子;以及
其中R2、R3、R4、R7和R8中的仅一个是–CH2CH2N(CH2SO3M)2。
在第三实施方式的第一方面中,脂肪族的C6-C10酰基基团或支链的C6-C10酰基基团可选地包含羟基基团。
第四实施方式涉及一种含有至少一种由式(I)表示的多粘菌素的组合物:
其中
R1是脂肪族的直链或支链的C6-C10酰基基团;
R5是–CH2CH(CH3)2或–CH2C6H5;
R6是–CH2CH(CH3)2;
R2、R3、R4、R7和R8中的每一个是–CH2CH2NH2或–CH2CH2N(CH2SO3M)2;
其中M是阳离子;以及
其中R2、R3、R4、R7和R8中的仅一个是–CH2CH2N(CH2SO3M)2。
在第四实施方式的第一方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素。
在第四实施方式的第二方面中,药物组合物包含如通过HPLC测量的大于80%的由式(I)表示的多粘菌素。
在第四实施方式的第三方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素,并且该药物组合物用于治疗由革兰氏阴性细菌引起的感染。
在第四实施方式的第四方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素,并且M选自于药学上可接受的阳离子。
在第四实施方式的第五方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素,并且M选自于药学上可接受的一价阳离子。
在第四实施方式的第六方面中,脂肪族的C6-C10酰基基团或支链的C6-C10酰基基团可选地包含羟基基团。
第五实施方式涉及一种含有至少一种由式(I)表示的多粘菌素的组合物:
其中
R1是6-甲基辛酰基、6-甲基庚酰基或辛酰基;
R5是–CH2CH(CH3)2或–CH2C6H5;
R6是–CH2CH(CH3)2;
R2、R3、R4、R7和R8中的每一个是–CH2CH2NH2或–CH2CH2N(CH2SO3Na)2;
以及
其中R2、R3、R4、R7和R8中的仅一个是–CH2CH2N(CH2SO3Na)2。
在第五实施方式的第一方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素。
在第五实施方式的第二方面中,药物组合物包含如通过HPLC测量的大于80%的由式(I)表示的多粘菌素。
在第五实施方式的第三方面中,药物组合物包含如通过HPLC测量的大于50%的由式(I)表示的多粘菌素,并且该药物组合物用于治疗由革兰氏阴性细菌引起的感染。
详细说明
附图的简要说明
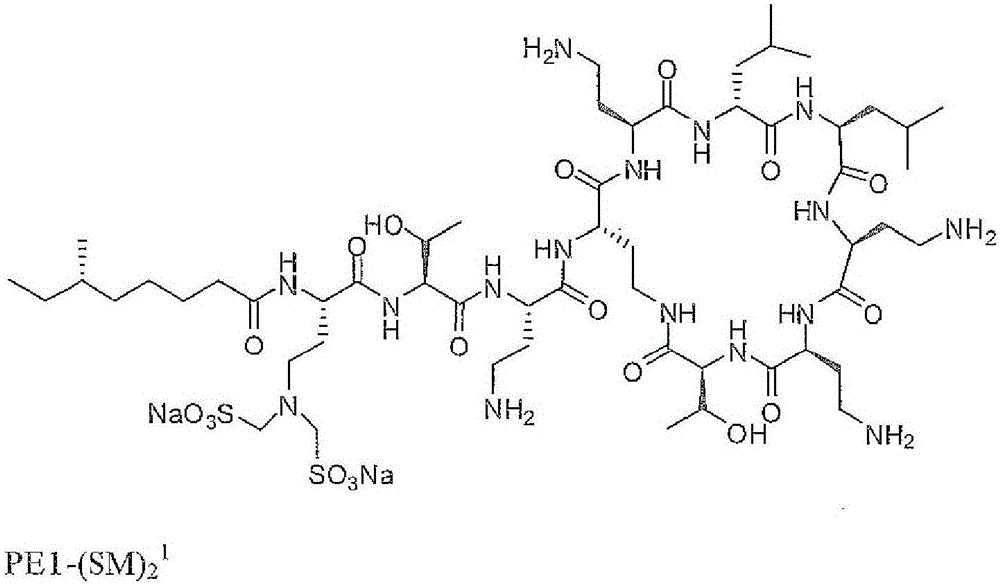
图1示出了PE1-(SM)21的二钠盐的结构
图2示出了PE1-(SM)23的二钠盐的结构
图3示出了PE1-(SM)25的二钠盐的结构
图4示出了PE1-(SM)28的二钠盐的结构
图5示出了PE1-(SM)29的二钠盐的结构
图6示出了PE1-(SM)101,3,5,8,9的色谱图
图7示出了在非平衡条件下在90分钟(pH 9)之后的PE1-(SM)101,3,5,8,9的降解。
图8示出了在非平衡条件下在3天(pH 8.0)之后的PE1-(SM)101,3,5,8,9的降解。
图9示出了在非平衡条件下在3天(pH 7.0)之后的PE1-(SM)101,3,5,8,9的降解。
图10示出了在非平衡条件下在3天(pH 6.5)之后的PE1-(SM)101,3,5,8,9的降解。
图11示出了在非平衡条件下在3天(pH 6.0)之后的PE1-(SM)101,3,5,8,9的降解。
图12示出了对于两种取代的多粘菌素E1获得的MS谱。以负模式m/z 677.3[-2]和1355.5[-1]获得。
图13(上部)示出了确认五种单独的包含两个磺甲基基团的多粘菌素组分的存在的色谱图(UV信号在215nm下)。
图13(下部)示出了对应于单(双-磺甲基化)多粘菌素E1的质量的引出束流(EIC)(677.62、1356.2、1378.06的m/z)。
图14示出了单(双-磺甲基化)多粘菌素E1的质谱。
定义
如贯穿本说明书和所附权利要求书所使用的,以下术语具有以下含义:
如在本文中描述的术语“多粘菌素”是指包含与脂肪酸部分酰胺偶联的肽部分的抗生素化合物。
如在本文中描述的术语“Dab残基”是指与至少一个氨基酸酰胺偶联的2,4-二氨基丁酸酯化合物。天然存在的多粘菌素通常包含6个Dab残基,其中5个具有游离的γ-氨基基团。
如在本文中描述的术语“Dab”是指衍生自2,4-二氨基丁酸的残基,其中与羰基碳相邻的碳原子(即α-碳)具有指定为L-构型的立体化学。L-Dab在文献中可替代地被称为L-Dbu。
由式(I)表示的多粘菌素中位置6的氨基酸具有D-构型,即将R5连接的氨基酸残基。
如在本文中描述的术语“DAP残基”是指与至少一个氨基酸酰胺偶联的2,3-二氨基丙酸酯化合物。
如在本文中描述的术语“DAP”是指化合物2,3-二氨基丙酸酯。
如在本文中描述的术语“磺甲基”是指-CH2SO3M部分,其中M如下所定义。磺酸酯(-SO3)部分可以是酸性形式,但在生理环境(体内)中,它将具有负电荷并且将具有相关联的阳离子,例如M。
如在本文中描述的术语“CMS”是指包含磺甲基化的粘菌素的组合物。化学文摘(Chemical abstract)已经为CMS分配了这类组合物编号8068-28-8。
如在本文中描述的术语“CMS E1”是指由相对纯的多粘菌素E1(通过HPLC测量的>80%纯)的磺甲基化制备的组合物。
如在本文中描述的术语“粘菌素”是指包含多粘菌素E1和多粘菌素E2的组合物。化学文摘为粘菌素已经分配了编号1066-17-7。根据欧洲药典,粘菌素应包含大于77%的多粘菌素E1、E2、E3、E1i和E1-7MOA,且较小组分多粘菌素E3、E1-i和E1-7MOA的每种少于10%。
如在本文中描述的术语“多粘菌素E”可与“粘菌素”互换使用。
如在本文中描述的术语“多粘菌素E1”是指具有CAS号7722-44-3的化合物。多粘菌素E1可与粘菌素A互换使用。
如在本文中描述的术语“多粘菌素E2”是指具有CAS号7239-48-7的化合物。多粘菌素E2可与粘菌素B互换使用。
如在本文中描述的表述“磺甲基化多粘菌素”是指包含至少一个连接至L-DAB残基上的γ-氨基基团的磺甲基基团的多粘菌素。
术语“M”是阳离子并且是指含有一个或两个正电荷的阳离子物质,其实例包括但不限于Li+、Na+、K+、1/2Mg2+、HmN(C1-4烷基)n+,其中m为0-4且n为0-4,条件是m+n=4。
如在本文中描述的表述“脂肪族的直链或支链C6-C10酰基基团”是指含有羰基部分和包含总共6至10个碳原子的非羰基部分的取代基。它包括在已知的多粘菌素化合物中发现的酰基基团。它还包括但不限于庚酰基、甲基庚酰基(包括(S)-6-甲基庚酰基)、辛酰基、甲基辛酰基(包括(S)-6-甲基辛酰基、7-甲基辛酰基)、壬酰基、甲基壬酰基和癸酰基。
如在本文中描述的术语“盐”或“它们的盐是指包含阳离子和阴离子的化合物,其可以通过普通技术人员已知的任何方法制备,例如通过接受质子部分的质子化和/或供给质子部分的去质子化。可替换地,可以通过阳离子/阴离子的复分解或阳离子/阴离子的交换反应制备该盐。
如在本文中描述的术语“通过HPLC测量的大于X%”应理解为由在本申请的实施例中描述的或者可替换地如WO2014195405A1中所描述的HPLC方法得到的色谱中相关峰的相对积分面积。
根据本发明,提供了包含两个磺甲基基团的新型的多粘菌素,该磺甲基基团连接至具有游离γ-胺的以上结构的任何Dab残基,即Dab残基Dab1、Dab3、Dab5、Dab8或Dab9中的任一个。因此,式(I)旨在涵盖单(双-磺甲基化)多粘菌素,而不是三-、四-或五(双-磺甲基化)多粘菌素。
新的多粘菌素的实例在本文中被称为单(Nγ-双-磺甲基)Dab9多粘菌素E1,即其中式I的取代基表示为R1是6-甲基辛酰基,R5和R6为-CH2CH(CH3)2;R2、R3、R4和R7中的每一个是-CH2CH2NH2;以及R8是-CH2CH2N(CH2SO3M)2
其中M是Na+。在图5中示出了这种化合物的实例。该化合物的缩写名为PE1-(SM)29。
单双-磺基甲基化多粘菌素的其他实例是单(Nγ-双-磺甲基)Dab1多粘菌素E1、单(Nγ-双-磺甲基)Dab3多粘菌素E1、单(Nγ-双-磺甲基)Dab5多粘菌素E1、单(Nγ-双-磺甲基)Dab8多粘菌素E1,在图1-4中分别示出了它们的二钠结构。
表述“-CH2CH2NH2”应理解为涵盖-CH2CH2NH2或-CH2CH2NH3+,取决于介质的pH。
表述“-CH2NH2”应理解为涵盖-CH2NH2或-CH2NH3+,取决于介质的pH。
在本文中描述的多粘菌素包括许多分子种类。例如在水溶液中,电荷将取决于pH。在本文中描述的多粘菌素化合物涵盖它们的所有药学上可接受的盐和离子。在这些中,多粘菌素当然是二钠盐。其他药学上可接受的盐也包括在内,例如,钾、锂和铵盐(如HmN(C1-4烷基)n+,其中m为0-4且n为0-4,条件是m+n=4)或它们的组合。
如在本文中描述的多粘菌素可用于治疗或预防感染性疾病,特别是由革兰氏阴性细菌引起的感染,该革兰氏阴性细菌如但不限于,绿脓杆菌(Pseudomonas aeruginosa)、肺炎克雷伯氏菌(Klebsiella pneumonia)和鲍氏不动杆菌(Acinetobacter baumannii)、大肠杆菌(Eschericia coli)和产气肠杆菌(Enterobacter aerogenes)。根据一个方面,本发明包括包含有效量的本文描述的任何组合物的药物组合物在治疗革兰氏阴性细菌感染中的用途。
可以以治疗有效量给药本发明化合物。“治疗有效量”旨在描述足以治疗感染的化合物的量。技术人员将认识到,特定患者的合适的日剂量可根据如所治疗的病症及其严重性;使用的组合物,患者的年龄、体重、性别和饮食,以及所涉及的医师的倾向和经验等的因素变化。
可以给药根据本发明的组合物用于人类以及兽医学的用途。可以经由各种途径,如皮下,通过吸入、口服、肠胃外或局部途径将本文描述的组合物给药至需要的患者。组合物可以是本领域技术人员熟知的任何形式,且包括例如片剂、胶囊、粉末、颗粒、锭剂、霜剂或液体制剂,如无菌的注入液或悬浮液。
在一个方面中,组合物可用于通过静脉输注或注射而给药。可以根据技术人员熟知的方法制备静脉内或注射制剂。例如,可以将在本文描述的化合物溶解于用于注射的水中,随后过滤灭菌,进一步地将所述过滤的组合物转移至合适的小瓶中。
根据一个方面,组合物是冻干的。在使用前,例如在通过注射给药之前,或在通过吸入给药(例如,使用喷雾器或任何其他合适的吸入设备)之前,将冻干的粉末重新组成,例如在用于注射的水中。因此,根据另一个方面,配制用于通过吸入给药的组合物。
本文描述的化合物可以进一步地包含一种或多种药学上可接受的赋形剂(辅料,excipient),包括但不限于防腐剂、缓冲剂和抗氧化剂或稀释剂。合适的稀释剂包括,例如用于注射的水、0.9%的NaCl、0.9%的NaCl中的5%的葡萄糖、水中的5%的葡萄糖、0.45%的NaCl中的5%的葡萄糖、0.225%的NaCl中的5%的葡萄糖和乳酸林格氏溶液(Lactated Ringer’s solution)。
此外,可以将本文公开的化合物与一种或多种另外的抗细菌剂组合该给药。当与另一抗菌剂组合使用时,本文描述的化合物可与一种或多种其他的抗菌剂同时地、分开地或依次地给药。
下面通过实施例的方式进一步地说明了本发明。应当理解,本发明的范围不以任何方式受限于以下实施例的范围。
实施例
根据以下实验性部分进一步地支持和举例说明了本公开,但不受限于其中。
实施例1:
起始材料.
将分离的多粘菌素E1硫酸盐(3.5g)与45%w/w的羟基甲烷硫酸钠的水溶液(11.3g)混合且加温至60℃,同时搅拌。然后通过几次添加2M的NaOH将pH保持在7.0-7.5。在18个小时之后,将混合物冷却至周围温度,并且通过在200mL的甲醇/乙腈(1/1v/v)中沉淀,将粗产物提供为白色固体。
通过以下步骤将产物脱盐和精处理(polish):洗涤C18柱6μ(例如Phenomenex X Bridge Prep Shield 10×250mm)或相似物且用5%的MeCN(无盐)平衡。将柱安装于Waters Delta Prep HPLC系统中,150mL/min的最大流速。检测器是调节至280nm的5a Waters 2487。将9mL的230mg PE1-(SM)101,3,5,8,9的5%MeCN溶液和1mL的2M NaCl的混合物加载于柱并且流速是6-8mL/min。
以6-8mL/min用5%的MeCN将柱洗脱并脱盐,并且收集PE1-(SM)101,3,5,8,9馏分。在过程期间在柱中出现一些降解,但是通过将头部和尾部切割掉,保持高纯度。在2L的梨形蒸发烧瓶中的97:3的MeCN:H2O溶液的真空蒸发之前,将头部馏分(Head Fraction),ca.35mL直接地收集至450mL 100%的MeCN中,并且添加另外的550mL 100%的MeCN。
利用Büchi 15旋转蒸发仪(Rotavapor)进行蒸馏过程。94:6的共沸物馏出使得不含水的PE1-(SM)101,3,5,8,9残留在2L的真空蒸馏烧瓶中。用3×8mL 100%的MeOH(干)将残余物移除并且倾倒至50mL的真空蒸发烧瓶中,并且真空蒸发至1-2mL的MeOH-PE1-(SM)101,3,5,8,9悬浮液。添加15mL 100%的MeCN,并且在用35℃的水浴温度干燥的情况下,将20溶液/悬浮液进一步地真空蒸发。在该过程期间,压力从70-60托降低至20-15托。进一步地利用在保持真空的35℃水浴中减缓旋转进行真空干燥30分钟。产率是150mg的PE1-(SM)101,3,5,8,9物质。
实施例2
包含单(Nγ-双-磺甲基)多粘菌素E1的混合物的生产。
当磺甲基化多粘菌素降解接近于粘菌素时,释放羟基甲烷磺酸酯。由于羟基甲烷磺酸酯易于再生母磺甲基化分子,因此该过程是可逆的。
该研究的目的是研究通过使用纳米过滤连续地去除羟基甲烷磺酸酯在非平衡条件下磺甲基化多粘菌素的降解。
在RO水中使用2L的10mM PE1-(SM)101,3,5,8,9建立实验,并且通过频繁地添加RO水,将溶液的体积在过滤单元中保持恒定。纳米过滤单元在40C在3巴压力下运行每日活动,每次去除约5l的流出液。用0.1M HCl调节pH直至稳定至8.0、7.0、6.5和6.0。在图6-11中示出了结果。
MS数据确定了多粘菌素的二磺甲基化。图12示出了以负模式(m/z677.3[-2]和1355.5[-1])获得的MS谱。
实施例3:低取代的粘菌素的合成。
将粘菌素硫酸盐(1.0g,0.71mmol)溶于20ml水中。添加45%的羟基甲烷磺酸钠(0.847g,2.841mmol)和NaHCO3(0.12g,1.40mmol)。将透明溶液在25℃下搅拌12h。通过缓慢添加100ml的乙腈和甲醇(50:50)沉淀出产物。将产物分离为白色粉末。
实施例4a:低取代的多粘菌素E1的合成。
将多粘菌素E1(1.0g,0.71mmol)溶于20ml水中。添加45%的羟基甲烷磺酸钠(0.847g,2.841mmol)和NaHCO3(0.12g,1.40mmol)。将澄清溶液(clear solution)在25℃下搅拌12小时。通过缓慢添加100ml的乙腈和甲醇(50:50)沉淀出产物。将产物分离为白色粉末。
实施例4b:低取代的多粘菌素E1的色谱和MS。
使用质谱(负模式的MS)和UV兼容的方法分析由实施例4a制备的单(双-磺甲基化)多粘菌素E1,其中在pH 6.6下进行分离。图13的上部示出了确认包含两个磺甲基的五种单独的多粘菌素组分存在的色谱图(在215nm处的UV信号)。图13的下部示出了对应于单(双-磺甲基化)多粘菌素E1的质量的引出束流(extracted ion current,EIC)(677.62、1356.2、1378.06的m/z)。
图14示出了单(双-磺甲基化)多粘菌素E1的单独的质谱。677的m/z对应于单(双-磺甲基化)多粘菌素E1的[M+2H]2+,1356的m/z对应于单(双-磺甲基化)多粘菌素E1的[M+H]+,并且1378的m/z对应于单(双-磺甲基化)多粘菌素E1的[M+Na]+。
实施例5:MIC
使包含ca.93%的单(Nγ-双-磺甲基)多粘菌素E1的样品经受针对支气管炎博德特氏菌(Bordetella bronchiseptica),ATCC 4617的MIC分析,并且测量的微生物效价是611μg/g。
MIC分析
在250rpm对于绿脓杆菌的34℃以及对于克雷伯氏菌鲍氏和鲍氏不动杆菌的37℃下,将测试生物体在摇瓶中培养约16小时。将它们重新培养至对数期晚期,稀释至准备使用的浓度,并在÷75℃下用甘油冷冻。所用的培养基是Mueller Hinton Broth。
通过将5mg的化合物溶解于1ml的Mueller Hinton Broth中制备样品。将样品稀释并添加至孔中,加入测试生物体且在温育大约16个小时之后(对于克雷伯氏菌鲍氏和鲍氏不动杆菌在37℃下摇动,对于绿脓杆菌在34℃下不摇动)通过OD600测量生长抑制。结果提供在表1中。
表1
实施例6:本发明的化合物的毒性
使用KIM-1(肾脏损伤分子-1)作为急性肾小管坏死的生物标志物测量肾毒性。
用包含93%的单(Nγ-双-磺甲基)多粘菌素E1或CMS的混合物治疗小鼠5天,并且监测毒性和KIM-1的尿浓度的临床征象。在5天的治疗小鼠期间没有示出毒性的临床征象。与载体治疗(vehicle treatment)相比,在尿中的KIM-1水平显示出轻微的增加。按照ELISA试剂盒说明中规定的,在小鼠尿中的KIM-1的正常范围是456-8048pg/ml。
作为干粉接收混合物,并且在注射前立即将其溶于无菌盐水的小瓶中至表1中描述的浓度。
每天一次,持续5天,在颈部区域用0.2ml的对应于表1中描述的剂量皮下地治疗小鼠。剂量基于28g的平均体重。
在第二次给药后24小时和第五次给药后4小时收集尿样品。将样品储存在-80℃直至分析KIM-1浓度。
在根据Quantikine ELISA小鼠TIM-1/KIM-1/HAVCR免疫测定试剂盒中的说明进行ELISA之前,将尿样品解冻,在2000g下离心5分钟并稀释×50。
表1.治疗计划表
如通过体重和临床得分测定的,小鼠对所有的测试混合物良好耐受。在注入有包含93%的单(Nγ-双-磺甲基)多粘菌素E1的混合物的小鼠的组中观察到在注入部位处的皮肤变厚。然而,观察到尿KIM-1水平仅仅轻微而不显著的增加:
表2.在5次给药后尿的KIM-1浓度。
实施例6:单双-磺甲基化多粘菌素E1的体内活性
用多粘菌素E1、CMS E1和单双-磺甲基化多粘菌素E1的腹膜给药治疗具有绿脓杆菌(菌株PAX11045)的肺部感染的小鼠模型。CFU是除了小鼠的未治疗组之外的在22小时之后在肺组织中的菌落形成单位的计算数量。临床得分基于在相应时间点的观察,如在表3中示出的:
表3:
- 还没有人留言评论。精彩留言会获得点赞!