用于放射性药物生产的系统的制作方法
发明领域
本发明的某些实施方案涉及用于生产放射性药物的系统和方法,其中所述系统由微流体流动系统形成和/或提供了微流体流动系统。在某些实施方案中,所述系统包括放射性同位素分离模块、放射性药物生产模块、纯化模块和质量控制模块。
发明背景
正电子发射断层摄影(pet)已经成为用于诊断和监测各种疾病和病症的非常强大且广泛使用的医学成像模式。该技术依赖于(通常)将放射性示踪剂(用短寿命放射性同位素标记的靶向分子)静脉内注射到患者体内,随后在pet扫描仪中扫描患者以对示踪剂的生物分布成像。
由于其适当的半衰期(109.8分钟),允许足够的时间用于多步合成标记反应并将剂量输送到几个小时之外的现场,并且低正电子能量产生高分辨率图像,18f已经成为最广泛使用的和通常可利用的pet成像的放射性同位素。目前,2-[18f]氟-2-脱氧-d-葡萄糖([18f]fdg)是pet研究中最频繁使用的放射性示踪剂。
历史上,pet示踪剂在集中式回旋加速器或衰变发生器设施处大批量生产,然后作为多个剂量输送到成像现场(通常为医院),以在预先安排的pet临床期间对多个患者施用。然而,这不能确保靶向患有特定疾病的特定患者,但是更经济,原因是与多个较小剂量的其他放射性示踪剂相比,更容易产生大体积的[18f]fdg。最近的技术进步已经表明各个成像现场能够在现场具有微型pet回旋加速器,因此允许生产小体积的放射性同位素例如18f,以用于按需合成单剂量放射性示踪剂,即“按需配剂(dose-on-demand)”。
放射性示踪剂如[18f]fdg可以通过前体化合物的亲核取代来合成。该方法通常开始于使用阴离子交换分离柱从回旋加速器产生的富含18o的水中将18f氟离子回收到适当的溶剂中,随后共沸蒸发以除去任何残留的水。这种方法耗时,需要复杂的自动操作且降低放射化学产率。已报道了基于电化学槽的供选方法,其中18f被捕获,然后直接释放到有机溶剂中,用于制备放射性示踪剂,而不需要蒸发步骤。然而,已知方法的缺点包括捕获和/或释放的低效率、对高电压的依赖和复杂电化学槽的使用。
对于该领域中的合成和/或分析方法,持续需要改进的制备方法。
显然,将含有放射性示踪剂的溶液注射到人类患者中需要可注射药剂是无菌的、在生理ph下、不含颗粒物质,并且不含任何可能有害的起始材料或可以作为合成过程的结果存在的副产物。考虑到这一点,必须对可注射药剂进行严格的质量控制(qc)测试,以确保它们适合于人类注射。具体放射性示踪剂所需的测试列于各种药典专论中,其详细描述了所使用的技术/仪器以及药剂中存在的不同分子所允许的限度。
随着放射合成技术的变化,需要质量控制系统来监测生产的放射性示踪剂。虽然药典试验设定了目前的标准,但它们需要使用各种不同的技术和仪器,包括薄层色谱(tlc)、高效液相色谱(hplc)和气相色谱(gc)等。尽管如此,仍在不断努力降低检测限,缩短测试时间,并减少所需的样品体积。最近,还进行了努力将多个qc测试集成到单个技术中以便简化qc过程,从而减少了所需的仪器和技术人员所经历的辐射暴露。更一般地,还期望对用于体内使用的其它化合物例如药物的质量控制过程进行简化。
本发明的方面的一个目的是至少部分地减轻与现有技术相关的问题。
本发明的某些实施方案的一个目的是提供一种能够生产和纯化放射性药物并且测试该放射性药物以用于质量控制目的的系统,其中所述系统适于生产单一单位剂量的放射性药物。
本发明的某些实施方案的概述
本发明的某些实施方案的一个目的是提供一种用于以微流体量生产放射性药物的系统。
本发明的某些实施方案的一个目的是提供一种以单一单位剂量形式生产放射性药物的“按需配剂”系统。
在本发明的第一方面,提供了一种用于生产放射性药物组合物的微流体系统,包括:
a)放射性同位素分离模块(rim),其构造成接收包含放射性同位素的水溶液;
b)放射性药物生产模块(rpm),其构造成从rim接收包含浓缩并活化的放射性同位素的第一样品;
c)纯化模块(pm),其构造成从rpm接收包含放射性药物和一种或多种另外的成分的第二样品;和
d)质量控制模块(qcm),其构造成从pm接收包含纯化的放射性药物的第三样品,并且还构造成确定第三样品的一个或多个特性,其中所述模块中的每一个是微流体部件。
适当地,所述系统构造成每次运行生产单一(一个)单位剂量的放射性药物组合物。适当地,所述系统具有小于约2ml的总体积容量。适当地,所述系统具有小于约1ml的总体积容量,例如500μl,例如小于约300μl。
在一个实施方案中,rim包括装置,例如,微流体槽,用于从包含放射性同位素的水溶液中分离和回收放射性同位素,所述装置包括:
入口;
出口;和
与入口和出口流体连通以形成流体通路的腔室,所述腔室包括第一电极和第二电极,
其中第一电极由碳棒形成;
其中所述腔室具有不大于约50μl的体积容量;且
其中第一电极和第二电极之间的距离不大于0.5mm。
适当地,与水溶液流接触的第一电极的表面积为至少20mm2。在一个实施方案中,第一电极具有包括多个凹部的平坦表面。适当地,第一电极具有抛光的表面层。适当地,所述装置构造成接收以至少0.1ml/min的流速的流体。
在一个实施方案中,第二电极由铂制成。
适当地,第一电极在莫氏标度(mohsscale)上具有至少2.0的硬度。在一个实施方案中,所述腔室具有不大于约30μl的体积容量。适当地,rim还包括加热器。适当地,rim是微流体槽或包括微流体槽。
在一个实施方案中,rim包括构造成将放射性同位素从所述基于水的溶液分离的色谱整体式主体,其中所述整体式主体是无机整体式主体。
在一个实施方案中,所述系统包括rpm,所述rpm包括构造成将放射性同位素从所述基于水的溶液分离的色谱整体式主体,其中所述整体式主体是无机整体式主体。
在一个实施方案中,所述系统包括pm,所述pm包括构造成将放射性同位素从所述基于水的溶液分离的色谱整体式主体,其中所述整体式主体是无机整体式主体。适当地,pm包括多个色谱整体式主体。
适当地,所述整体式主体包括选自基于硅的组分、基于铝的组分和基于钛的组分的组分,其中每种组分任选地被化学官能化。适当地,所述组分选自基于二氧化硅的组分、基于氧化铝的组分和基于二氧化钛的组分,其中每种组分任选地被化学官能化。适当地,所述整体式主体包括选自二氧化硅、亚氨基氮化硅(siliconimidonitride)、硅亚胺(siliconnitride)和氮化硅的基于硅的组分,其中每种组分任选地被化学官能化。
适当地,所述整体式主体包括二氧化硅或化学官能化的二氧化硅。在一个实施方案中,所述整体式主体是阳离子交换整体式主体,例如所述整体式主体包括用丙基磺酸基团改性的二氧化硅。
在一个实施方案中,所述整体式主体是阴离子交换整体式主体,例如所述整体式主体包含用季铵改性的二氧化硅。在一个实施方案中,所述整体式主体是反相整体式主体,例如所述整体式主体包括用十八烷基碳基团改性的二氧化硅。
标准整体式hplc柱可从例如phenomenex、merck、thermoscientific和agilent的组织商购获得。
在一个供选的实施方案中,rpm包括蛇形混合通道。
在一个实施方案中,水溶液由回旋加速器或衰变发生器产生。适当地,放射性同位素是89zr、64cu、18f或68ga或其阳离子(例如68ga3+)。
在一个实施方案中,所述系统还包括与rim流体连通的一个或多个入口,用于引入放射性药物前体或其受保护形式(例如乙酰化的[18f]fdg)。
在一个实施方案中,纯化模块(pm)构造成从rpm接收包含放射性药物和一种或多种另外的成分的第二样品,并将放射性药物与所述一种或多种另外的成分分离。
适当地,所述放射性药物选自18f-flt([18f]氟胸苷)、18f-fddnp(2-(1-{6-[(2-[18f]氟乙基)(甲基)氨基]-2-萘基}乙叉基)丙二腈)、18f-fhbg(9-[4-[18f]氟-3-(羟甲基)丁基]鸟嘌呤或[18f]喷昔洛韦(penciclovir))、18f-fesp([18f]氟乙基螺环哌啶酮)、18f-p-mppf(4-(2-甲氧基苯基)-l-[2-(n-2-哌啶基)-对-[18f]氟苯甲酰氨基]乙基哌嗪)、18f-fdg(2-[18f]氟-2-脱氧-d-葡萄糖)、18f-fmiso([18f]氟米索硝唑(misonidazole))和18f-氟化钠。
在一个实施方案中,所述一种或多种另外的成分是杂质。在一个实施方案中,所选择的杂质来自[18f]氟化物和内毒素,并且所述整体式主体是正相整体式主体(例如包含氧化铝或二氧化硅)。
在一个实施方案中,所述杂质选自乙酰化的[18f]fdg、乙酰化的[18f]fdm、cidg、甘露糖三氟甲磺酸酯和k222,并且所述整体式主体是反相整体式主体(例如包括用十八烷基碳改性的二氧化硅)。
在一个实施方案中,所述杂质选自k222和氢氧化钠,并且所述整体式主体是阳离子交换整体式主体(例如用丙基磺酸基团改性的二氧化硅)。在一个实施方案中,所述杂质选自盐酸,并且所述整体式主体是阴离子交换整体式主体(例如用季铵改性的二氧化硅)。
在一个实施方案中,所述系统包括qcm,所述qcm包括用于确定第三样品的至少一个特征的微流体芯片,所述微流体芯片包括:
a)长度(l1)、宽度(w1)和厚度(t1),其中t1<w1,t1<l1;
b)用于将样品引入芯片的供给部件;
c)与供应部件流体连通的流体流动路径,和
c)流体流动路径中的检测通道,其中所述检测通道至少部分地延伸通过微流体芯片的厚度(t1),并且其中所述检测通道构造成沿其长轴提供流体流动路径和路径长度二者。
因此,所述芯片包括至少部分地延伸通过芯片的厚度的检测通道。适当地,在使用中,所述检测通道提供检测器和源之间的光学路径长度,使得可以确定检测通道中的流体的吸光度。在一个实施方案中,所述源能够发射波长在约2nm至约2mm之间的电磁辐射。在一个实施方案中,路径长度和流体流动路径沿着检测通道的相同轴提供。在一个实施方案中,所述检测通道的长度为约2mm至4mm。在一个实施方案中,所述检测通道的长度为约3mm至4mm。
在一个实施方案中,所述芯片包括多个层,例如两个或三个或更多个。
在一个实施方案中,检测通道封闭在微流体芯片内,并且任选地其中所述芯片还包括用于引导和/或控制流体流动路径中的流体流动的一个或多个阀元件。适当地,检测通道在使用中与光源和检测器轴向准齐。适当地,检测器和/或光源各自包括用于将芯片连接到检测器和/或源的连接元件,并且其中检测通道在使用中与连接元件轴向准齐。
适当地,芯片的至少一部分由能够光学透射的材料构成。适当地,在使用中位于与光源和检测器相邻的芯片的每个部分能够光学透射。
在一个实施方案中,流体流动路径包括第一微通道。适当地,微流体芯片包括至少一个另外的微通道。在某些实施方案中,第一微通道和/或所述至少一个另外的微通道提供在与检测通道不同的平面中。在一个实施方案中,检测通道包括上部开口和下部开口,各自容纳在芯片内,并且其中检测通道构造成允许流体沿其长轴流动。
适当地,提供与检测通道的下部开口流体连通的出口。适当地,提供与检测通道的上部开口流体连通的出口。在一个实施方案中,微流体芯片包括多个检测通道。在一个实施方案中,检测通道是检测区域,并且微流体芯片还包括一个或多个另外的检测区域。
在一个实施方案中,qcm包括微流体芯片,所述微流体芯片包括:
a)用于将第三样品引入微流体芯片的供应部件;
b)与供应部件流体连通的流体流动路径;
c)至少两个检测区域,每个检测区域包括用于进行分析技术的部件;
d)多个隔离阀元件,其提供在流体流动路径中以控制和/或引导流体流动路径中的流体流动;
其中每个隔离阀元件能从打开位置移动到关闭位置,使得第三样品的一部分被隔离以引向检测区域。
在一个实施方案中,流体流动路径包括第一微通道,第一微通道包括多个隔离阀元件。在一个实施方案中,芯片包括至少一个另外的微通道,其中每个另外的微通道与提供在一对隔离阀元件之间的第一微通道的不同部分流体连通。适当地,第三样品的一部分隔离在成对的隔离阀元件之间,并且其中所述至少一个另外的微通道在一对隔离阀元件之间的接合点处与第一微通道相交。
在一个实施方案中,所述至少一个另外的微通道包括一对另外的隔离阀元件,所述一对另外的隔离阀元件中的一个提供在所述接合点上游的第一位置处,并且所述一对另外的隔离阀元件中的另一个放置在所述接合点下游的位置。适当地,提供在所述至少一个另外的微通道中的所述一对另外的隔离阀元件构造成当第一微通道的所述一对隔离阀元件处于打开位置时处于关闭位置。
适当地,隔离阀元件是如下文所述的阀组件。
根据本发明的另一方面,提供了一种用于微流体芯片的阀组件,包括:
阀构件,其具有阀轴、第一端部区域和另外的端部区域;和
阀壳体,其可与微流体芯片接合以将阀构件的所述另外的端部区域定位在微流体芯片的流体流动路径中;
其中阀构件的所述另外的端部区域包括至少一个贯通型导管,并且阀构件能够相对于阀壳体围绕阀轴旋转,以相对于微流体芯片的流体流动路径在打开位置和关闭位置之间选择性地移动所述至少一个贯通型导管。
适当地,阀构件能够相对于阀壳体以沿着阀轴的方向平移。
在某些实施方案中,阀组件还包括偏置元件,以沿着阀轴的方向使阀构件的另外的端部区域偏置远离阀壳体。
适当地,阀构件基本上是细长的,并且包括设置在第一端部区域和所述另外的端部区域之间的环形肩部,用于与偏置元件接合。
适当地,阀壳体包括环形壁部分和具有中心孔的上部,以接收阀构件并将偏置元件定位在阀构件的上部和环形肩部之间。
在某些实施方案中,环形壁部分包括用于与微流体芯片的另外的螺纹接合的第一螺纹。
适当地,偏置元件包括压缩弹簧。适当地,压缩弹簧具有与在微流体芯片的流体流动路径中可输送的流体的预定阈值压力相关联的弹簧力。
适当地,阀组件还包括用于调节压缩弹簧的长度的调节器。
适当地,阀构件包括从包括所述至少一个贯通型导管的阀头部分延伸的阀轴。在某些实施方案中,阀轴被接收在阀头部分的中心孔中。适当地,阀轴和阀头部分通过粘合剂、摩擦配合和螺纹中的至少一种连接。
适当地,阀轴包括环形肩部,并且阀头部分的上表面邻接环形肩部的下表面。在某些实施方案中,阀头部分包括基本上弹性的材料。适当地,基本上弹性的材料包括生物医学级弹性体。在某些实施方案中,生物医学级弹性体包括硅橡胶。
适当地,阀轴和阀壳体各自包括金属或聚合物材料。在某些实施方案中,所述至少一个贯通型导管包括设置在阀构件的所述另外的端部区域的下表面中的至少一个通道。
适当地,通道包括约100μm至约200μm的宽度,例如约150μm,且深度例如约50μm。
适当地,阀构件的第一端部区域包括用于与致动器接合以相对于阀轴驱动阀构件的花键。
在一个实施方案中,所述至少一个另外的微通道中的每一个与检测区域流体连通。在一个实施方案中,多个另外的微通道与单个检测区域流体连通。在一个实施方案中,所述至少一个另外的微通道包括下游阀元件以控制和/或引导流体从所述多个另外的微通道到检测区域的流动。
适当地,检测区域包括选自以下的一个或多个分析部件:
a)电化学槽;
b)辐射检测器;
c)分离元件;和
d)检测通道。
适当地,芯片包括多个检测区域,每个检测区域包括至少一个分析部件。
适当地,分析部件是电化学槽,其包括工作电极、反电极和参比电极。
在一个实施方案中,工作电极是金电极。或者,工作电极由铂、ito(氧化铟锡)或碳形成。适当地,反电极(也称为“辅助电极”)由银、碳或铂形成。适当地,参比电极由银形成。
适当地,电化学槽是丝网印刷的电极组件。
在一个实施方案中,分离元件是整体式主体,并且任选地其中所述整体式主体是正相整体式主体(例如包含氧化铝或二氧化硅)和/或强阴离子交换(sax)整体式主体和/或反相(c18)整料。在某些实施方案中,可分离部件包括多个可以相同或不同的整体式主体。适当地,可分离部件包括两个整体式主体。
适当地,检测区域还包括用于供应试剂或流动相的一个或多个入口,并且任选地其中所述芯片还包括一个或多个出口。
适当地,供应部件是入口端口。在一个实施方案中,流体流动路径在其至少一部分中包括至少一个被动混合元件,其中任选地所述被动混合元件选自交错的人字形图案、直脊、成角度的脊、人字形管、圆顶、锥体、凹坑、柱和它们的组合。
在一个实施方案中,qcm用于确定:
a)样品的ph;
b)样品的澄清度;
c)样品中细菌内毒素的存在和/或浓度;和
d)样品中杂质的存在和/或浓度;和/或
e)样品的辐射水平。
在一个实施方案中,系统是连续流动系统。在一个实施方案中,系统是模块化系统,并且其中每个模块可与所有其他模块分离。在一个实施方案中,模块通过微流体流动路径流体连通。
在一个实施方案中,系统是集成系统,并且在单一微流体装置上提供rim、rpm、pm和qcm。
在一个实施方案中,装置包括一个或多个微通道,所述微通道构造成在模块和/或一个或多个阀元件之间提供微流体流动路径,以引导和/或控制模块之间的流动。适当地,pm与构造成去除qcm上游的至少一部分第三样品的出口流体连通。
适当地,所述系统还包括:
a)源;和/或
b)检测器。
适当地,源是光源。在一个实施方案中,检测器是光谱仪,例如可见-近红外光谱仪、紫外-可见光光谱仪或拉曼光谱仪。适当地,系统包括用于使检测器和/或源与微流体芯片准齐的一个或多个连接元件。适当地,使源和检测器和/或一个或多个连接元件准齐,使得它们与qcm的芯片正交并且与检测通道的长轴准齐,使得检测通道提供源和检测器之间的路径长度。
在本发明的另一方面,提供了一种生产放射性药物组合物的方法,包括:
a)将包含放射性同位素的水溶液供应至放射性同位素分离模块(rim)并形成包含浓缩并活化的放射性同位素的第一样品;
b)将包含浓缩并活化的放射性同位素的第一样品从rim供应到放射性药物生产模块(rpm);
c)将包含放射性药物和一种或多种另外的成分的第二样品供应到纯化模块(pm),所述纯化模块构造成从rpm接收第二样品;
d)将包含来自pm的纯化的放射性药物的第三样品供应到质量控制模块(qcm);和
e)对第三样品或其一部分进行至少一种分析技术以确定所述样品的至少一个特性,其中所述模块中的每一个是微流体部件。
适当地,rim、rpm和qcm是微流体装置。
在一个实施方案中,步骤(a)包括将水溶液供应到包含色谱整体式主体的rim,并通过色谱整体式主体洗脱水溶液,其中所述整体式主体是无机整体式主体,并且是微流体流动系统的一部分。
适当地,步骤(a)包括:
使水溶液流动到rim,其中rim包括包含腔室的微流体槽,所述腔室包含第一电极和第二电极;
在第一电极和第二电极之间产生第一电场,从而将放射性同位素捕获在第一电极上;
使基于有机物的溶液的流到包含第一和第二电极的腔室;和
在第一电极和第二电极之间产生第二电场,其中第二电场具有与第一电场相反的极性,从而将放射性同位素从第一电极释放到基于有机物的溶液中,
其中第一电极由碳棒或其节段形成。
适当地,步骤(a)的方法包括以至少0.1ml/min的流速提供水溶液流。适当地,步骤(a)的方法包括以至少0.05ml/min的流速提供基于有机物的溶液的流。
在一个实施方案中,通过在第一和第二电极两端施加不大于30v的电压并且任选地在第一和第二电极两端施加不大于10v的电压来产生第一电场。适当地,腔室具有不大于约50μl的体积。适当地,第一电极具有包括多个凹部的平坦表面。适当地,第一和第二电极之间的距离不大于0.5mm。
在一个实施方案中,在步骤(a)中,放射性同位素以至少94%的效率捕获在第一电极上和/或放射性同位素以至少96%的效率从第一电极释放。适当地,步骤(a)的方法还包括在将基于有机物的溶液的流提供到腔室之前从腔室中除去水溶液。在一个实施方案中,步骤(a)的方法还包括在将放射性同位素捕获在第一电极上之后并且将基于有机物的溶液的流提供到腔室之前洗涤腔室。
适当地,基于有机物的溶液包含有机溶剂,其中任选地有机溶剂还包含1%至10%的水。适当地,步骤(a)的方法还包括在产生第二电场之前将腔室和/或基于有机物的溶液加热至50至100℃的温度。
在一个实施方案中,步骤(b)还包括使第一样品的放射性同位素与前体或其受保护形式反应,以提供包含放射性药物或中间体和任选的一种或多种另外的成分的第二样品。适当地,所述反应步骤在色谱整体式主体上进行。
在一个实施方案中,步骤(c)包括纯化第二样品,并且其中纯化在一个或多个色谱整体式主体上进行,其中任选地所述方法包括将放射性药物与杂质分离。
在一个实施方案中,步骤(c)包括纯化第二样品,并且其中纯化在一个或多个色谱整体式主体上进行,其中任选地所述方法包括去除选自[18f]氟化物、内毒素和其它极性杂质的杂质分离,以形成第三样品,并且其中所述整体式主体是正相整体式主体(例如包含氧化铝或二氧化硅)。
在一个实施方案中,步骤(c)包括纯化第二样品,并且其中纯化在一个或多个色谱整体式主体上进行,其中任选地所述方法包括将放射性药物与选自乙酰化的[18f]fdg、乙酰化的[18f]fdm、甘露糖三氟甲磺酸酯、k222和其它非极性杂质的杂质分离,以形成第三样品,其中所述整体式主体是反相整体式主体(例如包括用十八烷基碳改性的二氧化硅)。
在一个实施方案中,步骤(c)包括纯化第二样品,并且其中纯化在一个或多个色谱整体式主体上进行,并且任选地其中所述方法包括将放射性药物与选自k222、氢氧化钠和其他阳离子杂质的杂质分离,以形成第三样品,并且所述整体式主体是阳离子交换整体式主体(例如用丙基磺酸基团改性的二氧化硅)。
在一个实施方案中,步骤(c)在一个或多个色谱整体式主体上进行,并且任选地其中所述方法包括将放射性药物与选自盐酸和其他阴离子杂质的杂质分离,以形成第三样品,并且所述整体式主体是阴离子交换整体式主体(例如用季铵改性的二氧化硅)。
在一个实施方案中,步骤(d)包括在检测区域对第三样品或其一部分进行至少一种分析技术。适当地,步骤(d)包括:
a)确定样品的ph;
b)确定样品中杂质的存在和/或浓度;
c)确定样品中细菌内毒素的浓度;和/或
d)确定样品或其一部分的澄清度和/或外观。
在某些实施方案中,所述方法包括对样品或其一部分进行多种分析技术。适当地,分析技术同时或顺次进行。适当地,步骤(d)还包括对第三样品或其一部分或包含第三样品或其一部分的混合物进行光谱技术。适当地,所述方法包括对第三样品或其一部分进行可见-近红外光谱、uv-可见光谱或拉曼光谱。在一个实施方案中,所述方法包括放置光源和检测器,使得检测区域提供在光源和检测器之间,并且提供由光源发射的光被传输到检测器的路径长度,并且进行光谱技术。
适当地,检测区域包括至少部分地延伸通过微流体芯片的厚度的检测通道,其中所述检测通道提供用于来自光源的光被传输到检测器的路径长度。
在一个实施方案中,所述方法包括确定样品的辐射水平。适当地,所述微流体芯片包括多个检测区域,其中在每个检测区域确定一个或多个特性。
在某些实施方案中,使用本文所述的系统进行所述方法。适当地,所述方法每次运行产生单一(一个)单位剂量的放射性药物组合物。
英国专利申请号1418895.7、英国专利申请号1418897.3、英国专利申请号1418893.2和英国专利申请号1418899.9的内容通过引用结合到本文中。
本发明的实施方案的详细描述
现在将通过实例并参考附图来描述本发明的某些实施方案,其中:
图1是本发明的某些实施方案的系统的示意性流程图;
图2是本发明的某些实施方案的系统的示意性代表;
图3示出了本发明的某些实施方案的集成微流体系统;
图4示出了本发明的某些实施方案的放射性同位素分离模块(rim)的电极捕获槽;
图5示出了本发明的某些实施方案的放射性同位素分离模块(rim)的电极捕获槽;
图6示出了本发明的某些实施方案的放射性同位素分离模块(rim)的电极捕获槽;
图7是由本发明的某些实施方案的qcm确定的某些特性的表格
图8示出了包括本发明的某些实施方案的质量控制模块的微流体芯片;
图9a示出了包括本发明的某些实施方案的质量控制模块的微流体芯片;
图9b示出了包括本发明的某些实施方案的质量控制模块的微流体芯片的供选视图;
图10示出了包括本发明的某些实施方案的质量控制模块的微流体芯片;
图11示出了包括在根据本发明的某些实施方案的模块中的一对色谱整体式主体;
图12示出了包括本发明的某些实施方案的质量控制模块的微流体芯片;
图13示出了包括本发明的某些实施方案的质量控制模块的微流体芯片;
图14示出了根据本发明的某些实施方案的用于包括在系统中的阀组件;
图15是包括根据本发明的某些实施方案的阀组件的qcm的示意性代表;和
图16a示出了根据本发明的某些实施方案的组合的rim和rpm模块;
图16b是根据某些实施方案的在直接加热rpm之后通过红外温度计测量的rpm和rim之间的温度差的图形表示;以及
图17示出了提供在固定器中的图16a的组合的rim和rpm模块。所述组合系统还可包括如本文所述的一个或多个阀组件,用于控制rim和rpm之间或之内的样品溶液的流动。
本文所使用的类似附图标记表示类似的部分。
应当理解,在本申请文件中使用的许多术语和短语是本领域技术人员已知的。本文提供的定义意欲单独地以及与本文的任何其它实施方案和/或定义任意组合地用作本发明的实施方案。
如本文所使用的“分析物”是从样品中选出或分离的一种或多种物质。当分析物通过色谱整体式主体从样品中分离时,其可以保留在主体上,或者其可以比样品中的一种或多种其它物质更缓慢地洗脱通过主体。分析物可以是感兴趣的物质,例如感兴趣的化合物或同位素,或者它可以是待物质的组合物中除去的杂质。在一些实施方案中,分析物可以是反应物。
如本文所使用的“样品”是待通过色谱法研究或分析的材料。样品可以包含单种成分或成分的混合物。样品包含分析物和任选的待从其中分离分析物的其他物质。在一些实施方案中,样品可以包含反应物,并且可以通过色谱整体式主体洗脱,以在整体式主体的表面上实现化学反应,例如固相化学反应。
如本文所使用的“洗脱剂”是携带分析物和待从其中分离分析物的任何物质的溶剂。洗脱液携带样品。
如本文所使用的“洗脱液”是流出色谱主体的流动相,特别是在分析物已经从样品分离之后。
如本文所用的“流动相”包括流过色谱主体的相。流动相包括溶解在流入色谱主体中的洗脱剂中的样品。
本发明的某些实施方案涉及微流体系统及其微流体部件。如果流体通过具有至少一个小于1mm的尺寸的通道,特别是具有小于1mm的尺寸的通道,例如小于500μm,小于250μm,小于200μm或小于150μm,则流体流可被描述为“微流体”(即“微流体流体流”)。这产生了层流特性(通常具有小于100的雷诺数),其中扩散是主要的错流化学相互作用。因此,在微结构化装置内操作小体积(例如1nl至100μl)期间发生微流体流体流动,微结构化装置的特征在于尺寸为10至100μm的数量级。
本发明的某些实施方案的微流体系统可以是由多个单独部件组成的模块化系统,其中一个或多个部件在使用中是流体连通的。所述系统可以供选地是集成系统,其中一个或多个例如所有部件提供在单个平台例如微流体装置、例如包括芯片的装置上。装置可以包括微流体流动系统或包含在微流体流动系统中。
“微流体流动系统”包括具有至少一个用于流体流动的通道的系统,所述通道的至少一个尺寸小于1mm,例如小于500μm,例如300μm、200μm、150μm、100μm、50μm或更小。微流体流动系统包括微流体装置,但也可以包括与微流体装置流体连通的其它部件。
在一个实施方案中,系统包括具有例如约100μm至约200μm之间的宽度的一个或多个通道,例如,约150μm,深度例如为约50μm。
“微流体芯片”可以通过以下事实来识别:其具有一个或多个通道,所述通道具有小于1mm,例如小于500μm的至少一个尺寸,例如300μm、200μm、150μm、100μm、50μm或更小,特别是具有小于1mm的尺寸的通道,例如在约100μm至约200μm之间,例如约150μm,深度例如为约50μm。微流体芯片可以是微流体流动系统的一部分。所述一个或多个通道可以在芯片中形成流体流动路径。
如本文所用的术语“微流体芯片”是指可针对具有约10nl至10ml体积的样品用于合成或分析目的的装置。在一个实施方案中,微流体芯片用于处理、合成和/或分析体积在约1μl和2000μl之间、例如约1000μl或更少、例如500μl的样品。在一个实施方案中,微流体芯片是微流体装置和/或包含在微流体装置内。在某些实施方案中,微流体芯片可以包括一个或多个可分离的模块部件,例如包括电化学槽的部件等。适当地,模块化部件可以包括如本文所述的检测区域。
如本文所使用的术语“路径长度”是指光行进通过流体例如样品的距离。适当地,微流体芯片包括检测通道,所述检测通道具有适合于为光谱技术提供路径长度的长度。
适当地,检测通道的长度至少为2mm,例如2.5mm、3mm、3.5mm或更大。用于表征微流体流动(即,通过微流体通道的流体流动)的雷诺数根据方程1计算:
方程1
其中:
l是最相关长度尺度;
μ是粘度;
ρ是流体密度;和
vavg是流的平均速度。
对于许多微通道:
l=4a/p方程2
其中:
a是通道的横截面积;和
p是通道的润湿周长。
由于微流体装置中的通道的小尺寸,re通常小于100,特别是小于1.0。具有这种量级的雷诺数的流体流是完全层流的,具有非常少的湍流或没有湍流,使得分子运输是相对可预测的。
“放射性药物”是药物分子的同位素标记的类似物,其中同位素标记是放射性的。放射性药物可用于诊断或治疗目的。某些实施方案的系统可用于生产放射性药物,例如如本文所述。
“放射性示踪剂”是与未标记的类似物相比具有基本上未改变的代谢途径的放射性药物。因此,可以通过检测标记放射性同位素的放射性衰变来跟踪并量化特定代谢途径的过程。放射性示踪剂用于诊断目的。
放射性示踪剂的实例包括但不限于18f-flt([18f]氟胸苷)、18f-fddnp(2-(1-{6-[(2-[18f]氟乙基)(甲基)氨基]-2-萘基}乙叉基)丙二腈)、18f-fhbg(9-[4-[18f]氟-3-(羟甲基)丁基]鸟嘌呤或[18f]喷昔洛韦)、18f-fesp([18f]氟乙基螺环哌啶酮)、18f-p-mppf(4-(2-甲氧基苯基)-1-[2-(n-2-吡啶基)-对-[18f]氟代苯甲酰氨基]乙基哌嗪)、18f-fdg(2-[18f]氟-2-脱氧-d-葡萄糖)、18f-fmiso([18f]氟米索硝唑)和18f-氟化钠。
18f-fdg或[18f]fdg是放射性标记的糖分子。当与pet成像一起使用时,产生显示组织的代谢活性的图像。在fdg-pet扫描中,与正常周围组织的较低消耗相比,肿瘤细胞的高糖消耗将这些细胞识别为癌细胞。fdg也用于研究肿瘤对治疗的应答。如本文所用,术语fdg涉及化合物2-氟-2-脱氧-d-葡萄糖,且术语18f-fdg或[18f]fdg涉及放射性标记的(2-[18f]氟-2-脱氧-d-葡萄糖。
18氟化钠是用于新骨形成的pet成像的成像剂。其可以评估正常骨和骨肿瘤两者中的变化。因此可以用于测定对治疗的应答。
18f-flt或[18f]flt是一种放射性标记的成像剂,其正在pet成像中研究其检测原发性肿瘤生长的能力。研究还可以测定采用pet时flt检测肿瘤对治疗的应答的能力。
18f-fmiso或[18f]fmiso是与pet成像一起使用的可识别组织中的缺氧(低氧)的成像剂。已经表明低氧的肿瘤耐辐射和化疗。
或者,放射性示踪剂是放射性药物,其结合了选自89zr、11c、68ga和64cu的放射性同位素。
放射性示踪剂的另外的实例包括使用双官能螯合剂以形成68ga-dota、68ga-nota和68ga-dtpa与肽、抗体和其它靶向载体的缀合物的任何放射性示踪剂。基于68ga的放射性示踪剂的实例包括68ga-dota-tate和68ga-dota-toc,其可用于通过识别生长抑素受体来对神经内分泌肿瘤成像。
68ga-nota-双(膦酸酯)是用于骨成像的pet放射性示踪剂,68ga-dotatoc是用于在脑膜瘤患者中成像的pet放射性示踪剂。
68ga-dotatate是用于在恶性嗜铬细胞瘤患者中成像的pet放射性示踪剂。
k222是kryptofix2.2.2,在英国药典中称为“氨基聚醚”。它通常为通过亲核取代合成[18f]fdg中选择的相转移催化剂。然而,可以使用其它催化剂,例如四丁基铵和4-(4-甲基哌啶-1-基)吡啶。
dota是1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸。
dtpa是二亚乙基三胺五乙酸。
nota是1,4,7-三氮杂环壬烷-1,4,7-三乙酸。
cidg是2-氯-2-脱氧-d-葡萄糖。cidg是特别是当使用其中氯原子代替[18f]氟化物标记的酸水解时可能存在的杂质。另一种氯化物源可以是在许多系统中用于预浓缩[18f]氟化物标记物的阴离子交换柱,这取决于存在于柱树脂上的反荷离子。
acy-[18f]fdg是指[18f]fdg的乙酰化/未水解形式,其是2-[18f]氟-1,3,4,6-四-o-乙酰基-d-葡萄糖(也称为[18f]tag),也可以存在部分水解的acy-[18f]fdg。
[18f]fdm是2-[18f]氟-2-脱氧-d-甘露糖,其是可以在[18f]fdg合成过程中产生的副产物,并且也可以以完全或部分水解形式(acy-[18f]fdm)存在。
“放射性药物组合物”包含放射性药物或其药学上可接受的盐以及药学上可接受的佐剂、稀释剂或载体。在一个实施方案中,放射性药物组合物可包含放射性药物和等渗盐水溶液。
来看本发明的某些实施方案,图1是示出本发明的某些实施方案的系统的流程图。所示的每个模块适当地是微流体部件,该微流体部件的尺寸设定为容纳微流体量的样品,例如小于约2ml,例如小于1ml。
适当地,所述系统包括放射性同位素分离模块(rim)。
放射性同位素分离模块(rim)
适当地,系统包括rim。在一个实施方案中,rim包括电极捕获部件以分离并适当地浓缩放射性同位素用于制备放射性药物。在一些实施方案中,放射性同位素是放射性氟化物同位素,在本文中也称为18f-氟化物或18f。
在一些实施方案中,水溶液包含富含18o的水。富含18o的水可以包含18f。水溶液可以由回旋加速器产生和获得。回旋加速器可以是小型化的回旋加速器。
在一些实施方案中,所述方法包括以不大于约1ml/min的流速提供水溶液。在一些实施方案中,所述方法包括以不大于约0.5ml/分钟的流速向rim提供水溶液。在一些实施方案中,所述方法包括以至少0.1ml/min的流速提供水溶液。水溶液的流速可以为约0.1ml/min至约0.3ml/min,例如约0.2ml/min。流向并通过腔室的水溶液的总体积可以为0.1至0.5ml,或0.2至0.4ml,例如0.3ml。
在一些实施方案中,腔室具有不大于约50μl、不大于约40μl、不大于约30μl、不大于约20μl、不大于约15μl、不大于约10μl、或不大于约8μl的总体积容量。认为溶液体积与槽体积的高比率提高了释放效率。
腔室可以形成包括rim的微流体槽的一部分。rim可以提供在集成微流体系统中,例如,作为与本文所述的一个或多个其它模块相同的微流体装置的一部分。适当地,微流体槽的使用使得能够操作少体积,因此与已知的间歇方法相比,益处在于其产生更少的浪费、降低试剂成本并且需要更少体积的样品。微流体槽还由于短扩散距离、小的热容量和归因于系统更快响应的更好过程控制而能够实现更快的应答时间。微流体槽因此可以特别适合于放射性药物的按需配剂生产。
在一个实施方案中,第一电极也可以称为工作电极。适当地,第一电极与水溶液的流接触。第一电极可以是任何合适的形状,例如圆形、卵形、矩形、正方形或三角形。适当地,第一电极的横截面形状可以是任何合适的形状,例如圆形、椭圆形、矩形、正方形或三角形。适当地,圆形和矩形电极已显示在捕获和释放放射性同位素两方面具有优异的性能。
在一些实施方案中,第一电极由石墨形成。在一些实施方案中,第一电极由玻璃碳形成。在一些实施方案中,第一电极是碳盘。在一些实施方案中,第一电极可以是由碳棒形成的碳盘。例如,第一电极可以通过从市场上可买到的碳棒(例如由goodfellowcambridgeltd.出售的那些)切薄节段(thinsection)而形成。适当地,碳棒由石墨制成,但是是硬的,不像正常的软石墨。因此,在一些实施方案中,第一电极不由标准石墨如层状石墨形成。
在一些实施方案中,第一电极在莫氏标度上具有大于1.0的硬度,例如大于1.1,例如大于1.2,例如大于1.3,例如大于1.4,例如大于1.5,例如大于1.6,例如大于1.7,例如大于1.8,例如大于1.9或例如大于2.0。在某些实施方案中,第一电极在莫氏标度上的硬度大于2.0,例如2.1、2.2、2.3或更大。
sem图像已经表明,与具有层状结构的软石墨不同,碳棒的节段具有包括多个凹部的平坦表面。因此,第一电极可以包括不规则表面。适当地,该不规则表面与水溶液的流接触。碳棒的这种表面结构被认为有利于捕获和释放。还已经发现,与软石墨不同,由碳棒形成的第一电极在捕获之后不变形,从而显著增加电极的性能。因此,在一些实施方案中,第一电极在使用中不变形。在进一步的实施方案中,当在电极两端施加至少0.5v、至少1v、至少3v、至少5v、至少10v或至少15v或者至少20v的电压时,第一电极能够保持其初始形式。
在一些实施方案中,碳棒具有至少99%、至少99.5%、至少99.8%或至少99.9%的纯度。碳棒可以包含痕量的其它元素,例如但不限于al、b、ca、cu、fe、mg、na和/或si。这些元素中的每一种可以以不大于1%、不大于0.5%、不大于0.1%、不大于0.05%或不大于0.01%的量存在。
电极捕获槽的圆形第一电极可以通过从碳棒切所需厚度的节段而形成。如果需要非圆形电极(例如矩形),则可以使用砂纸将该节段成形。第一电极可以具有抛光的表面层。该抛光的表面层可以与水溶液的流接触。抛光被认为清洁电极表面并减少在使用期间可能不利地影响电极的性能的颗粒的出现。第一电极可以具有0.1mm至0.5mm或约0.2mm至0.3mm的厚度,例如0.25mm。
在一些实施方案中,与水溶液的流接触的第一电极的表面积为至少10mm2,例如至少15mm2,例如至少20mm2,例如至少30mm2,例如至少40mm2,例如至少50mm2,例如至少60mm2,或者例如至少70mm2。在一些实施方案中,与水溶液的流接触的第一电极的表面积不大于100mm2,例如不大于90mm2,例如不大于80mm2,例如不大于75mm2,例如不大于55mm2,例如不大于35mm2,或例如不大于25mm2。
第二电极也可以称为反电极。第二电极可以由过渡金属形成。合适的过渡金属包括例如金、银、铁、锌、铜和铂。在一些实施方案中,第二电极由铂形成,例如铂箔。由于其电化学稳定性,铂是特别合适的。
在一些实施方案中,第一和第二电极之间的距离不大于0.5mm。在一些实施方案中,第一和第二电极之间的距离为0.1至0.5mm,例如0.2mm至0.4mm或例如0.25mm至0.3mm。适当地,电极之间的间隙越小,电阻越小,允许使用相对低的电压。
在一些实施方案中,通过在第一和第二电极两端施加不大于50v、不大于30v或不大于20v的电压来产生第一电场。在一些实施方案中,通过在电极两端施加5至20v、例如10至20v、例如14至20v的电压来产生第一电场。当在电极之间产生第一电场时,第一电极将具有正电荷(即,第一电极用作阳极),使得存在于水溶液中的带负电荷的放射性同位素离子被吸引到第一电极,使它们被捕获在第一电极上。
在某些实施方案中,放射性同位素在第一电极上的捕获效率可以为至少94%。
在一些实施方案中,所述方法包括在将基于有机物的溶液的流提供到腔室中之前从腔室中除去水溶液。基于有机物的溶液可以包含有机溶剂。合适的有机溶剂包括乙腈、dmf、dmso和n-甲基甲酰胺。因为一些放射性同位素离子如18f不溶于有机溶剂,所以基于有机物的溶液可以进一步包含相转移试剂。在一些实施方案中,相转移试剂是kryptofix222(k222)。k222的浓度可以为0.027至0.08m。
适当地,有机溶液还包含反荷离子源。适当地,如果放射性同位素离子带负电荷,则反荷离子将带正电。反荷离子可以是碱金属离子,例如钠离子或钾离子。在一些实施方案中,有机溶液包含钾离子源,例如k2co3或khco3。k2co3或khco3的浓度可以为0.01至0.04m。
在一些实施方案中,有机溶液还包含1至10%体积,例如2至8%体积或3至6%体积的h2o。在一些实施方案中,有机溶液的h2o含量为约4%。适当地,少量的水显著地增加不溶性放射性同位素离子在基于有机物的溶液中的溶解度,从而促进放射性同位素从第一电极的释放。水含量大于10%可能对释放的放射性同位素的随后反应具有有害影响。
在一些实施方案中,将基于有机物的溶液以至少0.05ml/min的流速提供给rim。流速可以为0.05至1ml/min、例如0.05至0.5ml/min、0.08至0.3ml/min或0.1至0.2ml/min。在一些实施方案中,所述方法包括以更高的流速即以比提供基于有机物的溶液的流速更大的流速提供水溶液。
在一些实施方案中,所述方法包括以至少1ml/min的流速提供基于有机物的溶液。流速可以为0.05至1ml/min,例如0.1至1ml/min。
适当地,以约0.2ml/min的流速提供水溶液,以约0.1ml/min的流速提供基于有机物的溶液。提供给腔室的基于有机物的溶液的总体积可以为约0.1至0.5ml,或约0.2至0.4ml,例如0.3ml。
在一些实施方案中,所述方法还包括在提供基于有机物的溶液的流通过腔室之前洗涤所述腔室。洗涤步骤可以在将放射性同位素捕获在第一电极上之后进行。可以通过使有机溶剂或包含有机溶剂的溶液流过腔室来进行洗涤。有机溶剂可以与包含在随后在释放被捕获的离子之前流入腔室中的基于有机物的溶液中的有机溶剂相同。洗涤步骤有助于从腔室中除去残留的水溶液。在一些实施方案中,腔室用乙腈洗涤。
在一些实施方案中,通过在第一和第二电极两端施加不大于20v、例如不大于10v、例如不大于5v的电压来产生第二电场。在一些实施方案中,通过在电极两端施加从1至5v或约1.5至4.5v(例如1.6至4.1v)的电压来产生第二电场。应当理解,由于第二电场具有与第一电场相反的极性,因此本文关于第二电场描述的电压也可以表示为负值(例如-10v或-5v)。当产生第二电场时,第一电极获得负电荷(即其变为阴极)。这使得捕获的放射性同位素离子被排斥并从第一电极释放。
因此如由本发明的某些实施方案提供的放射性同位素离子从水溶液捕获在电极上、然后将离子释放到基于有机物的溶液中提供了一种简便的溶剂交换方法,其比基于阴离子交换和共沸蒸发的常规技术简单、快速和易于自动化。
因此,某些实施方案的系统的rim也可以用于浓缩放射性同位素。
在一些实施方案中,rim(例如包括本文所述的电极捕获槽)可以被加热,因此该系统可以包括加热元件。加热器可以构造成加热腔室,或者其可以构造成在流体进入腔室之前加热流体。在一些实施方案中,加热器包括热板、加热元件或加热垫。在一些实施方案中,腔室或整个装置或微流体槽位于加热器上。加热器可以是手动或自动操作的。
加热可以在施加第二电场之前进行。已经发现,加热可以促进放射性同位素从第二电极的释放,特别是当使用小体积的溶液时。腔室和/或基于有机物的溶液可以加热至40至100℃的温度,例如50-100℃,例如40-80℃、60-90℃或70-80℃。
在一些实施方案中,腔室可以被间接加热。例如,在腔室是集成系统的一部分、例如作为包括在微流体芯片上的微流体系统的一部分的情况下,可以不必将腔室直接邻近热源或与热源直接接触来加热腔室。加热可以通过加热集成系统的另一个区域间接地通过热传递实现,例如通过加热微流体芯片的另一个区域。
在一些实施方案中,微流体系统包括rim和rpm。rim包括腔室。rpm包括微反应器和/或微混合器。在包含释放的放射性同位素的基于有机物的溶液从rim转移到rpm的情况下,腔室的加热可以通过直接加热部分或全部rpm来实现。腔室不直接加热,而是通过来自rpm的热传递间接地加热。rpm可以包括反应器。反应器可以直接加热。rpm可以包括混合器。可以直接加热混合器。
rim还可以包括将电极连接到电路的引线。
在一个供选的实施方案中,rim包括如下所述的整体式主体。在该实施方案中,分析物是放射性同位素或其阳离子或阴离子,并且可以在回旋加速器或衰变发生器中产生。整体式主体用于将放射性同位素或其阴离子或阳离子从由回旋加速器或衰变发生器产生的放射性水溶液(例如样品)中分离。在一些实施方案中,水溶液包含富含18o的水。富含18o的水可以包含18f。适当地,整体式主体是强阴离子交换整体式主体。
分析物可以是放射性同位素[18f]氟化物(例如18f-),或分析物可以是放射性同位素68ga或其阳离子(例如68ga3+)。在该实施方案中,进行分离以浓缩放射性示踪剂。
rim适当地通过例如导管或微通道与所使用的放射性药物生产模块(rpm)流体连通。下面提供了示例性rpm的细节。
某些实施方案的放射性同位素分离模块
参考图4,形成rim10或包含在rim10中的微流体槽包括已经加工成所需尺寸和形状的上矩形玻璃板12和下矩形玻璃板14。应当理解,在供选的实施方案中,板可以由诸如石英或聚合物的其它材料形成。在下板14的中心有圆形切口16,该切口延伸通过板14的整个深度,并且接收形成工作电极18的碳盘(直径10mm)。工作电极18切成一定尺寸并抛光。第一引线20将工作电极18连接到电路(未示出)。工作电极18通过第一圆柱形玻璃衬里22固定在适当位置,第一圆柱形玻璃衬里22的尺寸适合装配到下板14的切口16中。玻璃衬里22可以是库存部件,或者可以加工成所需的形状和尺寸。
上板12在与下板14中的切口16的位置相对应的位置中具有圆形切口24。上板还包括两个孔26,切口24的一侧一个,各自经由通道28与切口26流体连接。孔中的一个26a提供入口以允许流体进入槽10,而另一个26b提供出口。圆形铂反电极30(直径10mm)接收在上板12的切口24中。反电极30通过第二引线32连接到电路。反电极30通过第二圆柱形玻璃衬里34固定在适当位置,第二圆柱形玻璃衬里34的尺寸适合装配到上板12的切口24中。玻璃衬里34可以是库存部件,或者可以加工成所需的形状和尺寸。
图5示出了具有组装好的部件的图4的槽10。为了组装该槽,上板12和下板14准齐,然后热粘合在一起。一旦板12、14被连接,反电极30被放置在上板12中的切口24内。在插入第二玻璃衬里34之前插入电极引线32并且将密封剂施用到切口24的内表面。在重复该过程之前将工作电极18固定在下板14中的切口16中,让密封剂凝固。
一旦组装,上板12和下板14与第一玻璃衬里22和第二玻璃衬里34一起限定了腔室,该腔室容纳面对面布置的工作电极18和反电极30。电极之间的间隙为250μm,并且腔室的体积为19.6μl。流体可以经由入口26a和出口26b流过该腔室。
图6示出了包括上部玻璃板112和下部玻璃板114的微流体槽110的供选的实施方案,玻璃板基本上是正方形的。下板114包括空腔116,该空腔提供了用于电捕获和释放的腔室。空腔116可以是任何深度或形状。在所示的实施方案中,空腔116是钥匙形的,即其包括圆形部分116a和从圆形部分116a延伸的细长部分116b。在空腔116的表面上形成的溅射涂覆的金属层提供反电极130。两个孔126延伸通过下板114进入空腔116,为流体提供入口126a和出口126b。
微流体槽110还包括由碳棒形成的盘形工作电极118。工作电极118的直径大于形成腔室的下板114中的空腔116的圆形部分116a。工作电极118容纳在上板112中的圆形凹部124内。上板112还包括在板的大致中心中的第一孔132,其延伸到凹部124中,确保工作电极118的电连接。上板112中的第二孔134提供在对应于下板114中的空腔116的细长部分116b的位置中,从而使得能够与反电极130电连接。
为了组装槽110,上板112、下板114和工作电极118松散地组装,并且在板112、114热粘合在一起之前使板112、114准齐。然后使用密封剂将电触头(未示出)固定在上板112中的孔132、134中。
参考图4-6,现在将描述根据本发明的通过使用微流体槽的电捕获和释放的回收放射性同位素(溶剂交换)的方法的一个实施方案。所述方法首先包括使含有18f的富含18o的水经由入口26a、126a流入微流体槽10、110的腔室中。通过在电极两端施加电压在电极18、118、30、130之间产生电场,使得带负电的18f离子被吸引到工作电极18、118,使得它们被捕获在电极18、118上。废物h218o经由出口26b、126b从槽10、110去除。然后通过使乙腈流过腔室来洗涤腔室。将包含在乙腈中的k222和k2co3(和任选的4%h2o)的基于有机物的溶液通过入口26a、126a引入腔室中。然后,使电场的极性反转,使得18f离子从工作电极18、118释放到基于有机物的溶液中。然后可以经由出口26b、126b从腔室中去除含有释放的18f离子的基于有机物的溶液,并将其转移到单独的反应器中,其中18f离子与前体反应以产生放射性示踪剂。或者,前体可以提供在基于有机物的溶液中,使得前体和18f离子之间的亲核取代反应在腔室内发生。
实施例1
包含电极槽的放射性同位素分离模块
通过将两块玻璃板、一对电极(包括铂反电极)和包含通道的硅间隔物夹在一起来制造微流体rim槽。槽的细节在表1中提供。
用来自abt回旋加速器的包含18f的小体积的18o-水来测试槽。在不同的电压下,随着流速的变化探测捕获和释放效率。结果示于表2和3中。观察到高达99%的捕获效率(表2)和高达98%的释放效率(表3)。
表1
表2
表3
在设计1中,使用石墨作为阳极(工作电极)。在1分钟内在20v下实现99%的捕获效率,但在3分钟内仅可获得44-69%的释放效率。认为低释放效率是由于石墨电极的变形。通过用由碳棒形成的电极(槽设计2、3和3)代替石墨电极来改进槽,并且观察到释放效率的显著改善(表3)。在多于40次运行中观察到槽2和3的性能没有显著差异,证明了优异的稳定性。
整体式主体
在一个供选的实施方案中,rim包括整体式主体。某些实施方案的系统包括一个或多个包含色谱整体式主体的模块。适当地,rim、rpm、pm和/或qcm可以包括如本文所述的色谱整体式主体。适当地,所述整体式主体可以是整体式模块的一部分。
认为使用整体式主体可能是有利的,因为整体式主体的污染可能性较小,因此从整体式主体转移污染的可能性较小,和/或因为整体式主体的故障可能性较小,例如由于在整体式主体或微流体流动系统中的泄漏或阻塞而导致的故障,和/或因为可以实现更有效的分离。还可以考虑其它优点。
本文所述的方法可以包括用于从放射性样品中分离分析物的方法,所述方法包括以下步骤:
a)通过色谱整体式主体洗脱样品;
其中所述整体式主体是无机整体式主体并且是微流体流动系统的一部分。所述整体式主体可以是整体式模块的一部分。
样品可以是例如从rim供应到rpm的第一样品。
因此,所述整体式主体可以用于一个或多个以下步骤中:
i)浓缩放射性同位素;例如在rim中;
ii)任选地,如果需要,活化放射性同位素,例如通过溶剂交换;例如在rim中;
iii)合成放射性药物,例如通过用放射性同位素标记放射性药物的非放射性类似物;例如在rpm中;
iv)纯化放射性药物,例如在pm中;和
v)分析放射性药物,例如在qcm中;
其中步骤i)、ii)、iii)、iv)和v)中的至少一个包括用于从放射性样品中分离分析物的方法。从放射性样品中分离分析物的方法包括以下步骤:
a)通过色谱整体式主体洗脱样品;
其中所述整体式主体是无机整体式主体并且是微流体流动系统的一部分。所述整体式主体可以是整体式模块的一部分。
应当理解,本文所述的“整体式主体”不仅可以用于rpm,而且可以用于rim、pm和qcm,并且除非明确说明,否则整体式主体的以下描述不限于在rpm中使用。为了避免疑问,如本文所用的“分离”是指例如为了浓缩、纯化、合成和/或分析的目的从样品中分离或除去分析物。
“整体式主体”或“整料”是包括开孔的单一固体结构,其中孔一起形成通道的互连网络。在一个实施方案中,整体式主体是包含双峰孔结构的单一固体结构,其中孔包括大孔和中孔。在一个实施方案中,在单一固体结构内,开放的大孔一起形成通道的互连的曲折网络,而中孔产生高功能性表面积。整体式主体可以以柱、管、杆、盘等形式成型。在一个实施方案中,所述整体式主体为长方体形状。在一个实施方案中,所述整体式主体为圆柱形。在一个实施方案中,所述整体式主体包括基于二氧化硅的组分,例如二氧化硅,例如官能化的二氧化硅。在另一个实施方案中,所述整体式主体包括中孔凝胶,该凝胶可以部分或完全热解以形成陶瓷材料,例如整体式主体可以包括硅二亚胺中孔凝胶,其任选部分热解以形成亚氨基氮化硅,或完全热解以形成氮化硅陶瓷材料。本文提及的整体式主体是无机的。通常,本发明的整体式主体是高度多孔的。通常,所述整体式主体具有高表面积,例如至少100m2/g,特别是使用至少150m2/g,更特别是100-300m2/g,例如100至250m2/g,例如150至200m2/g。
整体式主体可以使用溶胶-凝胶程序制备。例如,将聚合物如peo加入到酸的水溶液中,冷却并搅拌。在搅拌下加入醇化硅(siliconalkoxide)(例如teos)以形成透明溶液。将该溶液注入模具中并加热(40℃,3天)以形成湿的半固体凝胶整料。将凝胶从模具中取出,用水洗涤,然后加入到氢氧化铵中用于进一步的后处理(90℃,16小时)。洗涤并干燥整料(40℃,1天)。
“整体式模块”包括一个或多个整体式主体,该整体式主体气密密封在包括至少一个入口和至少一个出口的单元中。整体式模块可以适于结合到整体式流动系统中。整体式模块可以通过注塑工艺制备。适当地,所述整体式主体是无机的。
“微孔”是孔径小于2nm、特别是在0.1nm和2nm之间的孔。“中孔”是孔径在2nm和50nm之间的孔。“大孔”是孔径大于50nm、特别是50nm至1微米之间的孔。
在一个实施方案中,所述整体式主体是无机的,并且作为如本文所定义的整体式模块的一部分被包括。整体式模块包括在注塑聚合物内的无机整体式主体。所述整体式模块包括入口和出口。
在一个实施方案中,所述整体式主体包含选自基于硅的组分、基于铝的组分和基于钛的组分的组分,其中每种组分任选地被化学官能化。特别地,所述组分选自基于二氧化硅的组分、基于氧化铝的组分和基于二氧化钛的组分,其中每种组分任选地被化学官能化。在另一个实施方案中,所述整体式主体包括基于硅的组分,选自二氧化硅、亚氨基氮化硅、硅亚胺和氮化硅,其中每种组分任选地被化学官能化。特别地,所述整体式主体包括二氧化硅或化学官能化的二氧化硅。基于硅(例如二氧化硅)、基于铝(例如氧化铝)和基于钛(例如二氧化钛)的整体式主体的化学官能化的方法是本领域技术人员已知的。
在一个实施方案中,所述整体式主体是阳离子交换整体式主体,例如整体式主体包括用丙基磺酸基团改性的二氧化硅。在另一个实施方案中,所述整体式主体是阴离子交换整体式主体,例如整体式主体包括用季铵改性的二氧化硅。在另一个实施方案中,所述整体式主体是反相整体式主体,例如整体式主体包括用十八烷基碳基团改性的二氧化硅。
在一个实施方案中,所述整体式主体的长度为10至80mm,例如10至40mm,例如10至36mm。在一个实施方案中,所述整体式主体具有2mm至6mm的宽度,例如3mm至5mm的直径。
实施例2-整料生产
使用solidworks软件设计模具,该软件也用于对cnc机器进行编程。然后使用cnc机器由ptfe磨出模具。
将0.282g聚环氧乙烷(peo)加入50ml的falcon管中并用冰冷却。加入2.54ml硝酸(1n),并搅拌混合物。然后加入0.29ml水,在保持冷却下将混合物搁置1小时。1小时后,加入2.26ml原硅酸四乙酯(teos),继续搅拌和冷却。
将分成两半的ptfe模具在固定器中放在一起并在40℃下加热1小时,然后紧固固定器以确保没有泄漏。搅拌1小时后,将peo/teos混合物注入模具中,确保模具充满并且所有空气逸出。将具有帕拉膜(parafilm)层的夹具靠模具入口放置并且紧固以密封模具,并将整个装置加热至40℃保持72小时。此后,去除夹具,并且小心地分开模具的两半。
在模具中形成的整体式主体从模具中取出,用水冲洗,然后在水中浸泡24小时,定期更换水,以确保整体式主体被良好地洗涤。基于二氧化硅的整料显示纳米孔直径为16nm,纳米孔体积为0.7cm3/g,比表面积为209m2/g。
将整体式主体加入到40ml水和10ml氢氧化铵(5m)的混合物中,将混合物在90℃回流下加热16小时。此后,从混合物中取出整体式主体并置于水中。在接下来的8小时内定期更换水,然后将整体式主体在40℃下干燥。最后,所述整体式主体在炉中加热至550℃保持3小时。当冷却时,所述整体式主体准备使用。关于制备二氧化硅整料的更多细节,请参见p.d.i.fletcher,s.j.haswell,p.he,s.m.kelly,a.mansfield,jporousmater.2011,18,501。
2.a.阳离子交换整体式主体的制备
将所需量的3-巯基丙基三甲氧基硅烷加入到含有10ml乙醇和10ml水的溶液中,随后加入二氧化硅整料。将混合物回流过夜。回收整料负载的硫醇并用水洗涤以除去未反应的试剂。通过与在10ml水和10ml甲醇中的10ml过氧化氢(30%)在60℃下反应过夜来氧化所获得的二氧化硅整料。回收整料并用水洗涤,并用10ml的1mh2so4处理。磺酸改性的整料用水洗涤并在60℃下干燥过夜。该阳离子交换整料的cec(阳离子交换容量)为181μeq/g。
2.b.阴离子交换整体式主体的制备
将所需量的二氧化硅整料加入到无水甲苯中。向其中加入含有0.12ml甲基三氯硅烷和0.3m在无水甲苯中的3-氯丙基三氯硅烷溶液。反应在80℃在氮气气氛下进行24小时。此后,回收整料并用二氯甲烷、甲醇、水和甲醇洗涤以除去未反应的试剂,然后在60℃下干燥过夜。接下来,将该整料在80℃下用在dmf中的n,n-二甲基乙胺处理24小时,以在二氧化硅整料的表面上形成带正电的基团。
2.c.反相二氧化硅整料的制备
将所需量的二氧化硅整料加入到1.57mmol十八烷基三甲氧基硅烷在甲苯中的溶液中。反应在80℃下进行过夜。回收整料并用甲苯洗涤并在60℃下干燥过夜。
关于二氧化硅整料的官能化的更多细节,请参见c.s.gill,b.a.price,c.w.jones,jcatal.2007,251,145或c.r.silva,c.airoldi,k.e.collins,c.h.collins,lcglnorthamerica2004,22,632。
实施例3:氮化硅、亚氨基氮化硅和硅硅亚胺(siliconsiliconimide)整体式主体的合成
制备某些氮化硅材料的细节可以在wo2006/046012中找到,其描述了用于制备基于氮化硅和氮氧化硅的材料的溶胶-凝胶方法。包含亚氨基氮化硅、硅亚胺和/或氮化硅的整体式主体及其制备方法公开于wo2013/054129中。本文所述的包含亚氨基氮化硅、硅亚胺和/或氮化硅的整体式主体可以根据wo2006/046012和wo2013/054129中所述的制备方法制备。
硅二亚胺中孔凝胶任选地部分热解以形成亚氨基氮化硅,或完全热解以形成氮化硅陶瓷材料。
实施例4:整体式模块的制备
4.1使用双模具工艺制备整体式模块
一旦官能化,所述整体式主体必须被气密地密封,以确保当施用时,流体流过整体式主体而不是围绕整体式主体流动,例如在整体式主体和壳体之间的界面处。这可以通过形成根据本发明的一个方面的整体式模块来实现。特别是,所述整体式主体可以放置在两个模具中的第一个中,所述整体式主体的一半保持在凹部中。整体式主体通过延伸到整体式主体的主轴的中心并在第一模制步骤期间保持接触的在整体式主体的每个端部处的突起固定就位。将熔融聚合物注入第一模具中,并让其凝固,在整体式主体上形成第一模块部分。将所得的具有集成的整体式主体的第一模块部件放置在第二模具中,其中模块表面与整体式主体相对并且模块侧部保持在凹部内。将熔融聚合物注入该第二模具中覆盖暴露的整体式主体表面并结合到第一模块部件的表面。在固化之后,将完整的整体式模块在炉中退火。入口孔和出口孔可以在模制过程期间模制到整体式单元中,或者可以被加工到整体式模块中。通过该方法制备的整体式模块包括除了入口和出口之外气密密封的整体式主体。
4.2包含硅氧烷模塑的整体式模块的制备
通过将1重量份固化剂与10重量份的基础弹性体混合来制备mdx4-4210生物医学硅氧烷。然后将混合物暴露于约710mmhg的真空约30分钟以从硅氧烷中除去任何滞留的空气。
通过围绕整体式主体模制mdx4-4210生物医学硅氧烷制备整体式模块。将整体式主体放置在模具中,并且定位成使得从整体式主体的表面到模具表面有至少1mm的距离。模具提供有气孔以释放滞留在未固化的硅氧烷内的空气。模具还提供有用于管道的孔,该管道将整体式主体保持在适当位置并允许调整模具内的整体式主体。
将硅氧烷混合物加入模具中以覆盖模具中的整料和管道,并在55℃下固化2小时。
发现所得模块符合在1ml/min的流速下的泄漏和稳定性要求。用乙腈和氢氧化钠观察到化学相容性。在24℃下将模块浸入乙腈中20小时后没有观察到体积变化。浸入氢氧化钠后观察到的体积变化如下:
在50%浓度、70°f下7天后体积增加+9%,
在20%浓度、70°f下7天后体积增加-2%,
在20%浓度、212°f下3天后体积增加+1.2%。
实施例5:在放射性同位素分离模块中使用整体式主体分离68ga
阳离子交换整料已经用于从衰变发生器定量地捕获和回收68ga。使用市售阳离子交换树脂仅回收了约50%的68ga。
使含水放射性物质例如68ga溶液通过阳离子交换整料柱,使得68ga被捕获在整料上。然后用基于有机物的溶液洗涤该整料,并用小体积的基于有机物的溶液洗脱柱,以释放至少95%的68ga。
通过向所获得的68ga溶液中加入所需的试剂,即dota、nota或dtpa,可以获得优异的标记产率,例如对于dota(20μmdota,95℃,10-20分钟)为99%,对于nota(100μmnota,室温,10分钟)为99%且对于dtpa(20μmdtpa,95℃,20分钟)为96%。
在放射性示踪剂的标记/或合成之后,反应混合物然后通过反相(c18)整料柱用于纯化。
放射性示踪剂的标记/或合成通过在rpm中将所需试剂加入到所得溶液中,然后使反应混合物通过反相(c18)整料柱以在pm中纯化来进行。
实施例6
在系统的rpm和pm中使用整料合成放射性示踪剂[18f]fdg
在施加在碳和pt电极之间的恒定电位(14-20v)下,将0.2-0.3ml的18f的水溶液以0.2ml/min的流速通过电极捕获槽。然后在断开电压的同时用无水mecn(0.5ml/min,1min)冲洗槽。将含有在mecn-h2o中的k222和khco3(1-10%)的0.1ml基于有机物的溶液以0.1ml/min的流速在反向电位(2-4v)下通过槽,同时将槽加热至80℃的预定温度,释放的溶液储存在样品环路中。用流速为0.02ml/min的mecn推动含有18f、k222和khco3的释放的溶液以在y型微混合器内与0.1ml甘露糖三氟甲磺酸酯溶液(0.02ml/min)混合,然后一起进入在100℃下加热的微反应器(体积0.05ml)中。将反应溶液与h2o流(0.04ml/min)混合,然后通过c18-整料柱以捕获标记的前体。将整料用水洗涤并用n2干燥。将0.4ml2nnaoh溶液加载到整料中,并在室温下维持水解2分钟,并用1至5ml水洗脱产物[18f]fdg,使其通过阳离子-、阴离子-、二氧化硅-和c18-整料用于纯化[18f]fdg。
放射性药物生产模块
适当地,系统还包括在使用中与rim流体连通的放射性药物生产模块(rpm)。适当地,从rim释放的放射性同位素与前体反应以形成放射性药物或放射性示踪剂或在放射性药物的合成中的中间产物。
在一些实施方案中,rpm包括微混合器和/或微反应器。
微流体系统还可包括加热器,加热器构造成加热全部或部分rpm。适当地,加热器可以构造成加热微混合器和/或微反应器。适当地,加热全部或部分rpm导致热传递到rim的腔室。在一些实施方案中,加热器包括热板、加热元件或加热垫。加热器可以是手动或自动操作的。
温度在化学和电化学过程的反应速率和效率中起重要作用。在这些过程中的一个或多个发生在集成系统内、例如在微流体系统内(例如在集成的微流体芯片中)的情况下,控制和/或区分每个过程发生的温度可能是有利的。例如,如果腔室保持在低于全部或部分rpm的温度下可能是有利的。
适当地,微流体系统还可以包括热减少装置。当rpm被直接加热时,操作热减少装置以减少从rpm到腔室的热传递。在一些实施方案中,热减少装置是在腔室和rpm的全部或部分之间形成在微流体系统(例如,在包括rim和rpm的微流体芯片中)中的狭槽。
在一些实施方案中,在rpm的直接加热区域和腔室之间存在大于50℃的温度差,特别是当rpm被加热到超过90℃的温度,例如约100℃时。
应当理解,将根据所需的放射性示踪剂选择前体。放射性示踪剂可以是通过例如使用18f的亲核取代制备的任何化合物。放射性示踪剂的实例包括[18f]-fdg、3'-脱氧-3'-[18f]氟胸苷(flt)、[18f]fmiso和18f-氟化钠。
在其中所需放射性示踪剂是[18f]-fdg的实施方案中,前体适当地是甘露糖三氟甲磺酸酯。用于制备其它常用放射性标记物质的合适前体是本领域技术人员已知的。
在一些实施方案中,rpm包括反应器,其中放射性同位素与前体反应。反应器可以形成与rim相同的微流体装置的一部分,或者可以提供在单独的装置中。反应器可以包括混合通道,其可以是例如蛇形通道。或者,rpm可包括如本文所述的整体式主体或整体式模块。
在一些实施方案中,rpm包括混合器,其中放射性同位素与前体混合。然后可以将混合物转移到反应器,在那里进行放射性同位素和前体之间的反应,例如通过加热。
或者,释放的放射性同位素可以在提供给rpm之前与rim中的前体反应。在一些实施方案中,基于有机物的溶液可另外包含前体,使得在从第一电极释放放射性同位素时放射性同位素与腔室中的前体反应。
在rpm中的放射性药物的生产可包括另外的化学处理步骤,包括例如水解、脱保护和/或纯化。例如,在其中放射性同位素是[18f]氟化物并且前体是甘露糖三氟甲磺酸酯的实施方案中,亲核取代反应产生乙酰化的[18f]fdg,其然后必须水解以脱除保护基团,以产生最终放射性示踪剂[18f]-fdg。合成所需放射性药物所需的适当化学处理步骤对于本领域技术人员是显而易见的。
在一个实施方案中,放射性药物是[18f]fdg。[18f]fdg的合成示意如下:
[18f]fdg的合成可以遵循以下步骤:
1.通过经由回旋加速器质子轰击富氧回旋加速器产生[18f]氟化物;
2.预浓缩[18f]氟化物水溶液,例如使用离子交换柱,使用整体式主体或通过电化学捕获;
3.在含有添加的相转移催化剂(通常为kryptofix2.2.2)和碳酸钾的乙腈中释放[18f]氟化物;
4.通过sn2亲核取代使甘露糖三氟甲磺酸酯与[18f]氟化物发生放射性标记反应,产生[18f]fdg的乙酰化形式(即未水解的[18f]fdg);
5.从乙腈到水的溶剂交换;
6.通过酸水解(hcl)或碱水解(naoh)将乙酰化的-[18f]fdg水解成[18f]fdg;
7.粗[18f]fdg混合物的纯化,例如,通过固相萃取(spe),例如使用整体式主体;
8.将该[18f]fdg剂量的制剂作为等渗盐水(氯化钠)溶液。
实施例7-[18f]-fdg的合成
根据以下方法生产在下文更详细描述的类似于图2所示系统的系统并用于合成[18f]-fdg。在施加在碳和pt电极之间的恒定电位(14-20v)下,以0.2ml/min的流速使0.2-0.3ml的包含18f的富含18o的h2o通过该槽。然后通过用无水mecn(0.5ml/min,1分钟)冲洗来洗涤该槽,同时断开电压。接着,将含有在mecn-h2o中的k222和khco3(1-10%)的0.1ml基于有机物的溶液以0.1ml/min的流速在反向电位(2-4v)下通过。将槽加热至80℃的预定温度,释放的溶液储存在样品环路中。用流速为0.02ml/min的mecn推动含有18f、k222和khco3的释放的溶液以在y型微混合器内与0.1ml甘露糖三氟甲磺酸酯溶液(0.02ml/min)混合。然后将混合物转移到加热至100℃的微反应器(体积0.05ml)中。将反应溶液与以0.04ml/min流速的h2o混合,然后通过c18-整料柱以捕获标记的前体。将整料用水洗涤并用n2干燥。将0.4ml2nnaoh溶液加载到整料中,并在室温下维持水解2分钟。用1-5ml的水洗脱产物[18f]-fdg。
使用该系统,以94-99%的效率捕获18f氟化物(初始活性高达30mci),随后以90-95%的释放效率释放。在脱保护柱上碱性水解后,获得98.3%[18f]-fdg。任选地,[18f]-fdg可以通过经阳离子-、阴离子-、二氧化硅-和c18-整料进一步纯化。
图16a示出了用于制备放射性示踪剂的微流体系统600的俯视图。在所示的实施方案中,系统包括微流体槽610,微流体槽610包括用于通过电捕获和释放进行18f的溶剂交换的腔室611。与微流体槽相邻的是阀630。系统还包括微流体反应器620。微流体反应器的区域621通过直接位于区域621下方的加热器(未示出)直接加热。热减少装置以狭槽640的形式提供。狭槽减少从直接加热区域(621)到微流体槽的腔室的热传递。
图16b是在直接加热区域621之后通过红外温度计测量的区域621和微流体槽610之间的温度差的图示。
使用微流体槽来处理来自回旋加速器的小体积重水进料提供了用于溶剂交换以进行与标准前体的亲核取代反应的优异方法。除了优异的捕获和释放性能之外,本发明的益处还包括使用低电压、重复使用电极和简单的操作。因此,本发明提供了有效按需配剂放射性示踪剂生产方面的显著潜力。
纯化模块(pm)
纯化模块(pm)在使用中可以与rpm流体连通,例如通过微通道或导管。pm可以构成在与rpm和一个或多个另外的模块相同的微流体装置中,或者可以是单独的部件。
纯化模块(pm)构造成从rpm中产生的放射性药物中除去杂质和残留溶剂。适当地,纯化模块包括一个或多个高效液相色谱柱。或者,pm包含如本文所述的一个或多个色谱整体式主体。适当地,所述整体式主体包括在整体式模块中。
因此,在一个实施方案中,分析物是杂质,并且样品是由rpm生产的放射性药物的溶液。进行分离以纯化放射性示踪剂(上述步骤iv)。
适当地,下表示出了可用于分离某些杂质的整体式主体的类型:
例如,分析物是选自[18f]氟化物和内毒素的杂质。这里使用的整体式主体例如是正相整体式主体(例如包括氧化铝或二氧化硅)。例如,分析物是选自乙酰化的[18f]fdg、乙酰化的[18f]fdm、甘露糖三氟甲磺酸酯和k222的杂质。此处使用的整体式主体可以是反相整体式主体(例如包括用十八烷基碳改性的二氧化硅(c18或c18整体式主体))。例如,分析物是选自k222和氢氧化钠的杂质。本文使用的整体式主体可以是阳离子交换整体式主体(例如用丙基磺酸基团改性的二氧化硅)。例如,分析物是选自盐酸的杂质。本文使用的整体式主体可以是阴离子交换整体式主体(例如用季铵改性的二氧化硅)。
在一个实施方案中,分析物选自[18f]氟化物、[18f]乙酰化的-fdg和[18f]fdg。这里使用的整体式主体可以是正相整体式主体(例如包括氧化铝或二氧化硅)。例如,分析物可以包含分析物成分[18f]氟化物、[18f]乙酰化的-fdg和[18f]fdg且分析物组分通过整体式主体彼此分离。流动相可以包括乙腈和水,例如乙腈:水的比例例如为90:10至95:5,例如90:10或95:5。
在一个实施方案中,分析物选自甘露糖、葡萄糖、[18f]fdg、[18f]fdm和cidg。本文使用的整体式主体可以是强阴离子交换(sax)整体式主体。例如,分析物包括分析物组分[18f]fdg、[18f]fdm和[18f]fdg,分析物组分通过整体式主体彼此分离。样品可以包含选自[18f]fdg、[18f]fdm、[18f]fdg、乙腈和水的一种或多种组分。流动相可以包括氢氧化钠,例如20至200mm,例如20至100mm,例如50mm。
质量控制模块
所述系统适当地包括质量控制模块,质量控制模块用于确定包含从纯化模块获得的放射性药物的样品的一个或多个特性。
图7包括列出由英国药典2012规定的示例性放射性示踪剂([18f]fdg)必须满足的某些标准的表格。本领域技术人员应当理解,本发明的实施方案不限于[18f]fdg的测试。例如,本发明的某些实施方案涉及对其它放射性示踪剂和/或用于体内施用的其它化合物进行质量控制测试的装置、系统和方法。在本发明的某些实施方案中,所述装置、系统和方法用于确定药物化合物的至少一种特征。
在一个实施方案中,在纯化后,对[18f]fdg的样品进行qc测试,以确保所有杂质已被除去并且该药剂的性质适合于注射。本文所用的术语“[18f]fdg”和“fdg”是可互换的,并且涉及化合物2-[18f]氟-2-脱氧-d-葡萄糖。以上描述了制备[18f]fdg的方法的概述。
在给予患者之前,该批[18f]fdg必须经历多个质量控制测试以确保其满足必要的安全要求。适当地,本发明的某些实施方案提供了一种微流体系统,其可用于进行微流体量的化合物例如[18f]fdg的质量控制测试。本发明的某些实施方案提供了可用于确定样品的特性的测量值。然后可以将测量值与预定的相应标准值进行比较,以确定样品是否适合施用于患者。预定的相应标准值可以使用已知文献来确定,例如虽然不限于当前的英国药典、欧洲药典、国际药典、美国药典等。
适当地,本发明的某些实施方案测试了包含[18f]fdg的样品的“外观”和/或澄清度。在英国药典中,陈述了[18f]fdg的外观应该是“澄清、无色或微黄色溶液”。然而,通常认为微黄色溶液可能含有杂质。此外,其他药典陈述了,[18f]fdg应当是“无色的并且不含颗粒物质”。因此,通常提出[18f]fdg溶液应该是澄清、无色的,并且不含颗粒物质。本发明的某些实施方案确定用于体内使用的化合物例如放射性药物的外观,并且适当地确定该放射性药物是否适合施用。
此外,应当测试样品的化学杂质的存在和量。在化学纯度测试方面,cidg是指2-氯-2-脱氧-d-葡萄糖,其是特别是当使用酸水解时可存在的杂质,其中氯化物原子代替[18f]氟化物标记。氯化物的另一种来源可以是在许多系统中用于预浓缩[18f]氟化物标记的阴离子交换柱,这取决于存在于柱树脂上的反荷离子。
适当地,acy-[18f]fdg或者acy-fdg是指[18f]fdg的乙酰化/未水解形式,其是2-[18f]氟-1,3,4,6-四-o-乙酰基-d-葡萄糖(也称为[18f]tag),而部分水解的acy-[18f]fdg也可以存在。
[18f]fdm是2-[18f]氟-2-脱氧-d-甘露糖,一种可以在[18f]fdg合成过程中产生的副产物,并且也可以以完全或部分水解形式存在(acy-[18f]fdm)。
适当地,本发明的某些实施方案确定了样品中杂质的存在和/或量。在一个实施方案中,芯片、系统和/或方法可用于确定样品中残留溶剂的存在和/或量。
在一个实施方案中,样品可以包含乙腈和/或乙醇。适当地,本文所述的装置、系统和方法可用于确定样品中乙腈和/或乙醇的存在和/或量。
在[18f]氟化物标记期间使用乙腈作为溶剂。乙醇通常用于清洁系统和用于调适纯化柱。根据英国药典(bp)和欧洲药典(ep),乙腈和乙醇的浓度必须分别<410ppm和<5000ppm。
在一个实施方案中,其它杂质可以通过芯片、系统和/或方法来确定。适当地,杂质是溶剂。适当地,杂质选自乙醚、丙酮和甲醇。所述方法还可以检测[18f]氟化物和/或葡萄糖的存在和/或浓度。
ph
根据英国药典,用于体内使用的化合物的药剂例如[18f]fdg药剂的ph应该在4.5至8.5的范围内,但是该范围可以在其它药典中变化(例如美国药典中ph为4.5至7.5)。
kryptofix2.2.2
氨基聚醚,kryptofix2.2.2(4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]二十六烷),也称为穴状配体2.2.2,是[18f]fdg合成期间使用的相转移催化剂。它将钾离子结合到其笼状结构中,防止在乙腈中形成[18f]氟化钾,从而使[f]氟离子通过亲核取代与甘露糖三氟甲磺酸酯分子反应。然而,同时,合成的一个重要方面,kryptofix2.2.2(以下称为k222)也是非常有毒的,引起患者的呼吸暂停、上睑下垂和抽搐,且大鼠的静脉内ld50为35mg/kg。因此,将其从[18f]fdg去除是重要的,并且必须确定其在药剂中的浓度。
可存在于[18f]fdg中的k222的极限取决于不同的药典,其中欧洲药典和英国药典陈述了每体积药剂的极限为2.2mg(例如,在10ml药剂中k222的最大量可以为2.2mg,其等于220μgml-1),而在美国药典中,极限设定为50μgml-1。此外,k222对于许多涉及[18f]氟化物的放射性标记过程(因此不仅限于[18f]fdg)是必需的。
虽然在英国药典中称为“氨基聚醚”的kryptofix2.2.2通常是通过亲核取代合成[18f]fdg中所选的相转移催化剂,但是其它催化剂如四丁基铵和4-(4-甲基哌啶-1-基)吡啶也可替代使用。因此它们包含在英国药典中。然而,值得注意的是,英国药典陈述了,如果没有潜在杂质的来源,则不需要进行特定的测试(例如,如果使用kryptofix2.2.2作为相转移催化剂,则不需要测试四丁基铵)。
细菌内毒素
在[18f]fdg和其他放射性药物的情况下,必须在该放射性药物被认为对患者给药安全之前确定细菌内毒素的存在和/或量。细菌内毒素可以通过例如非无菌管、容器、化学品和/或水引入放射性药物制造过程中。
可以使用本发明的某些实施方案来确定上文提到的特征中的每一个。一旦已经确定了样品的特性,就可以决定该化合物是否适于体内使用。在本发明的某些实施方案中,样品的体积仅比化合物的单一单位剂量大百分之几。因此,包含所述化合物的单一单位剂量的样品离开芯片,并且适于施用于患者,条件是所有的样品特征满足体内使用的规定要求。
适当地,qcm包括在微流体芯片中或包括微流体芯片。适当地,使用光刻和湿蚀刻程序来制备芯片。此外,还可以使用这些技术形成包括如本文所述的一个或多个模块的集成微流体装置。适当地,以铬层和光致抗蚀剂层为特征的玻璃晶片通过以通道设计为特征的光掩模暴露于uv光。暴露于光的光致抗蚀剂区域变得可溶于照片显影剂溶液中,该显影剂溶液然后用于剥除曝光区域,显露铬层上的通道设计。然后蚀刻掉暴露的铬,使得通道设计在玻璃上可见。然后可以使用1%的氢氟酸溶液将通道设计蚀刻到玻璃中,之后可以在玻璃中钻入通路孔。然后除去剩余的光致抗蚀剂和铬层。然后将板彻底清洁并具有与其准齐的上平面结构。将两个板放置在炉中,顶部放有钢重物,并在约585℃下放置4小时,以使板热粘合。
在某些实施方案中,微流体装置包括使用上述标准光刻和湿蚀刻程序在玻璃(涂覆有铬和光致抗蚀剂层的b270,telic,usa)中制造的三个层。
在包括如本文所述的检测通道的实施方案中,检测通道通过钻入居中板或中间板中的孔形成。一旦除去光致抗蚀剂和铬层,将三块板彻底洗涤,然后仔细准齐,以匹配:(i)任何入口孔与蛇形通道入口,(ii)人字形结构(如果存在)与蛇形通道,(iii)所述一个或多个检测通道(在中间板中)与下板上的出口通道。然后将它们用带捆在一起,并在约585℃的温度下放置在炉中4小时,以将所有三个板热粘合在一起。
在一个实施方案中,上平面结构和下平面结构为1mm厚,约30mm乘30mm。本发明的实施方案包括其他尺寸。在一个实施方案中,中间平面结构106具有在约2mm至5mm之间的厚度。适当地,中间平面结构具有在2mm至4.5mm之间的厚度。适当地,中间平面结构具有在3mm至4mm之间的厚度。
本发明的实施方案也考虑并涵盖其它尺寸的微流体芯片。
芯片的总体积容量可以根据其用途而变化。在某些实施方案中,芯片的总体积容量可以小于2ml。适当地,芯片具有不超过约500μl的总流体体积容量。适当地,芯片具有200μl或更小的总流体体积容量。在一个实施方案中,芯片具有75μl或更小的总流体体积容量,例如,70μl或更小、60μl或更小或50μl或更小。在本发明的某些实施方案中,芯片可以具有10μl或更小、例如5μl或更小的总体积。在某些实施方案中,芯片具有小于2μl的总流体体积容量。适当地,芯片是微流体流动装置和/或为微流体流动装置的一部分。
平面结构中的每一个由光可以透射通过的材料制成。例如,每个平面结构可以由玻璃、塑料、环烯烃聚合物(cop)、石英或这些材料的组合形成。在一个实施方案中,平面结构由玻璃形成。
图8示出了可以形成系统的qcm的一部分的微流体芯片2000。微流体芯片2000包括用于将样品供应到芯片的入口端口2020。入口端口202提供在芯片的上表面2040上。上表面可以由如上所述的层状芯片中的上平面结构提供。在一个供选的实施方案中,芯片可以由单个部件形成,因此仅具有单个层。这种芯片可以通过本领域已知的技术形成,例如激光烧蚀、立体光刻和3d印刷。
微流体芯片2000还包括第二入口端口2060。第二入口端口可用于将一种或多种试剂引入芯片。第二入口端口2060经由第一微通道2080与第一入口端口流体连通。微通道2080连接到另外的微通道2100。在所示的实施方案中,所述另外的微通道2100在接合点2120处连接到第一微通道,接合点2120通常在第一入口端口和第二入口端口之间的第一微通道的中点处。
所述另外的微通道2100包括蛇形通路部分2140,其中在检测发生之前试剂和样品混合。因此,该另外的微通道可以称为混合微通道。
混合通道连接到检测通道2160,检测通道2160以至少部分地通过芯片的厚度与混合通道大致成直角提供。检测通道以在位于上板2200和下板2220之间的中间平面结构2210中的孔的形式提供。
下板2220提供有t形微通道2240,微通道2240与用于从芯片移除样品/试剂混合物的出口2260流体连通。在所示实施方案中,芯片包括两个出口。在一个供选的实施方案中,芯片可以包括单个出口,并且微通道2240可以相应地为线形或l形。
芯片或包括芯片的系统还可以包括一个或多个驱动元件(未示出),例如注射泵,以将试剂和样品从相应的入口端口移动到第一微通道中。驱动元件然后可用于迫使试剂和样品进入混合通道。在一个实施方案中,样品和试剂以基本上相同的速度沿着第一微通道移动,使得流体在接合点2120处相遇。
在一个实施方案中,驱动元件迫使样品和分析物的混合物沿着检测通道、随后沿着微通道2240、然后经由出口2260或出口2280离开芯片。
在使用中,检测通道2160提供源(例如光源)和检测器之间的路径长度。源可以在与检测通道的长轴准齐的位置(即通过芯片厚度的方向)定位于邻近第一表面或与第一表面例如芯片的上表面接触。
源可以是光源。在某些实施方案中,检测器和/或源是恒电位仪。
在某些实施方案中,系统包括多个源,例如恒电位仪和一个或多个光源。
在一个实施方案中,系统包括多个检测器,例如uv-可见光光谱仪、可见/近红外光谱仪、拉曼光谱仪和/或恒电位仪。
光源可以连接到例如连接或邻近于微流体芯片表面的光纤缆线。
检测器或连接元件(例如光纤缆线)可以连接到微流体芯片朝向光源的相对表面或定位成与微流体芯片朝向光源的相对表面相邻。检测器或连接元件与检测通道的长轴准齐,并且因此与光源准齐。在一些实施方案中,检测器与源提供在芯片的相同侧。
在使用中,提供在路径长度中的分析物(例如样品或包含样品或其一部分的混合物)可以吸收由源提供的一些光,因此意味着到达检测器(例如光谱仪)的信号将不同。
检测通道的每一端是封闭的,因此恰好提供在检测通道末端上下方的芯片的上表面和下表面由允许从源到检测器的传输的材料构成。在一个实施方案中,所述材料能够将紫外-可见光和/或可见光/近红外光从光源传输到检测器,例如uv-可见光谱仪或可见/近红外光谱仪。因此,在一个实施方案中,芯片至少部分地由光学透明材料形成。
包括本文所述的检测通道的芯片可用于确定化合物的一种或多种特性。如上所述,检测通道提供了源和检测器之间的路径长度并因此提供了特性,这些特性可以通过测量例如吸光度来检测和/或测量。在某些实施方案中,确定化合物的特性涉及分析特定波长处的特性值。
可以根据本发明的某些实施方案使用微流体芯片确定的样品的一个特性是ph。可以使用uv-可见光谱或可见-近红外光谱检测ph。在一个实施方案中,检测器检测可见光。
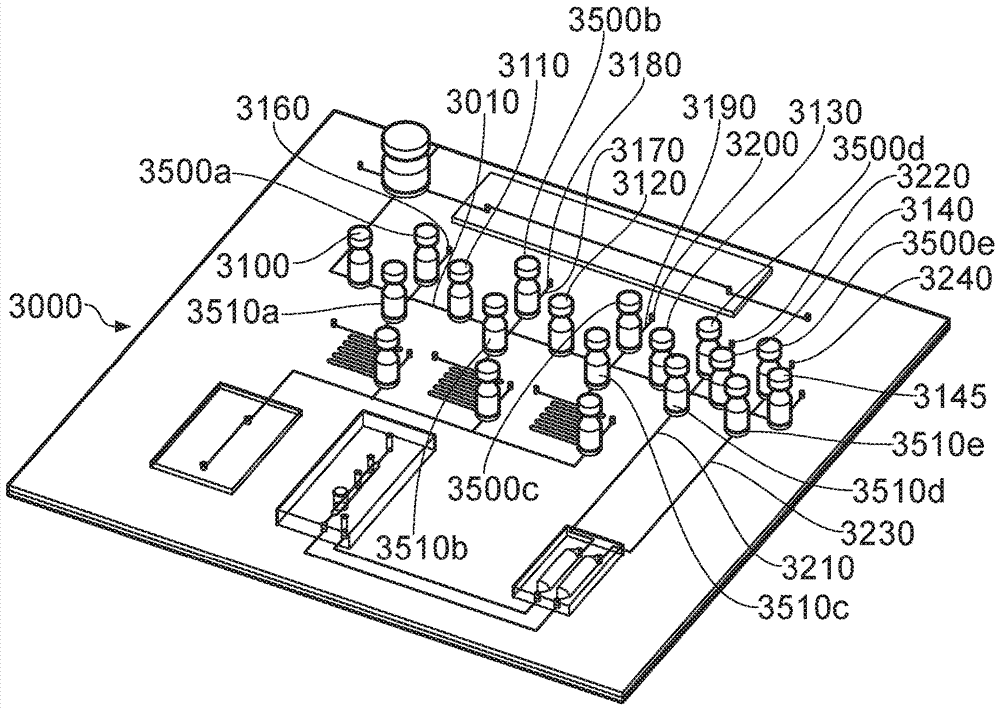
qcm的一个供选的实施方案在图9中示出。图9的微流体芯片3000包括与入口端口3020流体连通的第一微通道3010。样品流体可以通过入口端口3020引入微流体芯片。
微流体芯片可以包括如上所述的层状结构。也就是说,芯片可以包括由上平面结构、下平面结构(未示出)和位于上平面结构和下平面结构之间的中间平面结构(未示出)形成的三层。这些层可以如上所述以流体密封方式粘合或以其它方式彼此固定。
第一微通道3010包括第一阀元件3040,第一阀元件3040可以控制流体的移动,例如,使样品进入第一微通道。
图9中所示的芯片包括称为样品通道的额外的微通道3050。样品通道与样品入口端口流体连通。样品通道与第一微通道相交。第一阀元件可以是多向阀,该多向阀根据用户的要求控制样品到样品通道或第一微通道的移动。
样品通道与出口3060流体连通。适当地,样品通道不连接到任何另外的入口。因此,没有试剂加入到样品通道中的样品中,并且样品可以适合于给予有需要的患者。是否施用样品将取决于由本发明的实施方案的系统进行的一个或多个测试的结果和样品特性的确定。
样品通道可以与如本文所述的一个或多个检测通道流体连通。提供第一检测通道3070,其可以用于确定样品的特性诸如澄清度和/或外观。第二检测通道3080可以提供在第一检测通道的下游。
适当地,第一检测通道和第二检测通道可以经由提供在下平面结构中的样品通道的一部分而流体连通。因此,在使用中,样品或其一部分沿着样品通道、向下流过第一检测通道、沿着下平面结构中的样品通道、然后向上沿着第二检测通道流动。然后样品经由出口3060离开。
适当地,第一微通道包括多个阀元件,所述阀元件可以用于将样品和/或试剂和/或溶液从第一微通道引导到微流体芯片的其它区域。此外,阀元件可用于将第一微通道中的流体部分与第一微通道的其它区域隔离。适当地,阀元件以串联方式提供。
因此,第一微通道3010可以包括第二阀元件3100、第三阀元件3110、第四阀元件3120、第五阀元件3130、第六阀元件3140和第七阀元件3145。最终,阀元件的数目可以取决于待在芯片上提供多少测试,并且因此待引导到多少个样品检测区域部分。第一微通道可以包括用于施加负压以通过第一微通道取出样品的部件3600。
第一微通道可以包括在第一阀元件和第二阀元件之间方向的约90度的变化(3030)。第一交叉通道3150可以提供在芯片上。第一交叉通道3150与另外的入口(在本文中称为第二入口端口3160)流体连通。第一交叉通道在第二阀元件3100和第三阀元件3110之间的接合点处与第一微通道相交。
如本文所述,每个交叉通道可提供有一对阀元件,所述阀元件在用样品填充第一微通道期间防止流体从检测区域流出。适当地,该对阀元件中的一个提供在交叉通道之间的接合点上游的交叉通道中,且阀元件对中的另一个提供在接合点的下游。当第一微通道填充有样品时,用3500a、3500b、3500c、3500d、3500e和3510a、3510b、3510c、3510d和3510e表示的阀元件被置于关闭位置。一旦期望样品或其一部分流到检测区域时,可以打开交叉通道的阀以向检测区域提供流体流动路径。
应当理解,在某些实施方案中,第一微通道可以提供有供选的阀元件布置。例如,在一个实施方案中,第一微通道可以提供有单个阀元件,该阀元件位于第一微通道和交叉通道之间的交叉处,代替位于第一微通道和交叉通道之间的接合点附近的阀元件对。单个阀元件可以包括贯通型通道,该通道的尺寸适于容纳一定体积的样品。该体积的样品可以通过转动阀元件来隔离。然后,隔离的样品部分可以通过由驱动流动相提供的正压从阀通道流出。该实施方案在图10中示出。
在接合点的下游,第一交叉通道与试剂入口端口3260流体连通。在试剂入口端口3260的更下游,第一交叉通道包括蛇形混合部分3270。第一交叉通道与检测区域3280流体连通。检测区域适当地包括第三检测通道3285,第三检测通道3285至少部分地延伸通过芯片的厚度并提供源和检测器之间的路径长度。
第二交叉通道3170提供在芯片上。第二交叉通道与称为第三入口端口的入口端口3180流体连通。第二交叉通道在第三阀元件3110和第四阀元件3120之间的接合点处与第一微通道3010相交。在所示实施方案中,第二交叉通道具有与第一交叉通道类似的结构。第二交叉通道在接合点下游的位置处与第二试剂入口端口3290流体连通。第二交叉通道包括蛇形混合区3295,其中一部分样品和通过第二试剂入口端口引入的试剂可以在进入检测区域之前混合在一起。
芯片还可以包括第三交叉通道3190。第三交叉通道与称为第四入口端口的入口端口3200流体连通。第三交叉通道在第四阀元件3120和第五阀元件3130之间的接合点处与第一微通道相交。第三交叉通道在接合点下游的位置处与第三试剂入口端口3300流体连通。第二交叉通道包括蛇形混合区3305,其中一部分样品和通过第二试剂入口端口引入的试剂可以在进入检测区域之前混合在一起。
可以提供一个或多个阀元件3310、3320、3330以控制在第一、第二和/或第三交叉通道中的流体到检测区域的流动。因此,阀元件可以用于选择性地移动流体,例如样品的一部分和来自一个而不是另一个交叉通道的试剂的混合物。因此,一次仅将样品和试剂的一种混合物引导到检测区域并进入检测通道。
微流体芯片可以另外包括一个或多个入口端口以引入溶液(例如洗涤溶液或标准溶液)通过检测区域。这些入口端口3350、3360和3370适当地提供在阀元件的上游,从而能够控制通过这些入口端口引入的流体到检测区域的流动。
检测区域可以包括用于去除已经沿着检测通道行进的流体的出口3340。
在一个供选的实施方案中,第一、第二和第三交叉通道中的每一个可以与检测通道流体连通。也就是说,代替图9中所示的第三检测通道,可以提供多个检测通道,每个检测通道连接到单个交叉通道。在这样的实施方案中,使用多个检测通道来确定多个特性可以同时发生。
芯片还可以包括第四交叉通道3210,其在第五阀元件3130和第六阀元件3140之间的接合点处与第一微通道相交。第四交叉通道3210适当地与提供在接合点上游的称为第五入口端口的入口端口3220流体连通。第四交叉通道与包括第二分离元件3270的另外的检测区域3520流体连通。第二分离元件可包括如上所述的和/或如下所述制备的整体式主体。
作为分离元件的阳离子交换整体式主体的制备
将所需量的3-巯基丙基三甲氧基硅烷加入到含有10ml乙醇和10ml水的溶液中,然后加入二氧化硅整料。将混合物回流过夜。回收包含硫醇表面基团的整料,并用水洗涤以除去未反应的试剂。所得二氧化硅整料通过与在10毫升水和10毫升甲醇中的10毫升过氧化氢(30%)在60℃下反应过夜而氧化。回收整料并用水洗涤,并用10ml1mh2so4处理。磺酸改性的整料用水洗涤并在60℃下干燥过夜。
作为分离元件的阴离子交换整体式主体的制备
将所需量的二氧化硅整料加入到无水甲苯中。向其中加入含有0.12ml甲基三氯硅烷和0.3m3-氯丙基三氯硅烷在无水甲苯中的溶液。反应在80℃在氮气气氛下进行24小时。此后,回收整料并用二氯甲烷、甲醇、水和甲醇洗涤以除去未反应的试剂,然后在80℃干燥过夜。接下来,将该整料用在dmf中的n,n-二甲基乙胺在80℃下处理24小时,以在二氧化硅整料的表面上形成带正电的基团。
作为分离元件的反相二氧化硅整料的制备
将所需量的二氧化硅整料加入到1.57mmol十八烷基三甲氧基硅烷在甲苯中的溶液中。反应在80℃下进行过夜。回收整料并用甲苯洗涤并在60℃下干燥过夜。
关于二氧化硅整料的官能化的更多细节参见c.s.gill,b.a.price,c.w.jones,jcatal.2007,251,145或c.r.silva,c.airoldi,k.e.collins,c.h.collins,lcglnorthamerica2004,22,632。
整体式模块的制备
一旦官能化,整体式主体必须被气密地密封,以确保当施用时流体流过整体式主体而不是围绕整体式主体,例如在整体式主体和壳体之间的界面处。该过程如上所述。
第二分离元件可以包括在单独的模块中,该模块在使用中提供在上平面表面的上表面上。第二分离元件与流动到包括电化学槽3410的检测区域的微通道3420流体连通。第二分离元件与提供在也包括电化学槽的检测区域中的出口3450流体连通。
芯片还包括第五交叉通道3230,其在第六阀元件3140和第七阀元件3145之间的接合点处与第一微通道相交。称为第六入口端口的入口端口3240提供成与接合点上游的第五交叉通道流体连通。
第五交叉通道3230与提供在另外的检测区域3520中的第一分离元件3400流体连通。第一分离元件包括如本文所述的整体式主体或模块。
第一分离元件3400与流入包括电化学槽3410的检测区域的另外的微通道3420流体连通。电化学槽可包括约50μm深、150μm宽和20mm长的腔室。工作电极包含在槽中。在一个实施方案中,工作电极是包裹在玻璃管(直径3mm)中的铂丝(直径0.25mm)。电化学槽还包括反电极和参比电极。在一个实施方案中,反电极包括直径为约1mm的铂丝。在一个实施方案中,参比电极包括直径约为1mm的银/氯化银丝。每个电极通过槽中的孔放置。在一个供选的实施方案中,工作电极是金,反电极是铂丝,参比电极是钯丝。
芯片还可以包括在电化学槽的电极下游的出口3460。在一个供选的实施方案中,电化学槽包括丝网印刷的电极。丝网印刷的电极可以采用可商购的电极,例如可从dropsens,spain获得的电极。丝网印刷的电极可以通过o形环密封到微芯片。
在某些实施方案中,qcm还结合了辐射检测器。辐射检测器可以是例如正电子检测器或伽马检测器。
适当地,qcm还可以包括光纤缆线或者在使用中连接到光纤缆线,光纤缆线与第一检测通道3070大体上准齐放置。光纤缆线可以连接到源例如光源(未示出)。系统还包括在与缆线相对的表面上与第一检测通道大体上准齐的缆线。缆线4030连接到检测器,例如微型uv-可见光谱仪或可见-近红外光谱仪。
类似地,一对缆线定位成与第三检测通道相邻,并且分别连接到源和检测器。另外的缆线定位成与第二检测通道相邻并与第二检测通道大体上准齐。所述另外的缆线可以是拉曼光谱缆线。拉曼光谱缆线可以充当与拉曼探针的连接器,拉曼探针既作为源又作为检测器。
在本发明的某些实施方案中,提供在芯片中的一个或多个通道具有被动混合结构。在一个实施方案中,一个或多个通道在其一个或多个表面上包括人字形图案。
在使用中,将包含放射性药物的样品经由样品入口端口3020引入qcm。样品可通过本领域已知的方法引入,例如注射泵等。通常样品的量等于或略大于单一单位剂量。适当地,从纯化模块(pm)引入样品。
在使用中,将用于体内使用的化合物的样品例如放射性药物提供到微流体芯片。可以使用多种方法提供样品,包括例如通过注射器或滴管。样品可以泵送到微流体芯片中。流体(例如样品)可以流过微通道,例如通过向连接到微通道的出口施加负压或通过连接到注射泵(例如pump11elite,harvardapparatus,uk)的注射器。在微流体中引导流体流动的其它方法是本领域技术人员已知的。
样品输入可以自动或手动进行。样品可以以微流体量提供给芯片。在一个实施方案中,样品以通常等于用于患者的单位剂量的量提供。在一个实施方案中,一旦去除了进行质量控制分析技术所需的样品量,以等于单一单位剂量的量提供样品。
然后可以将样品或其一部分导向第一微通道和/或样品通道。第一阀元件3040可以第一方向提供,以将样品的一部分引入例如样品通道。当需要量的样品已经引导到样品通道中时,阀方向可以改变以防止任何更多的样品进入样品通道。
然后样品通道3050中的该部分样品可以沿着样品通道流动。在出口3060处施加的负压可以用于使样品的该部分沿着样品通道并且沿着第一检测通道3070和第二检测通道3080流动。源(例如经由光纤缆线的光)可以在样品或其一部分容纳在检测通道中的同时沿着检测通道的长轴传送。
在根据某些实施方案的系统中可以提供光源诸如卤素光源(hl-2000-fhsa(oceanoptics)。如上所述提供检测器(usb2000+vis-nir-es(oceanoptics)。光纤(qp400-1-uv-vis(oceanoptics)可以用于在与第一检测通道的长轴大体上准齐的位置处将光源和检测器连接到芯片。在某些实施方案中,检测器可以是例如红外检测器或荧光检测器。
为了确定外观和/或澄清度,记录样品的吸光度值。在光谱中存在意想不到的峰表示样品的污染。
可以对流入第二检测通道3080的样品的一部分进行拉曼光谱,以确定杂质的存在和任选的量,例如样品中的乙醇和/或乙腈。适当地,拉曼光谱设置包括耦合到光纤拉曼探针(rpb,inphotonics,oceanoptics)中的785nm连续波激光器(laser-785-ip-lab,oceanoptics,uk)。探针可以具有7.5mm的工作距离并且产生160μm的激光光斑尺寸,具有1.5mm的场深。来自样品的散射光可以经由相同的探针收集并且由分叉的光纤引导到小型光谱仪(qe65000,oceanoptics)中。
拉曼探针可以固定在定制的固定器中,通过来回移动探针来使激光聚焦,随后转动螺钉以将其锁定到其最终位置。拉曼光谱和其他吸收光谱结果可以使用spectrasuite软件(oceanoptics)记录。
将微流体芯片垂直定向放置在铝固定器中,并且经由x-y平移阶段定位,使得拉曼激光器与芯片中的直径368μm的检测通道准齐。然后使用上述固定器使探针聚焦到3mm长的通道中。
在一个实施方案中,对于被认为适合于体内使用的样品(例如包含[18f]fdg的样品),其必须含有不超过5000ppm乙醇(在水中)和不超过410ppm乙腈(在水中)。适当地,某些实施方案的方法包括通过记录乙醇和乙腈标准物的光谱并将峰强度与样品的峰强度进行比较来校准拉曼光谱仪。适当地,对于乙醇,在约882cm-1处获得峰值强度,对于乙腈,在约925cm-1处获得峰强度。
没有试剂被添加到引导到样品通道中的样品部分。因此,可以从出口3060收集该部分样品并施用给患者,条件是样品满足所有质量控制要求。因此,在某些实施方案中,导入样品通道的那部分样品等于化合物的单位剂量。
样品的其余部分可以引导到第一微通道中。这可以在那部分样品流入样品通道之前或之后发生。样品的一部分可以通过例如对出口3600施加负压的方式流入第一微通道。在该阶段期间,第二阀至第七阀全部打开以允许样品的该部分沿着第一微通道的长度流动。适当地,交叉通道中的阀关闭以避免来自预加载在检测区域中的试剂的污染。
一旦样品的该部分沿着第一微通道定位,就停止施加负压。适当地,第二阀至第七阀中的每一个都关闭,以便将样品的多个部分隔离在阀元件对之间。然后可以对每个隔离的样品部分进行不同的分析技术,以便确定样品的多个特性。
因此,适当地,可以分析隔离在第二阀元件和第三阀元件之间的样品部分,以确定样品的ph。驱动溶液引入入口端口并因此引入第一交叉通道3150中。驱动溶液的引入迫使隔离在关闭的阀元件之间的样品部分进入第一交叉通道以形成样品塞段。驱动溶液引起隔离的样品的夹带,使得隔离在阀之间的基本上所有的样品进入第一交叉通道。然后迫使样品塞段沿着在该通道和第一微通道的接合点下游的第一交叉通道。应当理解,交叉通道的阀必须打开以允许样品和溶液的移动。
通过试剂入口端口3260引入试剂。如果正在测量ph,则可以引入通用ph指示剂。然后将通用ph指示剂与样品塞段在第一交叉通道的混合区中混合。适当地,通用ph指示剂溶液(ph3-10)例如由fluke(代码:31282)供应,用乙醇以1:2的指示剂/乙醇比率稀释。在样品和通用指示剂之间进行比色反应,然后可以使用uv-可见光或可见-近红外光谱进行分析。适当地,样品的反应和ph的检测在室温或在温度受控的环境中进行。
可以在根据某些实施方案的系统中提供光源诸如卤素光源(hl-2000-fhsa(oceanoptics)。如上详述提供检测器(例如usb2000+vis-nir-es(oceanoptics))。可以使用光纤(qp400-1-uv-vis(oceanoptics))在第三检测通道3340处将光源和检测器连接到芯片。
系统可以通过将通用指示剂与一系列ph标准物或仅在允许的ph值下的ph标准物(例如,对于fdg为4.5和8.5)混合来校准。
可以通过分析记录的光谱来检测样品的ph。可以通过绘制v形图(其由在545-550nm范围内所取波长处的吸光度值产生以提供成功/失败标准)或者绘制来自波长520、540、560、600、620和640nm的雷达图来基于形状识别来确定ph。
一旦样品部分已经沿着第三检测通道流下,它可以从出口收集,然后被丢弃。
第三检测通道可用作容器以进行多个基于吸光度的测试,例如,确定ph。可以使用基于吸光度的设置来确定的其他特征例如包括确定样品中细菌内毒素的存在和/或量。在某些实施方案中,例如,当样品是放射性药物例如fdg时,特征可以是kryptofix2.2.2的存在和/或量。
适当地,当第三阀和第四阀关闭时,驱动溶液通过第三入口端口引入第二交叉通道。驱动溶液迫使隔离在第三阀和第四阀之间的那部分样品形成塞段并沿着第二交叉通道流动。与样品进行比色反应的试剂引入第二试剂入口端口3290,例如如果要确定的特征是kryptofix2.2.2的存在/量,则试剂为碘铂酸盐试剂,并且碘铂酸盐试剂和样品塞段的混合在第二交叉通道的蛇形混合区中进行。在一个实施方案中,所述方法包括在提供于流体流动路径中的腔室中将碘铂酸盐溶液与样品混合。
在一个实施方案中,碘铂酸盐试剂包含比率为5:45:100的5%w/v氯铂酸、10%w/v碘化钾和水。
为了校准系统,可将标准kryptofix2.2.2溶液加入入口3290,并在混合区中与碘铂酸盐试剂混合,随后在检测通道中检测。kryptofix2.2.2标准溶液可以包含溶解在水中的kryptofix2.2.2,其浓度等于标准规定,例如2.2mg/v,其中v是患者体内放射性示踪剂体积的最大推荐可注射体积,或者50ppm。
适当地,在574nm或590nm波长下进行分析。然后可以将碘铂酸盐试剂和样品的混合物的光谱值与针对标准物获得的光谱值进行比较并确定样品中的kryptofix2.2.2的量。
适当地,qcm可以用于确定样品中细菌内毒素的存在和/或量。适当地,驱动溶液在第四入口端口处引入第三交叉通道。形成隔离在第四阀元件和第五阀元件之间的样品塞段并且驱动到第三交叉通道中。将lal(鲎变形细胞裂解物(limulusamebocytelysate))试剂引入试剂端口3300中并与样品混合。随后,可以通过另外的试剂端口(未示出)引入发色底物。在进一步温育(参见下文)后,可以将“终止”试剂(例如25%乙酸)通过另一个入口端口(未示出)加入以淬灭反应。然后可以使用上述光谱装置分析混合物。适当地,在405-410nm之间的波长处取得吸光度读数。适当地,lal试剂和样品或标准物之间的反应在37+/-1℃下进行。因此,在某些实施方案中,芯片和系统包括一个或多个加热元件(未示出),以加热第三交叉通道的至少一部分例如混合区。
用于进行细菌内毒素测试的示例性方案如下:
1.混合lal试剂和样品,例如在第三交叉通道的蛇形部分中,并在37℃下温育10分钟;
2.将发色底物加入到该通道中并在37℃温育6分钟;
3.然后加入“终止”试剂例如稀乙酸以淬灭反应;
4.混合物沿着检测通道流动;
5.在光谱仪上在405-410nm下进行测量。
在样品分析之前,可以通过将标准物引入第三交叉通道并与lal试剂混合来校准芯片和系统。标准物可以具有175iu/v的浓度(其中iu是国际单位,v是根据欧洲药典对于患者化合物例如放射性药物的最大推荐可注射体积)。
应当理解,阀3295、3320、3330定位成允许流体仅从单个交叉通道流到检测区域,从而防止其它交叉通道中的流体流到检测区域。
在一个实施方案中,芯片和系统可以用于确定样品的化学纯度。在其中样品包含放射性药物例如fdg的实施方案中,芯片和系统可以用于确定杂质(例如fdm和cidg)的存在和/或量。这些杂质可以在使用强阴离子交换(sax)固定相柱(其可以是整体式主体或填充颗粒床)分离样品中的组分之后检测。适当地,流动相包含氢氧化钠。
可以经由入口端口3220向第四交叉通道3210提供流动相。形成隔离在第五阀元件和第六阀元件之间的第一微通道中的样品部分的塞段并且迫使以朝向分离元件的方向进入第四交叉通道。
然后可以使用辐射检测器来确定这些杂质的存在和/或量。辐射检测器可以是伽马检测器或正电子检测器。
sax柱可用于分离样品的成分。在其中化合物是fdg的实施方案中,在柱上分离杂质例如fdm、d-甘露糖、d-葡萄糖和cidg。然后使样品流过电化学槽。然后可以进行脉冲电流分析检测。在一个供选的实施方案中,可以使用光谱测定或折射率检测来代替pad检测。
pad使用三步电位波形来结合电流检测,随后是交替的阳极和阴极极化,以清洁和再激活工作电极表面。因此,使用三电位波形。该波形由包含施加到工作电极的三个不同电压的脉冲组成。第一电压用于测量,第二电压用于在测量之后清洁工作电极,第三电压用于再生工作电极。连续重复该波形以实现杂质的检测。恒电位仪例如可从荷兰的palmsens公司获得的palmsens3可用于控制电极和电压并测量检测信号。
第五交叉通道3230可提供有通过第六入口端口3240引入的流动相。如果第六阀和第七阀处于关闭位置,则驱动溶液迫使在阀之间隔离的样品塞段形成并沿着第五交叉通道朝向第二分离元件流动。流动相可以是例如由比率为90:10或95:10的乙腈:水组成的溶液。在某些实施方案中,例如,如果分离元件包含c18-官能化的二氧化硅,则流动相可以是由比率为约40:60至约60:40(例如50:50)的乙腈:水组成的溶液。
第二分离元件例如二氧化硅整料柱或c18-官能化的整料柱可用于分离样品的组分。在其中化合物是fdg的示例性实施方案中,第二分离元件可用于分离样品中的组分例如氟化物-18、fdg和乙酰化的-fdg。然后可以使用辐射检测器来确定样品中这些组分的存在和/或量。
应当理解,第一、第二和第三检测通道中的样品的分析可以同时或顺次进行。
图12和图13示出了根据本发明的某些实施方案的芯片6000。芯片包括可分离部件6010,其包括如本文所述的两个整体式主体6020和6030。芯片还结合了电化学槽6040,其在所示实施方案中是丝网印刷的电极。电极可以滑入芯片中的凹槽中。
芯片还包括拉曼腔室6060。提供针阀膜6050以控制样品到拉曼腔室的流动。芯片包括如本文所述的多个入口和出口。此外,芯片提供有多个检测通道。纤维,例如纤维6070和6080,位于邻近相应检测通道的端部,以用于溶液例如提供在检测通道中的样品部分的光谱分析。
在某些实施方案中,qcm和/或rim和/或rpm可包括一个或多个阀组件。图14和图15示出了用于引导和控制在本文所述的模块内和模块之间的流体流动的阀元件的实施方案。因此,图14示出了根据本发明的某些实施方案的用于微流体芯片的阀组件400,其包括具有花键联接的上端部区域404的阀轴402和连接到下端部区域408的阀头406。阀头406具有基本平坦的上表面410和基本平坦的下表面412。阀轴402的下端部区域408位于从阀头406的上表面410向下延伸到阀头406中的中心孔中。阀头的上表面410与阀轴402的环形肩部414的下表面邻接。阀头406可通过粘合剂、机械紧固件、摩擦配合或相应的螺纹等连接到阀轴402。
在阀头406的下表面412中布置了通道形式的贯通型导管416。或者,贯通型导管416可以不布置在阀头406的下表面412中,而是可以为布置在阀头406的上表面410和下表面412之间的贯通型孔。
阀组件400包括具有环形壁部分420和上部分422的帽状阀壳体418。上部分422具有位于中心的孔424,用于可滑动地接收阀轴402,使得阀壳体418可以滑向上端部区域404并沿着阀轴402的一部分滑动。中心孔424基本上是圆形的,并且阀轴402基本上是圆柱形的,使得当位于微流体芯片中时,其可围绕阀轴426旋转,同时能够沿着阀轴426的方向相对于阀壳体418平移。
阀壳体418的环形壁部分420包括螺纹428,螺纹428对应于微流体芯片的上层中的螺纹(如下所述)。环形壁部分420还包括多个平坦表面,用于与驱动阀壳体418的工具接合并将其固定在微流体芯片的上层中。压缩弹簧430的一端置于阀轴402的环形肩部414的上表面上,并且压缩弹簧430的另一端邻接阀壳体418的上部422的内表面。压缩弹簧430使阀头406偏置离开阀壳体418。适当地,弹簧可以直接置于由硅氧烷形成的肩部上,或者其可以使用其间的垫圈间接地置于肩部。或者,主轴可包括肩部。
为了在根据本发明的某些实施方案的微流体芯片500中安装阀组件400(例如旋塞型阀组件),例如如图32所示,阀头406定位于穿过在微流体芯片500的上层502中的相应形状和尺寸的孔520,以与设置在微流体芯片500的中间层504中的凹陷的阀座表面522接合。压缩弹簧430放置在阀轴402的上端部区域404上方以置于其环形肩部414上。阀壳体418然后放置在阀轴402的上端部区域404上方,并且其螺纹428与围绕微流体芯片500的上层502中的孔520的相应螺纹(未示出)接合。诸如六角扳手的合适工具用于驱动并且将阀壳体418牢固地附接到微流体芯片500的上层502。进而,压缩弹簧430被压缩在环形肩部414和阀壳体418之间,使得弹簧430使阀头406偏置靠在阀座表面522。在某些实施方案中,阀可以单独地完全组装,并且稍后插入微流体装置组装层中。
在使用中,合适的致动器诸如步进电机(未示出)联接到阀轴402的上花键联接的端部区域404,以选择性地使阀头406、特别是贯通型导管416相对于设置在微流体芯片500的中间层504中的一个或多个流体流动通道524在打开位置和关闭位置之间旋转。这提供了流体样品的至少一部分从微流体芯片500的输入区域朝向微流体芯片500的检测区域的选择性传送。
阀轴402的花键联接的上端部区域404还允许阀轴402相对于选择性地旋转阀轴402的致动器以沿着阀轴426的方向平移。选择压缩弹簧430使得其弹簧力对应于在流体流动通道524相对于阀组件400的至少上游部分中的流体的最大阈值压力。当流体压力超过最大阈值压力,并且因此作用在阀头406上的流体力超过压缩弹簧430的弹簧力时,阀头406和阀轴402被向上推动以将阀置于打开构型,并允许上游流体流过阀并朝向出口通道,用于安全释放过大的压力且对微流体芯片500的损害(如果不防止的话)最小化。适当地,阀组件400可以包括调节器(未示出),以允许调节压缩弹簧430的长度,并且因此继而允许根据预定的最大阈值流体压力按需要设定弹簧力。
阀头406由基本上弹性的材料制成,例如生物医用级弹性体。适当地,生物医用级弹性体可以是硅橡胶,例如医用级硅氧烷。这种材料改善了阀头406和阀座表面522之间的密封接合,并且适合与用于医疗应用的流体一起使用。此外,其易于模制,使得其适合于制造各种形状,并且由于是医用级的,所以由于从材料中浸出的杂质而引起的药剂污染应该非常少。阀轴402和阀壳体418由金属材料制成,例如黄铜或铝等,或者可以由相对硬的聚合物材料(例如尼龙或ptfe等)制成。
在某些实施方案中,阀头的下表面中的通道使得能够收集一定量的样品。然后阀的旋转可以使阀从微通道例如样品输入通道断开,并且连接到另一个通道,例如与流动相入口连接的通道。因此,样品塞段将从其后面具有流动相液体的阀的头部注射出来。换句话说,阀中通道的尺寸将确定包含在阀中的样品体积,阀可以填充有样品,然后通过转动阀来隔离,从而允许已知体积引导到新的通道中。
在某些实施方案中,微流体芯片不包括如本文所述的检测通道。例如,在其中芯片用于进行非光谱技术的实施方案中,芯片不需要包括检测通道。因此,在本发明的某些实施方案中,微流体芯片可包括例如本文所述的多个阀元件,其可用于隔离流体部分,例如,样品或包括样品的混合物,其中流体的隔离部分引导到微流体芯片上的区域,其中进行非光谱分析技术。非光谱分析技术的一个实例包括使用本文所述的电化学检测槽。非光谱分析技术的另一个实例是使用本文所述的辐射检测器和分离元件的辐射检测。
本发明的某些实施方案的系统还可以包括计算机硬件和软件。计算机硬件和软件可以用于确定在微流体芯片上测量的所述一个或多个特性或参数。此外,计算机系统可以记录在微流体芯片上进行的测试的结果。这样的结果可以记录为例如简单的“成功/失败”。或者,结果可以记录为总数值型的分数,如果其落入或超过某一值,则可以认为其为“失败”,因此不适合给予患者。
在某些实施方案中,系统还可以包括一个或多个元件以校准和控制系统的部件。
适当地,模块化部件中的每个流体连通,例如通过一个或多个导管或通过提供在微流体装置中的一个或多个微通道。模块可以单独部件的形式提供,该单独部件可以在使用之前固定到微流体芯片。该系统可以是完全自动化的系统。
系统
图2示出了用于制备放射性示踪剂的微流体系统240。在所示的实施方案中,设置该系统用于[18f]-fdg的合成,但是应当理解,该系统可以用于制备任何期望的放射性药物。该系统消除了用于溶剂交换的蒸发步骤,并且能够在集成系统中按需配剂生产放射性示踪剂。
系统240包括用于通过电捕获和释放进行18f的溶剂交换的微流体槽210。向微流体槽210供应来自一组四个注射器的流体,第一注射器242包含18f源,第二注射器244包含用于洗涤的乙腈,第三注射器246包含基于有机物的溶剂,第四注射器248包含水。管线250将注射器242、244、246、248连接到微流体槽210的入口226a。流体进入槽210的流动由第一阀252控制,第一阀252位于在通向第一注射器242的第一分支254与通向第二注射器244、第三注射器246和第四注射器248的第二分支256之间的管线250分叉处。
系统还包括微流体反应器258和含有甘露糖三氟甲磺酸酯的第五注射器260。流动路径262将第五注射器260连接到微流体反应器258。管线264将来自微流体槽210的出口226b的流体进料到流动路径262中。第二阀266定位在管线264与流动路径262的接合点,并且控制流体进入微流体反应器258的流动。
系统还包括c18脱保护柱268(整料)、含有用于洗脱的水的第六注射器270和含有用于水解的氢氧化钠的第七注射器272。流动路径274将流体从第六注射器270和第七注射器272供应到脱保护柱268。管线276将流体从微流体反应器258进料到流动路径274。第三阀278位于管线276与流动路径274的接合点,并且因此控制流体进入脱保护柱268的流动。
通过电捕获和释放将18f从水溶液中回收到基于有机物的溶液中使用如上所述的微流体槽210进行。含有释放的18f离子的基于有机物的溶液经由出口226b离开微流体槽210,并且经由管线264转移到微流体反应器258。甘露糖三氟甲磺酸酯经流动路径262从第五注射器260供应到微流体反应器258。在微流体反应器258中,甘露糖三氟甲磺酸酯与18f离子发生亲核取代反应,产生乙酰化的[18f]-fdg。然后将乙酰化的[18f]-fdg经由管线276和流动路径274转移到脱保护柱268,在此其在氢氧化钠溶液存在下经历水解以产生[18f]-fdg。
图3示出了用于生产微流体量的放射性药物的集成系统300。系统包括rim310,rim310包括如本文所述的电极捕获槽。rim可以与一个或多个用于引入包含放射性同位素的水溶液和一种或多种试剂和/或溶剂的入口320、330、340、350流体连通。所述一种或多种试剂包括例如在乙腈中的甘露糖三氟甲磺酸酯、在乙腈和水中的kryptofix2.2.2和碳酸钾、以及乙腈。
rim通过微通道360连接到rpm,在所示实施方案中rpm包括蛇形混合通道370。rpm通过另外的微通道380连接到pm390。pm可以包括如本文所述包含在模块中的多个整体式主体。pm可以与一个或多个入口流体连通以提供溶剂或其它流动相。入口孔可以用于引入例如水和氢氧化钠。
pm连接到包括一个或多个检测区域的qcm315。本文提供了示例性qcm的进一步细节。
在本申请文件的整个说明书和权利要求书中,词语“包括”和“包含”及其变体意味着“包括但不限于”,并且它们不旨在(并且不)排除其他部分、添加剂、组分、整数或步骤。在本申请文件的整个说明书和权利要求书中,除非上下文另有要求,否则单数包括复数。具体地,在使用不定冠词时,除非上下文另有要求,否则申请文件应被理解为考虑复数以及单数。
结合本发明的特定方面、实施方案或实施例描述的特征、整数、特性或基团应理解为可应用于本文所描述的任何其它方面、实施方案或实施例,除非与其不相容。在本申请文件(包括任何所附权利要求、摘要和附图)中公开的所有特征和/或所公开的任何方法或过程的所有步骤可以以任何组合进行组合,除非该组合中的至少一些特征和/或步骤相互排斥。本发明不限于任何前述实施方案的任何细节。本发明延伸到本申请文件(包括任何所附权利要求、摘要和附图)中公开的任何一个具有新颖性的特征或具有新颖性的特征组合,或延伸到所公开的任何方法或过程的任何一个具有新颖性的步骤或具有新颖性的步骤组合。
请读者注意的是,与本申请相关的与本申请文件同时提交或先于本申请文件提交并且与本申请文件一起对公众公开的所有论文和文献和所有这样的论文和文献的内容通过引用结合到本文中。
- 还没有人留言评论。精彩留言会获得点赞!