制备嵌合抗原受体表达细胞的方法与流程
本申请要求2014年12月29日提交的美国序列号62/097,375和2015年3月13日提交的美国序列号62/133,137的优先权,其全部内容通过引用并入本文。
序列表
本申请包含已经以ascii格式电子提交的序列表,并通过引用整体并入本文。所述ascii拷贝创建于2015年12月18日,名称为n2067-7067wo_sl.txt,大小为246,147字节。
本发明一般涉及制备工程化以表达嵌合抗原受体(car)的免疫效应细胞(例如,t细胞,nk细胞)的方法和包含所述免疫效应细胞的组合物。
背景技术:
采用自体t细胞,特别是用嵌合抗原受体(car)转导的t细胞的继承性细胞转移(act)疗法已经在一些血液癌症试验中显示出希望。
发明概述
本公开涉及制备可被工程化以表达car的免疫效应细胞(例如,t细胞,nk细胞)的方法和包含所述免疫效应细胞的组合物。
因此,在一个方面,本公开的特征在于制备可以被工程化以表达car的免疫效应细胞(例如,t细胞,nk细胞)群体的方法,所述方法包括提供免疫效应细胞(例如,t细胞)群体,从群体中除去t调节细胞,例如cd25+t细胞,从而提供适合于表达car的t调节性消耗细胞,例如cd25+消耗的细胞的群体。
在一个实施方案中,t调节性消耗细胞的群体含有少于30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞。
在一个实施方案中,免疫效应细胞群体是具有癌症的受试者的细胞,例如具有表达cd25的癌症例如慢性淋巴细胞白血病(cll)的受试者的细胞。在一个实施方案中,t调节性消耗细胞的群体含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的肿瘤细胞。
在一个实施方案中,免疫效应细胞群体对于将被给予细胞用于治疗的受试者是自体的。在一个实施方案中,免疫效应细胞群体与将被给予细胞用于治疗的受试者是同种异体的。
在一个实施方案中,使用抗-cd25抗体或其片段或cd25结合配体例如il-2,从群体中除去t调节细胞,例如cd25+t细胞。在一个实施方案中,抗cd25抗体或其片段或cd25结合配体与基质(例如珠粒)缀合,或以其它方式包被在基质(例如珠粒)上。在一个实施方案中,抗cd25抗体或其片段与本文所述的基质缀合。在一个实施方案中,使用抗cd25抗体分子或其片段从群体中除去t调节细胞,例如cd25+t细胞。
在一个实施方案中,使用来自miltenyitm的cd25消耗试剂从群体中除去t调节细胞,例如cd25+t细胞。在一个实施方案中,细胞与cd25消耗试剂的比例为1e7个细胞对20ul,或1e7个细胞对15μl,或1e7个细胞对10ul,或1e7个细胞对5ul,或1e7个细胞对2.5ul,或1e7个细胞对1.25ul。
在一个实施方案中,t调节性消耗细胞,例如cd25+消耗的细胞的群体适合于表达本文所述的car,例如本文所述的cd19car。在一个实施方案中,免疫效应细胞群体获自具有血液癌症的受试者,所述癌症为例如白血病,例如慢性淋巴细胞白血病(cll),急性淋巴细胞白血病(all)或淋巴瘤,例如外套细胞淋巴瘤(mcl)或霍奇金淋巴瘤(hl)。在一个实施方案中,t调节性消耗细胞的群体含有少于30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的白血病细胞,例如,cll细胞,all细胞或淋巴瘤细胞,例如mcl细胞或hl细胞。在一个实施方案中,从具有cll的受试者获得免疫效应细胞群体,并且t调节性消耗细胞群体,例如cd25+消耗细胞的群体含有少于30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的白血病细胞,例如cll细胞,并且适合于本文所述的cd19car的表达。在一个实施方案中,t调节性消耗细胞的群体含有少于15%,10%,5%,4%,3%,2%,1%的cd25+细胞,和少于15%,10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。在一个实施方案中,t调节性消耗细胞的群体含有少于10%,5%,4%,3%,2%,1%的cd25+细胞,和少于10%,5%,4%,3%2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。
在一个实施方案中,免疫效应细胞群体是从外周血淋巴细胞分离的t细胞。在一个实施方案中,通过裂解红细胞和/或通过消耗单核细胞获得t细胞群体。在一个实施方案中,使用例如本文所述的方法从外周淋巴细胞分离t细胞群体。
在一个实施方案中,免疫效应细胞群体可以从受试者的血液样品中获得,例如通过单采血液成分术获得。在一个实施方案中,通过单采血液成分术收集的细胞被洗涤以除去血浆部分,并且任选地,将细胞提供在适当的缓冲液或培养基中用于随后的加工步骤。在一个实施方案中,用缓冲液例如磷酸缓冲盐水(pbs)洗涤细胞。在一个实施方案中,细胞在缺乏一种或多种二价阳离子例如钙和镁,例如缺少钙和镁两者的洗涤溶液中洗涤。在一个实施方案中,将细胞在基本上不含二价阳离子的缓冲液中洗涤。
在一个实施方案中,所述方法还包括从表达肿瘤抗原(例如,不包含cd25,例如cd19,cd30,cd38,cd123,cd20,cd14或cd11b的肿瘤抗原)的群体移除细胞,从而提供t调节消耗的,例如cd25+消耗的的群体,以及适合于表达car,例如本文所述的car的肿瘤抗原消耗的细胞。在一个实施方案中,肿瘤抗原表达细胞与t调节的,例如cd25+细胞被同时除去。例如,抗cd25抗体或其片段和抗肿瘤抗原抗体或其片段可以连接到相同的基质,例如可用于除去细胞的珠粒或抗cd25抗体或其片段或抗肿瘤抗原抗体或其片段可以连接到分离的珠粒上,其混合物可用于除去细胞。在其它实施方案中,t调节细胞例如cd25+细胞的去除以及肿瘤抗原表达细胞的去除是顺序的,并且可以以任一顺序发生。
在一个实施方案中,所述方法还包括从表达检查点抑制剂,例如本文所述的检查点抑制剂的群体中移除细胞,例如pd1+细胞,lag3+细胞和tim3+细胞中的一种或多种(例如,2或3种),从而提供t调节消耗的,例如cd25+消耗的细胞和检查点抑制剂消耗的细胞,例如pd1+,lag3+和/或tim3+消耗的细胞的群体。在实施方案中,去除pd1+细胞和lag3+细胞;去除pd1+细胞和tim3+细胞;或去除lag3+和tim3+细胞。在一个实施方案中,与t调节性例如cd25+细胞同时除去检查点抑制剂表达细胞。例如,可以将抗cd25抗体或其片段和抗检查点抑制剂抗体或其片段连接到可用于除去细胞的相同珠粒上,或抗cd25抗体,或其片段,和抗检查点抑制剂抗体或其片段可以连接到分离的珠粒上,其混合物可用于除去细胞。在其它实施方案中,t调节细胞(例如cd25+细胞)的去除以及检查点抑制剂表达细胞的去除是顺序的,并且可以以任一顺序发生。
在一个实施方案中,要除去的细胞群既不是调节性t细胞或肿瘤细胞,而是另外的负面影响cart细胞的扩增和/或功能的细胞,例如,表达cd14,cd11b,cd33,cd15或潜在免疫抑制细胞表达的其他标志物的细胞。在一个实施方案中,可以设想这样的细胞与调节性t细胞和/或肿瘤细胞同时除去,或者在所述消耗后除去,或以另一顺序除去。
在一个实施方案中,所述方法还包括从表达cd14的群体中移除细胞,从而提供t调节性消耗的,例如cd25+消耗的细胞和cd14+消耗的细胞的群体。在一个实施方案中,cd14+细胞与t调节性例如cd25+细胞同时除去。例如,可以将抗cd25抗体或其片段和抗cd14抗体或其片段连接到可用于除去细胞的相同珠粒上;或抗cd25抗体或其片段,和抗-cd14抗体或其片段可以连接到分离的珠粒上,所述珠粒的混合物可用于除去细胞。在其他实施方案中,t调节细胞例如cd25+细胞的去除以及cd14+细胞的去除是顺序的,并且可以以任一顺序发生。在一个实施方案中,使用cd14抗体分子或其片段除去cd14+细胞。
在一个实施方案中,提供的免疫效应细胞群体已经基于一种或多种标志物(例如2,3,4,5,6,7或更多种标志物),例如,cd3,cd28,cd4,cd8,cd27,cd127,cd45ra,和cd45ro的表达来选择,例如所提供的免疫效应细胞群体(例如,t细胞)是cd3+和/或cd28+。
在一个实施方案中,该方法还包括获得富集一种或多种标志物(例如2,3,4,5,6,7或更多种标志物),例如cd3,cd28,cd4,cd8,cd27,cd127,cd45ra,和cd45ro的表达的免疫效应细胞(例如t细胞)群体。在一个实施方案中,免疫效应细胞群体富集cd3+和/或cd28+细胞。例如,获得通过与抗cd3/抗-cd28缀合的珠粒温育分离的t细胞。在一个实施方案中,所述方法还包括从t调节性消耗细胞例如cd25+消耗的细胞群体中选择细胞,所述细胞表达一种或多种标志物(例如2,3,4,5或更多标志物)例如,cd3,cd28,cd4,cd8,cd45ra,和cd45ro。
在一个实施方案中,该方法还包括例如通过本文所述的方法活化t调节性消耗细胞,例如cd25+消耗的细胞群体。
在一个实施方案中,所述方法还包括用包含编码car(例如本文所述的car,例如,本文描述的cd19car)的核酸的载体转导来自t调节性消耗细胞群体,例如cd25+消耗的细胞群体的细胞。在一个实施方案中,载体选自dna,rna,质粒,慢病毒载体,腺病毒载体或逆转录病毒载体。在一个实施方案中,来自t调节性消耗细胞群体(例如cd25+消耗细胞的群体)的细胞用载体转导一次,例如在从受试者的血液样品中获得免疫效应细胞的群体(例如通过单采血液成分术获得)后一天内。
在一个实施方案中,所述方法进一步包括从t调节性消耗细胞群体(例如cd25+消耗的细胞群体)产生瞬时表达外源性rna的rna工程化细胞群体。该方法包括将体外转录的rna或合成rna引入来自所述群体的细胞中,其中所述rna包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸。
在一个实施方案中,例如通过本文所述的方法扩增用编码car(例如本文所述的car,例如本文所述的cd19car)的核酸转导的细胞。在一个实施方案中,细胞在培养中扩增数小时(例如约2,3,4,5,6,7,8,9,10,15,18,21小时)至约14天(例如1,2,3,4,5,6,7,8,9,10,11,12,13或14天)。在一个实施方案中,将细胞扩增3至9天。在一个实施方案中,将细胞扩增4至9天。在一个实施方案中,将细胞扩增8天或更少的时间,例如7,6,5,4或3天。在一个实施方案中,细胞,例如本文所述的cd19car细胞在培养物中扩增3或4天,并且所得细胞比在相同培养条件下在培养物中扩增9天的相同细胞更有效。在一个实施方案中,将细胞,例如本文所述的cd19car细胞在培养物中扩增5天,并且所得细胞比在相同培养条件下在培养物中扩增9天的相同细胞更有效。效力可以例如通过各种t细胞功能,例如,增殖,靶细胞杀伤,细胞因子产生,活化,迁移或其组合来定义。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增了3或4天的细胞,例如本文所述的cd19car细胞,在抗原刺激时显示细胞倍增至少增加1倍,2倍,3倍或4倍。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增了5天的细胞,例如本文所述的cd19car细胞,在抗原刺激时显示细胞倍增至少增加1倍,2倍,3倍或4倍。在一个实施方案中,细胞,例如表达本文所述的cd19car的细胞在培养物中扩增3或4天,并且与在相同培养条件下培养9天的相同细胞相比,所得细胞表现出更高的促炎细胞因子产生,例如ifn-γ和/或gm-csf水平。在一个实施方案中,将细胞,例如表达本文所述的cd19car的细胞在培养物中扩增5天,并且与在相同培养条件下培养9天的相同细胞相比,所得细胞表现出更高的促炎细胞因子产生,例如ifn-γ和/或gm-csf水平。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增了3或4天的细胞,例如本文所述的cd19car细胞显示促炎细胞因子产生(以pg/ml计),例如,ifn-γ和/或gm-csf水平的至少一倍,二倍,三倍,四倍,五倍,十倍或更多倍增加。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增了5天的细胞,例如本文所述的cd19car细胞显示促炎细胞因子产生(以pg/ml计),例如,ifn-γ和/或gm-csf水平的至少一倍,二倍,三倍,四倍,五倍,十倍或更多倍增加。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增3,4或5天的细胞,例如本文所述的cd19car细胞,显示至少同样高的细胞因子产生(以pg/ml计),或至少一倍,两倍,三倍,四倍,五倍,十倍或更多倍细胞因子产生的增加(以pg/ml计),例如il2,ifn-γ,gm-csf,tnf-α,il-1b,il4,il5,il6,il8或il10水平。
在一个实施方案中,通过机械破坏从细胞中除去珠粒(例如cd3/28-刺激珠粒)。在一个实施方案中,机械破坏包括细胞穿过(例如重复穿过)移液管尖端(例如,窄孔移液管尖端)。在一些实施方案中,细胞穿过一个或多个(例如,2,3,4或5个或更多个)管,例如窄孔管。在一个实施方案中,管是闭合的培养系统的一部分。在一些实施方案中,移液管尖端或管的内径小于约1mm,0.9mm,0.8mm,0.7mm,0.5mm,0.4mm,0.3mm,或0.2mm,并且任选地,该直径大于0.1mm,0.2mm,0.3mm或0.4mm。
在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增3,4或5天的细胞,例如本文所述的car细胞,例如本文所述的cd19car细胞,具有增加比例的tem细胞,tcm细胞或tem和tcm细胞两者。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增3,4或5天的细胞,例如本文所述的car细胞,例如本文所述的cd19car细胞,具有增加比例的tem细胞,teff细胞或tem和teff细胞两者。在一个实施方案中,扩增3,4或5天的本文所述的细胞,例如本文所述的cd19car细胞的群体,具有至少约20%,25%,30%,35%,40%,45%或50%,以及任选高达约40%或50%的tnaive样细胞(tnaive样,teff和tcm细胞中)的百分比。在一个实施方案中,扩增3,4或5天的本文所述的细胞,例如本文所述的cd19car细胞的群体,具有至少约10%,15%,或20%,以及任选高达约15%或20%的tem细胞(tnaive样,teff和tcm细胞中)的百分比。在一个实施方案中,扩增3,4或5天的本文所述的细胞,例如本文所述的cd19car细胞的群体,具有至少约20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,或70%,以及任选高达约50%或70%的(tnaive样+tem)细胞(tnaive样,teff和tcm细胞中)的百分比。
在一个实施方案中,当在图31a的nalm6测定中以0.5x106个细胞的剂量施用时,扩增3,4或5天的细胞,例如本文所述的cd19car细胞具有大于或等于1x106,1.5x106,2x106,2.5x106,3x106,4x106,或5x106的剂量的在相同培养条件下培养9天的相同细胞的活性。在一些实施方案中,在1,2,3,4,5或6周测量活性。
在一个实施方案中,通过在刺激cd3/tcr复合体相关信号和刺激例如如本文所述细胞表面上的共刺激分子的配体的试剂存在下培养细胞来扩增细胞。在一个实施方案中,试剂是与抗cd3抗体或其片段和/或抗-cd28抗体或其片段缀合的珠粒。
在一个实施方案中,细胞在适当的培养基(例如,本文所述的培养基)中扩增,所述培养基可以任选地含有一种或多种(例如2,3,4或5种或更多种)增殖和/或活力因子,包括血清(如胎牛或人血清),白介素-2(il-2),胰岛素,ifn-γ,il-4,il-7,gm-csf,il-10,il-12,il-15,il-21,tgfβ和tnf-α或用于细胞生长的任何其它添加剂。
在一个实施方案中,细胞在包括一种或多种(例如,2,3,4或5或更多种)白介素的合适培养基(例如,本文所述的培养基)中扩增,其导致在14天的扩增期内细胞的至少200倍(例如,200倍,250倍,300倍,350倍)的增加,例如,如通过本文所述的方法,如流式细胞术测量。在一个实施方案中,细胞在il-15和/或il-7(例如il-15和il-7)的存在下扩增。
在一个实施方案中,细胞在适当的扩增期后冷冻保存。在一个实施方案中,根据本文所述的方法将细胞冷冻保存。在一个实施方案中,将扩增的细胞在合适的培养基(例如不溶性培养基)中冷冻保存,例如如本文所述。
在一个实施方案中,该方法还包括使免疫效应细胞群体与编码端粒酶亚基(例如htert)的核酸接触。在一个实施方案中,核酸是dna或rna。
另一方面,本公开的特征在于包含含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞的t调节性消耗细胞群体的反应混合物。在一个实施方案中,反应混合物包含含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的表达cd25的肿瘤细胞,例如cll细胞的t调节性消耗细胞群体。在一个实施方案中,细胞群体含有少于15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于15%,10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。在一个实施方案中,细胞群体含有少于10%,5%,4%,3%,2%,1%的cd25+细胞和少于10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。
在一个实施方案中,反应混合物包含含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的表达检查点抑制剂的细胞,例如pd1+细胞,lag3+细胞或tim3+细胞的t调节性消耗细胞群体。反应混合物还可以包含缓冲液或其它试剂,例如含pbs的溶液。
在一个实施方案中,反应混合物包含含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd14+细胞的t调节性消耗细胞群体。反应混合物还可以包含缓冲液或其它试剂,例如含pbs的溶液。
在一个实施方案中,反应混合物可进一步包含活化和/或扩增群体细胞的试剂,例如刺激cd3/tcr复合体相关信号的试剂和/或刺激例如,如本文所述的细胞表面上共刺激分子的配体。在一个实施方案中,试剂是与抗cd3抗体或其片段和/或抗-cd28抗体或其片段缀合的珠粒。
在一个实施方案中,反应混合物还包含一种或多种(例如2,3,4或5)用于增殖和/或存活的因子,包括血清(例如胎牛或人血清),白介素-2(il-2),胰岛素,ifn-γ,il-4,il-7,gm-csf,il-10,il-12,il-15,il-21,tgfβ,和tnf-α或用于细胞生长的任何其它添加剂。在一个实施方案中,反应混合物还包含il-15和/或il-7。
在一个实施方案中,反应混合物中群体的多个细胞包含核酸分子,例如本文所述的核酸分子,其包含car编码序列,例如cd19car编码序列,例如如本文所述。
在一个实施方案中,反应混合物中群体的多个细胞包含载体,其包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸序列。在一个实施方案中,载体是本文所述的载体,例如选自dna,rna,质粒,慢病毒载体,腺病毒载体或逆转录病毒载体的载体。
在一个实施方案中,反应混合物还包含冷冻保护剂或稳定剂,例如糖,寡糖,多糖和多元醇(例如海藻糖,甘露醇,山梨糖醇,乳糖,蔗糖,葡萄糖和葡聚糖),盐和冠醚。在一个实施方案中,冷冻保护剂是葡聚糖。
在另一方面,本公开的特征在于制备被工程化以表达car的免疫效应细胞(例如,t细胞,nk细胞)群体的方法,所述方法包括提供免疫效应细胞群体(例如,t细胞),其中多个免疫效应细胞包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸,并且在一种或多种(例如2,3,4或5)白介素的存在下扩增群体的细胞,其在14天的扩增期内导致细胞至少200倍(例如,200倍,250倍,300倍,350倍)的增加,例如,如通过本文所述的方法如流式细胞术测定。在一个实施方案中,在il-15和/或il-7例如il-15和il-7的存在下扩增群体的细胞。
在一个实施方案中,细胞在培养物中扩增数小时(例如约2,3,4,5,6,7,8,9,10,15,18,21小时)至约14天(例如1,2,3,4,5,6,7,8,9,10,11,12,13或14天)。在一个实施方案中,将细胞扩增4至9天。在一个实施方案中,将细胞扩增少于8天,例如7,6或5天的时间。在一个实施方案中,将细胞在培养物中扩增5天,并且所得细胞比在相同培养条件下在培养物中扩增9天的相同细胞更有效。效力可以例如通过各种t细胞功能,例如,增殖,靶细胞杀伤,细胞因子产生,活化,迁移或其组合来定义。在一个实施方案中,与在相同的培养条件下在培养物中扩增9天的相同细胞相比,扩增了5天的细胞,例如本文所述的cd19car细胞显示抗原刺激时细胞倍增增加至少一倍,两倍,三倍或四倍。在一个实施方案中,将细胞,例如表达本文所述的cd19car的细胞在培养物中扩增5天,并且与在相同培养条件下培养9天的相同细胞相比,所得细胞表现出更高的促炎细胞因子产生,例如ifn-γ和/或gm-csf水平。在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增了5天的细胞,例如本文所述的cd19car细胞显示促炎细胞因子产生(以pg/ml计),例如ifn-γ和/或gm-csf水平增加至少一倍,二倍,三倍,四倍,五倍,十倍或更多倍。
在一个实施方案中,通过在刺激cd3/tcr复合体相关信号的试剂和刺激例如如本文所述细胞表面上的共刺激分子的配体的存在下培养细胞来扩增细胞。在一个实施方案中,试剂是与抗cd3抗体或其片段和/或抗-cd28抗体或其片段缀合的珠粒。
在一个实施方案中,所提供的免疫效应细胞群体是含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞的t调节性消耗细胞群体。在一个实施方案中,所提供的免疫效应细胞群体是含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的表达cd25的肿瘤细胞,例如cll细胞的t调节性消耗细胞群体。在一个实施方案中,所提供的细胞群体含有少于15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于15%,10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。在一个实施方案中,所提供的细胞群体含有少于10%,5%,4%,3%,2%,1%的cd25+细胞和少于10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。
在一个实施方案中,所提供的免疫效应细胞群体是含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的表达检查点抑制剂的细胞,例如pd1+细胞,lag3+细胞或tim3+细胞的t调节性消耗细胞群体。
在一个实施方案中,所提供的免疫效应细胞群体是含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%cd14+细胞的t调节性消耗细胞群体。
在一个实施方案中,该方法还包括在扩增之前从群体中除去t调节细胞,例如cd25+t细胞,从而提供待扩增的的t调节性消耗细胞群体,例如cd25+消耗细胞。在一个实施方案中,通过本文所述的方法除去t调节细胞,例如cd25+细胞。
在一个实施方案中,该方法还包括在扩增之前从群体中除去t调节细胞,例如cd14+细胞,从而提供待扩增的cd14+消耗细胞的群体。在一个实施方案中,通过本文所述的方法除去t调节细胞,例如cd14+细胞。
在一个实施方案中,该方法还包括使免疫效应细胞群体与编码端粒酶亚基(例如htert)的核酸接触。在一个实施方案中,核酸是dna或rna。
在另一方面,本公开的特征在于包含免疫效应细胞群体的反应混合物,其中反应混合物中群体的多个细胞包含核酸分子,例如本文所述的核酸分子,其包含car编码序列,例如cd19car编码序列,例如本文所述,以及il-7和/或il-15。
在一个实施方案中,反应混合物中群体的多个细胞包含载体,其包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸序列。在一个实施方案中,载体是本文所述的载体,例如选自dna,rna,质粒,慢病毒载体,腺病毒载体或逆转录病毒载体的载体。
在一个实施方案中,反应混合物可进一步包含活化和/或扩增群体细胞的试剂,例如刺激cd3/tcr复合体相关信号的试剂和/或刺激如本文所述细胞表面上共刺激分子的配体。在一个实施方案中,试剂是与抗cd3抗体或其片段和/或抗-cd28抗体或其片段缀合的珠粒。
在另一方面,本公开的特征在于制备被工程化以表达car的免疫效应细胞(例如,t细胞,nk细胞)群体的方法,所述方法包括提供免疫效应细胞群体(例如,t细胞),其中多个免疫效应细胞包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸,并且在培养物中扩增群体的细胞5天,其中与在相同培养条件下在培养物中扩增9天的相同细胞相比,所得细胞更有效,如通过抗原刺激时的细胞增殖水平测量。
在一个实施方案中,与在相同培养条件下培养9天的相同细胞相比,扩增5天的细胞在抗原刺激时显示出细胞倍增至少一倍,两倍,三倍或四倍的增加。在一个实施方案中,将细胞,例如表达本文所述的cd19car的细胞在培养物中扩增5天,并且如与在相同培养条件下培养9天的相同细胞相比,所得细胞表现出更高的促炎细胞因子产生,例如ifn-γ和/或gm-csf水平。在一个实施方案中,与在相同培养条件下培养扩增9天的相同细胞相比,扩增5天的细胞显示促炎细胞因子产生(以pg/ml计),例如ifn-γ和/或gm-csf水平的至少一倍,二倍,三倍,四倍,五倍,十倍或更多倍增加。
在另一方面,本公开的特征在于方法,其包括向受试者施用通过本文所述的方法制备并经工程化以表达car,例如,本文描述的car,例如本文描述的cd19car的免疫效应细胞群体。
在一个实施方案中,方法在患有癌症,例如血液癌症,例如cll的受试者中提供抗肿瘤免疫。在一个实施方案中,该方法是治疗患有癌症,例如本文所述的血液癌症,例如白血病(例如cll,all)或淋巴瘤(例如mcl,hl)的受试者的方法。在一个实施方案中,细胞群体对于施用该群体的受试者是自体的。在一个实施方案中,细胞群体与施用群体的受试者是同种异体的。在一个实施方案中,受试者是人。
在一个实施方案中,与肿瘤抗原(例如本文所述的肿瘤抗原,例如cd19)相关的疾病选自增生性疾病如癌症或恶性肿瘤或癌前病症如骨髓增生异常,骨髓增生异常综合征或白血病前期,或是与本文所述肿瘤抗原表达相关的非癌症相关的适应证。在一个实施方案中,疾病是本文所述的癌症,例如与本文所述的靶标相关的本文所述的癌症。在一个实施方案中,血液癌症是白血病。在一个实施方案中,癌症选自一种或多种急性白血病,包括但不限于b细胞急性淋巴细胞性白血病(“ball”),t细胞急性淋巴细胞白血病(“tall”),急性淋巴性白血病(all);一种或多种慢性白血病,包括但不限于慢性骨髓性白血病(cml),慢性淋巴细胞性白血病(cll);额外的血液癌症或血液病症,包括但不限于b细胞幼淋巴细胞白血病,胚细胞浆细胞样树突状细胞瘤,伯基特淋巴瘤,弥漫性大b细胞淋巴瘤,滤泡淋巴瘤,毛细胞白血病,小细胞或大细胞滤泡淋巴瘤,恶性淋巴增殖性病症,malt淋巴瘤,套细胞淋巴瘤,边缘区淋巴瘤,多发性骨髓瘤,骨髓发育不良和骨髓增生异常综合征,非霍奇金淋巴瘤,浆母细胞淋巴瘤,浆细胞样树突状细胞瘤,瓦尔登斯特伦巨球蛋白血症,和“白血病前期”,其是通过骨髓细胞的无效生产(或发育不良)联合的血液学状况的多样集合,和与本文所述的肿瘤抗原表达相关的疾病,包括但不限于非典型和/或非经典癌症,恶性肿瘤,癌前病症或表达本文所述的肿瘤抗原的增生性疾病;及其任何组合。在另一个实施方案中,与本文所述的肿瘤抗原相关的疾病是实体瘤,例如本文所述的实体瘤,例如前列腺癌,结肠直肠癌,胰腺癌,宫颈癌,胃癌,卵巢癌,头癌或肺癌。
在一个实施方案中,例如通过本文所述的方法扩增用编码car(例如本文所述的car,例如本文所述的cd19car)的核酸转导的免疫效应细胞群体。在一个实施方案中,将细胞扩增8天或更少的时间,例如7,6,5,4或3天。在一个实施方案中,将细胞,例如本文所述的cd19car细胞在培养物中扩增5天,并且所得细胞比在如本文所述的相同培养条件下在培养物中扩增9天的相同细胞更有效。在一个实施方案中,对受试者施用104至106个免疫效应细胞/kg受试者的体重。在一个实施方案中,受试者接受免疫效应细胞群体的初始施用(例如,每kg受试者的体重初始施用104至106个免疫效应细胞,例如,每kg受试者的体重104至105个免疫效应细胞),许多所述免疫效应细胞包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸和一个或多个(例如2,3,4或5)个后续施用免疫效应细胞群体(例如,一次或多次后续施用104至106个免疫效应细胞/kg受试者的体重,例如,每kg受试者的体重104至105个免疫效应细胞),许多所述免疫效应细胞包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸。在一个实施方案中,一次或多次后续施用在前次施用之后少于15天,例如14,13,12,11,10,9,8,7,6,5,4,3或2天,例如,在前次施用之后少于4,3,2天施用。在一个实施方案中,受试者在至少三次施用免疫效应细胞群体的过程中接受总共约106个免疫效应细胞/kg受试者的体重,例如,受试者接受1x105个免疫效应细胞的初始剂量,第二次施用3x105个免疫效应细胞,以及第三次施用6x105个免疫效应细胞,并且例如每次施用在前次施用后不到4,3,2天施用。
一方面,本公开的特征在于一群自体免疫效应细胞,其多个被包含编码car,例如本文所述的car,例如本文所述的cd19car的核酸分子的载体转染或转导,其中细胞群体含有少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞,和少于50%,40%,30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的肿瘤细胞,例如cll细胞。在一个实施方案中,细胞群体含有少于15%,10%,5%,4%,3%,2%,1%的cd25+细胞和少于15%,10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。在一个实施方案中,细胞群体含有少于10%,5%,4%,3%,2%,1%的cd25+细胞和少于10%,5%,4%,3%,2%,1%的肿瘤细胞,例如表达cd25的肿瘤细胞,例如cll细胞。
在另一方面,本公开的特征在于制备免疫效应细胞(例如,t细胞,nk细胞)群体的方法。在一个实施方案中,所述方法包括:提供免疫效应细胞(例如t细胞或nk细胞)群体,并使免疫效应细胞群体与编码car的核酸和编码端粒酶亚基例如htert的核酸在允许car和端粒酶表达的条件下接触。
在一个实施方案中,编码端粒酶亚基的核酸是rna。在另一个实施方案中,编码端粒酶亚基的核酸是dna。在一个实施方案中,编码端粒酶亚基的核酸包含能够驱动端粒酶亚基表达的启动子。
在相关方面,本公开的特征在于制备免疫效应细胞(例如,t细胞,nk细胞)的群体方法,该方法包括:提供免疫效应细胞(例如,t细胞)群体,使免疫效应细胞群体与编码car的核酸和编码端粒酶亚基(例如htert)的rna在允许car和端粒酶表达的条件下接触。
在一个实施方案中,编码car的核酸和编码端粒酶亚基的rna是相同核酸分子的一部分。在一个实施方案中,编码car的核酸和编码端粒酶亚基的rna是分离的核酸分子的一部分。
在一个实施方案中,该方法包括使免疫效应细胞群体与编码car的核酸和编码端粒酶亚基的rna基本上同时接触。在一个实施方案中,该方法包括在将免疫效应细胞群体与编码端粒酶亚基的rna接触之前,使免疫效应细胞群体与编码car的核酸接触。在一个实施方案中,该方法包括在将免疫效应细胞群体与编码端粒酶亚基的rna接触后,使免疫效应细胞群体与编码car的核酸接触。
在一个实施方案中,编码端粒酶亚基的rna是mrna。在一个实施方案中,编码端粒酶亚基的rna包含多聚(a)尾。在一个实施方案中,编码端粒酶亚基的rna包含5'帽结构。
在一个实施方案中,该方法包括用编码端粒酶亚基的rna转染免疫效应细胞。在一个实施方案中,该方法包括用编码端粒酶亚基的rna转导免疫效应细胞。在一个实施方案中,该方法包括在允许car和端粒酶表达的条件下用编码端粒酶亚基的rna电穿孔免疫效应细胞。
在另一方面,本公开的特征在于制备免疫效应细胞(例如t细胞,nk细胞)群体的方法,其包括:提供表达car和/或包含编码car的核酸的免疫效应细胞(例如,t细胞或nk细胞)群体;并在允许htert表达的条件下使免疫效应细胞群体与编码端粒酶亚基(例如htert)的核酸接触。
在另一方面,本公开的特征在于制备免疫效应细胞(例如,t细胞,nk细胞)群体的方法,其包括:提供表达编码端粒酶亚基,例如htert的核酸的免疫效应细胞(例如,t细胞或nk细胞)群体,并在允许car表达的条件下使免疫效应细胞群体与编码car的核酸接触。
一方面,本公开提供了免疫效应细胞(例如t细胞或nk细胞),其包含:编码car,例如本文所述的car的核酸;和编码外源端粒酶亚基例如htert的核酸。在一个实施方案中,编码外源端粒酶亚基的核酸是rna,例如mrna。
一方面,本公开提供了免疫效应细胞(例如,t细胞或nk细胞),其包含:car,例如本文所述的car;和外源性端粒酶亚基,例如htert。在一个实施方案中,细胞不包含dna,例如外源dna,例如编码外源端粒酶亚基的载体。例如,细胞可能已经与编码外源端粒酶亚基的mrna接触。
尽管与本文所述类似或等同的方法和材料可以用于本发明的实践或测试中,但是合适的方法和材料在下面描述。本文提及的所有出版物,专利申请,专利和其它参考文献(例如,序列数据库参考号)通过引用整体并入。例如,本文中引用的所有genbank,unigene和entrez序列(例如在本文的任何表中)都通过引用并入本文。除非另有说明,本文指定的序列登录号(包括本文中任何表中的序列登录号)是指截至2014年12月29日的当前数据库条目。当一个基因或蛋白质引用多个序列登录号时,包含所有序列变体。
另外,材料,方法和实施例仅是说明性的,而不是限制性的。标题,子标题或编号或字母要素,例如(a),(b),(i)等仅仅是为了便于阅读而呈现。在本文档中使用标题或编号或字母要素不要求按字母顺序执行步骤或要素,或者步骤或要素必须彼此离散。本发明的其它特征,目的和优点将从说明书和附图以及权利要求书中变得显而易见。
附图简述
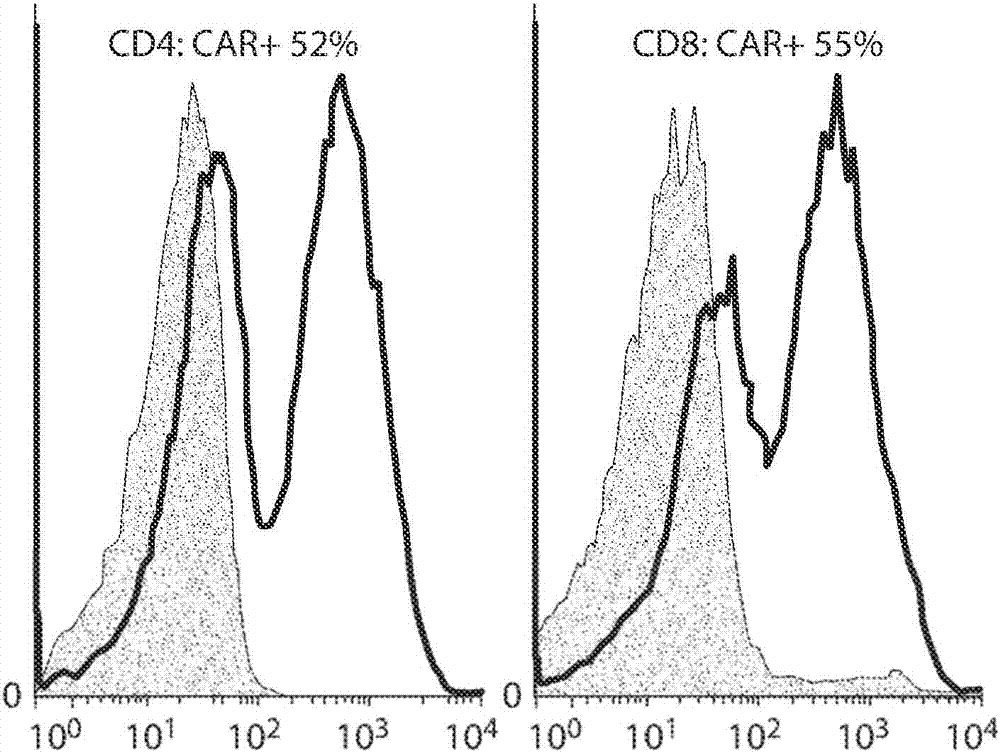
图1a-1h显示了γc细胞因子和il-18对car-t细胞积累的差异作用。图1a是c4-27zcar载体的示意图。图1b是在慢病毒转导后48小时,在cd4+和cd8+t细胞上car表达的两个代表性的facs直方图。图1c是显示car-t细胞响应于各种细胞因子暴露的总体累积的图。将t细胞转导并从第二天(第0天)暴露于终浓度为10ng/ml的各种外源性细胞因子。基于t细胞数和car表达百分数计算car-t细胞数目。曲线是6个供体的代表。**p<0.05,***p<0.001。nc,无细胞因子。图1d是显示慢病毒转导后15天t细胞的car表达的图。条形图描绘了cd3+,cd4+和cd8+t细胞表面上的car表达水平(±sem,n=6),nc组中的car表达量归一化为1。*相对于il-2组p<0.05。n.s.,无统计学差异。图1e是显示响应于各种细胞因子的t细胞增殖的直方图。慢病毒转导后第7天,nc组t细胞用cfse(2.5μm)标记,然后暴露于多种细胞因子。七天后,通过流式细胞术分析t细胞的cfse稀释。图1f是显示慢病毒转导后15天t细胞活力的图。来自各种细胞因子组的t细胞用annexinv和7-aad染色,然后分析活细胞的比例(annexinv和7-aad阴性)。*相对于il-2组p<0.05,**p<0.01(n=6)。图1g和1h显示car-t细胞的bcl-xl表达。在慢病毒转导后第15天,通过流式细胞术评估car-t细胞的bcl-2蛋白表达。图1g是各种细胞因子组中bcl-xl表达的代表性facs直方图。图1h是描述6个供体的cd4+和cd8+car-t细胞中的bcl-xl表达(±sem)的图。*相对于il-2组p<0.01。
图2a-2i显示了car-t细胞的记忆t细胞亚组。图2a是代表性facs图,其显示了t细胞亚组分析的门控策略。基于cd45ra和cd62l表达将t细胞分成四个亚组,然后进一步评估每个亚组的ccr7,cd27,cd28和cd95的表达。cd95表达在慢病毒转导时显著上调。图2b显示转染前t细胞的cd45ra+cd62l+亚群的cd95表达和在转导后15天car-t细胞的cd45ra+cd62l+亚群中的cd95表达。图2c和2d是显示慢病毒转导后cd4+(图2c)和cd8+t细胞(图2d)中记忆干t细胞(tscm)比例增加的图。tscm定义为cd45ra+cd62l+cd95+ccr7+t细胞亚组。图2e是显示转导前t细胞中初始t(tn,定义为cd45ra+cd62l+cd95-亚群)的量与转导(n=6)后car-t细胞中tscm的比例之间的相关性的图。左侧条形表示转导前cd4+和cd8+t细胞中tn的百分比,右侧条形表示cd4+和cd8+car-t细胞中tscm的百分比。*p<0.05,**p<0.01。图2f,2g和2h是显示cd4+和cd8+car-t细胞亚组分布的图。基于cd95,cd45ra和cd62l表达来定义cd4+和cd8+car-t细胞中的t亚组。在各种细胞因子组之间比较tscm的比例,*p<0.05,**p<0.01,相对于il-2组(n=6)。(f)不同亚组的car-t细胞的自我更新和分化。暴露于il-2(10ng/ml)培养facs分选的car+tscm,tcm,tem和temra细胞3天,然后基于cd45ra和cd62l表达(n=3)分析表型。图2i是直方图,显示响应il-2的car-t细胞各种亚组的增殖。用cfse(2.5μm)标记facs分选的car+tscm,tcm,tem和temra细胞,然后暴露于il-2(10ng/ml)培养3天。三天后,分析t细胞的cfse稀释。
图3a-3b:显示cd45ra表达与cfse强度之间的相关性。图3a阐明cd45ra表达与cfse强度成反比。图3b显示,对于所有细胞因子组(il-2,il-7,il-15,il-18和il-21),cd45ra+t细胞显示出比cd45radim和阴性t细胞低得多的cfse水平,表明cd45ra+t细胞具有比cd45ra-t细胞更强的增殖活性。
图4a-4b显示了暴露于不同细胞因子导致的car-t细胞的表型。图4a是代表性facs点图,显示在慢病毒转导后14天暴露于il-2的car-和car+t细胞上的cd45ra,cd62l,ccr7,cd27和cd28的表达。图4b是一系列图,显示了在指定的细胞因子组中car-t细胞表面上cd45ra,cd62l,ccr7,cd27,cd28和il7rα表达的定量。直方图表示来自6个独立供体的表达水平的平均值±sem。相对于il-2组*p<0.05,**p<0.01。
图5a-5i显示暴露于不同细胞因子的car-t细胞的功能分析。图5a是代表性的facs图,显示car-t细胞中细胞内ifn-γ,tnf-α和il-2的染色。图5b,5c和5d是定量图,显示用于产生ifnγ(图5b),tnf-α(图5c)和il-2(图5d)的各种细胞因子组(n=6)中产生细胞因子的car-t细胞百分比。将慢病毒转导的t细胞暴露于指定的细胞因子14天,然后与skov3细胞共培养5小时,然后收获用于流式细胞术分析。图5e是一系列饼图,其描绘了在skov3刺激后产生不同数量的细胞因子(ifn-γ,tnf-α和il-2)的细胞的比例。*p<0.05。图5f是代表性facs图,显示了car-t细胞中穿孔蛋白和粒酶b(granzb)的表达。图5g和5h是定量图,显示各种细胞因子组(n=6)中car-t细胞中穿孔蛋白(图5g)和粒酶b表达(图5h)的百分比。将慢病毒转导的t细胞暴露于指定的细胞因子14天,然后与skov3细胞共培养5小时,然后收获用于流式细胞术分析。图5i是显示car-t细胞的抗原特异性细胞毒活性的图。在指示细胞因子暴露后14天,以指定的e/t比与skov3共同培养18小时后,通过使用基于萤光素酶的测定法,来评估car-t细胞的细胞溶解能力。未转导的t细胞(unt)用作负效应物对照。显示的数据是六次独立细胞溶解测定的平均值±sem。
图6a-6c:显示了上述图5a-5i中car-t细胞的表型和功能。图6a和6b显示当与cd62l-car-t细胞(tem和temra)相比时,cd62l+car-t细胞(tscm和tcm)表现出较少的细胞因子产生活性(图6a和6b)和较弱的细胞溶解能力(图6c)。
图7a-7e显示暴露于抗原攻击的car-t细胞的扩增和表型。图7a是两个图,显示car-t细胞在暴露于抗原和指示的细胞因子中的总累积和存活力。暴露于il-2的t细胞在第15天收获,然后以5:1的e/t比与skov3和指示的细胞因子(10ng/ml)共培养7天,在第一和第四天补充skov3细胞(图7c,7d和7e中的相同方案)。扩增倍数为平均值±sem。t细胞用annexinv和7-aad染色,然后在同一天分析活细胞的比例。*与il-2组相比p<0.05。图7b描绘了两个图,其显示了先前在抗原攻击后暴露于指定细胞因子的car-t的总累积和存活力。暴露于指定细胞因子的t细胞在第15天收获,然后与skov3以5:1的e/t比率共培养7天。计算car-t细胞的扩增,并在第七天评估t细胞的存活力。图7c是显示与skov3和指示的细胞因子共培养7天后,t细胞的car表达图。*相对于il-2p<0.05。图7d是两个图,其显示了与skov3和指示的细胞因子共培养7天后,car-t细胞上cd27和cd28表达的定量。*相对于il-2p<0.05。图7e是两个图,其显示各种细胞因子组中cd4+和cd8+car-t细胞的记忆t亚组的分布。n.s.,无统计学差异。
图8a-8g显示了具有先前细胞因子暴露的各种car-t细胞的抗肿瘤活性。图8a是体内实验方案。图8b是用各种细胞因子暴露的c4-27zcar-t细胞,抗cd19-27zcar-t细胞和未转导的t细胞处理的小鼠的肿瘤生长曲线。数据以平均值±sem表示。箭头表示t细胞输注的时间。图8c是生物发光图像,显示了在第一次静脉注射car-t细胞即刻前(第38天),两周后(第53天)和五周后(第74天),nsg小鼠中的fluc+skov3肿瘤。图8d是显示在第一次剂量的car-t细胞输注后15天小鼠外周血中循环的人cd4+和cd8+t细胞计数的定量图。图8e是显示小鼠血液中循环的人cd4+和cd8+t细胞上car表达的定量图。图8f是显示基于cd45ra和cd62l染色的小鼠血液中循环人t细胞的t细胞亚组分布的图。图8g是显示小鼠血液中循环的人cd4+和cd8+t细胞上cd27和cd28表达的定量图。
图9a和9b显示了fac图。图9a是一系列fac图,其显示了来自cll患者的单采血液成分术的细胞中cd45,cd3和cd25表达的分布。图9b是一系列facs图(顶部),显示cd3和cd19群体和直方图(底部),显示了来自单采血液成分术的细胞、用抗cd3/cd28选择的细胞、cd25消耗的细胞和富含cd25的细胞的cd14表达。
图10是两个facs图,其比较cd3/cd28选择或cd25消耗后cd4+和cd8+t细胞群体的分布。
图11a-11c显示了cd3/cd28选择的细胞和cd25消耗的细胞之间的增殖能力的比较。图11a是显示培养中指定日的总细胞数的图。图11b是显示培养中每个指定日的定量群体倍增的图。图11c显示培养中指定日的活细胞百分比。
图12a和12b显示cd25消耗对car19的慢病毒转导的影响。图12a是显示cd25消耗效率的一系列facs图。图12b是显示未转导的细胞,cd3选择的细胞和cd25消耗的细胞的car19表达的一系列facs图。
图13是一系列facs图,其显示在用cd25消耗或用细胞因子补充剂培养之前来自患者的pbmc的细胞中cd3,cd19和cd25表达的分布。
图14是一系列facs图,显示了用指定的细胞因子补充剂il-7,il-15或il-7和il-15培养后未经操作的pbmc和cd25消耗的pbmc中cd3和cd19的分布。
图15是显示用所指定的细胞因子补充剂培养10天后的细胞总数的图。
图16是图,其显示绿色荧光蛋白(gfp)信号传导的百分比作为在两天——通过单采血液成分术获得细胞当天(第0天)和一天后(第1天)转染的供体细胞(第0+1天);通过单采血液成分术获得细胞当天立即转染的供体细胞(第0天);通过单采血液成分术获得细胞一天后立即转染的供体细胞(第1天);通过单采血液成分术获得细胞两天后立即转染的供体细胞(第2天);和通过单采血液成分术获得细胞三天后立即转染的供体细胞(第3天)的慢病毒转染水平的指标。
图17包括已经用抗cd3和cd28珠刺激,并且保留为未经操作的(utd)或用cd19car转导(cd19.bbz),脱珠,然后在第5天和第9天收获的pbmc的群体倍增(图17a)和平均大小(fl)(图17b)的扩增谱的图。
图18包括将细胞毒性描绘为用pmbcs处理的表达cd19的k562细胞的百分比溶解的图,所述pmbcs已经用抗cd3和cd28珠刺激,并且保留为未经操作的(utd)或用cd19car(cd19.bbz)转导,脱珠,然后在第5天和第9天收获。
图19包括描绘用抗cd3和cd28珠(3×28珠),野生型k562细胞,表达cd19的k562细胞,all细胞(nalm6)或cll细胞(pi14)刺激的pbmc的增殖的图。将pbmc保持未经操作(utd)或用cd19car(cart19)转导,脱珠,然后在第5天和第9天收获。
图20是示例性制造方案的示意图。
图21是示例性制造方案的示意图。
图22包括描绘两个不同制造批次的用ctl019car转染的供体细胞——患者15(左图)和患者21(右图)在0至9天期间扩增的细胞增殖水平的图。
图23包括显示在单采血液成分术后0至9天扩增的两种不同制造批次的用ctl019car转染的供体细胞(即患者15细胞)或用ss1-mesocar转染的供体细胞(即患者21细胞)的促炎细胞因子:ifn-γ,gm-csf,tnf-α和il-4的产生的图。
图24包括图,其描绘用抗car19独特型抗体珠或对照珠刺激,用ctl019car转染并扩增5至9天的供体细胞中ifn-γ,tnf-α,il-6,il-8,il-2,il-1β,gm-csf和il-4的产生水平。用对照珠没有检测到细胞因子或检测到低细胞因子水平(<200pg/ml)。
图25是描述了使用nalm6(all)细胞的萤光素酶测定法,基于保持未操作(utd)或用cd19car(cart19)转导,脱珠,然后在第5天和第9天收获的pbmc的总裂解物的细胞杀伤图。培养多种比例的pmbcs与nalm6细胞(效应物(e):靶标(t))。如图所示,在第5天收获的cart19细胞具有更好的杀伤能力。
图26是描绘未经操作(utd)或用cd19car(cart19)转导,脱珠,然后在第5天和第9天收获的pbmc的长期体内杀伤能力的图。将pbmc引入接种nalm6细胞的非肥胖糖尿病/重度联合免疫缺陷小鼠。
图27a-27d表明,早期时间点的珠粒去除不会诱导细胞损失。图27a是coulter分析,图解了在第3天通过磁铁去除αcd3/αcd28包被的磁珠之前和之后的平均t细胞体积和浓度。然后在除去珠子后冷冻细胞。图27b示出在除去磁珠之前和之后评价细胞数。浓度是相似的。图27c是显示解冻前后相同细胞的平均细胞体积的重叠图。细胞在冻融过程中保留其体积。结果代表至少15个不同的实验。图27d显示了αcd3/αcd28包被的磁珠除去前后t细胞产物的代表性coulter分析,表明了方法的效率。
图28a-28b显示活化的、用携带bbz信号传导的cd19特异性car转导并且在活化后第3天的时间点从t细胞培养物收获的t细胞在体外具有有效的抗原特异性细胞毒活性。图28a,上图,使用k562-wt细胞的四小时杀伤测定。图28a,下图,使用k562-19细胞的四小时杀伤测定。图28b上图,使用il7/il15(左)或il2(右)的转导效率。图28b中图,使用il7/il15与il2相比的群体倍增。图28b下图,使用il7/il15与il2相比的体积。
图29a-29c显示第3天和第9天4-1bbζcart细胞响应于k562-cd19产生相似的细胞因子模式。先前用il-2或il-7/15在培养基中培养的第3天和第9天cart19细胞与k562-cd19(图29a和29b)一起或者仅与培养基培养24小时(图29c)。图29a和图29b中“无抗原”表示用没有cd19的野生型k562细胞刺激的细胞。通过细胞因子珠阵列(luminex)在培养上清液中测量细胞因子。图29c显示解冻后24小时cart19t细胞中代表性的细胞因子产生。细胞因子水平最小。
图30a-30b显示出向具有增加比例的tem和tcm细胞的更分化表型的逐渐过度。
图31a-31d。图31a显示了用于测试在不同条件下产生的cart细胞的效力的实验设置。图31b显示il2处理的cart细胞在小鼠中减缓nalm6肿瘤生长的效力。d3,d5和d9指示在第3天,第5天或第9天收获的cart细胞。3e6和0.5e6表示所施用的car+细胞的数目。car+细胞的比例如图31所示。图31d比较了il2处理和il7/il15处理的cart细胞在减慢小鼠中nalm6肿瘤生长中的效力。
图32.抗原刺激后,含有il-2和il-7/15的培养基中car+t细胞的体外扩增。左侧组,第0天用αcd3/αcd28包被的dynal珠粒刺激来自健康人供体的pbmc,并在第1天用19-bbζ慢病毒转导。这些细胞在补充有il-2或il-7/15的培养基中扩增9天。通过流式细胞术每隔一天使用基于珠粒的计数来计数t细胞。右侧组,监测扩增过程中的平均t细胞体积(fl)。数据代表至少六个独立的供体。
图33.在具有il-2或il-7/15的培养基中培养的第3天和第9天cart19细胞响应于k562-cd19而不是k562-wt或仅培养基而增殖。t细胞用cfse标记,并与k562-cd19,作为阴性对照的野生型k562或单独的培养基共培养120小时。与野生型k562或单独培养基相比,应答k562-cd19的增殖t细胞的数目显著更高,并且在il-7/15和il-2组之间是相当的。结果代表两个不同的供体。
详述
定义
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。
术语“一个”是指物品的语法对象中的一个或多于一个(即至少一个)。作为示例,“元素”是指一个元素或多于一个元素。
当涉及可测量的值(例如量,持续时间等)时,术语“约”意在包括指定值的±20%或在某些情况下±10%,或在某些情况下±5%,或在某些情况下为±1%,或在某些情况下为±0.1%的变化,因为这些变化适用于公开的方法。
术语“嵌合抗原受体”或备选地“car”是指一组多肽,在最简单的实施方案中通常为两个多肽,当在免疫效应细胞中时,其提供细胞对靶细胞(通常为癌细胞)的特异性,并产生细胞内信号。在一些实施方案中,car包含至少一个细胞外抗原结合结构域,跨膜结构域和胞质信号结构域(本文中也称为“胞内信号结构域”),其包含衍生自如下所定义的刺激分子和/或共刺激分子的功能性信号结构域。在一些实施方案中,该组多肽在相同的多肽链中(例如,包含嵌合融合蛋白)。在一些实施方案中,该组多肽彼此不连续,例如在不同的多肽链中。在一些实施方案中,该组多肽包括二聚化开关,其在二聚化分子的存在下可将多肽彼此偶联,例如可将抗原结合结构域偶联至胞内信号结构域。在一个实施方案中,car的刺激分子是与t细胞受体复合体结合的ζ链。在一个方面,细胞质信号结构域包含主要信号结构域(例如,cd3-ζ的主要信号结构域)。在一个实施方案中,细胞质信号结构域还包含如下定义的至少一种共刺激分子的一个或多个功能性信号结构域。在一个实施方案中,共刺激分子是本文所述的共刺激分子,例如4-1bb(即cd137),cd27,icos和/或cd28。在一个实施方案中,car包含嵌合融合蛋白,其包含细胞外抗原结合结构域,跨膜结构域和包含刺激分子的功能性信号结构域的胞内信号结构域。在一个实施方案中,car包含嵌合融合蛋白,其包含细胞外抗原结合结构域,跨膜结构域和包含共刺激分子的功能性信号结构域和刺激分子的功能性信号结构域的胞内信号结构域。在一个实施方案中,car包含嵌合融合蛋白,该嵌合融合蛋白包含细胞外抗原结合结构域,跨膜结构域和胞内信号结构域,该胞内信号结构域包含一个或多个共刺激分子的两个功能性信号结构域和刺激性的功能性信号结构域分子。在一个实施方案中,car包含嵌合融合蛋白,其包含细胞外抗原结合结构域,跨膜结构域和胞内信号结构域,所述胞内信号结构域包含一个或多个共刺激分子的至少两个功能性信号结构域和刺激分子的功能性信号结构域。在一个实施方案中,car包含嵌合融合蛋白,其包含细胞外抗原结合结构域,跨膜结构域和胞内信号结构域,胞内信号结构域包含一个或多个共刺激分子的至少两个功能性信号结构域和刺激分子的功能性信号结构域。在一个实施方案中,car包含car融合蛋白的氨基末端(n末端)的任选的前导序列。在一个实施方案中,car进一步包含在细胞外抗原结合结构域的n末端的前导序列,其中前导序列任选地在细胞加工过程中从抗原结合结构域(例如scfv)切割,并将car定位于细胞膜。
包含靶向特定肿瘤抗原x(例如本文所述的那些)的抗原结合结构域(例如,scfv或tcr)的car也被称为xcar。例如,将包含靶向cd19的抗原结合结构域的car称为cd19car。
术语“信号结构域”是指蛋白质的功能部分,其通过在细胞内传递信息来调节细胞活性而发挥作用,通过产生第二个信使或通过响应这样的信使作为效应子来发挥作用经由确定的信号途径而调节所述细胞活性。
本文所用的术语“抗体”是指衍生自与抗原特异性结合的免疫球蛋白分子的蛋白质或多肽序列。抗体可以是多克隆或单克隆,多链或单链或完整的免疫球蛋白,并且可以衍生自天然来源或重组来源。抗体可以是免疫球蛋白分子的四聚体。
术语“抗体片段”是指抗体的至少一部分,其保留与抗原表位特异性相互作用(例如通过结合,空间位阻,稳定/去稳定,空间分布)的能力。抗体片段的实例包括但不限于fab,fab',f(ab')2,fv片段,scfv抗体片段,二硫键连接的fv(sdfv),由vh和ch1结构域组成的fd片段,线性抗体,单结构域抗体例如sdab(vl或vh),骆驼vhh结构域,由抗体片段形成的多特异性抗体,例如包含在铰链区通过二硫键连接的两个fab片段的二价片段,以及抗体的分离的cdr或其他表位结合片段。也可以将抗原结合片段掺入单结构域抗体,最大抗体,微型抗体,纳米抗体,胞内抗体,双抗体,三抗体,四抗体,v-nar和双scfv中(参见例如hollingerandhudson,naturebiotechnology23:1126-1136,2005)。抗原结合片段也可以移植到基于多肽例如iii型纤连蛋白(fn3)的支架中(参见美国专利号6,703,199,其描述了纤连蛋白多肽微抗体)。
术语“scfv”是指包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段的融合蛋白,其中轻链和重链可变区例如通过合成接头,例如短的柔性多肽接头连续连接,并且能够表达为单链多肽,并且其中所述scfv保留其所源自的完整抗体的特异性。除非另有说明,如本文所使用的,scfv可以具有任何顺序的vl和vh可变区,例如相对于多肽的n末端和c末端,scfv可以包含vl-接头-vh或可以包含vh-接头-vl。
包含抗体或其抗体片段的car的部分可以多种形式存在,其中抗原结合结构域被表达为连续多肽链的一部分,包括例如单结构域抗体片段(sdab),单链抗体(scfv)和人源化抗体(harlowetal.,1999,in:usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,ny;harlowetal.,1989,in:antibodies:alaboratorymanual,coldspringharbor,newyork;houstonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;birdetal.,1988,science242:423-426)。在一个实施方案中,car的抗原结合结构域包含抗体片段。在另一个实施方案中,car包含含有scfv的抗体片段。
如本文所用,术语“结合结构域”或“抗体分子”是指包含至少一个免疫球蛋白可变结构域序列的蛋白质,例如免疫球蛋白链或其片段。术语“结合结构域”或“抗体分子”包括抗体和抗体片段。在一个实施方案中,抗体分子是多特异性抗体分子,例如,其包含多个免疫球蛋白可变结构域序列,其中所述多个序列的第一免疫球蛋白可变结构域序列具有针对第一表位的结合特异性并且所述多个序列的第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。在一个实施方案中,多特异性抗体分子是双特异性抗体分子。双特异性抗体对不超过两种抗原具有特异性。双特异性抗体分子的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。
包含抗体或其抗体片段的本发明的car的部分可以多种形式存在,其中抗原结合结构域被表达为连续多肽链的一部分,包括例如单结构域抗体片段(sdab),单链抗体(scfv),人源化抗体或双特异性抗体(harlowetal.,1999,in:usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,ny;harlowetal.,1989,in:antibodies:alaboratorymanual,coldspringharbor,newyork;houstonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;birdetal.,1988,science242:423-426)。一方面,本发明的car组合物的抗原结合结构域包含抗体片段。另一方面,car包含含有scfv的抗体片段。
术语“抗体重链”是指抗体分子中以其天然存在的构象存在的两种类型的多肽链中较大的一个,并且其通常决定抗体所属的类别。
术语“抗体轻链”是指抗体分子中以其天然存在的构象存在的两种类型的多肽链中较小的一个。kappa()和lambda(λ)轻链是指两种主要的抗体轻链同种型。
本文所用的术语“互补决定区”或“cdr”是指赋予抗原特异性和结合亲和力的抗体可变区内的氨基酸序列。例如,一般来说,在每个重链可变区(例如hcdr1,hcdr2和hcdr3)中有三个cdr,并且在每个轻链可变区(lcdr1,lcdr2和lcdr3)中有三个cdr。给定cdr的精确氨基酸序列边界可以使用多种公知方案中的任何一种来确定,包括kabatetal.(1991),“sequencesofproteinsofimmunologicalinterest,”5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md描述的那些方案(“kabat”编号方案),al-lazikanietal.,(1997)jmb273,927-948(“chothia”编号方案)或其组合。根据kabat编号方案,在一些实施方案中,重链可变结构域(vh)中的cdr氨基酸残基编号为31-35(hcdr1),50-65(hcdr2)和95-102(hcdr3)和轻链可变结构域(vl)中的cdr氨基酸残基编号为24-34(lcdr1),50-56(lcdr2),和89-97(lcdr3)。根据chothia编号方案,在一些实施方案中,vh中的cdr氨基酸编号为26-32(hcdr1),52-56(hcdr2)和95-102(hcdr3);vl中的cdr氨基酸残基编号为26-32(lcdr1),50-52(lcdr2)和91-96(lcdr3)。在组合的kabat和chothia编号方案中,在一些实施方案中,cdr对应于作为kabatcdr,chothiacdr或两者的一部分的氨基酸残基。例如,在一些实施方案中,cdr对应于vh(例如哺乳动物vh,例如人vh)中的氨基酸残基26-35(hcdr1),50-65(hcdr2)和95-102(hcdr3);和vl(例如哺乳动物vl,例如人vl)中的氨基酸残基24-34(lcdr1),50-56(lcdr2),和89-97(lcdr3)。
术语“重组抗体”是指使用重组dna技术产生的抗体,例如由噬菌体或酵母表达系统表达的抗体。该术语还应解释为通过合成编码抗体的dna分子产生的抗体并且所述dna分子表达抗体蛋白或限定所述抗体的氨基酸序列,其中使用本领域可获得和熟知的重组dna或氨基酸序列技术获得所述dna或氨基酸序列。
术语“抗原”或“ag”是指引发免疫应答的分子。这种免疫应答可能涉及抗体产生或特异性免疫感受态细胞的活化,或两者兼有。技术人员将理解,任何大分子,包括基本上所有的蛋白质或肽,都可以用作抗原。此外,抗原可以衍生自重组或基因组dna。本领域技术人员将理解,包含编码引发免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna因此编码如本文所用的术语“抗原”。此外,本领域技术人员将理解,抗原不需要仅由基因的全长核苷酸序列编码。很明显,本发明包括但不限于使用多于一种基因的部分核苷酸序列,并且这些核苷酸序列以各种组合排列以编码引起所需免疫应答的多肽。此外,本领域技术人员将理解,抗原根本不需要由“基因”编码。很明显,可以合成产生或可以从生物样品衍生出抗原,或抗原可以是除了多肽以外的大分子。这样的生物样品可以包括但不限于组织样品,肿瘤样品,细胞或具有其他生物组分的流体。
术语“自体的”是指来自同一个个体的任何材料,所述材料后来被重新引入该个体。
术语“同种异体的”是指衍生自与引入材料的个体相同物种的不同动物的任何材料。当一个或多个基因座的基因不相同时,两个或多个个体被认为是彼此同种异体的。在一些方面,来自相同物种的个体的同种异体材料可能在遗传上充分不同而在抗原性上相互作用。
术语“异种的”是指源自不同物种的动物的任何材料。
术语“癌症”指以异常细胞的不受控制的生长为特征的疾病。癌细胞可以局部扩散或通过血流和淋巴系统扩散到身体的其他部分。各种癌症的实例在本文描述并且包括但不限于乳腺癌,前列腺癌,卵巢癌,宫颈癌,皮肤癌,胰腺癌,结肠直肠癌,肾癌,肝癌,脑癌,淋巴瘤,白血病,肺癌,等等。术语“肿瘤”和“癌症”在本文中可互换使用,例如,两个术语涵盖实体和液体肿瘤,例如弥漫性或循环肿瘤。如本文所用,术语“癌症”或“肿瘤”包括癌前病变以及恶性癌症和肿瘤。
本文使用的术语“衍生自”表示第一和第二分子之间的关系。它通常是指第一分子和第二分子之间的结构相似性,并且不意味着或包括衍生自第二分子的第一分子上的方法或源限制。例如,在衍生自cd3ζ分子的胞内信号结构域的情况下,胞内信号结构域保留足够的cd3ζ结构,使其具有所需的功能,即在适当条件下产生信号的能力。它不意味着或包括局限于产生胞内信号结构域的特定方法,例如,这并不意味着提供胞内信号结构域,必须从cd3ζ序列开始并缺失不需要的序列,或者施加突变以到达胞内信号结构域。
短语“与如本文所述的肿瘤抗原表达相关的疾病”包括但不限于与本文所述的肿瘤抗原的表达相关的疾病或与表达本文所述的肿瘤抗原的细胞相关的病症,包括,例如增生性疾病如癌症或恶性肿瘤或癌前病症如脊髓发育不良,脊髓发育不良综合征或白血病前期;或与表达本文所述的肿瘤抗原的细胞相关的非癌症相关适应证。在一个实施方案中,与本文所述的肿瘤抗原表达相关的癌症是血液癌症。在一个实施方案中,与本文所述的肿瘤抗原表达相关的癌症是实体癌。与本文所述的肿瘤抗原表达相关的其它疾病包括但不限于例如与本文所述的肿瘤抗原表达相关的非典型和/或非经典癌症,恶性肿瘤,癌前病症或增生性疾病。与本文所述的肿瘤抗原表达相关的非癌症相关适应证包括但不限于例如自身免疫性疾病(例如狼疮),炎症性疾病(变态反应和哮喘)和移植。在一些实施方案中,表达肿瘤抗原的细胞表达或者在任何时间表达编码肿瘤抗原的mrna。在一个实施方案中,表达肿瘤抗原的细胞产生肿瘤抗原蛋白(例如野生型或突变体),并且肿瘤抗原蛋白可以以正常水平或降低的水平存在。在一个实施方案中,表达肿瘤抗原的细胞一度产生可检测水平的肿瘤抗原蛋白质,随后基本上不产生可检测的肿瘤抗原蛋白质。
短语“与cd19表达相关的疾病”包括但不限于与cd19表达相关的疾病或与表达cd19的细胞相关的病症,包括例如增生性疾病如癌症或恶性肿瘤或癌前病症如脊髓发育不良,脊髓发育不良综合征或白血病前期;或与表达cd的细胞相关的非癌症相关适应证。一方面,与cd19表达相关的癌症是血液癌症。一方面,血液癌症是白血病或淋巴瘤。一方面,与cd19的表达相关的癌症包括癌症和恶性肿瘤,包括但不限于例如一种或多种急性白血病,包括但不限于例如急性骨髓性白血病(aml),b细胞急性淋巴细胞性白血病(ball),t细胞急性淋巴细胞白血病(tall),急性淋巴性白血病(all);一种或多种慢性白血病,包括但不限于慢性骨髓性白血病(cml),慢性淋巴细胞性白血病(cll)。与cd19表达相关的另外的癌症或血液病症包括但不限于,例如,b细胞幼淋巴细胞白血病,胚细胞浆细胞样树突状细胞瘤,伯基特淋巴瘤,弥漫性大b细胞淋巴瘤,滤泡淋巴瘤,毛细胞白血病,小细胞或大细胞滤泡淋巴瘤,恶性淋巴增殖性病症,malt淋巴瘤,套细胞淋巴瘤(mcl),边缘区淋巴瘤,多发性骨髓瘤,骨髓发育不良和骨髓增生异常综合征,非霍奇金淋巴瘤,霍奇金淋巴瘤,浆母细胞淋巴瘤,浆细胞样树突状细胞瘤,瓦尔登斯特伦巨球蛋白血症,骨髓增生性肿瘤;组织细胞病症(例如,肥大细胞病症或胚细胞浆细胞样树突状细胞瘤);肥大细胞病症,例如系统性肥大细胞增多症或肥大细胞白血病;b细胞前淋巴细胞性白血病,浆细胞骨髓瘤和“白血病前期”,它们是通过髓样血细胞的无效生产(或发育不良)联合在一起的血液病症的多样集合,等。与cd19的表达相关的其它疾病包括但不限于例如与cd19表达相关的非典型和/或非经典癌症,恶性肿瘤,癌前病症或增生性疾病。与cd19表达相关的非癌症相关适应证包括但不限于例如自身免疫性疾病(例如狼疮),炎症性疾病(变态反应和哮喘)和移植。在一些实施方案中,表达肿瘤抗原的细胞表达或在任何时间表达了编码肿瘤抗原的mrna。在一个实施方案中,表达肿瘤抗原的细胞产生肿瘤抗原蛋白(例如野生型或突变体),并且肿瘤抗原蛋白可以以正常水平或降低的水平存在。在一个实施方案中,表达肿瘤抗原的细胞一度产生可检测水平的肿瘤抗原蛋白质,随后基本上不产生可检测的肿瘤抗原蛋白质。在其它实施方案中,该疾病是cd19阴性癌症,例如cd19阴性复发性癌症。在一些实施方案中,表达肿瘤抗原(例如cd19)的细胞表达或在在任何时间表达了编码肿瘤抗原的mrna。在一个实施方案中,表达肿瘤抗原(例如cd19)的细胞产生肿瘤抗原蛋白(例如野生型或突变型),并且肿瘤抗原蛋白可以以正常水平或降低的水平存在。在一个实施方案中,表达肿瘤抗原(例如cd19)的细胞一度产生可检测水平的肿瘤抗原蛋白质,随后基本上不产生可检测的肿瘤抗原蛋白。
短语“与b细胞抗原表达相关的疾病”包括但不限于与cd19,cd20,cd22或ror1中的一种或多种的表达相关的疾病,或与表达或在任何时间表达了cd19,cd22,cd22或ror1中的一种或多种的病症,包括例如增生性疾病如癌症或恶性肿瘤或癌前病症如骨髓增生异常或骨髓增生异常综合征或白血病前期;或与表达cd19,cd20,cd22或ror1中的一种或多种的细胞相关的非癌症相关适应证。为了避免疑义,与b细胞抗原表达相关的疾病可以包括与目前不表达b细胞抗原的细胞相关的病症,例如因为抗原表达已被下调,例如由于用靶向b细胞抗原的分子,例如靶向car,但是从前表达所述抗原的b细胞治疗。短语“与b细胞抗原表达相关的疾病”包括与本文所述的cd19表达相关的疾病。在实施方案中,car表达细胞用于治疗与b细胞抗原相关的疾病。在实施方案中,通过本文方法产生的car包含靶向b细胞抗原的抗原结合结构域。
本文所用的术语“复发”是指在初始应答期之后,例如在用疗法,例如癌症疗法进行的先前治疗(例如,完全应答或部分应答)之后再次出现疾病(例如癌症)。初始应答期可能涉及癌细胞水平降到低于某一阈值,例如低于20%,15%,10%,5%,4%,3%,2%或1%。再次出现可能会使癌细胞的水平升高到某一阈值以上,例如高于20%,15%,10%,5%,4%,3%,2%或1%。例如,在b-all的上下文中,再次出现可能涉及例如在完全应答之后在血液,骨髓(>5%)或任何髓外部位中胚细胞的再次出现。在这种情况下,完全的应答可能涉及<5%的bm胚细胞。更一般地,在一个实施方案中,应答(例如完全应答或部分应答)可以涉及不存在可检测的mrd(最小残留疾病)。在一个实施方案中,应答的初始时间持续至少1,2,3,4,5或6天;至少1,2,3或4周;至少1,2,3,4,6,8,10或12个月;或至少1,2,3,4或5年。
本文所用的“难治的”是指对治疗无应答的疾病,例如癌症。在实施方案中,难治性癌症可以在治疗开始之前或开始时耐受治疗。在其它实施方案中,难治性癌症在治疗期间可变得耐受。难治性癌症也被称为耐药性癌症。
术语“保守序列修饰”指不显著影响或改变含有氨基酸序列的抗体或抗体片段的结合特征的氨基酸修饰。这种保守修饰包括氨基酸取代,添加和缺失。可以通过本领域已知的标准技术,例如定点诱变和pcr介导的诱变,将修饰引入本发明的抗体或抗体片段中。保守氨基酸取代是其中氨基酸残基被具有相似侧链的氨基酸残基替换的取代。具有相似侧链的氨基酸残基家族在本领域中已经定义。这些家族包括具有碱性侧链(例如赖氨酸,精氨酸,组氨酸),酸性侧链(例如天冬氨酸,谷氨酸),不带电的极性侧链(例如甘氨酸,天冬酰胺,谷氨酰胺,丝氨酸,苏氨酸,酪氨酸,半胱氨酸,色氨酸),非极性侧链(例如丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸),β-分支侧链(例如苏氨酸,缬氨酸,异亮氨酸)和芳族侧链(例如,酪氨酸,苯丙氨酸,色氨酸,组氨酸)的氨基酸。因此,本文所述的car内的一个或多个氨基酸残基可以被来自相同侧链家族的其它氨基酸残基替代,并且可以使用本文所述的功能测定法来测试改变的car。
术语“刺激”是指通过将刺激分子(例如tcr/cd3复合体或car)与其同源配体(或car的情况下的肿瘤抗原)结合诱导的初步应答,从而介导信号转导事件,例如但不限于通过tcr/cd3复合体的信号转导或通过适当的nk受体或car的信号结构域的信号转导。刺激可以介导某些分子的改变的表达。
术语“刺激分子”是指由免疫细胞(例如,t细胞,nk细胞,b细胞)表达的分子,其提供细胞质信号序列,所述细胞质信号序列对于免疫细胞信号途径的一些方面以刺激方式调节免疫细胞的活化。在一个方面,信号是通过例如tcr/cd3复合体与装载有肽的mhc分子的结合引发的主要信号,并且导致t细胞应答的介导,包括但不限于,增殖,激活,分化等。以刺激方式起作用的主要细胞质信号序列(也称为“主要信号结构域”)可以包含信号传导基序,该基序被称为基于免疫受体酪氨酸的激活基序或itam。在本发明中特别使用的包含细胞质信号序列的itam的实例包括但不限于衍生自cd3ζ,共同fcrγ(fcer1g),fcγriia,fcrβ(fcεr1b),cd3γ,cd3δ,cd3ε,cd79a,cd79b,dap10和dap12的那些。在本发明的特定car中,本发明的任何一种或多种cars中的胞内信号结构域包含细胞内信号序列,例如cd3-ζ的主要信号序列。在本发明的特定car中,cd3-ζ的主要信号序列是作为seqidno:9(突变体cd3ζ)提供的序列,或来自非人物种例如小鼠,啮齿动物,猴,猿等的等同残基。在本发明的特定car中,cd3-ζ的主要信号序列是seqidno:10(野生型人cd3ζ)中提供的序列,或来自非人物种,例如小鼠,啮齿动物,猴子,猿等的等同残基。
术语“抗原呈递细胞”或“apc”是指其表面上呈递与主要组织相容性复合体(mhc的)复合的外来抗原的免疫系统细胞,比如辅助细胞(例如,
b-细胞、树突细胞等)。t-细胞可以使用其t-细胞受体(tcr)识别这些复合体。apc加工抗原且将其呈递给t-细胞。
如本文所用的术语“胞内信号结构域”,是指分子的细胞内部分。胞内信号结构域可以产生促进含car细胞(例如cart细胞)的免疫效应子功能的信号。免疫效应子功能的实例(例如在cart细胞中)包括细胞溶解活性和辅助活性,包括细胞因子的分泌。在实施方案中,胞内信号结构域是蛋白质的部分,其转导效应子功能信号并指导细胞进行特化功能。虽然可以使用整个胞内信号结构域,但在许多情况下,不必使用整个链。就使用胞内信号结构域的截短部分而言,此类截短部分可用于代替完整链,只要其转导效应子功能信号即可。术语胞内信号结构域因此意在包括足以转导效应子功能信号的胞内信号结构域的任何截短部分。
在一个实施方案中,胞内信号结构域可以包括主要胞内信号结构域。示例性的主要胞内信号结构域包括来源于负责初次刺激或抗原依赖性刺激的分子的那些。在一个实施方案中,胞内信号结构域可以包括共刺激胞内结构域。示例性的共刺激胞内信号结构域包括来源于负责共刺激信号或抗原独立的刺激的分子的那些。例如,在cart的情况下,主要胞内信号结构域可以包含t细胞受体的细胞质序列,并且共刺激胞内信号结构域可以包含来自共同受体或共刺激性分子的细胞质序列。
主要胞内信号结构域可以包括被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。含有itam的主要细胞质信号序列的实例包括,但不限于来源于下述的那些:cd3ζ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(“icos”),fcεri,和cd66d,cd32,dap10和dap12。
术语“ζ”或备选地“ζ链”、“cd3-ζ”或“tcrζ”定义为如genbanacc.no.bag36664.1提供的蛋白质或来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基,且“ζ刺激结构域”或备选地“cd3-ζ刺激结构域”或“tcr-ζ刺激结构域”定义为来自ζ链的胞质结构域的氨基酸残基,其足以在功能上传递t细胞活化所需的起始信号。在一个方面,ζ的胞质结构域包括genbankacc.no.bag36664.1的残基52至164或作为其功能性同源物的来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基。在一个方面,“ζ刺激结构域”或“cd3-ζ刺激结构域”是作为seqidno:9提供的序列。在一个方面,“ζ刺激结构域”或“cd3-ζ刺激结构域”是如seqidno:10提供的序列。
术语“共刺激分子”是指t细胞上的同源结合配偶体,其与共刺激配体特异性结合从而介导t细胞的共刺激反应,例如但不限于增殖。共刺激分子是有效免疫应答所需的除抗原受体或其配体之外的细胞表面分子。共刺激分子包括但不限于mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,信号传导淋巴细胞活化分子(slam蛋白),激活nk细胞受体,btla,toll配体受体,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a和与cd83特异性结合的配体。
共刺激胞内信号结构域是指共刺激分子的细胞内部分。胞内信号结构域可以包括分子的全部细胞内部分或全部天然胞内信号结构域、或其功能片段。
胞内信号结构域可以包含整个细胞内部分或衍生其的分子的整个天然胞内信号结构域,或其功能片段。
术语“4-1bb”是指具有如genbankacc.no.aaa62478.2提供的氨基酸序列的tnfr超家族的成员,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基;并且“4-1bb共刺激结构域”被定义为genbankacc.no..aaa62478.2的氨基酸残基214-255,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。在一个方面,“4-1bb共刺激结构域”为如seqidno:14提供的序列或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。
正如本文中使用的那样,术语“免疫效应细胞”,是指参与免疫应答,例如,促进免疫效应子应答的细胞。免疫效应细胞的实例包括t细胞,例如,α/β的t细胞和γ/δt细胞、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞和骨髓源性吞噬细胞。
正如本文中使用的那样,术语“免疫效应子功能或免疫效应子应答”是指免疫效应细胞,例如增强或促进靶细胞的免疫攻击的功能或反应。例如,免疫效应子功能或应答是指促进靶细胞的杀伤或者抑制生长或增殖的t细胞或nk细胞的属性。在t细胞的情况下,主要刺激和共刺激是免疫效应子功能或应答的实例。
术语“效应子功能”是指细胞的特化功能。例如,t细胞的效应子功能可以是溶细胞活性或辅助活性,包括细胞因子的分泌。
术语“编码”是指多核苷酸比如基因、cdna、或mrna中的核苷酸的特异性序列在生物学过程中作为合成其它聚合物和大分子的模板的固有特性,该聚合物以及大分子具有确定的核苷酸序列(例如,rrna、trna和mrna)或确定的氨基酸序列及由其得到的生物学特性。因此,如果与所述基因对应的mrna的转录和翻译在细胞或其它生物系统中产生蛋白质,则基因,cdna,或rna编码蛋白质。其核苷酸序列与mrna序列相同且通常被提供在序列表中的编码链和用作转录基因或cdna的模板的非编码链这两者都可以被称为编码该基因或cdna的蛋白或其他产物。
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括作为彼此的简并形式且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质或rna的短语核苷酸序列还可以包括内含子,达到编码蛋白质的核苷酸序列可以在某些版本中含有内含子的程度。
术语“内源的”是指来自或在生物体、细胞、组织或系统内部产生的任何物质。
术语“外源的”是指从生物体、细胞、组织或系统外部引入或产生的任何物质。
术语“表达”是指由启动子驱动的特定核苷酸序列的转录和/或翻译。
术语“转移载体”是指包括分离的核酸且可用于将所分离的核酸递送至细胞内部的物质组合物。大量载体是本领域已知的,包括,但不限于线性多核苷酸、与离子或两亲性化合物有关的多核苷酸、质粒和病毒。因此,术语“转移载体”包括自主复制的质粒或病毒。该术语也应当被解释为进一步包括非质粒和促进核酸转移到细胞中的非病毒化合物,比如例如聚赖氨酸化合物、脂质体等。病毒转移载体的实例包括,但不限于腺病毒载体、腺伴随病毒载体、逆转录病毒载体、慢病毒(lentiviral)载体等。
术语"表达载体”是指包含重组多核苷酸的载体,其包含有效连接要表达的核苷酸序列的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其它元件可以由宿主细胞提供或在体外表达系统中。表达载体包括本领域已知的所有那些,包括被掺入重组多核苷酸的粘粒、质粒(例如,裸的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺伴随病毒)。
术语“慢病毒”是指逆转录病毒科的属。逆转录病毒在能够感染非分裂细胞方面在慢病毒中是独特的;它们可以将大量的遗传信息递送到宿主细胞的dna中,因此它们是基因递送载体最有效的方法之一。hiv,siv和fiv都是慢病毒的例子。
术语“慢病毒载体”是指衍生自慢病毒基因组的至少一部分的载体,包括miloneetal.,mol.ther.17(8):1453–1464(2009)中提供的自身灭活性慢病毒载体。可以在临床中使用的慢病毒载体的其它实例包括但不限于例如来自oxfordbiomedica的
术语“同源的”或“同一性”是指两个聚合分子之间,例如两个核酸分子之间,例如两个dna分子或两个rna分子之间,或两个多肽分子之间的亚基序列同一性。当两个分子两者中的亚基位置被相同的单体亚基占据时;例如,如果两个dna分子的每一个中的位置被腺嘌呤占据,则它们在该位置是同源或同一的。两个序列之间的同源性是匹配或同源位置数目的直接函数;例如,如果两个序列中的位置的一半(例如,长度为10个亚基的聚合物中的5个位置)是同源的,则这两个序列是50%同源的;如果90%的位置(例如,10个中的9个)是匹配或同源的,则两个序列是90%同源的。
非人(例如鼠)抗体的“人源化”形式是嵌合免疫球蛋白,免疫球蛋白链或其片段(例如fv,fab,fab’,f(ab’)2或抗体的其他抗原结合子序列),其含有来自非人免疫球蛋白的最小序列。大多数情况下,人源化抗体和其抗体片段是人免疫球蛋白(受体抗体或抗体片段),其中来自受体的互补决定区(cdr)的残基被来自非人物种(供体抗体)例如小鼠、大鼠或兔的具有所需的特异性,亲和力和能力的cdr的残基替换。在一些情况下,人免疫球蛋白的fv构架区(fr)残基被相应的非人残基替换。此外,人源化抗体/抗体片段可以包含既不在受体抗体中也不在输入的cdr或构架序列中发现的残基。这些修饰可以进一步改进和优化抗体或抗体片段性能。通常,人源化抗体或其抗体片段将包含基本上所有至少一个,通常两个可变结构域,其中所有或基本上所有cdr区对应于非人免疫球蛋白的cdr区,并且所有或重要部分的fr区是人免疫球蛋白序列的那些fr区。人源化抗体或抗体片段可以还包含通常是人免疫球蛋白的免疫球蛋白恒定区(fc)的至少一部分。更多细节参见jonesetal.,nature,321:522-525,1986;reichmannetal.,nature,332:323-329,1988;presta,curr.op.struct.biol.,2:593-596,1992。
“完全人”是指免疫球蛋白,例如抗体或抗体片段,其中整个分子是人源的或由与人形式的抗体或免疫球蛋白相同的氨基酸序列组成。
术语“分离的”意指从天然状态改变或除去。例如,天然存在于活动物中的核酸或肽不是“分离的”,但是与其天然状态的共存材料部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以以基本上纯化的形式存在,或可以存在于非天然环境,例如宿主细胞中。
在本发明的上下文中,使用通常出现的核酸碱基的以下缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是指尿苷。
术语“有效连接”或“转录控制”是指调节序列和异源核酸序列之间的功能性连接,导致异源核酸序列的表达。例如,当第一核酸序列与第二核酸序列处于功能关系时,第一核酸序列与第二核酸序列有效连接。例如,如果启动子影响编码序列的转录或表达,那么启动子有效连接到编码序列。有效连接的dna序列可以彼此连续,并且例如在必要时连接两个蛋白质编码区,在相同的可读框中。
术语免疫原性组合物的“胃肠外”施用包括例如皮下(s.c.),静脉内(i.v.),肌内(i.m.)或胸骨内注射,瘤内或输注技术。
术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)或其dna或rna的组合及其聚合物。术语“核酸”包括基因,cdna或mrna。在一个实施方案中,核酸分子是合成的(例如化学合成的)或重组的。除非特别限定,否则该术语包括含有天然核苷酸的类似物或衍生物的核酸,其具有与参考核酸相似的结合特性并且以类似于天然存在的核苷酸的方式进行代谢。除非另有说明,特定的核酸序列还隐含地包括其保守修饰的变体(例如简并密码子取代),等位基因,直向同源物,snp和互补序列以及明确指出的序列。具体地,简并密码子取代可以通过产生序列来实现,所述序列中一个或多个所选(或全部)密码子的第三个位置被混合碱基和/或脱氧肌苷残基取代(batzeretal.,nucleicacidres.19:5081(1991);ohtsukaetal.,j.biol.chem.260:2605-2608(1985);和rossolinietal.,mol.cell.probes8:91-98(1994))。
术语“肽”,“多肽”和“蛋白质”可互换使用,是指由肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对于包含蛋白质或肽序列的氨基酸的最大数目没有限制。多肽包括通过肽键彼此连接的包含两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语是指短链和长链,短链也在本领域中通常被称为肽,寡肽和寡聚体,长链在本领域中通常称为蛋白质,其存在很多类型。“多肽”包括例如生物活性片段,基本上同源的多肽,寡肽,同二聚体,异源二聚体,多肽的变体,修饰的多肽,衍生物,类似物,融合蛋白等。多肽包括天然肽,重组肽或其组合。
术语“启动子”是指由细胞的合成机器识别的dna序列,或引入的合成机器,需要其来启动多核苷酸序列的特异性转录。
术语“启动子/调节序列”是指与启动子/调节序列可有效连接的基因产物的表达所需的核酸序列。在一些情况下,该序列可以是核心启动子序列,并且在其他情况下,该序列也可以包括基因产物表达所需的增强子序列和其他调控元件。启动子/调节序列可以是例如以组织特异性方式表达基因产物的序列。
术语“组成型”启动子是指核苷酸序列,其当与编码或指定基因产物的多核苷酸有效连接时,在细胞的大多数或所有生理条件下引起在细胞中产生基因产物。
术语“诱导型”启动子是指核苷酸序列,其当与编码或指定基因产物的多核苷酸有效连接时,基本上只有当细胞中存在对应于启动子的诱导物时,才引起在细胞中产生基因产物。
术语“组织特异性”启动子是指核苷酸序列,其当与编码基因或由基因指定的多核苷酸有效连接时,基本上只有当细胞是对应于启动子的组织类型的细胞时,才引起在细胞中产生基因产物。
术语“癌症相关抗原”或“肿瘤抗原”可互换地是指与正常细胞相比,优选在癌细胞表面完全或作为片段(例如,mhc/肽)表达的分子(通常为蛋白质,碳水化合物或脂质),并且其可用于药理学试剂对癌细胞的优先靶向。在一些实施方案中,肿瘤抗原是由正常细胞和癌细胞两者所表达的标记,例如血清标记,例如b细胞上的cd19。在某些方面,本发明的肿瘤抗原衍生自癌症,包括但不限于原发性或转移性黑素瘤,胸腺瘤,淋巴瘤,肉瘤,肺癌,肝癌,非霍奇金淋巴瘤,霍奇金淋巴瘤,白血病,子宫癌,宫颈癌,膀胱癌,肾癌和腺癌如乳腺癌,前列腺癌,卵巢癌,胰腺癌等。在一些实施方案中,癌症相关抗原是与正常细胞相比在癌细胞中过表达的细胞表面分子,例如与正常细胞相比1倍过表达,2倍过表达,3倍过表达或更多倍过表达。在一些实施方案中,癌症相关抗原是在癌细胞中不适当地合成的细胞表面分子,例如与正常细胞上表达的分子相比含有缺失,添加或突变的分子。在一些实施方案中,癌症相关抗原将仅在癌细胞的细胞表面完整表达或作为片段(例如mhc/肽)表达,并且不在正常细胞的表面上合成或表达。在一些实施方案中,本发明的car包括car,其包含与mhc呈递的肽结合的抗原结合结构域(例如抗体或抗体片段)。通常,源自内源蛋白的肽填充了主要组织相容性复合体(mhc)i类分子的口袋,并被cd8+t淋巴细胞上的t细胞受体(tcr)识别。mhci类复合体由所有有核细胞组成型表达。在癌症中,病毒特异性和/或肿瘤特异性肽/mhc复合体代表免疫疗法的独特类型的细胞表面靶标。已经描述了在人白细胞抗原(hla)-a1或hla-a2的上下文中靶向衍生自病毒或肿瘤抗原的肽的tcr样抗体(参见例如sastryetal.,jvirol.201185(5):1935-1942;sergeevaetal.,blood,2011117(16):4262-4272;vermaetal.,jimmunol2010184(4):2156-2165;willemsenetal.,genether20018(21):1601-1608;daoetal.,scitranslmed20135(176):176ra33;tassevetal.,cancergenether201219(2):84-100)。例如,可以从筛选文库(例如人scfv噬菌体展示文库)鉴定tcr样抗体。
在scfv的上下文中使用的术语“柔性多肽接头”或“接头”是指由氨基酸组成的肽接头,例如单独或组合使用的甘氨酸和/或丝氨酸残基,以连接可变重链区和可变轻链区。在一个实施方案中,柔性多肽接头是gly/ser接头并且包含氨基酸序列(gly-gly-gly-ser)n(seqidno:15)。其中n是等于或大于1的正整数。例如,n=1,n=2,n=3,n=4,n=5,n=6,n=7,n=8,n=9和n=10。在一个实施方案中,所述柔性多肽接头包括但不限于(gly4ser)4(seqidno:27)或(gly4ser)3(seqidno:28)。在另一个实施方案中,接头包括多个重复的(gly2ser),(glyser)或(gly3ser)(seqidno:29)。还包括在本发明范围内的是wo2012/138475中描述的接头,其通过引用并入本文)。
如本文所用,5'帽(也称为rna帽,rna7-甲基鸟苷帽或rnam7g帽)是转录开始后不久已经添加到真核信使rna的“前面”或“5'末端的经修饰的鸟嘌呤核苷酸。5'帽由与第一转录核苷酸连接的末端基团组成。其存在对于核糖体的识别和受保护免于rna酶的作用至关重要。帽添加与转录相结合,并且与转录共同发生,使得每个都影响另一个。在转录开始后不久,正被合成的mrna的5'末端被与rna聚合酶结合的帽合成复合体结合。该酶复合体催化mrna帽化所需的化学反应。合成作为多步生化反应进行。可以修饰帽化部分以调节mrna的功能,例如其稳定性或翻译效率。
如本文所用,“体外转录的rna”是指已经在体外合成的rna,例如mrna。通常,体外转录的rna是从体外转录载体产生的。体外转录载体包含用于产生体外转录的rna的模板。
如本文所用,“多聚(a)”是通过聚腺苷酸化连接到mrna的一系列腺苷。在用于瞬时表达的构建体的一些实施方案中,多聚a在50至5000(seqidno:30)之间,例如大于64,例如大于100,例如大于300或400个多聚(a)序列,其可通过化学或酶学方法修饰来调节mrna功能,如定位,稳定性或翻译效率。
如本文所用,“聚腺苷酸化”是指多聚腺苷酰部分或其修饰变体与信使rna分子的共价连接。在真核生物中,大多数信使rna(mrna)分子在3'末端聚腺苷酸化。3'多聚(a)尾是通过酶多聚腺苷酸聚合酶的作用而被加入前mrna的腺嘌呤核苷酸(通常数百)的长序列。在高等真核生物中,将多聚(a)尾添加到含有特异性序列——多聚腺苷酸化信号的转录物上。多聚(a)尾和与其结合的蛋白质有助于保护mrna免受外切核酸酶的降解。多聚腺苷酸化对于转录终止,mrna从核的输出和翻译也是重要的。多聚核苷酸化在dna转录成rna之后立即发生在细胞核中,但另外也可以在细胞质中发生。转录终止后,通过与rna聚合酶相关的核酸内切酶复合体的作用将mrna链切割。切割位点的特征通常是在切割位点附近存在碱基序列aauaaa。在mrna被切割后,将腺苷残基加入切割位点的游离3'末端。
如本文所用,“瞬时”是指非整合转基因表达数小时,数天或数周,其中表达时间段少于如果整合到基因组中或包含在宿主细胞中的稳定的质粒复制子中时基因表达的时间段。
单采血液成分术是将全血从个体中除去,分离成选择的组分,其余的回流到循环的方法。一般来说,有两种分离血液成分的方法:离心和非离心方法。白细胞分离术导致患者白细胞的主动选择和去除。
如本文所用,术语“治疗”是指减少或改善增生性病症的进展,严重性和/或持续时间,或改善由施用一种或多种疗法(例如,一种或多种治疗剂如本发明的car)引起的增生性病症的一种或多种症状(例如,一种或多种明显的症状)。在具体实施方案中,术语“治疗”是指改善增生性病症的至少一种可测量的物理参数,例如肿瘤生长,其不一定被患者识别。在其它实施方案中,术语“治疗”指通过身体上(通过例如稳定可辨别的症状)或生理上(通过例如稳定身体参数)或两者来抑制增生性病症的进展。在其它实施方案中,术语“治疗”是指肿瘤大小或癌细胞计数的减少或稳定化。
术语“信号转导途径”是指在将信号从细胞的一部分传递到细胞的另一部分中发挥作用的多种信号转导分子之间的生化关系。短语“细胞表面受体”包括能够接收信号并跨细胞膜传递信号的分子和分子复合体。
术语“受试者”意欲包括其中可引发免疫应答的活的生物体(例如哺乳动物,人)。
术语“基本上纯化的”细胞指基本上不含其它细胞类型的细胞。基本上纯化的细胞还指已经与其通常与其天然存在状态相关的其它细胞类型分离的细胞。在一些情况下,基本上纯化的细胞群体是指同源的细胞群体。在其它情况下,该术语简单地指已经与细胞分离的细胞,后者细胞在其天然状态下与前者细胞天然结合。在一些方面,细胞在体外培养。在其他方面,细胞不在体外培养。
在本发明的上下文中,“肿瘤抗原”或“过度增生性病症抗原”或“与过度增生性病症相关的抗原”是指特定过度增生性病症常见的抗原。在某些实施方案中,肿瘤抗原衍生自癌症,包括但不限于原发性或转移性黑素瘤,胸腺瘤,淋巴瘤,肉瘤,肺癌,肝癌,非霍奇金淋巴瘤,霍奇金淋巴瘤,白血病,子宫癌,宫颈癌,膀胱癌,肾癌和腺癌如乳腺癌,前列腺癌,卵巢癌,胰腺癌等。
术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源核酸转染,转化或转导的细胞。细胞包括原代受试细胞及其后代。
术语“特异性结合”是指识别并结合存在于样品中的同源结合配偶体蛋白的抗体或配体,但所述抗体或配体基本上不识别或结合样品中的其他分子。
范围∶在整个公开中,本发明的各个方面都可以以范围形式存在。应当理解,范围形式的描述仅仅为方便和简洁起见,而不应当被看作是对本发明的范围不可改变的限制。因此,范围的描述应当被认为特别地公开了所有可能的子范围以及该范围内的单独数值。例如,范围的描述比如从1至6就应当被认为具体地公开了子范围比如1至3、1至4、1至5、2至4、2至6、3至6等,以及该范围内的单独数值,例如1、2、2.7、3、4、5、5.3、和6。作为另一个例子,95-99%同一性的范围包括具有95%,96%,97%,98%或99%同一性的内容,并且包括诸如96-99%,96-98%,96-97%,97-99%,97-98%和98-99%同一性的子范围。这无论范围的广度如何都适用。
描述
本文提供了可以用car(例如本文所述的car)进行工程化的免疫效应细胞(例如,t细胞,nk细胞),以及包含此类细胞的反应混合物和组合物的制备方法。
在一个方面,本公开的特征在于工程化以表达car的免疫效应细胞(例如,t细胞,nk细胞),其中工程化的免疫效应细胞表现出抗肿瘤特性。示例性抗原是本文所述的癌症相关抗原(即肿瘤抗原)。在一个方面,用car转化细胞,并且在细胞表面上表达car。在一些实施方案中,细胞(例如,t细胞,nk细胞)用编码car的病毒载体转导。在一些实施方案中,病毒载体是逆转录病毒载体。在一些实施方案中,病毒载体是慢病毒载体。在一些这样的实施方案中,细胞可以稳定地表达car。在另一个实施方案中,用编码car的核酸例如mrna,cdna,dna转染细胞(例如,t细胞,nk细胞)。在一些这样的实施方案中,细胞可以瞬时表达car。
此外,本发明提供car表达细胞,例如cart组合物及其在用于治疗涉及表达本文所述的肿瘤抗原的细胞或组织的癌症或任何恶性肿瘤或自身免疫性疾病等疾病的药物或方法中的用途。
一方面,本发明的car可用于根除表达本文所述的肿瘤抗原的正常细胞,从而可应用于用作细胞移植前的细胞调节疗法。
免疫效应细胞的来源
在实施方案中,在扩增和遗传修饰或其它修饰之前,可以从受试者获得细胞来源,例如t细胞或天然杀伤(nk)细胞。受试者的实例包括人,猴,黑猩猩,狗,猫,小鼠,大鼠及其转基因物种。t细胞可以从许多来源获得,包括外周血单核细胞,骨髓,淋巴结组织,脐带血,胸腺组织,来自感染部位的组织,腹水,胸腔积液,脾组织和肿瘤。
在本公开的某些方面,可以使用技术人员已知的任何数量的技术,例如ficolltm分离,从受试者收集的血液单位获得免疫效应细胞例如t细胞。一方面,通过单采血液成分术获得来自个体的循环血液的细胞。单采血液成分术制品通常含有淋巴细胞,包括t细胞,单核细胞,粒细胞,b细胞,其他有核白细胞,红细胞和血小板。在一个方面,可以洗涤通过单采血液成分术采集收集的细胞以除去血浆级分,并且任选地将细胞置于合适的缓冲液或培养基中以用于随后的加工步骤。在一个实施方案中,用磷酸缓冲盐水(pbs)洗涤细胞。在备选实施方案中,洗涤溶液缺乏钙并且可能缺少镁,或者可能缺少许多(如果不是全部)二价阳离子。
在不存在钙的情况下的初始活化步骤可导致放大的活化。如本领域普通技术人员将容易理解的,洗涤步骤可以通过本领域技术人员已知的方法来实现,例如通过使用半自动化的“流通”离心机(例如,cobe2991细胞处理器,baxtercytomate或haemoneticscellsaver5)根据生产商的说明书进行。洗涤后,细胞可以重新悬浮在各种生物相容的缓冲液中,例如无ca,无mg的pbs,plasmalytea或其他含或不含缓冲剂的盐溶液。或者,可以除去单采血液成分术样品的不期望的组分,并将细胞直接重悬于培养基中。
一方面,通过裂解红细胞并消耗单核细胞,例如通过percolltm梯度离心或通过逆流离心淘析从外周血淋巴细胞中分离t细胞。
本文描述的方法可以包括例如使用例如本文所描述的负选择技术来选择免疫效应细胞的特定亚群,例如作为t调节细胞消耗的群体的t细胞——cd25+消耗的细胞。在一些实施方案中,t调节性消耗细胞的群体含有少于30%,25%,20%,15%,10%,5%,4%,3%,2%,1%的cd25+细胞。
在一个实施方案中,使用抗cd25抗体或其片段,或cd25结合配体,例如il-2,从群体中除去t调节细胞,例如cd25+t细胞。在一个实施方案中,抗cd25抗体或其片段或cd25结合配体与基质(例如珠粒)缀合,或者另外包被在基质(例如珠粒)上。在一个实施方案中,抗cd25抗体或其片段与本文所述的基质缀合。
在一个实施方案中,使用来自miltenyitm的cd25消耗试剂从群体中除去t调节细胞,例如cd25+t细胞。在一个实施方案中,细胞与cd25消耗试剂的比例为1e7细胞对20ul,或1e7细胞对15μl,或1e7细胞对10ul,或1e7细胞对5ul,或1e7细胞对2.5ul,或1e7细胞对1.25ul。在一个实施方案中,例如对于t调节细胞,例如cd25+消耗,使用大于5亿个细胞/ml。另一方面,使用6,7,8,或9亿个细胞/ml的细胞浓度。
在一个实施方案中,要消耗的免疫效应细胞群体包括约6x109个cd25+t细胞。在其他方面,要消耗的免疫效应细胞群体包括约1x109至1x1010个cd25+t细胞,以及其间的任何整数值。在一个实施方案中,所产生的t调节性消耗细胞群体具有2x109个t调节细胞,例如cd25+细胞或更少(例如,1x109,5x108,1x108,5x107,1x107,或更少的cd25+细胞)。
在一个实施方案中,使用具有消耗管设置(例如管道162-01)的clinimac系统从群体中除去t调节细胞,例如cd25+细胞。在一个实施方案中,clinimac系统在诸如例如depletion2.1的消耗设置上运行。
不希望被特定理论束缚,在单采血液成分术前或在制备表达car的细胞产物的过程中降低免疫细胞的负调节剂的水平(例如,减少不需要的免疫细胞,例如treg细胞的数量),显著降低受试者复发的风险。例如,消耗treg细胞的方法是本领域已知的。降低treg细胞的方法包括但不限于环磷酰胺,抗gitr抗体(本文所述的抗gitr抗体),cd25-消耗,mtor抑制剂及其组合。
在一些实施方案中,制备方法包括在制备表达car的细胞之前减少(例如,消耗)treg细胞的数目。例如,制造方法包括将样品(例如,单采血液成分术样品)与抗gitr抗体和/或抗-cd25抗体(或其片段,或cd25结合配体)接触,例如以在制备car表达细胞(例如,t细胞,nk细胞)产物前消耗treg细胞。
不希望被特定理论束缚,在单采血液成分术前或在制备表达car的细胞产物的过程中降低免疫细胞的负调节子的水平(例如,减少不需要的免疫细胞,例如treg细胞的数量)可以降低受试者复发的风险。在一个实施方案中,在收集用于car表达细胞产物制造的细胞之前,用一种或多种减少treg细胞的疗法对受试者进行预治疗,从而降低受试者对car表达细胞治疗复发的风险。在一个实施方案中,减少treg细胞的方法包括但不限于向受试者施用环磷酰胺,抗gitr抗体,cd25消耗或其组合中的一种或多种。在一个实施方案中,减少treg细胞的方法包括但不限于向受试者施用环磷酰胺,抗gitr抗体,cd25-消耗,mtor抑制剂或其组合中的一种或多种。施用环磷酰胺,抗gitr抗体,cd25消耗或其组合中的一种或多种可以在表达car的细胞产物的输注之前,期间或之后发生。施用环磷酰胺,抗gitr抗体,cd25消耗,mtor抑制剂或其组合中的一种或多种可以在表达car的细胞产物的输注之前,期间或之后进行。
在一些实施方案中,制备方法包括在制备表达car的细胞之前减少(例如,消耗)treg细胞的数目。例如,制造方法包括在制备car表达细胞(例如,t细胞,nk细胞)产物之前,将样品(例如,单采血液成分术样品)与抗gitr抗体和/或抗-cd25抗体(或其片段,或cd25结合配体)接触,例如以消耗treg细胞。
在一个实施方案中,在收集用于car表达细胞产物制造的细胞之前,将受试者用环磷酰胺预治疗,从而降低受试者对car表达细胞治疗(例如ctl019治疗)复发的风险。在一个实施方案中,在收集用于表达car的细胞(例如,t细胞或nk细胞)产物制造的细胞之前,用抗gitr抗体预治疗受试者,从而降低受试者对car表达细胞治疗复发的风险。
在一个实施方案中,修饰car表达细胞(例如,t细胞,nk细胞)制备方法以在制备表达car的细胞(例如,t细胞,nk细胞)产物(例如ctl019产物)之前消耗treg细胞。在一个实施方案中,在制备表达car的细胞(例如t细胞,nk细胞)产物(例如ctl019产物)之前,使用cd25消耗来消耗treg细胞。
在一个实施方案中,要除去的细胞群体既不是调节性t细胞也不是肿瘤细胞,而是否则负面影响cart细胞的扩增和/或功能的细胞,例如,表达cd14,cd11b,cd33,cd15或潜在免疫抑制细胞表达的其他标志物的细胞。在一个实施方案中,可以设想此类细胞与调节性t细胞和/或肿瘤细胞同时去除,或者在所述消耗后除去,或者以另一顺序去除。
本文描述的方法可以包括多于一个选择步骤,例如多于一个消耗步骤。可以通过负选择来富集t细胞群体,例如,使用针对针对负选择细胞特有的表面标志物的抗体的组合。一种方法是通过负磁性免疫粘附或流式细胞术进行的细胞分选和/或选择,其使用针对存在于负选择的细胞上的细胞表面标志物的单克隆抗体的混合物。例如,为了通过负选择来富集cd4+细胞,单克隆抗体混合物可以包括针对cd14,cd20,cd11b,cd16,hla-dr和cd8的抗体。
本文所述的方法还可以包括从表达肿瘤抗原的群体,例如,不包含cd25,例如cd19,cd30,cd38,cd123,cd20,cd14或cd11b的肿瘤抗原的群体中移除细胞,从而提供t调节性消耗的,例如cd25+消耗的群体,以及适合于表达car,例如本文所述的car的肿瘤抗原消耗的细胞。在一个实施方案中,肿瘤抗原表达细胞与t调节性,例如cd25+细胞同时除去。例如,可以将抗cd25抗体或其片段和抗肿瘤抗原抗体或其片段连接到相同的基质,例如珠粒上,所述基质可用于除去细胞或抗cd25抗体或其片段,或抗肿瘤抗原抗体或其片段可以连接到分离的珠粒上,其混合物可用于除去细胞。在其他实施方案中,t调节细胞例如cd25+细胞的去除以及肿瘤抗原表达细胞的去除是顺序的,并且可以以任何顺序发生。
还提供了包括从表达检查点抑制剂(例如本文所述的检查点抑制剂)的群体中除去细胞(例如pd1+细胞,lag3+细胞和tim3+细胞中的一种或多种)的方法,从而提供t调节性消耗的,例如cd25+消耗的细胞和检查点抑制剂消耗的细胞,例如pd1+,lag3+和/或tim3+消耗的细胞群体。示例性检查点抑制剂包括pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfr(例如tgfrβ),例如,如本文所述。在一个实施方案中,检查点抑制剂表达细胞与t调节(例如cd25+细胞)同时除去。例如,可以将抗cd25抗体或其片段和抗检测点抑制剂抗体或其片段连接到可用于除去细胞的相同珠粒上,或抗cd25抗体,或其片段,以及抗检测点抑制剂抗体或其片段可以连接到分离的珠粒上,其混合物可用于除去细胞。在其他实施方案中,除去t调节细胞,例如cd25+细胞,以及除去表达抑制剂的细胞是顺序的,并且可以以任何顺序发生。
本文描述的方法可以包括正选择步骤。例如,可以通过与抗cd3/抗-cd28(例如3×28)缀合的珠粒,例如
cd8+t细胞捕获的效率。因此,通过简单地缩短或延长t细胞与cd3/cd28珠粒结合的时间和/或通过增加或减少珠粒与t细胞的比例(如本文进一步描述),在培养开始时或在该过程的其他时间点可以优先选择支持或反对t细胞的亚群。此外,通过增加或减少珠粒或其他表面上的抗cd3和/或抗-cd28抗体的比例,可以在培养起始时或在其它期望的时间点优先选择支持或反对的t细胞的亚群。
在一个实施方案中,可以选择表达ifn-γ,tnfα,il-17a,il-2,il-3,il-4,gm-csf,il-10,il-13,粒酶b,穿孔蛋白或其它合适的分子,例如其它细胞因子中的一种或多种的t细胞群体。用于筛选细胞表达的方法可以例如通过pct公开号wo2013/126712中描述的方法来确定。
为了通过正或负选择分离所需细胞群,可以改变细胞和表面(例如颗粒如珠粒)的浓度。在某些方面,可能需要显著降低其中珠粒和细胞混合在一起的体积(例如,增加细胞的浓度),以确保细胞和珠粒的最大接触。例如,一方面,使用浓度为100亿细胞/ml,90亿/ml,80亿/ml,70亿/ml,60亿/ml或50亿/ml的浓度。一方面,使用浓度为10亿个细胞/ml。在一个方面,使用7500万,8000万,8500万,9000万,9500万或1亿个细胞/ml的细胞浓度。在另外的方面,可以使用1.25亿或1.5亿个细胞/ml的浓度。
使用高浓度可导致细胞产量的增加,细胞活化和细胞扩增。此外,使用高细胞浓度允许更有效地捕获可能弱表达目的靶抗原的细胞,如cd28阴性t细胞或从存在许多肿瘤细胞的样品(例如,白血病,肿瘤组织等)中捕获所述弱表达目的靶抗原的细胞。这样的细胞群可能具有治疗价值,并且可以希望获得。例如,使用高浓度的细胞允许更有效地选择通常具有较弱cd28表达的cd8+t细胞。
在相关方面,可能需要使用较低浓度的细胞。通过显著稀释t细胞和表面(例如颗粒如珠粒)的混合物,颗粒和细胞之间的相互作用被最小化。这选择表达大量要结合到颗粒上的所需抗原的细胞。例如,cd4+t细胞表达较高水平的cd28,并在稀释浓度比cd8+t细胞更有效地捕获。一方面,所用细胞的浓度为5x106/ml。在其它方面,所使用的浓度可以为约1x105/ml至1x106/ml,和其间的任何整数值。
在其他方面,细胞可以在2-10℃或室温下以不同的速度在旋转器上温育不同长度的时间。
在一个实施方案中,群体的多个免疫效应细胞不表达双甘油激酶(dgk),例如是dgk缺陷型。在一个实施方案中,群体的多个免疫效应细胞不表达ikaros,例如是ikaros缺陷型。在一个实施方案中,群体的多个免疫效应细胞不表达dgk和ikaros,例如是dgk和ikaros缺陷的。
用于刺激的t细胞也可以在洗涤步骤后冷冻。希望不受理论束缚,冻结和随后的解冻步骤通过去除细胞群体中的粒细胞和某种程度的单核细胞来提供更均匀的产物。在去除血浆和血小板的洗涤步骤之后,细胞可以悬浮在冷冻溶液中。虽然本领域已知许多冷冻溶液和参数是已知的,并且在本文中将是有用的,但是一种方法涉及使用含有20%dmso和8%人血清白蛋白的pbs,或含有10%葡聚糖40和5%葡萄糖,20%人血清白蛋白和7.5%dmso,或31.25%plasmalyte-a,31.25%葡萄糖5%,0.45%nacl,10%葡聚糖40和5%葡萄糖,20%人血清白蛋白和7.5%dmso或其他合适的含有例如hespan和plasmalytea的细胞冷冻介质的细胞培养基,然后将细胞以每分钟1°的速度冷冻至-80℃,并储存在液氮储存罐的气相中。可以使用其他控制冷冻的方法,也可以在-20℃或液氮中立即进行不受控制的冷冻。
在某些方面,如本文所述将冷冻保存的细胞解冻和洗涤,并在活化前使用本发明的方法在室温下静置1小时。
在本发明的上下文中还考虑到在可能需要本文描述的扩增的细胞之前的时间段收集来自受试者的血液样品或单采血液成分术制品。因此,可以在必要的任何时间点收集要扩增的细胞来源,并且分离和冷冻所需的细胞,例如t细胞,用于随后用于任何数量的疾病或病症的免疫效应细胞疗法中,所述疾病或病症,如本文所述的那些疾病或病症将从免疫效应细胞疗法中获益。在一个方面,血液样品或单采血液成分术样品从通常健康的受试者取得。在一个方面,血液样品或单采血液成分术样品从通常健康的受试者取得,所述受试者有患病的风险,但尚未患病,感兴趣的细胞被分离并冷冻供以后使用。在某些方面,t细胞可以在以后的时间被扩增,冷冻和使用。在某些方面,如本文所述但在任何治疗之前,在诊断特定疾病后不久从患者收集样品。在另一方面,在任何数量的相关治疗方式之前,从血液样品或受试者的单采血液成分术样品分离细胞,所述治疗方式包括但不限于用活性剂诸如那他珠单抗,依非珠单抗,抗病毒剂,化学疗法,辐射,免疫抑制剂,如环孢菌素,硫唑嘌呤,甲氨蝶呤,霉酚酸酯和fk506,抗体或其他免疫消蚀剂如campath,抗cd3抗体,环磷酰胺,氟达拉滨,环孢菌素,fk506,雷帕霉素,霉酚酸,类固醇,fr901228和辐射进行治疗。
在本发明的另一方面,t细胞是直接在治疗后从患者获得的,所述治疗给受试者留下功能性t细胞。在这方面,已经观察到,在某些癌症治疗之后,特别是用破坏免疫系统的药物治疗不久之后,在患者通常正在从治疗中恢复的时期内,获得的t细胞的质量可能是最佳的或者其离体扩增的能力得到改善。同样,在使用本文所述的方法的离体操作之后,这些细胞可能处于用于增强移植和体内扩增的优选状态。因此,在本发明的上下文中,考虑在该恢复期期间收集血细胞,包括造血谱系的t细胞,树突状细胞或其他细胞。此外,在某些方面,动员(例如,使用gm-csf动员)和调节方案可以用于在受试者中产生一种病症,其中特定细胞类型的再增殖,再循环,再生和/或扩增是有利的,特别是在治疗后限定的时间窗口内。说明性细胞类型包括免疫系统的t细胞,b细胞,树突细胞和其他细胞。
在一个实施方案中,表达car分子,例如本文所述的car分子的免疫效应细胞从已经接受低的免疫增强剂量的mtor抑制剂的受试者获得。在一个实施方案中,在足够的时间之后或在充足剂量的低的免疫增强剂量的mtor抑制剂之后收获待工程化以表达car的免疫效应细胞(例如,t细胞)的群体,使得已经将受试者中或从受试者收获的pd1阴性免疫效应细胞(例如,t细胞)的水平或pd1阴性免疫效应细胞(例如t细胞)/pd1阳性免疫效应细胞(例如t细胞)在比例至少暂时增加了。
在其它实施方案中,具有或将被工程化以表达car的免疫效应细胞(例如t细胞)的群体可以通过与一定量的mtor抑制剂接触离体处理,所述mtor抑制剂增加pd1阴性免疫效应细胞例如t细胞的数量,或增加pd1阴性免疫效应细胞(例如t细胞)/pd1阳性免疫效应细胞(例如t细胞)的比例。
认识到本申请的方法可以利用包含5%或更少,例如2%人ab血清的培养基条件,并且使用已知的培养基条件和组合物,例如smithetal.,“exvivoexpansionofhumantcellsforadoptiveimmunotherapyusingthenovelxeno-freectsimmunecellserumreplacement”clinical&translationalimmunology(2015)4,e31;doi:10.1038/cti.2014.31中描述的那些。
在一个实施方案中,本申请的方法可以利用包含无血清培养基的培养基条件。在一个实施方案中,无血清培养基是optmizercts(lifetech),immunocultxf(stemcelltechnologies),cellgro(cellgenix),texmacs(miltenyi),stemline(sigma),xvivo15(lonza),primexv(irvinescientific),或stemxvivo(randdsystems)。无血清培养基可补充来自lifetech的血清替代品如icsr(免疫细胞血清替代品)。血清替代品(例如,icsr)的水平可以是例如至多5%,例如约1%,2%,3%,4%或5%。
在一个实施方案中,t细胞群体是缺乏二甘油激酶(dgk)的。dgk缺陷型细胞包括不表达dgkrna或蛋白质或具有降低或抑制的dgk活性的细胞。可通过遗传方法产生dgk缺陷细胞,例如,施用rna干扰剂,例如sirna,shrna,mirna,以减少或防止dgk表达。或者,通过用本文所述的dgk抑制剂处理可以产生dgk缺陷细胞。
在一个实施方案中,t细胞群体为ikaros缺陷型。ikaros缺陷型细胞包括不表达ikarosrna或蛋白质的细胞,或具有降低或抑制的ikaros活性的细胞,ikaros缺陷型细胞可以通过遗传方法产生,例如,施用rna干扰剂,例如sirna,shrna,mirna,以减少或防止ikaros表达。或者,ikaros缺陷型细胞可以通过用ikaros抑制剂例如来那度胺处理来产生。
在实施方案中,t细胞群体是dgk缺陷型的,并且ikaros缺陷型,例如不表达dgk和ikaros,或已经减少或抑制dgk和ikaros活性。可以通过本文所述的任何方法产生这样的dgk和ikaros缺陷型细胞。
在一个实施方案中,从受试者获得nk细胞。在另一个实施方案中,nk细胞是nk细胞系,例如nk-92细胞系(conkwest)。
同种异体car
在本文所述的实施方案中,免疫效应细胞可以是同种异体免疫效应细胞,例如t细胞或nk细胞。例如,细胞可以是同种异体t细胞,例如缺乏功能性t细胞受体(tcr)和/或人白细胞抗原(hla)表达的同种异体t细胞,例如hlai类和/或hlaii类。
缺乏功能性tcr的t细胞可以例如被工程化为使得其在其表面上不表达任何功能性tcr,被工程化为使得其不表达包含功能性tcr的一个或多个亚基(例如,经工程化使其不表达(或表现出降低的表达)tcrα,tcrβ,tcrγ,tcrδ,tcrε和/或tcrζ)或被工程化,使得其在其表面上产生非常少的功能性tcr。或者,t细胞可以表达实质上受损的tcr,例如通过tcr的一个或多个亚基的突变或截短形式的表达。术语“实质上受损的tcr”是指该tcr不会在宿主中引起不利的免疫反应。
本文描述的t细胞可以例如被工程化,使得其表面上不表达功能性hla。例如,本文描述的t细胞可以进行工程化,使得细胞表面表达hla,例如hla1类和/或hlaii类被下调。在一些实施方案中,hla的下调可以通过减少或消除β-2微球蛋白(b2m)的表达来实现。
在一些实施方案中,t细胞可能缺乏功能性tcr和功能性hla,例如hlai类和/或hlaii类。
缺乏功能性tcr和/或hla表达的修饰的t细胞可以通过任何合适的方法获得,包括tcr或hla的一个或多个亚基的敲除或敲减。例如,t细胞可以包括使用sirna,shrna,聚集的规则间隔的短回文重复(crispr),转录活化子样效应核酸酶(talen)或锌指内切核酸酶(zfn)敲减tcr和/或hla。
在一些实施方案中,同种异体细胞可以是不表达或以低水平表达(例如,通过本文所述的任何方法)抑制性分子的细胞。例如,细胞可以是不表达或以低水平表达抑制性分子的细胞,例如其可以降低car表达细胞引起免疫效应应答的能力。抑制性分子的实例包括pd1,pd-l1,pd-l2,ctla4,tim3,ceacam例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfr(例如tgfrβ)。对抑制性分子的抑制(例如通过dna,rna或蛋白质水平上的抑制)可以优化car表达细胞的性能。在实施方案中,可以使用如本文所述的抑制性核酸,例如抑制性核酸,例如dsrna,例如sirna或shrna,聚集的规则间隔的短回文重复(crispr),转录活化子样效应核酸酶(talen)或锌指内切核酸酶(zfn)。
sirna和shrna抑制tcr或hla
在一些实施方案中,可以在细胞如t细胞中使用靶向编码tcr和/或hla的核酸的sirna或shrna和/或本文所述的抑制性分子来抑制tcr表达和/或hla表达,所述抑制性分子为例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfrβ)。
用于sirna和shrna以及示例性shrna的表达系统描述于例如2015年3月13日提交的国际申请wo2015/142675的第649和650段,其全部内容通过引用并入本文。
crispr抑制tcr或hla
本文所用的“crispr”或“crispr至tcr和/或hla”或“crispr抑制tcr和/或hla”是指一组聚集的规则间隔的短回文重复序列,或包含这样一组重复序列的系统。本文所用的“cas”是指crispr相关蛋白。“crispr/cas”系统是指crispr和cas衍生的系统,其可用于在细胞,如t细胞中沉默或突变tcr和/或hla基因和/或本文所述的抑制性分子(例如,pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfrβ)。
crispr/cas系统及其用途描述于例如2015年3月13日提交的国际申请wo2015/142675的第651-658段中,其全部内容通过引用并入本文。
talen抑制tcr和/或hla
“talen”或“针对hla和/或tcr的talen”或“talen抑制hla和/或tcr”是指一种人工核酸酶:转录活化子样效应核酸酶,其可用于在细胞中,例如t细胞中编辑hla和/或tcr基因的,和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷,和tgfrβ)。
talen及其用途描述于例如2015年3月13日提交的国际申请wo2015/142675的第659-665段,其全部内容通过引用并入本文。
tcr锌指核酸酶抑制hla和/或tcr
“zfn”或“锌指核酸酶”或“针对hla和/或tcr的zfn”或“zfn抑制hla和/或tcr”是指锌指核酸酶,其是一种人工核酸酶,可用于编辑细胞中,例如t细胞中hla和/或tcr基因,和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfrβ)。
zfn及其用途描述于例如2015年3月13日提交的国际申请wo2015/142675的第666-671段,其全部内容通过引用并入本文。
端粒酶表达
端粒在体细胞持久性中起关键作用,其长度由端粒酶(tert)维持。cll细胞中的端粒长度可能非常短(rothetal.,“significantlyshortertelomeresint-cellsofpatientswithzap-70+/cd38chroniclymphocyticleukaemia”britishjournalofhaematology,143,383-386.,august282008),并且在制造的car表达细胞(例如cart19细胞)中可能更短,限制了其在过继转移到患者之后的扩增潜力。端粒酶表达可以从复制性消耗中拯救car表达细胞。
虽然不希望受任何特定理论的束缚,但在一些实施方案中,由于t细胞中缩短的端粒,治疗性t细胞在患者中具有短期持续性;因此,用端粒酶基因转染可以延长t细胞的端粒,并改善患者中t细胞的持久性。参见carljune,“adoptivetcelltherapyforcancerintheclinic”,journalofclinicalinvestigation,117:1466-1476(2007)。因此,在一个实施方案中,免疫效应细胞,例如t细胞,异位表达端粒酶亚基,例如端粒酶的催化亚基,例如tert,例如htert。在一些方面,本公开提供了产生car表达细胞的方法,其包括使细胞与编码端粒酶亚基(例如端粒酶的催化亚基,例如tert,例如htert)的核酸接触。细胞可以在与编码car的构建体接触之前,同时或之后与核酸接触。
端粒酶表达可能是稳定的(例如,核酸可以整合入细胞的基因组)或短暂的(例如,核酸不整合,并且表达在一段时间后,例如几天后下降)。通过用编码端粒酶亚基和可选择标记的dna转染或转导细胞,并选择稳定的整合体,可以实现稳定的表达。或者或组合地,可以通过位点特异性重组,例如使用cre/lox或flp/frt系统来实现稳定表达。
瞬时表达可能涉及用核酸例如dna或rna如mrna转染或转导。在一些实施方案中,瞬时mrna转染避免了有时与用tert稳定转染相关的遗传不稳定性。外源端粒酶活性的瞬时表达描述于例如国际申请wo2014/130909中,其通过引用整体并入本文。在实施方案中,根据由modernatherapeutics商业化的信使rnatherapeuticstm平台进行端粒酶亚基的基于mrna的转染。例如,该方法可以是美国专利号8710200,8822663,8680069,8754062,8664194,或8680069中描述的方法。
在一个实施方案中,htert具有genbank蛋白idaac51724.1的氨基酸序列(meyersonetal.,“hest2,theputativehumantelomerasecatalyticsubunitgene,isup-regulatedintumorcellsandduringimmortalization”cellvolume90,issue4,22august1997,pages785–795):
mpraprcravrsllrshyrevlplatfvrrlgpqgwrlvqrgdp
aafralvaqclvcvpwdarpppaapsfrqvsclkelvarvlqrlcergaknvlafgfalldgarggppeafttsvrsylpntvtdalrgsgawglllrrvgddvlvhllarcalfvlvapscayqvcgpplyqlgaatqarppphasgprrrlgcerawnhsvreagvplglpapgarrrggsasrslplpkrprrgaapepertpvgqgswahpgrtrgpsdrgfcvvsparpaeeatslegalsgtrhshpsvgrqhhagppstsrpprpwdtpcppvyaetkhflyssgdkeqlrpsfllsslrpsltgarrlvetiflgsrpwmpgtprrlprlpqrywqmrplflellgnhaqcpygvllkthcplraavtpaagvcarekpqgsvaapeeedtdprrlvqllrqhsspwqvygfvraclrrlvppglwgsrhnerrflrntkkfislgkhaklslqeltwkmsvrgcawlrrspgvgcvpaaehrlreeilakflhwlmsvyvvellrsffyvtettfqknrlffyrksvwsklqsigirqhlkrvqlrelseaevrqhrearpalltsrlrfipkpdglrpivnmdyvvgartfrrekraerltsrvkalfsvlnyerarrpgllgasvlglddihrawrtfvlrvraqdpppelyfvkvdvtgaydtipqdrlteviasiikpqntycvrryavvqkaahghvrkafkshvstltdlqpymrqfvahlqetsplrdavvieqssslneassglfdvflrfmchhavrirgksyvqcqgipqgsilstllcslcygdmenklfagirrdglllrlvddfllvtphlthaktflrtlvrgvpeygcvvnlrktvvnfpvedealggtafvqmpahglfpwcgllldtrtlevqsdyssyartsirasltfnrgfkagrnmrrklfgvlrlkchslfldlqvnslqtvctniykilllqayrfhacvlqlpfhqqvwknptfflrvisdtaslcysilkaknagmslgakgaagplpseavqwlchqafllkltrhrvtyvpllgslrtaqtqlsrklpgttltaleaaanpalpsdfktild(seqidno:108)
在一个实施方案中,htert具有与seqidno:108的序列至少80%,85%,90%,95%,96%,97%,98%,或99%同一性的序列。在一个实施方案中,htert具有seqidno:108的序列。在一个实施方案中,htert包含在n末端,c末端或这两端的缺失(例如,不超过5,10,15,20或30个氨基酸)。在一个实施方案中,htert包含n-末端,c-末端或这两端的转基因氨基酸序列(例如,不超过5,10,15,20或30个氨基酸)。
在一个实施方案中,htert由genbank登录号af018167的核酸序列编码(meyersonetal.,“hest2,theputativehumantelomerasecatalyticsubunitgene,isup-regulatedintumorcellsandduringimmortalization”cellvolume90,issue4,22august1997,pages785–795):
在一个实施方案中,htert由具有与seqidno:23的序列有至少80%,85%,90%,95%,96%,97%,98%,或99%同一性的序列的核酸编码。在一个实施方案中,htert由seqidno:23的核酸编码。
嵌合抗原受体(car)
本发明提供免疫效应细胞(例如,t细胞,nk细胞),其被工程化以包含将免疫效应细胞引导至癌症的一种或多种car。这通过对癌症相关抗原特异性的car上的抗原结合结构域来实现。有两类可以被本文所述的car靶向的癌症相关抗原(肿瘤抗原):(1)在癌细胞表面上表达的癌症相关抗原;和(2)本身是细胞内的癌症相关抗原,然而,这种抗原(肽)的片段通过mhc(主要组织相容性复合体)呈递在癌细胞的表面上。
因此,例如通过本文所述的方法获得的免疫效应细胞可被工程化以含有靶向下列癌症相关抗原(肿瘤抗原)之一的car:cd19,cd123,cd22,cd30,cd171,cs-1,cll-1,cd33,egfrviii,gd2,gd3,bcma,tnag,psma,ror1,flt3,fap,tag72,cd38,cd44v6,cea,epcam,b7h3,kit,il-13ra2,间皮素,il-11ra,psca,vegfr2,lewisy,cd24,pdgfr-β,prss21,ssea-4,cd20,叶酸受体α,erbb2(her2/neu),muc1,egfr,ncam,prostase,pap,elf2m,肝配蛋白b2,igf-i受体,caix,lmp2,gp100,bcr-abl,酪氨酸酶,epha2,岩藻糖基gm1,sle,gm3,tgs5,hmwmaa,邻乙酰基-gd2,叶酸受体β,tem1/cd248,tem7r,cldn6,tshr,gprc5d,cxorf61,cd97,cd179a,alk,聚唾液酸,plac1,globoh,ny-br-1,upk2,havcr1,adrb3,panx3,gpr20,ly6k,or51e2,tarp,wt1,ny-eso-1,lage-1a,legumain,hpve6,e7,mage-a1,magea1,etv6-aml,精子蛋白17,xage1,tie2,mad-ct-1,mad-ct-2,fos相关抗原1,p53,p53突变体,prostein,存活蛋白和端粒酶,pcta-1/galectin8,melana/mart1,ras突变体,htert,肉瘤易位断点,ml-iap,erg(tmprss2ets融合基因),na17,pax3,雄激素受体,细胞周期蛋白b1,mycn,rhoc,trp-2,cyp1b1,boris,sart3,pax5,oy-tes1,lck,akap-4,ssx2,rage-1,人端粒酶逆转录酶,ru1,ru2,肠羧酸酯酶和muthsp70-2。
双特异性car
在一个实施方案中,多特异性抗体分子是双特异性抗体分子。双特异性抗体对不超过两种抗原具有特异性。双特异性抗体分子的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。在一个实施方案中,第一和第二表位在相同的抗原上,例如相同的蛋白(或多聚体蛋白的亚基)上。在一个实施方案中,第一和第二表位重叠。在一个实施方案中,第一和第二表位不重叠。在一个实施方案中,第一和第二表位在不同的抗原上,例如不同的蛋白质(或多聚体蛋白质的不同亚基)上。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列和对第二表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的半抗体和对第二表位具有结合特异性的半抗体。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的半抗体或其片段和对第二表位具有结合特异性的半抗体或其片段。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的scfv或其片段,和对第二表位具有结合特异性的scfv或其片段。
在某些实施方案中,抗体分子是多特异性(例如,双特异性或三特异性)抗体分子。用于产生双特异性或异二聚体抗体分子以及双特异性抗体分子的各种构型的方案描述于例如2015年3月13日提交的wo2015/142675的第455-458段中,其全部内容通过引用并入本文。
在一个方面,双特异性抗体分子的特征在于第一免疫球蛋白可变结构域序列,例如scfv,其对cd19具有结合特异性,例如包含本文所述的scfv,或包含来自本文所述的scfv的轻链cdr和/或重链cdr以及对不同抗原上的第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。
嵌合tcr
一方面,本发明的抗体和抗体片段(例如,cd19抗体和片段)可以被移植到t细胞受体(“tcr”)链,例如tcrα或tcrβ链的一个或多个恒定结构域,以产生嵌合tcr。不受理论的束缚,据信嵌合tcr将在抗原结合时通过tcr复合体发出信号。例如,本文公开的scfv可以移植到例如tcr链,例如tcrα链和/或tcrβ链的恒定结构域,例如,细胞外恒定结构域的至少一部分,跨膜结构域和胞质结构域。作为另一个实例,抗体片段,例如本文所述的vl结构域可以移植到tcrα链的恒定结构域,并且抗体片段,例如本文所述的vh结构域可以移植到tcrβ链的恒定结构域(或者,vl结构域可以被移植到tcrβ链的恒定结构域,并且vh结构域可以被移植到tcrα链上)。作为另一个实例,抗体或抗体片段的cdr可以移植到tcrα和/或β链中以产生嵌合tcr。例如,本文公开的lcdr可以移植到tcrα链的可变结构域中,并且本文公开的hcdr可以移植到tcrβ链的可变结构域,反之亦然。这样的嵌合tcr可以例如通过本领域已知的方法产生(例如,willemsenraetal,genetherapy2000;7:1369–1377;zhangtetal,cancergenether2004;11:487–496;aggenetal,genether.2012apr;19(4):365-74)。
非抗体支架
在实施方案中,抗原结合结构域包含非抗体支架,例如纤连蛋白,锚蛋白,结构域抗体,脂质运载蛋白,小模块免疫药物,maxybody,蛋白a或affilin。非抗体支架具有结合细胞上的靶抗原的能力。在实施方案中,抗原结合结构域是在细胞上表达的天然存在的蛋白质的多肽或其片段。在一些实施方案中,抗原结合结构域包含非抗体支架。可以使用多种非抗体支架,只要所得多肽包含至少一个特异性结合靶细胞上的靶抗原的结合区域即可。
非抗体支架包括:纤连蛋白(novartis,ma),锚蛋白(molecularpartnersag,苏黎世,瑞士),结构域抗体(domantis,ltd.,cambridge,ma和ablynxnv,zwijnaarde,belgium),脂质运载蛋白(pierisproteolabag,freising,germany),小模块免疫药物(trubionpharmaceuticalsinc.,seattle,wa),maxybodies(avidia,inc.,mountainview,ca),蛋白a(affibodyag,sweden)和affilin(γ-晶状体蛋白或泛素)(scilproteinsgmbh,halle,germany)。
在一个实施方案中,抗原结合结构域包含结合靶细胞表面上的反配体的分子的胞外结构域或其反配体结合片段。
免疫效应细胞可以包含含有编码car的序列的重组dna构建体,其中car包含特异性结合肿瘤抗原,例如本文所述的肿瘤抗原的抗原结合结构域(例如,抗体或抗体片段,tcr或tcr片段)和胞内信号结构域。胞内信号结构域可以包含共刺激信号结构域和/或主要信号结构域,例如ζ链。如其他地方所述,本文所述的方法可包括用编码car,例如本文描述的car的核酸转导细胞,例如来自t调节性消耗细胞群体的细胞。
在具体方面,car包含scfv结构域,其中scfv之前可以是任选的如seqidno:1中提供的前导序列,然后是任选的如seqidno:2或seqidno:36或seqidno:38中提供的铰链序列,如seqidno:6中提供的跨膜区,包含seqidno:7或seqidno:16的胞内信号结构域和包括seqidno:9或seqidno:10的cd3ζ序列,例如,其中结构域相邻并且在相同可读框内以形成单个融合蛋白。
一方面,示例性car构建体包含任选的前导序列(例如,本文所述的前导序列),细胞外抗原结合结构域(例如本文所述的抗原结合结构域),铰链(例如本文所述的铰链区),跨膜结构域(例如,本文所述的跨膜结构域)和细胞内刺激结构域(例如,本文所述的细胞内刺激结构域)。一方面,示例性car构建体包含任选的前导序列(例如,本文所述的前导序列),细胞外抗原结合结构域(例如本文所述的抗原结合结构域),铰链(例如本文所述的铰链区),跨膜结构域(例如,本文所述的跨膜结构域),细胞内共刺激信号结构域(例如,本文所述的共刺激信号结构域)和/或细胞内主要信号结构域(例如,本文所述的主要信号结构域)。
示例性前导序列如seqidno:1提供。示例性的铰链/间隔序列如seqidno:2或seqidno:36或seqidno:38提供。示例性跨膜结构域序列如seqidno:6提供。4-1bb蛋白的胞内信号结构域的示例性序列如seqidno:7提供。cd27的胞内信号结构域的示例性序列如seqidno:16提供。示例性的cd3ζ结构域序列如seqidno:9或seqidno:10提供。
在一个方面,免疫效应细胞包含重组核酸构建体,其包含编码car的核酸分子,其中所述核酸分子包含编码抗原结合结构域的核酸序列,其中所述序列与编码胞内信号结构域的核酸序列相邻并且在相同的可读框中。可以在car中使用的示例性胞内信号结构域包括但不限于例如cd3-ζ,cd28,cd27,4-1bb等的一个或多个胞内信号结构域。在一些情况下,car可以包含cd3-ζ,cd28,4-1bb等的任何组合。
编码所需分子的核酸序列可以使用本领域已知的重组方法获得,例如通过从表达核酸分子的细胞中筛选文库,通过从已知包括该核酸分子的载体衍生出核酸分子,或通过使用标准技术从包含其的细胞和组织直接分离。或者,感兴趣的核酸可以合成,而不是克隆产生。
可以使用例如逆转录病毒或慢病毒载体构建体将编码car的核酸引入免疫效应细胞。
编码car的核酸也可以使用例如可直接转染入细胞的rna构建体引入免疫效应细胞。用于产生用于转染的mrna的方法涉及使用特别设计的引物体外转录(ivt)模板,随后加入多聚a以产生含有3'和5'非翻译序列(“utr”)的构建体(例如,本文所述的3'和/或5'utr),5'帽(例如,本文所述的5'帽)和/或内部核糖体进入位点(ires)(例如,本文所述的ires),待表达的核酸和多聚a尾,长度通常为50-2000个碱基(例如,在实施例中描述,例如seqidno:35)。如此生产的rna可以有效地转染不同种类的细胞。在一个实施方案中,模板包括car的序列。在一个实施方案中,通过电穿孔将rnacar载体转导入细胞例如t细胞中。
抗原结合结构域
一方面,多个免疫效应细胞,例如t调节性消耗细胞的群体,包括编码car的核酸,其包含靶特异性结合元件,另外被称为抗原结合结构域。结合元件的选择取决于限定靶细胞表面的配体的类型和数目。例如,可以选择抗原结合结构域以识别配体,所述配体作为与特定疾病状态相关的靶细胞上的细胞表面标志物。因此,可以充当本文所述的car中的抗原结合结构域的配体的细胞表面标志物的实例包括与病毒,细菌和寄生虫感染,自身免疫疾病和癌细胞相关的那些细胞表面标志物。
一方面,包含抗原结合结构域的car部分包含靶向肿瘤抗原,例如本文所述的肿瘤抗原的抗原结合结构域。
抗原结合结构域可以是与抗原结合的任何结构域,包括但不限于单克隆抗体,多克隆抗体,重组抗体,人抗体,人源化抗体及其功能片段,包括但不限于单结构域抗体,例如重链可变结构域(vh),轻链可变结构域(vl)和骆驼衍生的纳米抗体的可变结构域(vhh),以及本领域已知的用作抗原结合结构域的备选支架,例如重组纤连蛋白结构域,t细胞受体(tcr)或其片段,例如单链tcr等。在一些情况下,抗原结合结构域来源于与car最终将被用于其中的物种相同的物种是有益的。例如,对于在人类中使用,对于car的抗原结合结构域可能有益的是包含抗体或抗体片段的抗原结合结构域的人或人源化残基。
在一个实施方案中,抗原结合结构域包含抗cd19抗体或其片段,例如scfv。例如,抗原结合结构域包含表1中列出的可变重链和可变轻链。连接可变重链和可变轻链的接头序列可以是例如本文所述的任何接头序列,或者备选地,可以为gstsgsgkpgsgegstkg(seqidno:104)。
表1:抗cd19抗体结合结构域
表2:其他抗cd19抗体结合结构域
可以根据本公开使用任何cd19car,例如任何已知cd19car的cd19抗原结合结构域。例如,lg-740;在美国专利号8,399,645;美国专利号7,446,190;xuetal.,leuklymphoma.201354(2):255-260(2012);cruzetal.,blood122(17):2965-2973(2013);brentjensetal.,blood,118(18):4817-4828(2011);kochenderferetal.,blood116(20):4099-102(2010);kochenderferetal.,blood122(25):4129-39(2013);和16thannumeetamsocgencellther(asgct)(may15-18,saltlakecity)2013,abst10中描述的cd19car。
可以使用car表达细胞靶向的示例性靶抗原包括但不限于cd19,cd123,egfrviii,间皮素等,如例如wo2014/130635,wo2014/130657,和wo2015/090230中所述,其各自的全部内容通过引用并入本文。
在一个实施方案中,特异性结合cd19的cart细胞具有usan名称tisagenlecleucel-t。ctl019通过t细胞的基因修饰来制备,其通过用含有ef-1α启动子控制下的ctl019转基因的自失活的复制缺陷型慢病毒(lv)载体转导通过稳定插入介导。ctl019可以是转基因阳性和阴性t细胞的混合物,其基于转基因阳性t细胞的百分比递送给受试者。
在其它实施方案中,car表达细胞可以特异性结合人cd19,例如,可以包括根据wo2014/153270(通过引用并入本文)的表3的car分子或抗原结合结构域(例如,人源化抗原结合结构域)。
在其它实施方案中,car表达细胞可以特异性结合cd123,例如,可以包括根据wo2014/130635(通过引用并入本文)的表1-2的car分子(例如任何car1-car8)或抗原结合结构域,
在其它实施方案中,car表达细胞可以特异性结合egfrviii,例如可以包括根据wo2014/130657(通过引用并入本文)的表2或seqidno:11的car分子或抗原结合结构域。
在其它实施方案中,car表达细胞可以特异性结合间皮素,例如可以包括根据wo2015/090230(通过引用并入本文)的表2-3的car分子或抗原结合结构域。
在一个实施方案中,抗原结合结构域包含来自上述抗体的一个,两个,三个(例如全部三个)重链cdr:hccdr1,hccdr2和hccdr3,和/或来自上述抗体的一个,二个,三个(例如,全部三个)轻链cdr:lccdr1,lccdr2和lccdr3。在一个实施方案中,抗原结合结构域包含上文列出或描述的抗体的重链可变区和/或轻链可变区。
在一些实施方案中,肿瘤抗原是在2015年3月13日提交的国际申请wo2015/142675(其全部内容通过引用并入本文)中描述的肿瘤抗原。在一些实施方案中,肿瘤抗原选自以下一种或多种:cd19;cd123;cd22;cd30;cd171;cs-1(也称为cd2子集1,cracc,slamf7,cd319和19a24);c型凝集素样分子-1(cll-1或clecl1);cd33;表皮生长因子受体变体iii(egfrviii);神经节苷脂g2(gd2);神经节苷脂gd3(aneu5ac(2-8)aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);tnf受体家族成员b细胞成熟(bcma);tn抗原((tnag)或(galnacα-ser/thr));前列腺特异性膜抗原(psma);受体酪氨酸激酶样孤儿受体1(ror1);fms样酪氨酸激酶3(flt3);肿瘤相关糖蛋白72(tag72);cd38;cd44v6;癌胚抗原(cea);上皮细胞粘附分子(epcam);b7h3(cd276);kit(cd117);白介素-13受体亚基α-2(il-13ra2或cd213a2);间皮素;白介素11受体α(il-11ra);前列腺干细胞抗原(psca);蛋白酶丝氨酸21(睾丸素或prss21);血管内皮生长因子受体2(vegfr2);lewis(y)抗原;cd24;血小板衍生生长因子受体β(pdgfr-β);阶段特异性胚胎抗原-4(ssea-4);cd20;叶酸受体α;受体酪氨酸蛋白激酶erbb2(her2/neu);细胞表面相关的粘蛋白1(muc1);表皮生长因子受体(egfr);神经细胞粘附分子(ncam);prostase;前列腺酸性磷酸酶(pap);突变的延伸因子2(elf2m);肝配蛋白b2;成纤维细胞激活蛋白α(fap);胰岛素样生长因子1受体(igf-1受体),碳酸酐酶ix(caix);蛋白酶体(prosome,macropain)亚基,beta型,9(lmp2);糖蛋白100(gp100);由断裂簇区域(bcr)和abelson鼠白血病病毒致癌基因同源物1(abl)组成的癌基因融合蛋白(bcr-abl);酪氨酸酶;肝配蛋白a型受体2(epha2);岩藻糖基gm1;唾液酸路易斯粘附分子(sle);神经节苷脂gm3(aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);转谷氨酰胺酶5(tgs5);高分子量黑素瘤相关抗原(hmwmaa);邻乙酰gd2神经节苷脂(oacgd2);叶酸受体β;肿瘤内皮标志物1(tem1/cd248);肿瘤内皮标志物7相关的(tem7r);claudin6(cldn6);促甲状腺激素受体(tshr);g蛋白偶联受体c类5组,成员d(gprc5d);染色体x开放阅读框61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);聚唾液酸;胎盘特异性1(plac1);globohglycoceramide的六糖部分(globoh);乳腺分化抗原(ny-br-1);uroplakin2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺素受体β3(adrb3);pannexin3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合体,基因座k9(ly6k);嗅觉受体51e2(or51e2);tcrγ替代阅读框蛋白(tarp);肾母细胞瘤蛋白(wt1);癌/睾丸抗原1(ny-eso-1);癌/睾丸抗原2(lage-1a);黑素瘤相关抗原1(mage-a1);位于染色体12p的ets易位变异基因6(etv6-aml);精子蛋白17(spa17);x抗原家族,成员1a(xage1);血管生成素结合细胞表面受体2(tie2);黑色素瘤癌睾丸抗原-1(mad-ct-1);黑色素瘤癌睾丸抗原-2(mad-ct-2);fos相关抗原1;肿瘤蛋白p53(p53);p53突变体;prostein;存活蛋白;端粒酶;前列腺癌肿瘤抗原-1(pcta-1或galectin8),由t细胞1识别的黑素瘤抗原(melana或mart1);大鼠肉瘤(ras)突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;黑素瘤细胞凋亡抑制剂(ml-iap);erg(跨膜蛋白酶,丝氨酸2(tmprss2)ets融合基因);n-乙酰基葡糖胺基转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期蛋白b1;v-myc髓细胞瘤病病毒癌基因神经母细胞瘤来源的同源物(mycn);ras同源物家族成员c(rhoc);酪氨酸酶相关蛋白2(trp-2);细胞色素p4501b1(cyp1b1);ccctc-结合因子(锌指蛋白)-样(boris或印迹位点调节子的兄弟),t细胞识别的鳞状细胞癌抗原3(sart3);配对盒蛋白pax-5(pax5);proacrosin结合蛋白sp32(oy-tes1);淋巴细胞特异性蛋白酪氨酸激酶(lck);激酶锚蛋白4(akap-4);滑膜肉瘤,x断点2(ssx2);高级糖化终产物受体(rage-1);肾遍在蛋白1(ru1);肾遍在蛋白2(ru2);legumain;人乳头状瘤病毒e6(hpve6);人乳头状瘤病毒e7(hpve7);肠羧基酯酶;突变的热休克蛋白70-2(muthsp70-2);cd79a;cd79b;cd72;白细胞相关免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar或cd89);白细胞免疫球蛋白样受体亚家族a成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素结构域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);含egf样模块的粘蛋白样激素受体样2(emr2);淋巴细胞抗原75(ly75);磷脂酰肌醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);和免疫球蛋白λ样多肽1(igll1)。
在一个实施方案中,抗原结合结构域包含来自上述抗体的一个,两个,三个(例如全部三个)重链cdr:hccdr1,hccdr2和hccdr3,和/或来自上述抗体的一个,二个,三个(例如,全部三个)轻链cdr:lccdr1,lccdr2和lccdr3。在一个实施方案中,抗原结合结构域包含上文列出或描述的抗体的重链可变区和/或可变轻链区。
一方面,抗肿瘤抗原结合结构域是片段,例如单链可变片段(scfv)。一方面,如本文所述的抗癌症相关抗原结合结构域是fv,fab,a(fab')2或双功能(例如双特异性)杂交抗体(例如,lanzavecchiaetal.,eur.j.immunol.17,105(1987))。在一个方面,本发明的抗体及其片段与本文所述的癌症相关抗原结合,具有野生型或增强的亲和力。
在一些情况下,scfv可以根据本领域已知的方法制备(参见例如birdetal.,(1988)science242:423-426和hustonetal.,(1988)proc.natl.acad.sci.usa85:5879-5883)。可以通过使用柔性多肽接头将vh和vl区域连接在一起来产生scfv分子。scfv分子包含具有优化的长度和/或氨基酸组成的接头(例如,ser-gly接头)。接头长度可以极大地影响scfv的可变区域如何折叠和相互作用。事实上,如果使用短多肽接头(例如,5-10个氨基酸之间),则可防止链内折叠。还需要链间折叠以使两个可变区在一起形成功能性表位结合位点。接头取向和尺寸的实例参见例如hollingeretal.1993procnatlacad.sci.u.s.a.90:6444-6448,美国专利申请公开号2005/0100543,2005/0175606,2007/0014794,和pct公开号wo2006/020258和wo2007/024715,其通过引用并入本文。
scfv可以在其vl和vh区之间包含至少1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,25,30,35,40,45,50或更多个氨基酸残基的接头。接头序列可以包含任何天然存在的氨基酸。在一些实施方案中,接头序列包含氨基酸甘氨酸和丝氨酸。在另一个实施方案中,接头序列包含甘氨酸和丝氨酸重复序列的集合,例如(gly4ser)n,其中n是等于或大于1的正整数(seqidno:25)。在一个实施方案中,接头可以是(gly4ser)4(seqidno:27)或(gly4ser)3(seqidno:28)。接头长度的变化可能会保留或增强活性,从而在活性研究中产生出色的功效。
在另一方面,抗原结合结构域是t细胞受体(“tcr”)或其片段,例如单链tcr(sctcr)。制备此类tcr的方法是本领域已知的。参见例如willemsenraetal,genetherapy7:1369–1377(2000);zhangtetal,cancergenether11:487–496(2004);aggenetal,genether.19(4):365-74(2012)(将参考文献全部并入本文)。例如,可以改造sctcr,其含有来自通过接头(例如,柔性肽)连接的t细胞克隆的vα和vβ基因。这种方法对于本身是细胞内的癌相关靶标非常有用,然而,这种抗原(肽)的片段通过mhc呈递在癌细胞的表面上。
跨膜结构域
关于跨膜结构域,在各种实施方案中,可以将car设计为包含附着于car细胞外结构域的跨膜结构域。跨膜结构域可以包括与跨膜区相邻的一个或多个另外的氨基酸,例如与衍生跨膜的蛋白质的细胞外区域相关的一个或多个氨基酸(例如,细胞外区的1,2,3,4,5,6,7,8,9,10,多达15个氨基酸)和/或一个或多个与衍生跨膜蛋白的蛋白质的细胞内区域相关的另外的氨基酸(例如,细胞内区域的1,2,3,4,5,6,7,8,9,10,多达15个氨基酸)。在一个方面,跨膜结构域是与car的其他结构域之一相关的跨膜结构域。在一些情况下,跨膜结构域可以通过氨基酸取代来选择或修饰,以避免这些结构域与相同或不同表面膜蛋白的跨膜结构域的结合,例如使与受体复合体的其它成员的相互作用最小化。一方面,跨膜结构域能够与car表达细胞的细胞表面上的另一car同源二聚化。在不同的方面,可以修饰或取代跨膜结构域的氨基酸序列,以便与存在于相同cart中的天然结合配偶体的结合结构域的相互作用最小化。
跨膜结构域可以衍生自天然或重组来源。如果来源是天然的,则该结构域可以衍生自任何膜结合的或跨膜蛋白。在一个方面,每当car结合到靶标上时,跨膜结构域能够向细胞内结构域发信号。本发明特别有用的跨膜结构域可至少包括例如t细胞受体的α,β或ζ链,cd28,cd27,cd3ε,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154的跨膜区。在一些实施方案中,跨膜结构域可以至少包括例如kir2ds2,ox40,cd2,cd27,lfa-1(cd11a,cd18),icos(cd278),4-1bb(cd137),gitr,cd40,baffr,hvem(lightr),slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd160,cd19,il2rβ,il2rγ,il7rα,itga1,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,tnfr2,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,pag/cbp,nkg2d,nkg2c,或cd19的跨膜区。
在一些情况下,跨膜结构域可以通过铰链(例如来自人类蛋白质的铰链)连接到car的细胞外区域,例如car的抗原结合结构域。例如,在一个实施方案中,铰链可以是人ig(免疫球蛋白)铰链,例如igg4铰链或cd8a铰链。在一个实施方案中,铰链或间隔区包含(例如由...组成)seqidno:2的氨基酸序列。一方面,跨膜结构域包含(例如由...组成)seqidno:6的跨膜结构域。
一方面,铰链或间隔区包含igg4铰链。例如,在一个实施方案中,铰链或间隔区包含氨基酸序列
eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkm(seqidno:36)的铰链。在一些实施方案中,铰链或间隔区包含由以下核苷酸序列编码的铰链:
gagagcaagtacggccctccctgccccccttgccctgcccccgagttcctgggcggacccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagccggacccccgaggtgacctgtgtggtggtggacgtgtcccaggaggaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagccccgggaggagcagttcaatagcacctaccgggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaggaatacaagtgtaaggtgtccaacaagggcctgcccagcagcatcgagaaaaccatcagcaaggccaagggccagcctcgggagccccaggtgtacaccctgccccctagccaagaggagatgaccaagaaccaggtgtccctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtgctggacagcgacggcagcttcttcctgtacagccggctgaccgtggacaagagccggtggcaggagggcaacgtctttagctgctccgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgtccctgggcaagatg(seqidno:37)。
在一个方面,铰链或间隔区包括igd铰链。例如,在一个实施方案中,铰链或间隔区包含氨基酸序列
rwpespkaqassvptaqpqaegslakattapattrntgrggeekkkekekeeqeeretktpecpshtqplgvylltpavqdlwlrdkatftcfvvgsdlkdahltwevagkvptggveegllerhsngsqsqhsrltlprslwnagtsvtctlnhpslppqrlmalrepaaqapvklslnllassdppeaaswllcevsgfsppnillmwledqrevntsgfaparpppqpgsttfwawsvlrvpappspqpatytcvvshedsrtllnasrslevsyvtdh(seqidno:38)的铰链。在一些实施方案中,铰链或间隔区包含由以下核苷酸序列编码的铰链
aggtggcccgaaagtcccaaggcccaggcatctagtgttcctactgcacagccccaggcagaaggcagcctagccaaagctactactgcacctgccactacgcgcaatactggccgtggcggggaggagaagaaaaaggagaaagagaaagaagaacaggaagagagggagaccaagacccctgaatgtccatcccatacccagccgctgggcgtctatctcttgactcccgcagtacaggacttgtggcttagagataaggccacctttacatgtttcgtcgtgggctctgacctgaaggatgcccatttgacttgggaggttgccggaaaggtacccacagggggggttgaggaagggttgctggagcgccattccaatggctctcagagccagcactcaagactcacccttccgagatccctgtggaacgccgggacctctgtcacatgtactctaaatcatcctagcctgcccccacagcgtctgatggcccttagagagccagccgcccaggcaccagttaagcttagcctgaatctgctcgccagtagtgatcccccagaggccgccagctggctcttatgcgaagtgtccggctttagcccgcccaacatcttgctcatgtggctggaggaccagcgagaagtgaacaccagcggcttcgctccagcccggcccccaccccagccgggttctaccacattctgggcctggagtgtcttaagggtcccagcaccacctagcccccagccagccacatacacctgtgttgtgtcccatgaagatagcaggaccctgctaaatgcttctaggagtctggaggtttcctacgtgactgaccatt(seqidno:103)。
在一个方面,跨膜结构域可以是重组的,在这种情况下,它将主要包含疏水残基,如亮氨酸和缬氨酸。在一个方面,可以在重组跨膜结构域的每个末端发现苯丙氨酸,色氨酸和缬氨酸的三联体。
任选地,长度为2至10个氨基酸的短的寡肽或多肽接头可以形成car的跨膜结构域和胞质区之间的连接。甘氨酸-丝氨酸双联体提供了特别合适的接头。例如,一方面,接头包含ggggsggggs(seqidno:5)的氨基酸序列。在一些实施方案中,接头由
ggtggcggaggttctggaggtggaggttcc(seqidno:8)的核苷酸序列编码。
在一个方面,铰链或间隔区包含kir2ds2铰链。
胞质结构域
car的胞质结构域或区域包括胞内信号结构域。胞内信号结构域通常负责激活已经引入car的免疫细胞的至少一种正常效应子功能。
用于本文所述的car的胞内信号结构域的实例包括t细胞受体(tcr)的细胞质序列和协同作用以在抗原受体衔接后启动信号转导的共同受体,以及这些的任何衍生物或变体和具有相同功能能力的任何重组序列。
已知通过tcr单独生成的信号不足以完全激活t细胞,并且还需要次要和/或共刺激信号。因此,t细胞活化可以说是由两种不同类型的细胞质信号序列介导的:通过tcr(主要胞内信号结构域)引发抗原依赖性主要激活的那些和以抗原独立的方式起作用以提供次要或共刺激信号(次要细胞质结构域,例如共刺激结构域)的那些。
主要信号结构域以刺激方式或以抑制方式调节tcr复合体的主要激活。以刺激方式起作用的主要胞内信号结构域可能含有已知为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。
在本发明中特别有用的含有主要胞内信号结构域的itam的实例包括tcrζ,fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,dap10,dap12和cd66d的那些。在一个实施方案中,本发明的car包含胞内信号结构域,例如cd3-ζ的主要信号结构域,例如本文所述的cd3-ζ序列。
在一个实施方案中,主要信号结构域包含经修饰的itam结构域,例如与天然itam结构域相比,具有改变(例如,增加或减少)活性的突变的itam结构域。在一个实施方案中,主要信号结构域包含经修饰的含itam的主要胞内信号结构域,例如优化和/或截短的含有itam的主要胞内信号结构域。在一个实施方案中,主要信号结构域包含一个,两个,三个,四个或更多个itam基序。
共刺激信号结构域
car的胞内信号结构域本身可以包含cd3-ζ信号结构域,或者可以与在本发明的car的上下文中有用的任何其它所需的胞内信号结构域组合。例如,car的胞内信号结构域可以包含cd3ζ链部分和共刺激信号结构域。共刺激信号结构域是指包含共刺激分子的细胞内结构域的car的一部分。在一个实施方案中,细胞内结构域被设计为包含cd3-ζ的信号结构域和cd28的信号结构域。在一个方面,细胞内结构域被设计成包含cd3-ζ的信号结构域和icos的信号结构域。
共刺激分子可以是除了抗原受体或配体之外的细胞表面分子,其是淋巴细胞对抗原的有效应答所需的。这些分子的实例包括cd27,cd28,4-1bb(cd137),ox40,cd30,cd40,pd-1,icos,淋巴细胞功能相关抗原-1(lfa-1),cd2,cd7,light,nkg2c,b7-h3,和与cd83特异性结合的配体等。例如,cd27共刺激已被证明可以增强体外人类cart细胞的扩增,效应子功能和存活,并增强体内人类t细胞的持续性和抗肿瘤活性(songetal.blood.2012;119(3):696-706)。此类共刺激分子的其它实例包括cds,icam-1,gitr,baffr,hvem(lightr),slamf7,nkp80(klrf1),nkp30,nkp44,nkp46,cd160,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,nkg2d,nkg2c和pag/cbp。
car胞质部分内的细胞内信号序列可以以随机或指定的顺序相互连接。任选地,短的寡肽或多肽接头,例如长度在2至10个氨基酸(例如,2,3,4,5,6,7,8,9或10个氨基酸)之间的接头可以在细胞内信号序列之间形成连接。在一个实施方案中,甘氨酸-丝氨酸双联体可用作合适的接头。在一个实施方案中,单个氨基酸,例如丙氨酸,甘氨酸可用作合适的接头。
在一个方面,胞内信号结构域被设计为包含两个或多个,例如2,3,4,5或更多个共刺激信号结构域。在一个实施方案中,两个或多个,例如2,3,4,5或更多个共刺激信号结构域通过接头分子,例如本文所述的接头分子分离。在一个实施方案中,胞内信号结构域包含两个共刺激信号结构域。在一些实施方案中,接头分子是甘氨酸残基。在一些实施方案中,接头是丙氨酸残基。
在一个方面,胞内信号结构域被设计为包含cd3-ζ的信号结构域和cd28的信号结构域。在一个方面,胞内信号结构域被设计为包含cd3-ζ的信号结构域和4-1bb的信号结构域。一方面,4-1bb的信号结构域是seqidno:7的信号结构域。一方面,cd3-ζ的信号结构域是seqidno:9的信号结构域。
一方面,胞内信号结构域被设计为包含cd3-ζ的信号结构域和cd27的信号结构域。一方面,cd27的信号结构域包含qrrkyrsnkgespvepaepcryscpreeegstipiqedyrkpepacsp(seqidno:16)的氨基酸序列。一方面,cd27的信号结构域由aggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctcc(seqidno:14)的核酸序列编码。
一方面,本文所述的car表达细胞可以进一步包含第二car,例如第二car,其包括不同的抗原结合结构域,例如针对相同的靶标或不同的靶标(例如,不同于本文所述的癌症相关抗原或本文所述的不同癌症相关抗原的靶标,例如cd19,cd33,cll-1,cd34,flt3或叶酸受体β)的抗原结合结构域。在一个实施方案中,第二car包括针对癌症相关抗原相同的癌细胞类型表达的靶标的靶抗原结合结构域。在一个实施方案中,car表达细胞包含第一car,其靶向第一抗原并且包括具有共刺激信号结构域但不是主要信号结构域的胞内信号结构域,和第二car,其靶向第二种不同抗原并且包括具有主要信号结构域但不是共刺激信号结构域的胞内信号结构域。虽然不希望受理论束缚,但是将共刺激信号结构域(例如4-1bb,cd28,icos,cd27或ox-40)放置在第一car上,并且将主要信号结构域例如cd3ζ放置在第二个car上可以将car活性限制在表达两个目标的细胞上。在一个实施方案中,car表达细胞包含第一癌症相关抗原car,其包括结合本文所述的靶抗原的抗原结合结构域,跨膜结构域和共刺激结构域,以及靶向不同靶抗原的第二car(例如,抗原与第一靶抗原在相同的癌细胞类型上表达),并且包括抗原结合结构域,跨膜结构域和主要信号结构域。在另一个实施方案中,car表达细胞包含第一car,其包括结合本文所述的靶抗原的抗原结合结构域,跨膜结构域和主要信号结构域,以及靶向除第一靶抗原之外的抗原的第二car(例如,抗原与第一靶抗原在相同的癌细胞类型上表达),并且包括针对抗原的抗原结合结构域,跨膜结构域和共刺激信号结构域。
在另一方面,本公开特征在于car表达细胞,例如cart细胞的群体。在一些实施方案中,car表达细胞群体包含表达不同car的细胞的混合物。
例如,在一个实施方案中,cart细胞群体可以包括表达具有针对本文所述的癌症相关抗原的抗原结合结构域的car的第一细胞和表达具有不同抗原结合结构域的car的第二细胞,所述不同抗原结合结构域为例如针对本文所述的不同的癌症相关抗原的抗原结合结构域,例如针对本文所述的癌症相关抗原的抗原结合结构域,该抗原结合结构域与由第一细胞表达的car的抗原结合结构域结合的癌症相关抗原不同。
作为另一个实例,car表达细胞的群体可以包括表达car的第一细胞,该car包括针对本文所述的癌症相关抗原的抗原结合结构域,以及表达car的第二个细胞,该car包含针对不同于本文所述的癌症相关抗原的靶标的抗原结合结构域。在一个实施方案中,car表达细胞的群体包括例如第一细胞和第二细胞,第一细胞表达包含主要胞内信号结构域的car,第二细胞表达包含次要信号结构域的car。
另一方面,本公开特征在于细胞群体,其中群体中的至少一个细胞表达具有针对本文所述的癌症相关抗原的抗原结合结构域的car,以及表达另一种物质,例如增强car表达细胞的活性的物质的第二细胞。例如,在一个实施方案中,所述物质可以是抑制抑制性分子的物质。在一些实施方案中,抑制性分子例如pd-1可以降低car表达细胞引起免疫效应应答的能力。抑制性分子的实例包括pd-1,pd-l1,pd-l2,ctla4,tim3,ceacam(ceacam-1,ceacam-3,和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfr(例如tgfrβ)。在一个实施方案中,抑制抑制性分子的物质包含第一多肽(例如抑制性分子),其与向细胞提供阳性信号的第二多肽(例如,本文所述的胞内信号结构域)结合。在一个实施方案中,该物质包含第一多肽,例如抑制性分子如pd-1,pd-l1,ctla4,tim3,ceacam(ceacam-1,ceacam-3,和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4和tgfrβ,或这些任何一种的片段的第一多肽,以及作为本文所述胞内信号结构域的第二多肽(例如,包含共刺激结构域(例如,41bb,cd27,ox40或cd28,例如本文所述)和/或主要信号结构域(例如,本文所述的cd3ζ信号结构域)。在一个实施方案中,该物质包含pd-1的第一多肽或其片段,和本文描述的胞内信号结构域的第二多肽(例如,本文所述的cd28信号结构域和/或本文所述的cd3ζ信号结构域)。
抗cd19结合结构域的序列在本文中提供于表1中。可以使用表1中描述的任何抗原结合结构域与下面提供的一种或多种另外的car组分产生完整car构建体。
●前导序列(氨基酸序列)(seqidno:1)
malpvtalllplalllhaarp
●前导序列(核酸序列)(seqidno:12)
atggccctgcctgtgacagccctgctgctgcctctggctctgctgctgcatgccgctagaccc
●cd8铰链(氨基酸序列)(seqidno:2)
tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacd
●cd8铰链(核酸序列)(seqidno:13)
accacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgat
●cd8跨膜(氨基酸序列)(seqidno:6)
iyiwaplagtcgvlllslvitlyc
●跨膜(核酸序列)(seqidno:17)
atctacatctgggcgcccttggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgc
●4-1bb细胞内结构域(氨基酸序列)(seqidno:7)
krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
●4-1bb细胞内结构域(核酸序列)(seqidno:18)
aaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactg
●cd3ζ结构域(氨基酸序列)(seqidno:9)
rvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
●cd3ζ(核酸序列)(seqidno:20)
agagtgaagttcagcaggagcgcagacgcccccgcgtacaagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc
●cd3ζ结构域(氨基酸序列;ncbi参考序列nm_000734.3)
(seqidno:10)
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
●cd3ζ(核酸序列;ncbi参考序列nm_000734.3);(seqid
no:21)
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc
igg4铰链(氨基酸序列)(seqidno:36)
eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkm
igg4铰链(核苷酸序列)(seqidno:37)
gagagcaagtacggccctccctgccccccttgccctgcccccgagttcctgggcggacccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagccggacccccgaggtgacctgtgtggtggtggacgtgtcccaggaggaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagccccgggaggagcagttcaatagcacctaccgggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaggaatacaagtgtaaggtgtccaacaagggcctgcccagcagcatcgagaaaaccatcagcaaggccaagggccagcctcgggagccccaggtgtacaccctgccccctagccaagaggagatgaccaagaaccaggtgtccctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtgctggacagcgacggcagcttcttcctgtacagccggctgaccgtggacaagagccggtggcaggagggcaacgtctttagctgctccgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgtccctgggcaagatg
ef1α启动子
cgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggtaagtgccgtgtgtggttcccgcgggcctggcctctttacgggttatggcccttgcgtgccttgaattacttccacctggctgcagtacgtgattcttgatcccgagcttcgggttggaagtgggtgggagagttcgaggccttgcgcttaaggagccccttcgcctcgtgcttgagttgaggcctggcctgggcgctggggccgccgcgtgcgaatctggtggcaccttcgcgcctgtctcgctgctttcgataagtctctagccatttaaaatttttgatgacctgctgcgacgctttttttctggcaagatagtcttgtaaatgcgggccaagatctgcacactggtatttcggtttttggggccgcgggcggcgacggggcccgtgcgtcccagcgcacatgttcggcgaggcggggcctgcgagcgcggccaccgagaatcggacgggggtagtctcaagctggccggcctgctctggtgcctggcctcgcgccgccgtgtatcgccccgccctgggcggcaaggctggcccggtcggcaccagttgcgtgagcggaaagatggccgcttcccggccctgctgcagggagctcaaaatggaggacgcggcgctcgggagagcgggcgggtgagtcacccacacaaaggaaaagggcctttccgtcctcagccgtcgcttcatgtgactccacggagtaccgggcgccgtccaggcacctcgattagttctcgagcttttggagtacgtcgtctttaggttggggggaggggttttatgcgatggagtttccccacactgagtgggtggagactgaagttaggccagcttggcacttgatgtaattctccttggaatttgccctttttgagtttggatcttggttcattctcaagcctcagacagtggttcaaagtttttttcttccatttcaggtgtcgtga(seqidno:11).
gly/ser(seqidno:25)
ggggs
gly/ser(seqidno:26):该序列可以包含1-6个“glyglyglyglyser”重复单元
ggggsggggsggggsggggsggggsggggs
gly/ser(seqidno:27)
ggggsggggsggggsggggs
gly/ser(seqidno:28)
ggggsggggsggggs
gly/ser(seqidno:29)
gggs
polya(seqidno:30):a5000
polya(seqidno:31):a100
polyt(seqidno:32):t5000
polya(seqidno:33):a5000
polya(seqidno:34):a400
polya(seqidno:35):a2000
●gly/ser(seqidno:15):该序列可以包含1-10个“glyglyglyser”重复单元
gggsgggsgggsgggsgggsgggsgggsgggsgggsgggs可用于本文所述方法的示例性cd19car构建体示于表3中:
表3:cd19car构建体
与其他分子或物质的共表达
第二个car的共表达
一方面,本文所述的car表达细胞可以进一步包含第二car,例如第二car,其包括不同的抗原结合结构域,例如针对相同的靶标(例如cd19)或不同的靶标(例如,cd19以外的靶标,例如本文描述的靶标)的抗原结合结构域。在一个实施方案中,car表达细胞包含第一car和第二car,第一car靶向第一抗原并且包括具有共刺激信号结构域但不是主要信号结构域的胞内信号结构域,第二car靶向第二种不同的抗原并且包括具有主要信号结构域但不是共刺激信号结构域的胞内信号结构域。将共刺激信号结构域(例如4-1bb,cd28,cd27,ox-40或icos)置于第一car上,并且将主要信号结构域例如cd3ζ置于第二car上可将car活性限制于表达两种靶标的细胞。在一个实施方案中,car表达细胞包含第一car和第二car,第一car包括抗原结合结构域,跨膜结构域和共刺激结构域,第二car靶向另一种抗原并包括抗原结合结构域,跨膜结构域和主要信号结构域。在另一个实施方案中,car表达细胞包含第一car和第二car,第一car包括抗原结合结构域,跨膜结构域和主要信号结构域,第二car靶向另一抗原并且包括针对该抗原的抗原结合结构域,跨膜结构域和共刺激信号结构域。
在一个实施方案中,car表达细胞包含本文所述的xcar和抑制性car。在一个实施方案中,抑制性car包含结合正常细胞(例如也表达x的正常细胞)而不是癌细胞上发现的抗原的抗原结合结构域。在一个实施方案中,抑制性car包含抗原结合结构域,跨膜结构域和抑制性分子的细胞内结构域。例如,抑制性car的细胞内结构域可以是pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(ceacam-1,ceacam-3,和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfr(例如,tgfrβ)的细胞内结构域。
在一个实施方案中,当car表达细胞包含两种或更多种不同的car时,不同car的抗原结合结构域可以使得抗原结合结构域彼此不相互作用。例如,表达第一和第二car的细胞可以具有第一car的抗原结合结构域,例如,不与第二car的抗原结合结构域形成结合的片段,例如scfv,例如,第二car的抗原结合结构域是vhh。
在一些实施方案中,抗原结合结构域包含单结构域抗原结合(sdab)分子,包括其互补决定区是单结构域多肽的一部分的分子。实例包括但不限于重链可变结构域,天然缺乏轻链的结合分子,衍生自常规4-链抗体的单结构域,工程化结构域和除抗体衍生的那些支架以外的单结构域支架。sdab分子可以是本领域任何一种,或任何未来的单结构域分子。sdab分子可以衍生自任何物种,包括但不限于小鼠,人,骆驼,骆马,七鳃鳗,鱼,鲨鱼,山羊,兔和牛。该术语还包括来自骆驼科和鲨鱼以外的物种的天然存在的单结构域抗体分子。
一方面,sdab分子可以衍生自在鱼中发现的免疫球蛋白的可变区,例如衍生自在鲨鱼血清中发现的称为新型抗原受体(nar)的免疫球蛋白同种型的sdab分子。产生衍生自nar可变区(“ignar”)的单结构域分子的方法描述于wo03/014161和streltsov(2005)proteinsci.14:2901-2909。
根据另一方面,sdab分子是称为无轻链的重链的天然存在的单结构域抗原结合分子。这样的单结构域分子公开在wo9404678和hamers-casterman,c.etal.(1993)nature363:446-448。为了清楚起见,衍生自天然缺乏轻链的重链分子的这种可变结构域在本文中称为vhh或纳米抗体,以将其与四链免疫球蛋白的常规vh区分开。这样的vhh分子可以衍生自骆驼科(camelidae)物种,例如骆驼,骆马,单峰骆驼,羊驼和大羊驼。除骆驼科之外的其他物种可能产生天然缺乏轻链的重链分子;这样的vhh在本发明的范围内。
sdab分子可以是重组的,cdr-移植的,人源化的,骆驼化的,去免疫的和/或体外产生的(例如通过噬菌体展示来选择)。
还已经发现,具有多个嵌合膜包埋的受体(所述受体包含在所述受体的抗原结合结构域之间的相互作用的抗原结合结构域)的细胞可能是不期望,例如因为其抑制一种或多种抗原结合结构域结合其同源抗原的能力。因此,本文公开了具有第一和第二非天然存在的嵌合膜包埋的受体的细胞,所述受体包含使这种相互作用最小化的抗原结合结构域。本文还公开了编码第一和第二非天然存在的嵌合膜包埋的受体的核酸,所述受体包含使这种相互作用最小化的抗原结合结构域,以及制备和使用这些细胞和核酸的方法。在一个实施方案中,第一和第二非天然存在的嵌合膜包埋的受体之一的抗原结合结构域包含scfv,另一个包含单个vh结构域,例如骆驼科动物,鲨鱼或七鳃鳗单个vh结构域,或衍生自人或小鼠序列的单个vh结构域。
在一些实施方案中,本文的组合物包含第一和第二car,其中第一和第二car之一的抗原结合结构域不包含可变轻结构域和可变重结构域。在一些实施方案中,第一和第二car之一的抗原结合结构域是scfv,另一个不是scfv。在一些实施方案中,第一和第二car之一的抗原结合结构域包含单个vh结构域,例如骆驼科动物,鲨鱼或七鳃鳗单一vh结构域,或衍生自人或小鼠序列的单个vh结构域。在一些实施方案中,第一和第二car之一的抗原结合结构域包含纳米抗体。在一些实施方案中,第一和第二car之一的抗原结合结构域包含骆驼vhh结构域。
在一些实施方案中,第一和第二car之一的抗原结合结构域包含scfv,另一个包含单个vh结构域,例如骆驼科动物,鲨鱼或七鳃鳗单个vh结构域,或源自人或小鼠序列的单个vh结构域。在一些实施方案中,第一和第二car之一的抗原结合结构域包含scfv,另一个包含纳米抗体。在一些实施方案中,第一和第二car之一的抗原结合结构域包含scfv,另一个包含骆驼vhh结构域。
在一些实施方案中,当存在于细胞表面时,第一car的抗原结合结构域与其同源抗原的结合通过第二car的存在基本上不减少。在一些实施方案中,在第二car存在下第一car的抗原结合结构域与其同源抗原的结合为在第二car不存在下第一car的抗原结合结构域与其同源抗原的结合的至少85%,90%,95%,96%,97%,98%或99%,例如,85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,当存在于细胞表面上时,第一和第二car的抗原结合结构域彼此结合少于如果两者均为scfv抗原结合结构域时的结合。在一些实施方案中,第一和第二car的抗原结合结构域彼此结合比两种均为scfv抗原结合结构域时的结合少至少85%,90%,95%,96%,97%,98%或99%,例如,85%,90%,95%,96%,97%,98%或99%。
增强car活性的物质的共表达
另一方面,本文所述的car表达细胞可进一步表达另一种物质,例如增强car表达细胞的活性或适应性的物质。
例如,在一个实施方案中,该物质可以是抑制调控或调节例如抑制t细胞功能的分子的物质。在一些实施方案中,调控或调节t细胞功能的分子是抑制性分子。在一些实施方案中,抑制性分子例如pd1可以降低car表达细胞引发免疫效应应答的能力。抑制分子的实例包括pd1,pd-l1,ctla4,tim3,lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷或tgfrβ。
在实施方案中,物质,例如抑制性核酸,例如dsrna,例如sirna或shrna;或例如抑制性蛋白质或系统,例如,聚集的规则间隔的短回文重复序列(crispr),转录活化子样效应核酸酶(talen)或锌指内切核酸酶(zfn),如本文所述,可以用于抑制调控或调节,例如抑制car表达细胞中的t细胞功能的分子的表达。在一个实施方案中,所述物质是shrna,例如本文所述的shrna。在一个实施方案中,调控或调节例如抑制t细胞功能的物质在car表达细胞内被抑制。例如,抑制调控或调节例如抑制t细胞功能的分子表达的dsrna分子与编码car的组分(例如所有组分)的核酸连接。
在一个实施方案中,抑制抑制性分子的物质包含与第二多肽结合的第一多肽,例如抑制性分子,所述第二多肽向细胞提供阳性信号,例如,本文所述的胞内信号结构域。在一个实施方案中,该物质包含例如抑制性分子的第一多肽,所述抑制性分子为例如pd1,pd-l1,ctla4,tim3,lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷或tgfrβ或这些任何一种的片段(例如,这些任一个的细胞外结构域的至少一部分),和第二多肽,其是本文所述的胞内信号结构域(例如,包含共刺激结构域(例如,41bb,cd27或cd28,例如本文所述)和/或主要信号结构域(例如本文所述的cd3ζ信号结构域)。在一个实施方案中,所述物质包含pd1的第一多肽或其片段(例如,pd1的细胞外结构域的至少一部分)和本文所述的胞内信号结构域的第二多肽(例如,本文所述的cd28信号结构域和/或本文所述的cd3ζ信号结构域)。pd1是cd28家族受体的抑制成员,该家族受体还包括cd28,ctla-4,icos和btla。pd-1在活化的b细胞,t细胞和骨髓细胞上表达(agataetal.1996int.immunol8:765-75)。已经显示pd1,pd-l1和pd-l2的两个配体在结合pd1时下调t细胞活化(freemaneta.2000jexpmed192:1027-34;latchmanetal.2001natimmunol2:261-8;carteretal.2002eurjimmunol32:634-43)。pd-l1在人类癌症中是丰富的(dongetal.2003jmolmed81:281-7;blanketal.2005cancerimmunol.immunother54:307-314;konishietal.2004clincancerres10:5094)。通过抑制pd1与pd-l1的局部相互作用可以逆转免疫抑制。
在一个实施方案中,该物质包含抑制性分子的细胞外结构域(ecd),例如程序性死亡1(pd1),可以融合到跨膜结构域和胞内信号结构域如41bb和cd3ζ(本文也称为pd1car)。在一个实施方案中,当与本文所述的xcar组合使用时,pd1car改善了t细胞的持续性。在一个实施方案中,car是包含在seqidno:105中以下划线表示的pd1的细胞外结构域的pd1car。在一个实施方案中,pd1car包含seqidno:105的氨基酸序列。
malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seqidno:105)。
在一个实施方案中,pd1car包含下面提供的氨基酸序列(seqidno:106)。
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seqidno:106).
在一个实施方案中,所述物质包含编码pd1car,例如本文所述的pd1car的核酸序列。在一个实施方案中,pd1car的核酸序列如下所示,其中pd1ecd在seqidno:107中下面加下划线。
atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc(seqidno:107).
在另一个实例中,在一个实施方案中,增强car表达细胞活性的物质可以是共刺激分子或共刺激分子配体。共刺激分子的实例包括mhci类分子,btla和toll配体受体,以及ox40,cd27,cd28,cds,icam-1,lfa-1(cd11a/cd18),icos(cd278),和4-1bb(cd137)。此类共刺激分子的其它实例包括cds,icam-1,gitr,baffr,hvem(lightr),slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd160,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a,以及与cd83特异性结合的配体,例如如本文所述。共刺激分子配体的实例包括cd80,cd86,cd40l,icosl,cd70,ox40l,4-1bbl,gitrl,和light。在实施方案中,共刺激分子配体是不同于car的共刺激分子结构域的共刺激分子的配体。在实施方案中,共刺激分子配体是与car共刺激分子结构域相同的共刺激分子的配体。在一个实施方案中,共刺激分子配体是4-1bbl。在一个实施方案中,共刺激配体是cd80或cd86。在一个实施方案中,共刺激分子配体是cd70。在实施方案中,本文所述的car表达免疫效应细胞可进一步工程化以表达一种或多种另外的共刺激分子或共刺激分子配体。
car与趋化因子受体的共表达
在实施方案中,本文所述的car表达细胞,例如cd19car表达细胞,还包含趋化因子受体分子。趋化因子受体ccr2b或cxcr2在t细胞中的转基因表达增强了对分泌ccl2-或cxcl1的实体瘤(包括黑素瘤和神经母细胞瘤)的运输(craddocketal.,jimmunother.2010oct;33(8):780-8andkershawetal.,humgenether.2002nov1;13(16):1971-80)。因此,不希望受理论束缚,认为在car表达细胞中表达的趋化因子受体(其识别由肿瘤,例如实体瘤分泌的趋化因子)可以改善car表达细胞归巢到肿瘤中,促进car表达细胞向肿瘤的浸润,并增强car表达细胞的抗肿瘤功效。趋化因子受体分子可以包含天然存在的或重组的趋化因子受体或其趋化因子结合片段。适用于在本文所述的car表达细胞(例如,car-tx)中表达的趋化因子受体分子包括cxc趋化因子受体(例如cxcr1,cxcr2,cxcr3,cxcr4,cxcr5,cxcr6或cxcr7),cc趋化因子受体(例如ccr1,ccr2,ccr3,ccr4,ccr5,ccr6,ccr7,ccr8,ccr9,ccr10,或ccr11),cx3c趋化因子受体(例如cx3cr1),xc趋化因子受体(例如xcr1)或其趋化因子结合片段。在一个实施方案中,基于肿瘤分泌的趋化因子选择要用本文所述的car表达的趋化因子受体分子。在一个实施方案中,本文所述的car表达细胞进一步包含,例如表达ccr2b受体或cxcr2受体。在一个实施方案中,本文所述的car和趋化因子受体分子在相同的载体上或在两个不同的载体上。在本文所述的car和趋化因子受体分子在相同载体上的实施方案中,car和趋化因子受体分子各自由两种不同的启动子控制,或者在同一启动子的控制下。
编码car的核酸构建体
本发明还提供免疫效应细胞,例如通过本文所述的方法制备的免疫效应细胞,其包括编码本文所述的一种或多种car构建体的核酸分子。一方面,提供核酸分子作为信使rna转录物。一方面,提供核酸分子作为dna构建体。
本文所述的核酸分子可以是dna分子,rna分子或其组合。在一个实施方案中,核酸分子是编码如本文所述的car多肽的mrna。在其它实施方案中,核酸分子是包括任何前述核酸分子的载体。
在一个方面,本发明的car的抗原结合结构域(例如,scfv)由核酸分子编码,其序列已被密码子优化用于在哺乳动物细胞中表达。一方面,本发明的整个car构建体由核酸分子编码,其整个序列已被密码子优化以在哺乳动物细胞中表达。密码子优化是指发现编码dna中同义密码子(即编码相同氨基酸的密码子)的发生频率在不同物种中是偏向的。这种密码子简并允许相同的多肽由多种核苷酸序列编码。各种密码子优化方法是本领域已知的,并且包括例如至少在美国专利号5,786,464和6,114,148中公开的方法。
因此,一方面,例如通过本文所述的方法制备的免疫效应细胞包括编码嵌合抗原受体(car)的核酸分子,其中car包含与本文所述的肿瘤抗原结合的抗原结合结构域,跨膜结构域(例如,本文所述的跨膜结构域)以及包含刺激结构域的胞内信号结构域(例如,本文所述的胞内信号结构域),例如共刺激信号结构域(例如,本文所述的共刺激信号结构域)和/或主要信号结构域(例如,本文描述的主要信号结构域,例如本文所述的ζ链)。
本发明还提供载体,其中插入了编码car的核酸分子(例如本文所述的核酸分子)。衍生自逆转录病毒如慢病毒的载体是实现长期基因转移的合适工具,因为它们允许转基因的长期稳定整合及其在子细胞中的繁殖。慢病毒载体相对于衍生自癌逆转录病毒例如鼠白血病病毒的载体具有附加的优点,因为它们可以转导非增殖细胞,例如肝细胞。它们还具有低免疫原性的附加优点。逆转录病毒载体也可以是例如γ逆转录病毒载体。γ逆转录病毒载体可以包括例如启动子,包装信号(ψ),引物结合位点(pbs),一个或多个(例如两个)长末端重复序列(ltr)和感兴趣的转基因,例如编码car的基因。γ逆转录病毒载体可能缺乏病毒结构,如gag,pol和env。示例性的γ逆转录病毒载体包括鼠白血病病毒(mlv),脾脏病灶形成病毒(sffv)和骨髓增生性肉瘤病毒(mpsv)以及由其衍生的载体。其他γ逆转录病毒载体描述于例如tobiasmaetzigetal.,“gammaretroviralvectors:biology,technologyandapplication”viruses.2011jun;3(6):677–713。
在另一个实施方案中,包含编码所需car的核酸的载体是腺病毒载体(a5/35)。在另一个实施方案中,编码car的核酸的表达可以使用转座子如睡美人(sleepingbeauty),crisper,cas9和锌指核酸酶来完成。参见juneetal.2009naturereviewsimmunology9.10:704-716,其通过引用并入本文。
总之,编码car的天然或合成核酸的表达通常通过将编码car多肽或其部分的核酸有效连接至启动子,并将构建体掺入表达载体中来实现。载体可以适用于复制和整合真核生物。典型的克隆载体含有转录和翻译终止子,引发序列和可用于调节所需核酸序列表达的启动子。
核酸可以克隆到多种类型的载体中。例如,可以将核酸克隆到载体中,所述载体包括但不限于质粒,噬菌粒,噬菌体衍生物,动物病毒和粘粒。特别感兴趣的载体包括表达载体,复制载体,探针产生载体和测序载体。
此外,表达载体可以以病毒载体的形式提供给细胞。病毒载体技术在本领域中是众所周知的,并且描述于例如sambrooketal.,2012,molecularcloning:alaboratorymanual,volumes1-4,coldspringharborpress,ny)和其他病毒学和分子生物学手册。可用作载体的病毒包括但不限于逆转录病毒,腺病毒,腺伴随病毒,疱疹病毒和慢病毒。通常,合适的载体包含在至少一个生物体中起作用的复制起点,启动子序列,方便的限制性内切核酸酶位点和一个或多个可选择标记(例如,wo01/96584;wo01/29058;和美国专利号6,326,193)。
已经开发了许多基于病毒的系统用于将基因转移到哺乳动物细胞中。例如,逆转录病毒为基因递送系统提供了便利的平台。可以使用本领域已知的技术将所选择的基因插入载体并包装在逆转录病毒颗粒中。然后可以将重组病毒分离并在体内或离体递送至受试者的细胞。许多逆转录病毒系统是本领域已知的。在一些实施方案中,使用腺病毒载体。许多腺病毒载体是本领域已知的。在一个实施方案中,使用慢病毒载体。
额外的启动子元件,例如增强子调节转录起始的频率。通常,它们位于起始位点上游30-110bp的区域,尽管许多启动子也显示在起始位点的下游含有功能元件。启动子元件之间的间隔通常是柔性的,因此当元件相对于彼此倒置或移动时,启动子功能被保留。在胸苷激酶(tk)启动子中,在活性开始下降之前,启动子元件之间的间距可以增加到50bp。取决于启动子,似乎单个元件可以协同或独立地起作用以激活转录。示例性启动子包括cmvie基因,ef-1α,泛素c或磷酸甘油激酶(pgk)启动子。
能够在哺乳动物t细胞中表达car编码核酸分子的启动子的实例是ef1a启动子。天然ef1a启动子驱动延伸因子-1复合体的α亚基的表达,所述复合体负责将氨酰基trna酶促递送至核糖体。ef1a启动子已被广泛用于哺乳动物表达质粒,并且已被证明能有效驱动克隆到慢病毒载体中的核酸分子的car表达。参见,例如,miloneetal.,mol.ther.17(8):1453–1464(2009)。一方面,ef1a启动子包含实施例中提供的序列。
启动子的另一个例子是立即早期巨细胞病毒(cmv)启动子序列。该启动子序列是能够驱动与其有效连接的任何多核苷酸序列的高水平表达的强组成型启动子序列。然而,也可以使用其他组成型启动子序列,包括但不限于猿猴病毒40(sv40)早期启动子,小鼠乳腺肿瘤病毒(mmtv),人免疫缺陷病毒(hiv)长末端重复(ltr)启动子,momulv启动子,禽白血病病毒启动子,eb病毒立即早期启动子,劳斯肉瘤病毒启动子,以及人基因启动子,例如但不限于肌动蛋白启动子,肌球蛋白启动子,延伸因子-1α启动子,血红蛋白启动子和肌酸激酶启动子。此外,本发明不应限于使用组成型启动子。也可以考虑诱导型启动子作为本发明的一部分。诱导型启动子的使用提供了分子开关,当期望这种表达时,所述分子开关能够启动有效连接的多核苷酸序列的表达,或者当不需要表达时关闭表达。诱导型启动子的实例包括但不限于金属硫蛋白启动子,糖皮质激素启动子,孕酮启动子和四环素启动子。
启动子的另一个例子是磷酸甘油酸激酶(pgk)启动子。在实施方案中,可能需要截短的pgk启动子(例如,当与野生型pgk启动子序列比较时,具有一个或多个,例如1,2,5,10,100,200,300,或400个核苷酸缺失的pgk启动子)。
示例性pgk启动子的核苷酸序列在下面提供。
wtpgk启动子:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccgcctcgtccttcgcagcggccccccgggtgttcccatcgccgcttctaggcccactgcgacgcttgcctgcacttcttacacgctctgggtcccagccgcggcgacgcaaagggccttggtgcgggtctcgtcggcgcagggacgcgtttgggtcccgacggaaccttttccgcgttggggttggggcaccataagct(seqidno:109)
示例性截短的pgk启动子:
pgk100:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtg(seqidno:110)
pgk200:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacg(seqidno:111)
pgk300:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccg(seqidno:112)
pgk400:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccgcctcgtccttcgcagcggccccccgggtgttcccatcgccgcttctaggcccactgcgacgcttgcctgcacttcttacacgctctgggtcccagccg(seqidno:113)
载体还可以包括例如促进分泌的信号序列,聚腺苷酸化信号和转录终止子(例如,来自牛生长激素(bgh)基因)),允许在原核生物中进行附加型复制和复制的元件(例如sv40原点和cole1或本领域已知的其他元件)和/或允许选择的元件(例如,氨苄青霉素抗性基因和/或zeocin标记)。
为了评估car多肽或其部分的表达,待引入细胞的表达载体还可以含有选择性标记基因或报告基因或两者,以便于从细胞群体中鉴定和选择试图通过病毒载体转染或感染的表达细胞。在其他方面,选择标记可以携带在单独的dna片段上并用于共转染过程。选择性标记和报告基因均可以在侧翼有适当的调控序列以使得能够在宿主细胞中表达。有用的选择标记包括例如抗生素抗性基因,例如neo等。
报告基因用于鉴定潜在转染的细胞并用于评估调节序列的功能性。通常,报告基因是不存在于受体生物或组织中或不由受体生物或组织表达的基因,并且其编码多肽,该多肽的表达由一些易于检测的性质(例如酶活性)表现。在dna被引入受体细胞后的合适时间内测定报告基因的表达。合适的报告基因可以包括编码萤光素酶,β-半乳糖苷酶,氯霉素乙酰转移酶,分泌的碱性磷酸酶的基因或绿色荧光蛋白基因(例如,ui-teietal.,2000febsletters479:79-82)。合适的表达系统是公知的,并且可以使用已知技术制备或从商业上获得。通常,具有显示报告基因最高表达水平的最小5'侧翼区的构建体被鉴定为启动子。这样的启动子区域可以连接到报告基因,并用于评估试剂调节启动子驱动的转录的能力。
在实施方案中,载体可以包含两个或更多个核酸序列,其编码car,例如本文所述的car,例如cd19car和第二car,例如抑制性car或特异性结合cd19以外的抗原的car。在这样的实施方案中,编码car的两个或多个核酸序列由相同框中的单个核酸分子编码和作为单个多肽链编码。在这方面,两个或更多个car可以例如被一个或多个肽切割位点分开(例如,自身切割位点或细胞内蛋白酶的底物)。肽切割位点的实例包括t2a,p2a,e2a或f2a位点。
将基因导入细胞和在其中表达的方法是本领域已知的。在表达载体的上下文中,可以通过任何方法,例如本领域已知的方法,将载体容易地引入宿主细胞,例如哺乳动物,细菌,酵母或昆虫细胞。例如,表达载体可以通过物理,化学或生物学方式转移到宿主细胞中。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀,脂转染,粒子轰击,显微注射,电穿孔等。用于产生包含载体和/或外源核酸的细胞的方法是本领域公知的。参见例如sambrooketal.,2012,molecularcloning:alaboratorymanual,volumes1-4,coldspringharborpress,ny)。将多核苷酸引入宿主细胞的合适方法是磷酸钙转染。
将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。病毒载体,特别是逆转录病毒载体,已经成为将基因插入到哺乳动物例如人细胞中的最广泛使用的方法。其他病毒载体可衍生自慢病毒,痘病毒,单纯疱疹病毒i,腺病毒和腺伴随病毒等。参见例如美国专利号5,350,674和5,585,362。
用于将多核苷酸引入宿主细胞的化学方法包括胶体分散系统,例如大分子复合体,纳米胶囊,微球,珠粒和基于脂质的系统,包括水包油乳液,胶束,混合胶束和脂质体。在体外和体内用作递送载体的示例性胶体系统是脂质体(例如,人造膜囊泡)。核酸的当前的靶向递送的其他方法是可获得的,例如用靶向纳米颗粒或其它合适的亚微米尺寸的递送系统递送多核苷酸。
在使用非病毒递送系统的情况下,示例性递送载体是脂质体。考虑使用脂质制剂将核酸引入宿主细胞(体外,离体或体内)。在另一方面,核酸可以与脂质结合。与脂质结合的核酸可以包封在脂质体的水性内部,散布在脂质体的脂质双层内,通过与脂质体和寡核苷酸相关联的连接分子连接到脂质体上,截留在脂质体中,与脂质体复合,分散在含脂质的溶液中,与脂质混合,与脂质组合,作为悬浮液包含在脂质中,包含在胶束中或与胶束复合,或以其它方式与脂质相关联。脂质,脂质/dna或脂质/表达载体相关的组合物不限于溶液中的任何特定结构。例如,它们可以存在于双层结构中,如胶束或具有“塌陷”结构。它们也可以简单地散布在溶液中,可能形成尺寸或形状不均匀的聚集体。脂质是可能是天然存在的或合成的脂质的脂肪物质。例如,脂质包括天然存在于细胞质中的脂肪液滴以及含有长链脂肪族烃及其衍生物如脂肪酸,醇,胺,氨基醇和醛的化合物类别。
可以从商业来源获得适合使用的脂质。例如,二肉豆蔻酰磷脂酰胆碱(“dmpc”)可以从sigma,st.louis,mo获得;磷酸鲸蜡酯(“dcp”)可从k&klaboratories(plainview,ny)获得;胆固醇(“choi”)可以从calbiochem-behring获得;二肉豆蔻酰磷脂酰甘油(“dmpg”)和其他脂质可以从avantipolarlipids,inc.(birmingham,al.)获得。脂质在氯仿或氯仿/甲醇中的储备溶液可以在约-20℃下储存。使用氯仿作为唯一的溶剂,因为它比甲醇更容易蒸发。“脂质体”是通用术语,包括通过产生封闭的脂质双层或聚集体形成的各种单层和多层脂质载体。脂质体可以表征为具有磷脂双层膜和内水性介质的囊泡结构。多层脂质体具有通过水性介质分离的多个脂质层。当磷脂悬浮在过量的水溶液中时,它们自发形成。脂质组分在闭合结构形成之前经历自我重排,并将水和溶解的溶质截留在脂质双层之间(ghoshetal.,1991glycobiology5:505-10)。然而,也包括在溶液中具有与正常囊泡结构不同的结构的组合物。例如,脂质可以呈现胶束结构,或仅作为脂质分子的不均匀聚集体存在。还考虑了lipofectamine-核酸复合体。
不管用于将外源核酸引入宿主细胞或以其他方式将细胞暴露于本发明的抑制剂的方法,为了确认宿主细胞中重组核酸序列的存在,可以进行多种测定。此类测定包括例如本领域技术人员熟知的“分子生物学”测定,例如southern和northern印迹,rt-pcr和pcr;“生物化学”测定,例如通过免疫学手段(elisa和western印迹)检测特定肽的存在或不存在,或通过本文所述的测定来鉴定属于本发明范围内的物质。
天然杀伤细胞受体(nkr)car
在一个实施方案中,本文所述的car分子包含天然杀伤细胞受体(nkr)的一种或多种组分,从而形成nkr-car。nkr组分可以是以下任何天然杀伤细胞受体的跨膜结构域,铰链结构域或细胞质结构域:杀伤细胞免疫球蛋白样受体(kir),例如kir2dl1,kir2dl2/l3,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds2,kir2ds3,kir2ds4,dir2ds5,kir3dl1/s1,kir3dl2,kir3dl3,kir2dp1,和kir3dp1;天然细胞毒性受体(ncr),例如nkp30,nkp44,nkp46;免疫细胞受体的信号传导淋巴细胞活化分子(slam)家族,例如cd48,cd229,2b4,cd84,ntb-a,cracc,blame和cd2f-10;fc受体(fcr),例如cd16和cd64;和ly49受体,例如ly49a,ly49c。本文所述的nkr-car分子可与衔接分子或胞内信号结构域例如dap12相互作用。包含nkr组分的car分子的示例性构型和序列描述在国际公开号wo2014/145252中,其内容通过引用并入本文。
分裂car
在一些实施方案中,car表达细胞使用分裂car。分裂car方法在出版物wo2014/055442和wo2014/055657中有更详细的描述。简而言之,分裂car系统包括表达具有第一抗原结合结构域和共刺激结构域(例如,41bb)的第一car的细胞,并且该细胞还表达具有第二抗原结合结构域和胞内信号结构域的第二car(例如,cd3ζ)。当细胞遇到第一抗原时,共刺激结构域被激活,并且细胞增殖。当细胞遇到第二抗原时,胞内信号结构域被激活,细胞杀伤活性开始。因此,car表达细胞仅在两种抗原存在下完全活化。
调节嵌合抗原受体的策略
在一些实施方案中,可以控制car活性的可调节car(rcar)是期望的,以优化car疗法的安全性和功效。有多种方式可以调节car活性。例如,使用例如融合到二聚化结构域的胱天蛋白酶(见例如,distasaetal.,nengl.j.med.2011nov.3;365(18):1673-1683),诱导性凋亡可以在本发明的car疗法中用作安全开关。在一个实施方案中,表达本发明的car的细胞(例如,t细胞或nk细胞)还包含可诱导的凋亡开关,其中人胱天蛋白酶(例如胱天蛋白酶9)或修饰的形式融合到人类fkb蛋白的修饰形式,其允许条件二聚化。在小分子如rapalog(例如ap1903,ap20187)的存在下,可诱导的胱天蛋白酶(例如胱天蛋白酶9)被激活并导致表达本发明的car的细胞(例如,t细胞或nk细胞)的快速凋亡和死亡。基于胱天蛋白酶的可诱导凋亡开关(或这种开关的一个或多个方面)的实例已经在例如us2004040047;us20110286980;us20140255360;wo1997031899;wo2014151960;wo2014164348;wo2014197638;wo2014197638中进行了描述;所有这些都通过引用并入本文。
在另一个实例中,car表达细胞还可以表达诱导型胱天蛋白酶-9(icaspase-9)分子,其在施用二聚体药物(例如,rimiducid(也称为ap1903(bellicumpharmaceuticals)或ap20187(ariad))时导致胱天蛋白酶-9的激活和细胞凋亡。icaspase-9分子含有在cid存在下介导二聚化的二聚化(cid)结合结构域的化学诱导剂。这导致car表达细胞的可诱导和选择性消耗。在一些情况下,icaspase-9分子由与car编码载体分开的核酸分子编码,在一些情况下,icaspase-9分子由与car编码载体相同的核酸分子编码。icaspase-9可以提供安全开关,以避免car表达细胞的任何毒性。参见例如songetal.cancergenether.2008;15(10):667-75;clinicaltrialid.no.nct02107963;和distasietal.n.engl.j.med.2011;365:1673-83。
用于调节本发明的car疗法的备选策略包括利用失活或关闭car活化的小分子或抗体,例如,通过缺失car表达细胞,例如通过诱导抗体依赖性细胞介导的细胞毒性(adcc)。例如,本文所述的car表达细胞还可以表达由能够诱导细胞死亡,例如adcc或补体诱导的细胞死亡的分子识别的抗原。例如,本文所述的car表达细胞也可以表达能够被抗体或抗体片段靶向的受体。这些受体的实例包括epcam,vegfr,整联蛋白(例如整联蛋白αvβ3,α4,αι3/4β3,α4β7,α5β1,ανβ3,αν),tnf受体超家族成员(例如trail-r1,trail-r2),pdgf受体,干扰素受体,叶酸受体,gpnmb,icam-1,hla-dr,cea,ca-125,muc1,tag-72,il-6受体,5t4,gd2,gd3,cd2,cd3,cd4,cd5,cd11,cd11a/lfa-1,cd15,cd18/itgb2,cd19,cd20,cd22,cd23/lge受体,cd25,cd28,cd30,cd33,cd38,cd40,cd41,cd44,cd51,cd52,cd62l,cd74,cd80,cd125,cd147/basigin,cd152/ctla-4,cd154/cd40l,cd195/ccr5,cd319/slamf7,和egfr及其截短形式(例如,保留一个或多个细胞外表位但缺少胞质结构域内一个或多个区域的形式)。
例如,本文所述的car表达细胞还可以表达截短的表皮生长因子受体(egfr),其缺少信号传导能力,但保留由能够诱导adcc的分子(例如西妥昔单抗
在其它实施方案中,本文所述的car表达细胞还可以表达由t细胞消耗剂识别的靶蛋白。在一个实施方案中,靶蛋白是cd20,t细胞消耗剂是抗cd20抗体,例如利妥昔单抗。在这样的实施方案中,一旦需要减少或消除car表达细胞,例如减轻car诱导的毒性,则施用t细胞消耗剂。在其它实施方案中,t细胞消耗剂是如本文实施例中所述的抗cd52抗体,例如阿仑珠单抗。
在其它实施方案中,rcar包括一组多肽,其在最简单的实施方案中通常为两个多肽,其中本文描述的标准car的组分,例如抗原结合结构域和胞内信号结构域在分离的多肽或成员上分配。在一些实施方案中,该组多肽包括二聚化开关,其在二聚化分子的存在下可将多肽彼此偶联,例如可将抗原结合结构域偶联至胞内信号结构域。在一个实施方案中,本发明的car利用二聚化开关,如在例如wo2014127261中所描述的,其通过引用并入本文。本文和例如2015年3月13日提交的国际公开号wo2015/090229的第527-551段提供了这种可调节car的附加描述和示例性结构,其全部内容通过引用并入本文。在一些实施方案中,rcar涉及如seqidno:114所示的开关结构域,例如fkbp开关结构域,或包含具有与frb结合能力的fkbp片段,例如seqidno:115中给出的fkbp片段。在一些实施方案中,rcar涉及包含例如seqidno:116所示的frb序列或例如seqidno:117-122任一项给出的突变型frb序列的开关结构域。
dvpdyaslggpsspkkkrkvsrgvqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkletsy(seqidno:114)
vqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellklets(seqidno:115)
ilwhemwhegleeasrlyfgernvkgmfevleplhammergpqtlketsfnqaygrdlmeaqewcrkymksgnvkdltqawdlyyhvfrrisk(seqidno:116)
表4.具有对二聚化分子增加的亲和力的示例性突变frb。
rna转染
本文公开了用于产生体外转录的rnacar的方法。rnacar及其使用方法描述于例如2015年3月13日提交的国际申请wo2015/142675的第553-570段,其全部内容通过引用并入本文。
免疫效应细胞可以包括由信使rna(mrna)编码的car。在一个方面,将编码本文所述的car的mrna引入例如通过本文所述的方法制备的免疫效应细胞,用于产生car表达细胞。
在一个实施方案中,体外转录的rnacar可以作为瞬时转染的形式引入细胞。通过使用聚合酶链反应(pcr)生成的模板通过体外转录产生rna。使用合适的引物和rna聚合酶,来自任何来源的目的dna可以通过pcr直接转化成用于体外mrna合成的模板。dna的来源可以是例如基因组dna,质粒dna,噬菌体dna,cdna,合成dna序列或任何其它合适的dna来源。用于体外转录的所需模板是本文所述的car。例如,rnacar的模板包含细胞外区域,其包含针对本文所述的肿瘤相关抗原的抗体的单链可变结构域;铰链区(例如,本文所述的铰链区),跨膜结构域(例如本文所述的跨膜结构域,例如cd8a的跨膜结构域);以及细胞质区域,其包括胞内信号结构域,例如本文所述的胞内信号结构域,例如包含cd3-ζ的信号结构域和4-1bb的信号结构域。
在一个实施方案中,用于pcr的dna含有可读框。该dna可以来自生物体基因组的天然存在的dna序列。在一个实施方案中,核酸可以包括一些或所有的5’和/或3’非翻译区(utr)。核酸可以包括外显子和内含子。在一个实施方案中,用于pcr的dna为人核酸序列。在另一个实施方案中,用于pcr的dna为包括5’和3’utr的人核酸序列。dna可以备选地为通常在天然存在生物体中不表达的人工dna序列。示例性的人工dna序列为含有连接在一起形成编码融合蛋白的可读框的基因部分的序列。连接在一起的dna部分可以来自单个生物体或多于一个生物体。
pcr用于产生用于转染的mrna的体外转录的模板。进行pcr的方法是本领域所熟知的。把用于pcr的引物设计成具有与用作pcr模板的dna的区域基本上互补的区域。如本文所用的“基本上互补的”是指核苷酸的序列,其中引物序列中大多数或所有的碱基都是互补的或一个或更多个碱基是非互补的或错配的。基本上互补的序列能够与目标dna靶在用于pcr的退火条件下退火或杂交。可以把引物设计成与dna模板的任何部分基本上互补。例如,可以把引物设计成扩增在细胞中通常转录的核酸的部分(可读框),包括5’和3’utr。也可以把引物设计成扩增编码目的特定结构域的核酸的部分。在一个实施方案中,把引物设计成扩增人cdna的编码区,包括5’和3’utrs的全部或部分。可以通过本领域熟知的合成方法产生用于pcr的引物。“正向引物”是含有与要被扩增的dna序列上游的dna模板上的核苷酸基本上互补的核苷酸区域的引物。“上游的”在本文用于指相对于编码链的待扩增的dna序列的5’位。“反向引物”为含有与要被扩增的dna序列下游的双链dna模板基本上互补的核苷酸区域的引物。“下游的”在本文用于指相对于编码链的要扩增的dna序列的3位。
用于pcr的任何dna聚合酶都可以用于本文公开的方法中。试剂和聚合酶为从多个来源市售获得的。
也可以使用具有促进稳定性和/或翻译效率的能力的化学结构。在一个实施方案中,rna具有5’和3’utr。在一个实施方案中,5’utr的长度在1个和3000个核苷酸之间。可以通过不同的方法改变添加到编码区的5’和3’utr序列的长度,所述方法包括但不限于设计用于退火到utr的不同区域的pcr引物。使用该方法,本领域普通技术人员可以改变在转染转录的rna之后获得最佳翻译效率所需的5’和3’utr长度。
5’和3’utr可以是对于目的核酸来说天然存在的、内源性的5’和3’utr。备选地,可以通过将utr序列掺入到正向和反向引物中或通过模板的任何其它修饰加入不是目的核酸内源的utr序列。使用不是目的核酸内源的utr序列可以用于改变rna的稳定性和/或翻译效率。例如,众所周知3’utr序列中的富含au的元件可以降低mrna的稳定性。因此,可以基于本领域熟知的utr的性质来选择或设计3’utr以提高转录的rna的稳定性。
在一个实施方案中,5’utr可含有内源性核酸的kozak序列。备选地,当通过如上所述pcr加入不是目的核酸内源的5’utr时,可以通过加入5’utr序列来重新设计共有kozak序列。kozak序列可以提高一些rna转录物的翻译效率,但是似乎并非是确保所有rna有效翻译所需的。本领域已知许多mrna需要kozak序列。在其它实施方案中,5’utr可以是rna病毒的5’utr,所述病毒的rna基因组在细胞中是稳定的。在其它实施方案中,多种核苷酸类似物可用于3’或5’utr中以阻止mrna的核酸外切酶降解。
为了能够在不需基因克隆下从dna模板合成rna,应当把转录的启动子连接到待转录的序列的dna模板上游。当把充当rna聚合酶启动子的序列添加到正向引物的5’端时,rna聚合酶启动子变得掺入待转录的可读框的pcr产物上游中。在一个实施方案中,启动子为如本文在别处描述的t7聚合酶启动子。其它有用的启动子包括但不限于t3和sp6rna聚合酶启动子。用于t7、t3和sp6启动子的共有核苷酸序列是本领域已知的。
在一个实施方案中,mrna具有决定核糖体结合、翻译起始和细胞中mrna稳定性的5’端和3’聚(a)尾部上的帽。在环状dna模板上,例如质粒dna上,rna聚合酶产生不适于真核细胞中表达的多联体产物。在3’utr末端线性化的质粒dna的转录产生正常尺寸mrna,其即使在转录后聚腺苷酸化,在真核转染中也不是有效的。
在线性dna模板上,噬菌体t7rna聚合酶可以使转录物的3’端延伸超出模板的最后一个碱基(schenbornandmierendorf,nucacidsres.,13:6223-36(1985);nachevaandberzal-herranz,eur.j.biochem.,270:1485-65(2003)。
将一段聚a/t序列整合到dna模板中的常规方法为分子克隆。然而,整合到质粒dna中的聚a/t序列可以引起质粒不稳定,这就是为什么从细菌细胞得到的质粒dna模板通常是高度污染的,具有缺失及其它畸变。这使得克隆过程不仅费力而且费时,但通常不可靠。这就是为什么非常期望一种允许用一段聚a/t3序列而非克隆来构建dna模板的方法的原因。
可以通过使用含有聚t尾(例如100t尾部)(seqidno:31)的反向引物(尺寸可以为50-5000t(seqidno:32)),或在pcr之后通过任何其它方法(包括,但不限于dna连接或体外重组),在pcr期间产生所述的转录dna模板的聚a/t段。聚(a)尾也给rna提供稳定性并且减少其降解。通常,聚(a)尾部的长度与转录的rna的稳定性正相关。在一个实施方案中,聚(a)尾在100和5000个腺苷(例如,seqidno:33)之间。
可以在体外转录之后,使用聚(a)聚合酶比如大肠杆菌聚(a)聚合酶(e-pap),进一步延伸rna的聚(a)尾部。在一个实施方案中,聚(a)尾部的长度从100个核苷酸增加至在300至400个核苷酸(seqidno:34)之间,导致rna的翻译效率提高约两倍。另外,将不同的化学基团连接至3’端可以提高mrna稳定性。这样的连接可以含有修饰的/人工的核苷酸、适体及其它化合物。例如,可以使用聚(a)聚合酶将atp类似物掺入到聚(a)尾部中。atp类似物可以进一步提高rna的稳定性。
5’帽也给rna分子提供稳定性。在一个实施方案中,通过本文公开的方法产生的rna包括5’帽。使用本领域已知的(cougot,等人,trendsinbiochem.sci.,29:436-444(2001);stepinski,等人,rna,7:1468-95(2001);elango,等人,biochim.biophys.res.commun.,330:958-966(2005))和本文所述的技术提供5’帽。
通过本文公开的方法产生的rna也可以含有内部核糖体进入位点(ires)序列。ires序列可以是任何病毒、染色体或人工设计的序列,其引发帽独立性核糖体结合于mrna和促进翻译的起始。可以包括适于细胞电穿孔的任何溶质,其可以含有有助于细胞渗透性和生存力的因子,比如糖、肽、脂质、蛋白质、抗氧化剂和表面试剂。
可以使用大量不同方法中的任一种把rna引入到靶细胞中,所述方法为例如市售可获得的方法,其包括但不限于电穿孔(amaxanucleofector-ii(amaxabiosystems,cologne,germany))、(ecm830(btx)(harvardinstruments,boston,mass.)或genepulserii(biorad,denver,colo.)、multiporator(eppendort,hamburggermany)、使用脂质转染的阳离子脂质体介导的转染、聚合物包封、肽介导的转染、或生物弹粒子递送系统比如“基因枪”(参见例如nishikawa,等人humgenether.,12(8):861-70(2001)。
非病毒递送方法
在一些方面中,非病毒方法可用于递送编码本文所述的car的核酸到细胞或组织或受试者中。
在一些实施方案中,非病毒方法包括使用转座子(也称为转座元件)。在一些实施方案中,转座子是一段dna,其可以自身插入在基因组中的位置,例如,能够自我复制和插入其拷贝到基因组的一段dna,或一段dna片段,其可以从更长的核酸剪接出来并插入在基因组中另一个地方。例如,转座子包含由用于转座的基因侧翼的反向重复序列组成的dna序列。
使用转座子的核酸递送的示范性方法包括睡美人转座子系统(sbts)和piggybac(pb)转座子系统。见,例如,aronovichetal.hum.mol.genet.20.r1(2011):r14-20;singhetal.cancerres.15(2008):2961–2971;huangetal.mol.ther.16(2008):580–589;grabundzijaetal.mol.ther.18(2010):1200–1209;kebriaeietal.blood.122.21(2013):166;williams.moleculartherapy16.9(2008):1515–16;belletal.nat.protoc.2.12(2007):3153-65;anddingetal.cell.122.3(2005):473-83,所有这些都通过引用并入本文。
所述sbts包括两个组件:1)含有转基因的转座子和2)转座酶的来源。转座酶可以将来自载体质粒(或其他供体dna)的转座子转座到靶dna,诸如宿主细胞染色体/基因组。例如,转座酶结合至所述载体质粒/供体dna,从质粒中切割出转座子(包括转基因),并将其插入到宿主细胞的基因组中。见,例如,aronovich等,如上。
示例性转座子包括基于pt2的转座子。见,例如,grabundzijaetal.nucleicacidsres.41.3(2013):1829-47;和singhetal.cancerres.68.8(2008):2961–2971,所有这些都通过引用并入本文。示例性转座酶包括tc1/mariner型转座酶,例如,sb10转座酶或sb11转座酶(超活性转座酶,其可以例如,从巨细胞病毒启动子表达)。见,例如,aronovich等;kebriaei等人;和grabundzija等,所有这些都通过引用并入本文。
使用所述sbts允许转基因,例如,编码本文中所述的car的核酸有效整合和表达。本文提供了例如,使用转座子系统如sbts,产生细胞,例如,t细胞或nk细胞的方法,所述细胞稳定表达本文所述的car。
根据本文所述方法,在一些实施方案中,将含有sbts组件的一种或多种核酸,例如,质粒递送到细胞(例如,t细胞或nk细胞)。例如,通过标准的核酸(例如,质粒dna)递送方法,例如,本文描述的方法,例如,电穿孔,转染或脂转染递送核酸。在一些实施方案中,核酸含有包含转基因,例如,编码本文中所述的car的核酸的转座子。在一些实施方案中,核酸含有包含转基因的转座子(例如,编码本文中所述的car的核酸)以及编码转座酶的核酸序列。在其他实施方案中,提供有两个核酸的系统,例如,双质粒系统,例如,其中第一质粒含有包含转基因的转座子,并且第二质粒含有编码转座酶的核酸序列。例如,第一和第二核酸共同递送到宿主细胞中。
在一些实施方案中,通过使用sbts的基因插入与使用核酸酶的基因编辑(例如,锌指核酸酶(zfn),转录活化子样效应核酸酶(talens),crispr/cas系统或工程化的大范围核酸酶重新工程化的归巢内切核酸酶)的组合,产生表达本文所述的car的细胞,例如,t或nk细胞。
在一些实施方案中,使用递送的非病毒方法允许细胞例如,t细胞或nk细胞重新编程,并指导细胞输注到受试者。非病毒载体的优点包括但不限于容易和相对低成本产生满足患者群体所需的足够量,贮存过程中的稳定性和缺失免疫原性。
制造/生产方法
在一些实施方案中,本文公开的方法还包括在用细胞(例如本文所述的免疫效应细胞)处理后施用t细胞消耗剂,从而减少(例如,消耗)car表达细胞(例如,cd19car表达细胞)。这样的t细胞消耗剂可用于有效地消耗car表达细胞(例如cd19car表达细胞)以减轻毒性。在一些实施方案中,根据本文的方法制备car表达细胞,例如根据本文方法测定(例如,在转染或转导之前或之后)。
在一些实施方案中,在施用细胞(例如本文所述的免疫效应细胞群体)后一,二,三,四或五周施用t细胞消耗剂。
在一个实施方案中,t细胞消耗剂是例如通过诱导抗体依赖性细胞介导的细胞毒性(adcc)和/或补体诱导的细胞死亡而消耗car表达细胞的试剂。例如,本文所述的car表达细胞还可以表达由能够诱导细胞死亡,例如adcc或补体诱导的细胞死亡的分子识别的抗原(例如,靶抗原)。例如,本文所述的car表达细胞还可以表达能够被抗体或抗体片段靶向的靶蛋白(例如受体)。这些靶蛋白的实例包括但不限于epcam,vegfr,整联蛋白(例如整联蛋白ανβ3,α4,αι3/4β3,α4β7,α5β1,ανβ3,αν),tnf受体超家族的成员(例如trail-r1,trail-r2),pdgf受体,干扰素受体,叶酸受体,gpnmb,icam-1,hla-dr,cea,ca-125,muc1,tag-72,il-6受体,5t4,gd2,gd3,cd2,cd3,cd4,cd5,cd11,cd11a/lfa-1,cd15,cd18/itgb2,cd19,cd20,cd22,cd23/lge受体,cd25,cd28,
cd30,cd33,cd38,cd40,cd41,cd44,cd51,cd52,cd62l,cd74,
cd80,cd125,cd147/basigin,cd152/ctla-4,cd154/cd40l,
cd195/ccr5,cd319/slamf7,和egfr及其截短形式(例如,保留一个或多个胞外表位但是缺乏细胞质结构域内的一个或多个区域的形式)。
在一些实施方案中,car表达细胞共表达car和靶蛋白,例如天然表达靶蛋白或被工程化以表达靶蛋白。例如,细胞,例如免疫效应细胞群体可以包括包含car核酸(例如本文所述的car核酸)和编码靶蛋白的核酸的核酸(例如载体)。
在一个实施方案中,t细胞消耗剂是cd52抑制剂,例如抗cd52抗体分子,例如阿仑珠单抗。
在其它实施方案中,细胞,例如免疫效应细胞群体表达如本文所述的car分子(例如cd19car)和由t细胞消耗剂识别的靶蛋白。在一个实施方案中,靶蛋白是cd20。在靶蛋白是cd20的实施方案中,t细胞消耗剂是抗cd20抗体,例如利妥昔单抗。
在任何上述方法的进一步实施方案中,所述方法还包括将细胞例如造血干细胞或骨髓移植到哺乳动物中。
在另一方面,本发明的特征在于在细胞移植之前调节哺乳动物的方法。该方法包括向哺乳动物施用有效量的包含car核酸或多肽例如cd19car核酸或多肽的细胞。在一些实施方案中,细胞移植是干细胞移植,例如造血干细胞移植或骨髓移植。在其它实施方案中,在细胞移植之前调节受试者包括减少受试者中表达靶标的细胞,例如表达cd19的正常细胞或表达cd19的癌细胞的数目。
免疫效应细胞(例如,t细胞)的活化和扩增
通常可以使用例如美国专利6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利公开号20060121005中所述的方法进行免疫效应细胞如t细胞的活化和扩增。
通常,免疫效应细胞群,例如t调节细胞耗尽的细胞通过与连接有刺激cd3/tcr复合体相关的信号的作用剂和刺激t细胞表面上的共刺激性分子的配体的表面接触进行扩增。特别地,可以如本文所述的刺激t细胞群,比如通过与抗-cd3抗体或其抗原结合片段、或固定在表面上的抗-cd2抗体接触,或通过与钙离子载体协同与蛋白激酶c活化剂(例如苔藓抑素)接触。为了共刺激t细胞表面上的辅助分子,使用结合辅助分子的配体。例如,可以在适于刺激t细胞增殖的条件下,使t细胞群与抗-cd3抗体和抗cd28抗体接触。为了刺激cd4+t细胞或cd8+t细胞的增殖,可以使用抗-cd3抗体和抗-cd28抗体。可以如本领域已知的其它常用方法那样使用抗-cd28抗体的实例,包括9.3、b-t3、xr-cd28(diaclone,
在某些方面,可以通过不同的方案提供用于t细胞的初次刺激信号和共刺激信号。例如,提供每种信号的作用剂可以在溶液中或被偶联至表面。当与表面偶联时,可以把所述作用剂偶联到相同的表面(即,“顺式”形式)或单独的表面(即,“反式”形式)。备选地,可以把一种作用剂偶联到表面,且另一种作用剂可以在溶液中。在一个方面,提供共刺激信号的作用剂与细胞表面结合,且提供主要活化信号的作用剂在溶液中或被偶联至表面。在某些方面,两种作用剂都可以在溶液中。在一个方面,作用剂可以呈可溶性形式,然后被交联至表面,比如表达将会与该作用剂结合的fc受体或抗体或其它结合剂的细胞。在这点上,关于人工抗原呈递细胞(aapcs),参见例如美国专利申请公开号:20040101519和20060034810,考虑其在本发明中用于活化和扩增t细胞。
在一个方面,把两种作用剂都固定在珠上,在相同的珠上,即“顺式”,或在不同的珠上,即“反式”。例如,提供主要活化信号的作用剂是抗cd3抗体或其抗原结合片段,并且提供共刺激信号的作用剂是抗-cd28抗体或其抗原结合片段;并且两种作用剂以等同的分子数量被共同固定在相同珠上。在一个方面,使用与所述珠结合的每种抗体的1:1的比率,用于cd4+t细胞扩增和t细胞生长。在本发明的某些实施方案,使用与所述珠结合的抗cd3:cd28抗体的比率,使得与使用1:1的比率观察的扩增相比,观察到t细胞扩增的增加。在一个特别的方面,与使用1:1的比率观察的扩增相比,观察到约1至约3倍的增加。在一个方面,与所述珠结合的cd3:cd28抗体的比率范围为100:1至1:100及其中所有整数值。在一个方面,与粒子结合的抗-cd28抗体比抗cd3抗体多,即cd3:cd28的比率少于1。在某些方面,与珠结合的抗cd28抗体与抗cd3抗体的比率大于2:1。在一个特别的方面,使用1:100的与珠结合的抗体的cd3:cd28比率。在另一个方面,使用1:75的与珠结合的抗体的cd3:cd28比率。在一个进一步的方面,使用1:50的与珠结合的抗体cd3:cd28比率。在另一个实施方案,使用1:30的与珠结合的抗体的cd3:cd28比率。在一个方面,使用1:10的与珠结合的抗体的cd3:cd28比率。在一个方面,使用的与珠结合的抗体的1:3cd3:cd28比率。在还有一个方面中,使用3:1的与珠结合的抗体cd3:cd28比率。
可以使用1:500至500:1及其间任何整数值的粒子与细胞的比率来刺激t细胞或其它靶细胞。正如本领域普通技术人员可以容易地理解的那样,粒子与细胞的比率可以取决于相对于靶细胞的粒子尺寸。例如,小尺寸珠可能仅结合少数细胞,而较大珠可结合许多细胞。在某些方面,细胞与粒子的比率范围为1:100至100:1及其中任何整数值,并且在进一步的方面,也可以使用包括1:9至9:1的及其中任何整数值的比率来刺激t细胞。导致t细胞刺激的抗-cd3-和抗-cd28偶联的粒子与t细胞的比率可以如上所述变化,然而某些合适的值包括1:100、1:50、1:40、1:30、1:20、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1和15:1,一个合适的比率为至少1:1的粒子/t细胞。在一个方面,使用1:1或更小的粒子与细胞的比率。在一个特别的方面,合适的粒子:细胞比率为1:5。在进一步的方面,粒子与细胞的比率可以根据刺激的天数变化。例如,在一个方面,在第一天,粒子与细胞的比率为1:1至10:1,并且此后每天或每隔一天向细胞中加入另外的粒子,直到10天,最终比率为1:1至1:10(基于加入当天的细胞计数)。在一个特别的方面,在刺激的第一天,粒子与细胞的比率为1:1,并在刺激的第三天和第五天调节为1:5。在另一个方面,以每日或每隔一天为基准加入粒子至刺激的第一天最终比为1:1,且在刺激的第三天和第五天为1:5。在一个特别的方面,在刺激的第一天,粒子与细胞的比率为2:1,并在刺激的第三天和第五天调节为1:10。在一个方面,以每日或每隔一天为基准加入粒子至刺激的第一天最终比为1:1,且在刺激的第三天和第五天为1:10。本领域技术人员应当理解多种其它比率都可以适用于本发明。特别地,比率将根据粒径及细胞尺寸和类型而变化。在一个方面,在第一天,最典型的使用比率为约1:1、2:1和3:1左右。
在进一步的方面,将细胞比如t细胞与作用剂包被的珠混合,接着分离珠和细胞,然后培养细胞。在备选的方面,在培养之前,作用剂-包被的珠和细胞没有分离,而是一起培养。在一个进一步的方面,首先通过施加力(比如磁力)浓缩珠和细胞,导致细胞表面标记物的连接增加,从而诱导细胞刺激。
例如,可以通过允许附着了抗-cd3和抗-cd28的顺磁性的珠(3x28珠)与t细胞接触来连接细胞表面蛋白。在一个方面,将细胞(例如104至109个t细胞)和珠(例如,比率1:1的
在一个实施方案中,通过例如本文所述的方法扩增用编码car,例如,本文所述的car,例如,本文所述的cd19car的核酸转导的细胞。在一个实施方案中,将细胞在培养中扩增几个小时(例如,约2,3,4,5,6,7,8,9,10,15,18,21小时)到约14天(例如,1,2,3,4,5,6,7,8,9,10,11,12,13或14天)。在一个实施方案中,细胞被扩增4至9天。在一个实施方案中,细胞被扩增8天或更短,例如,7,6或5天。在一个实施方案中,所述细胞在培养中扩增5天,所得细胞比相同的培养条件下培养扩增9天的相同的细胞更有效。效力可以通过例如,由不同的t细胞的功能,例如增殖,靶细胞杀伤,细胞因子的产生,活化,迁移,或它们的组合来定义。在一个实施方案中,相比于在相同培养条件下扩增9天的相同细胞,扩增了5天的细胞,例如,本文所述的cd19car细胞显示细胞倍增的至少1、2、3或4倍增加。在一个实施方案中,所述细胞,例如,表达本文所述的cd19car的细胞培养扩增了5天,并且相比于在相同培养条件下扩增9天的相同细胞,所得的细胞显示出更高的促炎细胞因子产生,例如,ifn-γ和/或gm-csf的水平。在一个实施方案中,相比于在相同培养条件下扩增9天的相同细胞,扩增了5天的细胞,例如,本文所述的cd19car细胞显示出促炎细胞因子产生,例如,ifn-γ和/或gm-csf的水平以pg/ml计至少1、2、3、4、5、10倍或更多倍的增加。
也可能需要几个刺激循环,使得t细胞的培养时间可以为60天或以上。适于t细胞培养的条件包括合适的培养基(例如,极限必需培养基或rpmi培养基1640或x-vivo15,(lonza)),其可以含有增殖和生存所必需的因子,包括血清(例如胎牛血清或人血清)、白介素-1(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-12、il-15、tgfβ和tnf-α或本领域技术人员已知用于细胞生长的任何其它添加剂。用于细胞生长的其它添加剂包括,但不限于表面活性剂、plasmanate和还原剂比如n-乙酰基半胱氨酸和2-巯基乙醇。培养基可以包括rpmi1640、aim-v、dmem、mem、α-mem、f-12、x-vivo15和x-vivo20、optimizer,具有加入的氨基酸、丙酮酸钠和维生素、无血清或补充有适合量的血清(或血浆)或定义的激素组、和/或足以使t细胞生长和扩增的量的细胞因子。抗生素,例如青霉素和链霉素,仅包括在实验培养物中,而不在输注到受试者中的细胞培养物中。靶细胞保持在载体生长必需的条件下,例如适合的温度(例如37℃)和气氛(例如,空气加5%co2)。
在一个实施方案中,将细胞在合适的培养基(如,本文中所描述的培养基)中扩增,所述培养基包括导致细胞在14天的扩增期间增加至少200倍(例如,200倍,250倍,300倍,350倍)的一种或多种白介素,例如,如通过本文所述的方法如流式细胞术测定。在一个实施方案中,将细胞在il-15和/或il-7(例如il-15和il-7)存在下扩增。
在实施方案中,本文描述的方法,例如,car表达细胞的制造方法,包括例如,用抗cd25抗体或其片段,或cd25-结合配体il-2从细胞群体除去调节性t细胞,例如,cd25+t细胞。从细胞群体除去调节性t细胞,例如,cd25+t细胞的方法在本文中描述。在实施方案中,这些方法,例如,制造方法,进一步包括将细胞群(例如,其中调节性t细胞,例如cd25+t细胞已耗尽的细胞群;或已预先接触抗cd25抗体,或其片段,或cd25-结合配体的细胞群)与il-15和/或il-7接触。例如,细胞群(例如,已经预先接触抗cd25抗体,其片段,或cd25-结合配体的细胞群)在il-15和/或il-7的存在下扩增。
在一些实施方案中,在制造car表达细胞期间,本文所述的car表达细胞与包含白介素-15(il-15)多肽,白介素15受体α(il-15ra)多肽,或il-15多肽和il-15ra多肽例如,hetil-15的组合的组合物离体接触。在实施方案中,本文所述的car表达细胞与包含il-15多肽的组合物在制造car表达细胞期间例如,离体接触。在实施方案中,本文所述的car表达细胞与包含il-15多肽和il-15ra多肽的组合的组合物在制造car表达细胞期间,例如,离体接触。在实施方案中,本文所述的car表达细胞与包含hetil-15的组合物在制造car表达细胞期间,例如,离体接触。
在一个实施方案中,本文描述的car表达细胞与包含hetil-15的组合物在离体扩增期间接触。在一个实施方案中,本文描述的car表达细胞与包含il-15多肽的组合物在离体扩增期间接触。在一个实施方案中,本文描述的car表达细胞与包含il-15多肽和il-15ra多肽的组合物在离体扩增期间接触。在一个实施方案中,接触导致淋巴细胞亚群例如,cd8+t细胞的存活和增殖。
已经暴露于不同刺激时间的t细胞可以显示出不同的特征。例如,典型的血液或单采血液成分术外周血单核细胞产物具有大于细胞毒性或抑制t细胞群(tc,cd8+)的辅助t细胞群(th,cd4+)。通过刺激cd3和cd28受体的离体t细胞扩增产生t细胞群,该细胞群在约第8-9天前主要由th细胞组成,而在约第8-9天之后,t细胞群包括越来越大的tc细胞群。因此,根据治疗的目的,向受试者输注主要包括th细胞的t细胞群可能是有利的。类似地,如果已经分离了tc细胞的抗原特异性亚组,则使该亚组在更大程度上扩增可能是有益的。
进一步,除了cd4和cd8标记物之外,其它表型标记物显著变化,但大部分在细胞扩增过程中可再重现。因此,这样的可重现性使能够针对特定目的裁剪活化的t细胞产物。
一旦构建了本文描述的car,可以使用各种测定法来评估分子的活性,例如但不限于在抗原刺激后扩增t细胞的能力,在没有再刺激的情况下维持t细胞扩增,和在适当的体外和动物模型中的抗癌活性。评价本发明的car的效果的测定法在下面进一步详细说明。
可以使用原代t细胞中car表达的蛋白质印迹分析来检测单体和二聚体的存在,例如,如2015年3月13日提交的国际申请wo2015/142675的第695段所述,其通过引用整体并入本文。
抗原刺激后car+t细胞的体外扩增可以通过流式细胞术测定。例如,用αcd3/αcd28aapcs刺激cd4+和cd8+t细胞的混合物,随后用在待分析启动子控制下表达gfp的慢病毒载体转导。示例性启动子包括cmvie基因,ef-1α,泛素c或磷酸甘油激酶(pgk)启动子。通过流式细胞术在cd4+和/或cd8+t细胞亚群中培养的第6天评估gfp荧光。参见例如miloneetal.,moleculartherapy17(8):1453-1464(2009)。或者,在第0天用αcd3/αcd28包被的磁珠刺激cd4+和cd8+t细胞的混合物,并在第1天用car转导,使用表达car以及使用2a核糖体跳跃序列的egfp的双顺反子慢病毒载体。培养物用本文所述的癌症相关抗原+k562细胞(表达本文所述的癌症相关抗原的k562),野生型k562细胞(k562野生型)或表达hcd32和4-1bbl的k562细胞,在抗cd3和抗cd28抗体(k562-bbl-3/28)存在下再刺激培养物,然后洗涤。每隔一天以100iu/ml将外源il-2加入到培养物中。通过使用基于珠粒的计数通过流式细胞术列举gfp+t细胞。参见例如miloneetal.,moleculartherapy17(8):1453-1464(2009)。
也可以测量在没有再刺激的情况下持续的car+t细胞扩增。参见例如miloneetal.,moleculartherapy17(8):1453-1464(2009)。简而言之,在第0天用αcd3/αcd28包被的磁珠刺激之后,使用coultermultisizeriii颗粒计数器nexcelomcellometervision或milliporescepter在培养的第8天测量平均t细胞体积(fl),在第1天用所示的car转导。
也可以使用动物模型来测量表达car的细胞活性,例如,如2015年3月13日提交的国际申请wo2015/142675的第698段所述,其全部内容通过引用并入本文。
可以评估剂量依赖性car治疗应答,例如,如2015年3月13日提交的国际申请wo2015/142675的第699段所述,其全部内容通过引用并入本文。
之前已经描述了细胞增殖和细胞因子产生的评估,如2015年3月13日提交的国际申请wo2015/142675的第700段所述,其全部内容通过引用并入本文。
细胞毒性可以通过标准的51cr释放测定来评估,例如,如2015年3月13日提交的国际申请wo2015/142675的第701段所述,其全部内容通过引用并入本文。
也可以通过测量贴壁细胞电阻抗的变化来评估细胞毒性,例如使用xcelligence实时细胞分析仪(rtca)。在一些实施方案中,在多个时间点测量细胞毒性。
成像技术可用于评估荷瘤动物模型中car的特异性运输和增殖,例如,如2015年3月13日提交的国际申请wo2015/142675的段落702所述,其全部内容通过引用并入本文。
其他测定法,包括本文实施例部分中描述的那些以及本领域已知的那些也可用于评估本文所述的car。
备选地或与本文公开的方法组合,公开了用于以下一种或多种的方法和组合物:检测和/或定量car表达细胞(例如体外或体内(例如临床监测));免疫细胞扩增和/或活化;和/或car特异性选择,其涉及使用car配体。在一个示例性实施方案中,car配体是结合car分子的抗体,例如结合car的细胞外抗原结合结构域的抗体(例如,结合抗原结合结构域的抗体,例如抗独特型抗体;或结合细胞外结合结构域的恒定区的抗体)。在其它实施方案中,car配体是car抗原分子(例如本文所述的car抗原分子)。
一方面,公开了一种用于检测和/或定量car表达细胞的方法。例如,car配体可用于在体外或体内检测和/或定量car表达细胞(例如,临床监测患者中car表达细胞或对患者给药)。该方法包括:
提供car配体(任选地,标记的car配体,例如包括标签,珠,放射性或荧光标记的car配体);
获取car表达细胞(例如,获取含有car表达细胞的样品,例如制造样品或临床样品);
在发生结合的条件下使car表达细胞与car配体接触,从而检测存在的car表达细胞的水平(例如,量)。car表达细胞与car配体的结合可以使用标准技术如facs,elisa等检测。
另一方面,公开了扩增和/或激活细胞(例如免疫效应细胞)的方法。该方法包括:
提供car表达细胞(例如,第一car表达细胞或瞬时表达car细胞);
在发生免疫细胞扩增和/或增殖的条件下使所述car表达细胞与car配体例如本文所述的car配体接触,从而产生活化和/或扩增的细胞群体。
在某些实施方案中,car配体存在于(例如,固定化或连接到)基质,例如非天然存在的基质上。在一些实施方案中,基质是非细胞基质。非细胞基质可以是选自例如平板(例如,微量滴定板),膜(例如硝酸纤维素膜),基质,芯片或珠粒的固相支持体。在实施方案中,car配体存在于基质(例如,在基质表面上)。car配体可以固定,附着或共价或非共价结合(例如交联)至基质。在一个实施方案中,将car配体连接(例如共价连接)到珠粒上。在上述实施方案中,免疫细胞群可以在体外或离体扩增。该方法还可以包括在car分子的配体存在下培养免疫细胞群体,例如使用本文所述的任何方法。
在其它实施方案中,扩增和/或活化细胞的方法还包括添加第二刺激分子例如cd28。例如,car配体和第二刺激分子可固定在基质例如一个或多个珠粒上,从而提供增加的细胞扩增和/或活化。
另一方面,提供了一种用于选择或富集car表达细胞的方法。该方法包括使car表达细胞与本文所述的car配体接触;并基于car配体的结合选择细胞。
在其它实施方案中,提供了用于消耗,减少和/或杀死car表达细胞的方法。该方法包括使car表达细胞与本文所述的car配体接触;并基于car配体的结合靶向细胞,从而减少car表达细胞的数量和/或杀死car表达细胞。在一个实施方案中,car配体与毒性剂(例如毒素或细胞消融性药物)偶联。在另一个实施方案中,抗独特型抗体可以引起效应细胞活性,例如adcc或adc活性。
可以在本文公开的方法中使用的示例性抗car抗体描述于例如wo2014/190273和jjenaetal.,“chimericantigenreceptor(car)-specificmonoclonalantibodytodetectcd19-specifictcellsinclinicaltrials”,plosmarch20138:3e57838,其内容通过引用并入。
在一些方面和实施方案中,本文的组合物和方法针对t细胞的特定子集进行了优化,例如如2015年7月31日提交的美国系列号pct/us2015/043219中所述,其内容通过引用整体并入本文。在一些实施方案中,与对照t细胞(例如表达相同构建体的不同类型的t细胞(例如,cd8+或cd4+))相比,t细胞的优化子集显示增强的持续性。
在一些实施方案中,cd4+t细胞包含本文所述的car,所述car包含适于cd4+t细胞(例如,为导致在cd4+t细胞中增强的持久性而优化)的胞内信号结构域,例如icos结构域。在一些实施方案中,cd8+t细胞包含本文所述的car,所述car包含适于cd8+t细胞(例如,为导致cd8+t细胞增强的持久性而优化)的胞内信号结构域,例如4-1bb结构域,cd28结构域或icos结构域以外的另一共刺激结构域。在一些实施方案中,本文所述的car包含本文所述的抗原结合结构域,例如包含抗原结合结构域的car。
在一方面,本文描述了治疗受试者,例如患有癌症的受试者的方法。该方法包括向所述受试者施用有效量的:
1)包含car的cd4+t细胞(carcd4+)
其包含:
抗原结合结构域,例如本文所述的抗原结合结构域;
跨膜结构域;和
胞内信号结构域,例如第一共刺激结构域,例如icos结构域;和
2)包含car的cd8+t细胞(carcd8+),其包含:
抗原结合结构域,例如本文所述的抗原结合结构域;
跨膜结构域;和
胞内信号结构域,例如第二共刺激结构域,例如4-1bb结构域,cd28结构域或除icos结构域之外的另一共刺激结构域;
其中carcd4+和carcd8+彼此不同。
任选地,所述方法还包括施用:
3)包含car的第二cd8+t细胞(第二carcd8+),其包含:
抗原结合结构域,例如本文所述的抗原结合结构域;
跨膜结构域;和
胞内信号结构域,其中第二carcd8+包含不存在于carcd8+上的胞内信号结构域,例如共刺激信号结构域,并且任选地不包含icos信号结构域。
生物聚合物递送方法
在一些实施方案中,本文公开的一种或多种car表达细胞可经由生物聚合物支架(例如生物聚合物植入物)施用或递送至受试者。生物聚合物支架可以支持或增强本文所述的car表达细胞的递送,扩增和/或分散。生物聚合物支架包含生物相容性(例如,基本上不诱导炎性或免疫应答)和/或可天然存在或合成的可生物降解的聚合物。示例性生物聚合物描述于例如在2015年3月13日提交的国际申请wo2015/142675的段落1004-1006中,其全部内容通过引用并入本文。
药物组合物和治疗
在一些方面,本公开提供了治疗患者的方法,其包括施用如本文所述产生的表达car的细胞,任选地与一种或多种其它疗法组合。在一些方面,本公开提供了治疗患者的方法,包括施用包含如本文所述的car表达细胞的反应混合物,任选地与一种或多种其它疗法组合。在一些方面,本公开提供了运送或接收包含如本文所述的car表达细胞的反应混合物的方法。在一些方面,本公开提供了一种治疗患者的方法,其包括接收如本文所述产生的表达car的细胞,并且还包括向患者施用car表达细胞,任选地与一种或多种其它疗法组合。在一些方面,本公开提供了一种治疗患者的方法,包括产生本文所述的car表达细胞,并且还包括向患者施用car表达细胞,任选地与一种或多种其它疗法组合。其他疗法可以是例如癌症疗法,例如化疗。
在一个实施方案中,本文所述的表达car的细胞与减少treg细胞群的分子组合施用于受试者。减少treg细胞的数量(例如,耗尽)的方法在本领域中是已知的,并且包括,例如,cd25耗尽,环磷酰胺给药,调节gitr功能。不希望受理论的束缚,但相信在单采血液成分术前或施用所述的car表达细胞前,降低受试者中treg细胞的数目减少了肿瘤微环境中不希望的免疫细胞(例如,treg细胞)的数目并降低了受试者复发的风险。
在一个实施方案中,本文所述的疗法,例如,表达car的细胞与靶向gitr和/或调节gitr功能,诸如gitr激动剂和/或耗尽调节性t细胞(tregs)的gitr抗体的分子组合施用于受试者。在实施方案中,表达本文所述的car细胞与环磷酰胺组合施用于受试者。在一个实施方案中,gitr结合分子和/或调节gitr功能的分子(例如,gitr激动剂和/或treg耗尽gitr抗体)在car表达细胞之前施用。例如,在一个实施方案中,gitr激动剂可以在细胞的单采血液成分术之前施用。在实施方案中,在施用(例如,输注或再输注)car表达细胞之前或在细胞的单采血液成分术之前将环磷酰胺施用于受试者。在实施方案中,在施用(例如,输注或再输注)car表达细胞之前或在细胞的单采血液成分术前将环磷酰胺和抗gitr抗体施用于受试者。在一个实施方案中,受试者患有癌症(例如,实体癌症或诸如all或cll的血液癌症)。在一个实施方案中,受试者患有cll。在实施方案中,受试者患有all。在实施方案中,受试者患有实体癌,例如,本文所述的实体癌。示例性的gitr激动剂包括例如gitr融合蛋白和抗-gitr抗体(例如,二价抗gitr抗体),比如例如美国专利号∶6,111,090、欧洲专利号:090505b1、美国专利号:8,586,023、pct公开号∶wo2010/003118和2011/090754中描述的gitr融合蛋白,或例如在美国专利号∶7,025,962、欧洲专利号∶1947183b1、美国专利号:7,812,135、美国专利号:8,388,967、美国专利号:8,591,886、欧洲专利号:ep1866339、pct公开号:wo2011/028683、pct公开号:wo2013/039954、pct公开号:wo2005/007190、pct公开号:wo2007/133822、pct公开号:wo2005/055808、pct公开号:wo99/40196、pct公开号:wo2001/03720、pct公开号:wo99/20758、pct公开号:wo2006/083289、pct公开号:wo2005/115451、美国专利号∶7,618,632和pct公开号:wo2011/051726中所述的抗gitr抗体。
在一个实施方案中,将本文所述表达car的细胞与gitr激动剂(例如,本文所述gitr激动剂)联合施用给受试者。在一个实施方案中,在表达car的细胞之前,施用gitr激动剂。例如,在一个实施方案中,可以在细胞的单采血液成分术之前,施用gitr激动剂。在一个实施方案中,受试者患有cll。
本文所述的方法还可包括在药物组合物中配制car表达细胞。药物组合物可以包含与一种或多种药学上可接受的或生理上可接受的载体、稀释剂或赋形剂组合的表达car的细胞,例如,许多表达car的细胞(正如本文中描述的那样)。这样的组合物可以包含缓冲液例如中性的缓冲盐水、磷酸缓冲盐水以及诸如此类;碳水化合物例如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸例如甘氨酸;抗氧化剂;螯合剂例如edta或谷胱甘肽;佐剂(例如氢氧化铝);和防腐剂。组合物可以配制成例如用于静脉内施用。
在一个实施方案中,所述的药物组合物基本上不含有污染物,例如,没有可检测到的水平的污染物,例如,该污染物选自由下列组成的组:内毒素、支原体、有复制能力的慢病毒(rcl)、p24、vsv-g核酸、hivgag、残留的抗cd3/抗cd28包被的珠、小鼠抗体、汇合的人血清、牛血清白蛋白、牛血清、培养基组分、包装载体的细胞或质粒组件、细菌和真菌。在一个实施方案中,所述的细菌是选自由下列组成的组的至少一种:粪产碱菌(alcaligenesfaecalis),白念珠菌(candidaalbicans),大肠杆菌(escherichiacoli),流感嗜血杆菌(haemophilusinfluenza),脑膜炎奈瑟菌(neisseriameningitides),绿脓假单胞菌(pseudomonasaeruginosa),金黄色葡萄球菌(staphylococcusaureus),肺炎链球菌(streptococcuspneumonia),和酿脓链球菌a群(streptococcuspyogenesgroupa)。
当指示“免疫学上有效量”,“抗癌有效量”,“抑制癌有效量”或“治疗有效量”时,将要被施用的组合物的精确数量可以由医师在考虑个体在年龄、体重、肿瘤大小、感染或转移的程度以及患者(受试者)的状况的情况下确定。一般地可以声明:可以以104至109个细胞/kg体重(在一些情况下105至106个细胞/kg体重,包括这些范围内所有的整数值)的剂量,施用包含本文中描述的免疫效应细胞(例如,t细胞,nk细胞)的药物组合物。也可以在这些剂量下多次施用t细胞组合物。可以通过使用免疫疗法中通常已知的输注技术来施用细胞。
在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含至少约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含至多约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如cd19car细胞)的剂量包含约1.1x106–1.8x107细胞/kg。在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含至少约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。在一些实施方案中,car细胞(例如,cd19car细胞)的剂量包含至多约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。
在某些方面,可能需要向受试者施用活化的免疫效应细胞(例如,t细胞,nk细胞),然后随后重新抽取血液(或进行单采血液成分术),活化免疫效应细胞(例如,t细胞,nk细胞),并且用这些活化和扩增的免疫效应细胞(例如,t细胞,nk细胞)再次输注患者。这个过程可以每几周进行多次。在某些方面,免疫效应细胞(例如,t细胞,nk细胞)可以从10cc至400cc的抽血活化。在某些方面,免疫效应细胞(例如,t细胞,nk细胞)从20cc,30cc,40cc,50cc,60cc,70cc,80cc,90cc或100cc的抽血中活化。
主题组合物的施用可以以任何方便的方式进行。本文所述的组合物可以经动脉,皮下,皮内,肿瘤内,淋巴结内,髓内,肌肉内,静脉内(i.v.)注射或腹膜内注射,例如通过皮内或皮下注射施用于患者。免疫效应细胞(例如,t细胞,nk细胞)的组合物可以直接注射到肿瘤,淋巴结或感染部位。
实施例
通过参考以下实验实施例进一步详细描述本发明。这些实施例仅是为了说明的目的而提供的,除非另有说明,否则不是限制性的。因此,本发明绝不应被解释为限于以下实施例,而应理解为包括由于本文提供的教导而变得显而易见的任何和所有的变型。
实施例1:用外源性细胞因子优化cart生产
细胞因子具有与t细胞扩增,分化,存活和内稳态相关的重要功能。临床使用的最重要的细胞因子家族之一是常见的γ链(γc)家族细胞因子,其包括白介素(il)-2,il-4,il-7,il-9,il-15和il-21(liaoetal.,2013,immunity,38:13-25)。il-2作为癌症的免疫治疗剂被广泛研究。临床试验中il-2的补充增强了抗cd19car-t细胞的抗肿瘤能力(xuetal.,2013,lymphoma,54:255-60)。然而,il-2的施用受到副作用和调节性t细胞扩增倾向以及活化的诱导的细胞死亡(aicd)的影响的限制(maleketal.,2010,immunity,33:153-65;和lenardoetal.,1999,annurevimmunol,17:221-53)。il-7,il-15和il-21各自可以提高过继性免疫疗法的有效性,并且与il-2相比似乎毒性较低((alvesetal.,2007,immunollett,108:113-20)。尽管对上述细胞因子的作用进行了广泛的临床前和临床研究,但是缺乏对多种外源γc细胞因子对car-t细胞过继疗法的作用的多参数比较研究。
除了γ-链细胞因子外,il-18是调节免疫应答的另一种免疫刺激细胞因子,其增强t细胞的ifn-γ产生,增加ctl的细胞溶解活性(srivastavaetal.,2010,currmedchem,17:3353-7)。即使剂量高达1000μg/kg,il-18的施用也是安全和良好耐受的(robertsonetal.,2006,clincancerres,12:4265-73)。因此,il-18可能是用于增强car-t细胞抗肿瘤活性的另一种候选药物。
在该实施例中,检查了不同外源细胞因子的施用对t细胞和叶酸受体α(frα).cart细胞的扩增,表型,体外效应子功能和体内抗肿瘤功效的影响。
在本实施例中描述的实验中使用以下材料和方法。
car构建和慢病毒制备
pelns-c4-27zcar载体如前所述构建(评审中的手稿)。简言之,将含有抗frαc4/afra4scfv的phen2质粒用作c4片段的pcr扩增模板,使用引物5′-ataggatcccagctggtggagtctgggggaggc-3′(seqidno:19)和5′-atagctagcacctaggacggtcagcttggtccc-3′(seqidno:24)(bamhi和nhei加下划线)。pcr产物和第三代自灭活慢病毒表达载体pelns用bamhi和nhei消化。然后将消化的pcr产物插入含有cd27-cd3zt细胞信号结构域的pelns载体,该载体中延伸因子-1α(ef-1α)启动子驱动转基因的表达。
通过使用如前所述的expressin(openbiosystems),用四种质粒(pvsv-g,prsv.rev,pmdlg/p.rre和pelns-c4-27zcar)转染人胚胎肾细胞系293t(293t)细胞产生高滴度复制缺陷型慢病毒。转染后24h和48h收集上清液,并通过超速离心浓缩。通过使用有限稀释法,基于慢病毒向supt1细胞的转导效率确定病毒滴度。
t细胞和细胞系
根据美国宾夕法尼亚大学的大学机构审查委员会批准的方案在知情同意后,从健康供体获得外周血淋巴细胞。通过阴性选择纯化后,主要t细胞购自人类免疫学核心。将t细胞在完全培养基(补充有10%fbs,100u/ml青霉素,100μg/ml硫酸链霉素的rpmi1640)中培养,并用抗cd3和抗cd28mab包被的珠粒(invitrogen)以1:1的比例按照说明书刺激。活化后24小时,细胞用慢病毒以5的moi转导。从第二天向转导的t细胞中加入终浓度为10ng/ml的所示细胞因子。细胞因子每3天更换一次。
用于慢病毒包装的293t细胞和用于慢病毒滴定的supt1细胞从atcc获得。将已建立的卵巢癌细胞系skov3(frα+)和c30(frα-)用作细胞因子分泌和细胞毒性测定的靶细胞。对于生物发光测定,skov3用慢病毒转导以表达萤火虫萤光素酶(fluc)。
流式细胞分析和细胞分选
流式细胞术在bdfacscanto上进行。抗人cd45(hi30),cd3(hit3a),cd8(hit8a),cd45ra(hi100),cd62l(dreg-56),ccr7(g043h7),il-7rα(a019d5),cd27(m-t271),cd28(cd28.2),cd95(dx2),tnf-α(mab11),ifn-γ(4s.b3),il-2(mq1-17h12),穿孔蛋白(b-d48),粒酶-b(gb11)从biolegend获得。生物素-sp缀合的兔抗人igg(h+l)购自jacksonimmunoresearch,apc共轭的链霉抗生物素蛋白购自biolegand。抗人bcl-xl(7b2.5)购自souhernbiotech。细胞凋亡试剂盒和trucount管从bdbioscience获得。对于外周血t细胞计数,通过眶后取血获得血液,并染色确定人cd45,cd3,cd4和cd8t细胞的存在。按照制造商的说明书,用trucount管定量人cd45+门控的,cd3+,cd4+和cd8+亚组。
过继细胞疗法的体内研究
从宾夕法尼亚大学艾布拉姆森癌症中心的干细胞和异种移植中心(stemcellandxenograftcoreoftheabramsoncancercenter,universityofpennsylvania)获得8至12周龄的雌性非肥胖糖尿病/重度联合免疫缺陷/γ链-/-(nsg)小鼠。在第0天将小鼠皮下接种3×106个fluc+skov3细胞。在治疗前,每组4只或5只小鼠随机分组。肿瘤变得可触知,如前所述活化并转导人原代t细胞。t细胞在il-2(5ng/ml)存在下扩增约2周。当肿瘤负荷为~250-300mm3,静脉内注射5×106个car-t细胞或100μl盐水,然后每日腹膜内注射5μgil-2,il-7,il-15,il-18,il-21或磷酸缓冲溶液(pbs)7天。用卡尺测量肿瘤尺寸,用下列公式计算肿瘤体积:肿瘤体积=(长×宽2)/2。眶后取血后通过流式细胞术测定受体小鼠血液中转移的t细胞的数量和表型。当肿瘤体积大于2000mm3时,将小鼠安乐死,并立即切除肿瘤进行进一步分析。
统计分析
使用prism5(graphpad软件)和ibmspssstatistics20.0软件进行统计分析。除非明确指出,数据显示为平均值±sem。配对样本t检验或非参数wilcoxon秩检验用于比较两组,并使用重复测量anova或friedman检验来检验三组或更多组之间差异的统计学显著性。当p值小于0.05时,结果被认为是统计学显著的。
结果
1.抗-frαc4car的构建和表达
pelns-c4-27zcar由与cd8α铰链和跨膜区连接的抗frαc4scfv,接着是与cd27细胞内信号传导基序串联的cd3ζ信号传导部分组成(图1a)。原代人t细胞用c4car慢病毒载体有效转导,在转导后48h检测到转导效率为43%~65%(图1b)。car表达水平在cd4+和cd8+t细胞之间是相当的(52.6±10.2%vs.49.5±17.1%,p=0.713)。
2.细胞因子对car转导的t(car-t)细胞扩增的影响
研究了各种γc细胞因子和il-18存在下,car-t细胞的扩增和积累。在暴露于培养物中不同细胞因子三周后,已经在il2,il-7或il-5存在下培养的car-t细胞扩增了1000-2000倍。在il-18,il-21或nc(对照,无细胞因子)存在下培养的car-t细胞显示少于200倍的扩增(图1c)。
在不同t细胞群体:cd3+,cd4+和cd8+t细胞中转导后15天比较car表达水平。在不同细胞因子存在下生长的各组car-t细胞的car表达水平在cd3+,cd4+和cd8+t细胞群体中相似。在il-21存在下培养的car-t细胞显示比暴露于其它细胞因子的car-t细胞(包括il-2)和在cd3+和cd4+t细胞群体中在细胞因子(nc)存在下不生长的对照细胞更高水平的car表达(图1d)。
分析了导致car-t细胞较高积累的原因,特别地,评估了t细胞的增殖和凋亡。通过监测培养7天的cfse标记的t细胞的细胞分裂来测量增殖反应。如图1e所示,用il-2和il-15培养的t细胞显示出最高的增殖能力,其次是il-7;而il-21和il-18是不太有效的促有丝分裂刺激物。使用annexin-v染色测试在不同细胞因子中培养的t细胞的凋亡。结果表明,与nc,il-18和il-21组相比,用il-2,il-7和il-15培养的t细胞经历较少凋亡(图1f)。接下来,通过facs分析检查淋巴细胞凋亡的关键负调节物bcl-xl的表达。与图1f中的凋亡结果一致,存在il-2,il-7和il-15暴露导致cd4+和cd8+t细胞中bcl-xl表达上调,而il-21不增加bcl-xl表达(图1g和1h)。这些结果表明,在细胞因子例如il-2,il-7或il-15的存在下扩增的t细胞的增加的积累可能由增殖增加和通过bcl-xl抗凋亡途径的活化引起的凋亡减少两者所造成。
3.细胞因子对car-t细胞表型的影响
接下来,检查在存在外源性细胞因子的情况下扩增的car-t细胞的表型。来自健康供体的新鲜t细胞通常基于cd45ra和cd62l表达分为四个亚组:1)初始t细胞(cd45ra+cd62l+,称为tn),2)中央记忆t细胞(cd45ra-cd62l+,称作tcm),3)效应记忆t细胞(cd45ra-cd62l-,称为tem)和4)cd45ra阳性效应t细胞(cd45ra+cd62l-,简称temra)。然后进一步评估每个亚组ccr7,cd27,cd28和cd95的表达(图2a)。后三种t细胞亚群对cd95阳性,而仅有一小部分tn表达cd95(cd4+中为3.6±1.4%,cd8+t细胞中为3.7±1.3%)。这个小群体也共同表达cd27,cd28和ccr7,被认为是记忆干细胞(tscm)。然而,在用car进行慢病毒转导前后用抗cd3/cd28珠刺激后,cd95在该群体中极大地上调到接近100%(图2b)。与新鲜t细胞相比,在cd4+和cd8+t和car-t细胞中抗cd3/cd28珠刺激后,cd45ra+cd62l+cd95+t细胞的百分比大大增加(图2c和2d)。该群体同时高水平表达cd27,cd28和ccr7(图2a),表明其可以定义为tscm。此外,cd8+car-t细胞具有较高百分比的tscm细胞,这可能与初始cd8+t细胞中tn的较高比例有关(图2f和2g)。
与各种细胞因子共培养后14天,通过测量cd45ra,cd62l和cd95的表达来研究car-t细胞的t细胞亚群的比例。如图2e所示,在cd4+car-t细胞中,与il-2组相比,il-7组中存在显著较高百分比的tscm细胞,而nc和il-18组存在较低百分比的tscm,但较高百分比的tcm。il-15组中t细胞亚群的分布与il-2组相似,而il-21组tcm百分比较高,而tscm百分比与il-2组相当。对于每个细胞因子给药组的四种t细胞亚群的分化和分布,cd8+car-t细胞表现出与cd4+car-t细胞相似的趋势,与cd8+car-t细胞的相应组中cd4+car-t细胞相比,tscm的比例较高。
进一步研究了各种car-t细胞亚群自我更新和分化成其他细胞类型的能力。基于car,cd45ra和cd62l表达对car-t细胞的四个亚组进行分选,并在含有il-2的培养基中分别培养3天。如图2h所示,tscm亚组能够分化为所有其他三个亚组,tcm和temra亚组能够分化为tem。这些结果表明cd62l+和cd45ra+t细胞能分别分化成cd62l和cd45ra-t细胞。通过cfse稀释法评估四个亚组的增殖能力,然后进行比较。结果表明,tscm表现出比其他亚组更强的增殖能力(图2i)。此外,cd45ra表达与cfse强度呈负相关,而cd62l和ccr7表达与增殖正相关。在所有细胞因子组中,cd45ra+t细胞表现出比cd45radim和阴性t细胞低得多的cfse水平(图3),表明cd45ra+t细胞具有比cd45ra-t细胞更强的增殖活性。因此,在il-2,il-7和il-15存在下生长的t细胞的增加的积累可能与cd45ra+t细胞(其增殖能力增加)的增加的比例有关(图4b)。
对于car-t细胞的表型,car-t细胞表现出较低的cd45ra,cd62l,cd27和cd28的表达,但在t细胞表面上ccr7的表达较高(图4a)。基于以下表面标记:cd27,cd28,cd62l,ccr7和il7rα的表达,进一步评估细胞因子对car-t细胞表型的影响。在il-18存在下生长的car-t细胞与不补充细胞因子而生长的细胞呈非常相似的表达模式。与nc对照相比,il-2显著下调cd27,cd28cd62l,ccr7和ilr7α的表达。其他γc细胞因子中,与il-2暴露的car-t细胞相比,il-7暴露的car-t细胞呈现更高的cd62l,cd27和cd28表达,但显著降低的ccr7表达;il-15组car-t细胞呈现更高的cd27和cd28表达;il-21暴露的car-t细胞呈现更高的cd62l,ccr7,cd27和cd28表达,表明il-2暴露诱导具有比所有其他组更成熟的t细胞表型的t细胞亚群的扩增(图4b)。
4.细胞因子对car-t细胞效应子功能的影响
为了研究细胞因子对car-t细胞效应子功能的影响,评估了用表达frα的skov3细胞刺激后car-t细胞的细胞因子产生能力。刺激5小时后,在car-t细胞的细胞质中检测到tnf-α,ifn-γ和il-2,其中41.5-54.0%的car-t细胞产生tnf-α,12.4-15.3%的car-t细胞产生ifnγ,4.3-6.5%的car-t细胞产生il-2(图5a和b)。在扩增期间il-2,il-7和il-15暴露促进car-t细胞产生tnf-α,而产生ifn-γ和il-2的car-t细胞数目在所有细胞因子组中相当(图5b,5c和5d)。接下来,比较响应car-t细胞的分数及其多功能性(图5e)。与扩增期间暴露于il-2相比,在扩增期间暴露于il-18,il-21或无细胞因子暴露诱导了较少的产生细胞因子的car-t细胞,而较少的car-t细胞具有被靶细胞刺激时产生多种细胞因子的能力。这些结果与如下表型一致:il-18,il-21和nc组中的car-t细胞比il-2暴露组中的car-t细胞分化程度低。
然后,确定扩增期间细胞因子暴露对抗原刺激后细胞溶解分子穿孔蛋白和粒酶b的表达的影响(图5i)。与tnf-α生产类似,暴露于il-2,il-7和il-15的car-t细胞与暴露于nc,il-18和il-21的car-t细胞相比,表现出增加的穿孔蛋白表达。然而,尽管暴露于il-21的car-t细胞产生较少的tnf-α和穿孔蛋白,但它们产生最高水平的粒酶-b。在扩增期间暴露于il-2和il-15的car-t细胞中观察到下一个最高水平的粒酶-b产生。il-18组中的car-t细胞在抗原刺激后呈现最少量的穿孔蛋白和粒酶-b表达(图5g和5h)。
最后,通过萤光素酶测定法定量暴露于多种细胞因子的car-t细胞在暴露期间的肿瘤裂解活性。如图5f所示,与il-2和il-15共培养的car-t细胞比与nc和il-18共培养的那些car-t细胞更有效地裂解skov3(均p<0.05)。
car-t细胞表型与其功能之间的关联被进一步证实。在基于car和cd62l表达的慢病毒转导后14天分选t细胞。与cd62l-car-t细胞(tem和temra)相比,cd62l+car-t细胞(tscm和tcm)表现出较少的细胞因子产生活性和较弱的细胞溶解能力(图6)。在这个角度来看,暴露于il-2和il-15的car-t细胞产生更多的细胞因子并呈现更强的肿瘤裂解活性,这可能部分归因于这些组中tem和temra的较高比例。
5.抗原攻击后car-t细胞的扩增和表型
为了研究细胞因子对特定抗原攻击下car-t细胞扩增的影响,将暴露于il-2两周的car-t细胞与skov3(frα+)或c30(frα-))细胞在指示的细胞因子存在下共培养7天。类似于无抗原的情况,暴露于il-2,il-7和il-15的car-t细胞比暴露于其它细胞因子的car-t细胞呈现更高倍数的扩增。在扩增期间暴露于il-21的car-t细胞更可能经历细胞凋亡(图7a)。然而,当暴露于指定的细胞因子两周的car-t细胞与skov3或c30细胞在没有另外的细胞因子补充情况下共同培养7天时,所有组中car-t细胞的积累是相当的,暴露于il-15和il-18的那些细胞经历最少量的凋亡(图7b)。具有最高car表达的t细胞是在扩增期间暴露于il-21的组(图7c)。还分析了car-t细胞的表型。cd27和cd28分别在所有细胞因子组中在cd8+和cd4+car-t细胞中高表达。类似于无抗原扩增,il-21暴露增加了car-t细胞中cd27和cd28的表达(图7d)。对于记忆t细胞的四个亚组,结果不同于无抗原研究:tscm是罕见的,并且tem在无细胞因子,il-18和il-21的所有组中都占50%以上。细胞因子对记忆t亚组的组成没有显著影响,il-7暴露不利于tscm的增加(图7e)。
6.各种细胞因子在动物模型中的抗肿瘤功效
为了评估car-t细胞的体外扩增过程中各种细胞因子对体内car-t细胞功效的影响,采用nsg小鼠卵巢癌异种移植模型研究了car-t细胞的持续性及其结果。用两次剂量的5×106c4-27zcar-t细胞静脉内注射带有皮下skov3肿瘤的小鼠,所述car-t细胞之前已经离体暴露于指定的细胞因子2周(图8a)。与注射未转染的t细胞和抗cd19car-t细胞的那些小鼠相比,接受c4-27zcar-t细胞输注的所有小鼠呈现较少的肿瘤负担(图8b和8c)。在各种细胞因子组中,接受先前il-2暴露的car-t细胞的小鼠显示出最高的肿瘤负担,与这些小鼠中循环的人t细胞的最少量一致。nc,il-7,il-15,il-18和il-21组中肿瘤均被显著抑制甚至消失,肿瘤大小无统计学差异。在过继转移后15天和32天确定外周血中转移的t细胞的持续性。接受il-7和il-21处理的car-t细胞的小鼠在第+15天在外周血中似乎具有比其他组更高量的人t细胞,而接受il-2处理的car-t细胞的小鼠具有最低数目的人t细胞(图8d)。对于不同的car-t细胞群体的百分比,与il-2组相比,nc,il-15,il-18和il-21暴露组均呈现较高的cd4+car-t细胞,而cd8+car-t细胞的百分比在所有组中是相当的(图8e)。在t细胞表型中,cd62l,cd27和cd28仅在大约5-10%的t细胞上表达,并且在所有组中都是相当的,只是il-21组中的cd8+t细胞表达比il-2和nc组中更高的cd28(均p<0.05)(图8f和8g)。有趣的是,nc和il-18在血液中具有高得多的量的cd45ra+cd62l+t细胞,这与从体外实验获得的结果相反(图8f,2e和2f)。在第+32天,除了il-2组外,所有car-t细胞组中循环的人t细胞显著扩大,平均t细胞占14907/μl至19651/μl(而il-2组中仅242/μl)。虽然肿瘤消退,但是两只老鼠死亡。
讨论
il-2是用于产生用于过继性免疫疗法的淋巴细胞的最常用的细胞因子。它促进t细胞的存活和扩增,增强t细胞的肿瘤杀伤能力。然而,il-2的作用是有限的,因为它导致t细胞的活化诱导的细胞死亡(aicd)和调节性t细胞的发育(maleketal.,immunity,2010,33:153-65;和lenardoetal.,annurevimmunol,1999,17:221-53)。在这个例子中,il-2显著增加了car-t细胞的积累及其细胞毒性能力,但il-2暴露的car-t细胞在过继转移后呈现较低的抗肿瘤免疫力。这一发现证明了体外肿瘤裂解和体内肿瘤根除之间的反比关系。il-2暴露的car-t细胞表现出相对成熟的表型,cd62l,ccr7,cd27和cd28的表达低,体内持久性较差(yangetal.,cancerimmunolimmunother,2013,62:727-36)。最近的研究表明,较低分化的t细胞的过继转移与优良的肿瘤消退相关,这支持了il-2暴露的car-t细胞比其他组更低效的发现(gattinonietal.,natmed,2011,17:1290-7;和markleyetal.,blood,2010,115:3508-19)。
il-15呈现与il-2相似的刺激car-t细胞扩增和肿瘤裂解功能的表现,但诱导较少分化的表型(cd27和cd28的较高表达)。因此,il-15支持在体内car-t细胞的持续性,并且在动物模型中显示出更好的抗肿瘤免疫性。
与il-2和il-15相比,il-7显示出促进car-t细胞扩增的相似能力,但诱导更高水平的cd62l表达,并且在无抗原环境中表现出最高比例的car-tscm细胞。因此,与暴露于il-2的car-t细胞相比,没有抗原攻击的il-7的离体暴露增强了car-t细胞的抗肿瘤功效。由于在抗原攻击下car-t细胞的扩增较少,il-7暴露的car-t细胞与il-2细胞相比没有导致更高的体内抗肿瘤功效并且功效弱于il-15。
il-21对car-t细胞的积累几乎没有影响,因为它不能例如通过促进bcl-xl表达增强抗细胞凋亡能力。然而,即使在抗原攻击的情况下,il-21也诱导较少分化的car-t细胞的扩增,具有高表达cd62l,ccr7,cd27和cd28的表型。因此,il-21暴露的car-t细胞在体内的动物模型和il-21注射中表现出最佳的持续性,并且在促进肿瘤根除方面表现出比除了il-15之外的其它细胞因子组更好的疗效。这些结果与先前发现一致:较少分化的car-t细胞与优异的肿瘤消退相关。
il-18是属于il-1家族的促炎细胞因子,其通过在体内激活单核细胞,nk细胞和t细胞以及产生ifn-γ以及其他细胞因子来调节先天和适应性免疫应答(srivastavaetal.,currmedchem,2010,17:3353-7)。本文提出的结果表明,il-18在体外实验中对car-t细胞的扩增,表型和功能影响不大,因为il-18组的大部分结果与nc组相似和相当。与对照(nc)组相比,il-18促进了t细胞的少量增殖,并且在抗原攻击下维持更多的t细胞存活。体内研究表明,与没有细胞因子补充的小鼠相比,il-18对car-t细胞功效没有显著影响。
总之,这些实验的发现表明,尽管广泛使用,但离体用于car-t细胞扩增的il-2补充物不是最佳策略。对于il-18,il-21或没有细胞因子补充物,尽管它们可能诱导相对有效的car-t细胞,但它们不足够有效地促进car-t细胞的扩增,使得可以制备足够的car-t细胞在有限的扩增时间内用于临床使用。因此,il-15和il-7可能是更好的car-t细胞扩增剂。此外,il-7和il-15补充物的组合指示产生tscm,其有益于产生更多的“年轻”car-t细胞。关于体内细胞因子注射,所有γc细胞因子补充物增强抗肿瘤功效,因为许多有利于car-t细胞的扩增,il-15呈现最佳效果。通过注射接受il-15暴露的car-t细胞的小鼠具有增加的功效,部分是由于肿瘤治疗期间car-t细胞的扩增能力增加和持续性增加。因此,这些实验的结果表明,il-7和il-15显示出促进car-t细胞扩增的希望,并诱导对治疗性治疗最有效的t细胞表型。
实施例2:cd25消耗对细胞生长和转导效率的影响
白介素-2a链,也称为cd25,由调节性t细胞(treg)表达,但也在慢性b细胞白血病(cll)细胞(大于85%的cll患者)中观察到。treg具有免疫抑制功能,并且可以阻止免疫治疗的功效,例如通过抑制t细胞增殖。当前通过单采血液成分术从cll患者中分离或富集t细胞通常含有显著增加比例的treg和cll细胞。通过cd25消耗方法在起始物质中消耗treg和cll细胞可显著改善效应t细胞的纯度,从而增加表达car19的t细胞(例如cart19细胞)的效力。
图9a显示来自cll患者的单采血液成分术的细胞的流式细胞术分析图。首先对cd45表达进行细胞分选,然后进一步分析cd45表达(cd45+)亚群的cd25和cd3表达。如图9a右图所示,cll患者表现出高百分比的cd25表达细胞。
优化cd25消耗
使用clinimacs系统中miltenyi的cd25试剂进行验证实验以从两名患者的单采血液成分术的cd25消耗中鉴定最佳条件。使用制造商建议量的100%,70%和30%的cd25消耗试剂来鉴定是否通过使用较少的试剂可以获得相同的消耗效率。还测试了两个来自miltenyi的不同试管组。消耗是按照制造商的指示进行的。实验结果如下表所示。对于对照,使用抗cd3/cd28免疫磁珠进行选择。
表5.cd25消耗的实验结果。
预期的cd25-(cd25阴性)t细胞产量代表通过假设相应操作中的100%效率计算的理论cd25-t细胞产量。cd25-t细胞的观测产量表示各个操作后cd25-t细胞的数目。如表5所示,使用比制造商推荐的更少的试剂没有导致cd25消耗中相同的效率。使用不同的管导致t细胞富集增加一个对数。
图9b显示代表性流式细胞术分析图(顶图),表明与来自单采血液成分术的总细胞(图9b的左上图),对照cd3/cd28选择的细胞(图9b的顶部中间左侧图),cd25消耗的细胞(图9b的中间右上图)和富含cd25的细胞(图9b的右上图)相比,cd25消耗的效率。直方图(底部图)显示细胞群的单核细胞含量,如通过cd3-cd19亚组的cd14表达所确定。这些结果表明有效的cd25消耗,并且cd25消耗也导致显著的单核细胞含量(相比来自单采血液成分术、对照和富含cd25的细胞的总细胞中少于2%,61.1%的cd14表达细胞)。
cd25消耗对t细胞群体和增殖的影响
接下来,通过测定cd4+和cd8+t细胞的比例和增殖能力来评估cd25消耗后t细胞产物的质量。
为了确定特定t细胞群体的比例,如上所述,通过抗-cd3/cd28或cd25消耗选择后9天通过流式细胞术分析细胞。结果显示,与cd25消耗的细胞相比,cd3/cd28选择的t细胞具有更大比例的cd4+t细胞(84.6%,相比46.8%的cd4+t细胞,图10左上方图的盒子)。相反,与cd3/cd28选择的细胞相比,cd25消耗的细胞具有更大比例的cd8+t细胞(与11.5%的cd8+t细胞相比为47.2%;图10中的右下方图的盒子)。因此,cd25消耗导致具有较大比例的cd8+t效应细胞的t细胞。
还在对照(cd3/cd28选择的细胞)和cd25消耗的细胞中评估增殖能力和细胞活力。将来自对照和cd25消耗细胞的1.6x107个细胞平板接种,并在10-13天测定细胞数量和活力。图11a显示了随时间的总细胞数,图11b显示了计算的群体倍增(从总细胞数计算)。结果表明cd25消耗的细胞表现出与对照细胞相似的生长特征。图11c显示了活细胞的百分比,并且结果显示对照和cd25消耗的细胞之间的活力也是相似的。
cd25消耗对慢病毒转导效率的影响
通过测定转导后car的表达来评估cd25消耗对慢病毒转导效率的影响。如上所述,用cd25细胞消耗患者单采血浆。流式细胞仪分析图显示了cd25消耗的效率,比较了(单采血液成分术样品)前和cd2消耗(cd25耗尽的级分)后cd25表达细胞群(图12a)。cd25消耗后,cd25消耗的级分含有约59.2%的cd25阴性细胞和仅10.3%的cd25阳性细胞。
cd25消耗的级分用编码car19的慢病毒构建体转导。培养11天后,通过流式细胞术评价car表达。未转导的细胞和转导的cd3选择的细胞用作对照。如图12b所示,与cd3选择的细胞相比,cd25消耗细胞中car19表达显著较高(相比12.8%,51.4%)。该结果表明cd25消耗的细胞具有改善的慢病毒转导效率,这对于改善cart疗法的治疗效果可能是重要的。
实施例3:使用细胞因子与cd25消耗的细胞
在该实施例中,检查了在培养物扩增期间cd25消耗与细胞因子补充物的作用。从患者中分离出外周血单核细胞(pbmc),如实施例2所述,将它们不经操作或者被耗尽表达cd25的细胞。通过用抗cd3和cd28包被的珠粒刺激来实现t细胞富集。立即在补充有10ng/mlil-7,10ng/mlil-15或10ng/mlil-7和10ng/mlil-15的组合的培养基中培养t细胞。在第3天,添加相同的细胞因子来改变培养基。在第5天,加入含有100iuil-2/ml的培养基,细胞共培养10天。
流式细胞术分析显示在il7,il-15或il7和il15存在下培养后,与未经操作的pbmc(标准cd3/cd28选择)相比,cd25消耗的细胞中cd3和cd19细胞的分布的变化。起始群体中cd3,cd19和cd25表达细胞的分布(例如,在cd25消耗之前和用补充细胞因子培养之前)如图13所示。起始群体具有高比例的cd3-cd19+细胞(顶部图,图11)和高比例的cd25表达细胞(底部图,图13)。在操作(cd25消耗)和用细胞因子培养后,分布如图14所示改变。与未操作的细胞相比,cd25消耗的细胞总体显示出cd19表达细胞更大的减少。
还通过在用抗cd3和抗cd28包被的珠粒刺激后第10天,测定培养物中的细胞总数来评估相同细胞样品的增殖能力。每个细胞样品的细胞数目如下和图15所示。
表6.体外扩增
这些结果表明,与未经操作的细胞相比,在cd25消耗的t细胞培养过程中补充il-15导致增加的扩增。在培养过程中培养基中il-7和il-15的添加导致与未操作的细胞相比,并且与独立添加细胞因子il-7或il-15相比,扩增显著增加。因此,il-7和il-15补充的组合导致增殖能力增加最多的t细胞。
实施例4:三天制造方法
使用基因转移技术,可以对t细胞进行遗传修饰以在其表面上稳定表达抗体结合结构域,其赋予t细胞特异性,所述特异性独立于主要组织相容性复合体(mhc)所施加的限制。car疗法可以利用在t细胞上表达的合成蛋白,其将抗体的抗原识别片段(scfv或单链可变区片段)与cd3-ζ链的细胞内结构域融合。在与表达scfv的同源抗原的靶细胞相互作用时,在t细胞上表达的car可触发t细胞活化,导致靶细胞杀伤(也称为靶细胞裂解)。当与额外的共刺激信号(例如cd137或cd28的细胞质结构域)组合时,这些受体也可以在体内刺激t细胞增殖并增加car-修饰的t细胞(cart)持久性。
正在探索cart持久性的机制。car中的信号结构域似乎是确定持久性的重要因素;然而,许多在小鼠和非人类灵长类动物中发表的研究(klebanoff,c.a.,etal.(2005)."centralmemoryself/tumor-reactivecd8+tcellsconfersuperiorantitumorimmunitycomparedwitheffectormemorytcells."procnatlacadsciusa102(27):9571-9576,berger,c.,etal.(2008)."adoptivetransferofeffectorcd8+tcellsderivedfromcentralmemorycellsestablishespersistenttcellmemoryinprimates."jclininvest118(1):294-305,hinrichs,c.s.,etal.(2009)."adoptivelytransferredeffectorcellsderivedfromnaiveratherthancentralmemorycd8+tcellsmediatesuperiorantitumorimmunity."procnatlacadsciusa106(41):17469-17474,wang,x.,etal.(2011)."engraftmentofhumancentralmemory-derivedeffectorcd8+tcellsinimmunodeficientmice."blood117(6):1888-1898)和人临床试验相关研究的数据表明,过继转移产物中t细胞的表型也是过继转移之后t细胞持续性的重要决定因素(xu,y.,etal.(2014)."closelyrelatedt-memorystemcellscorrelatewithinvivoexpansionofcar.cd19-tcellsandarepreservedbyil-7andil-15."blood123(24):3750-3759)。虽然不希望被理论束缚,但假设在抗cd3和抗cd28激动剂抗体与外源性il-2组合的常规使用的系统下,离体培养过程中扩增的t细胞将扩增的t细胞偏向持久性降低的更加分化的细胞。假设用il-7和il-15替代il-2将使离体培养物随时间偏向具有更佳的tscm/cm表型的细胞。还假设,较少离体培养的产物可能具有较大比例的具有最佳的表型的细胞,用于移植和过继转移后的持久性。
本实施例均表征了培养物中随时间推移细胞的表型,并在激活和转导后的不同时间点评价细胞的功能性。
如图27a-27d所示,用cd3/28-刺激珠粒活化后可以通过机械破坏以高效率实现从t细胞去除珠粒。在这些临床前研究中通过细胞悬浮液重复穿过(挤出)窄孔移液管尖端来完成珠分离。在封闭的培养系统中,可以使用封闭系统进行挤出以产生柔和的剪切,所述封闭系统在除去珠之前在封闭系统中包括一组窄孔管。
如图28所示,在早至活化后第3天的时间点,用具有bbz信号传导和从t细胞培养物收获的cd19特异性car活化、转导的t细胞在体外具有有效的抗原特异性细胞毒活性。这些早期收获细胞还能够产生与离体培养5或9天的较长时间的那些细胞(图29a)相似的模式和数量的细胞因子,具有相似的基础分泌(图29b)。
在离体培养过程中,如图30a所示,t细胞群体经历向更加分化的表型的逐渐转变,所述更加分化的表型具有增加比例的t效应记忆(tem)和tcm细胞。tem和tcm细胞比例的这种增加是由于更分化的t细胞亚群的增加,其中初始样/tscm细胞具有最小的扩增和/或减少(图30b)。
图31a显示了用于测试在不同条件下产生的cart细胞效力的实验设置。图31b显示il2处理的cart细胞在减慢小鼠中nalm6肿瘤生长的效力。第3天细胞在所有剂量下表现出增强的效力。用具有4-1bbz信号结构域的cd19特异性car激活和转导的t细胞在早期时间点收获时显示出更有效的体内抗白血病活性。该增加的效力通过如下证明:第3天收获的cart19细胞与第5天或第9天收获的细胞相比,需要较低剂量的t细胞来消除白血病。car+细胞的比例如图31c所示。
在两个不同的天(3,9)收获用il-2和il7/15处理的细胞。使用相对低剂量的0.7e6car+细胞。在用具有4-1bbz信号结构域的cd19特异性car活化、转导并在il-7/il-15中培养的t细胞在限制剂量下比在il-2中在早期(第3天)和晚期(第9天)时间点扩增的细胞显示出更有效的活性(图31d)。用il7/15处理的第3天细胞在早期时间点表现出增强的效力。
等同方案
本文引用的每篇专利,专利申请和出版物的公开内容通过引用整体并入本文。虽然已经参考具体方面公开了本发明,但是显而易见的是,在不脱离本发明的真实精神和范围的情况下,本领域技术人员可以设计出本发明的其它方面和变型。所附权利要求旨在被解释为包括所有这些方面和等同变型。
- 还没有人留言评论。精彩留言会获得点赞!
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种全人源化EGFRvIII嵌合抗原受体T细胞及其制备方法与制造工艺
- 嵌合抗原受体及制备方法与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- CD20特异性嵌合抗原受体及其应用的制造方法与工艺
- 一种用于辣根过氧化物酶染色的染色剂及其制备方法、染色组合、应用及标记酶染色试剂盒与制造工艺
- 对SSEA4抗原具有特异性的嵌合抗原受体的制造方法与工艺
- 具有针对CD79和CD22的特异性的分子的制造方法与工艺
- 具有针对CD45和CD79的特异性的分子的制造方法与工艺
- 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与制造工艺