治疗或预防偏头痛的方法与流程
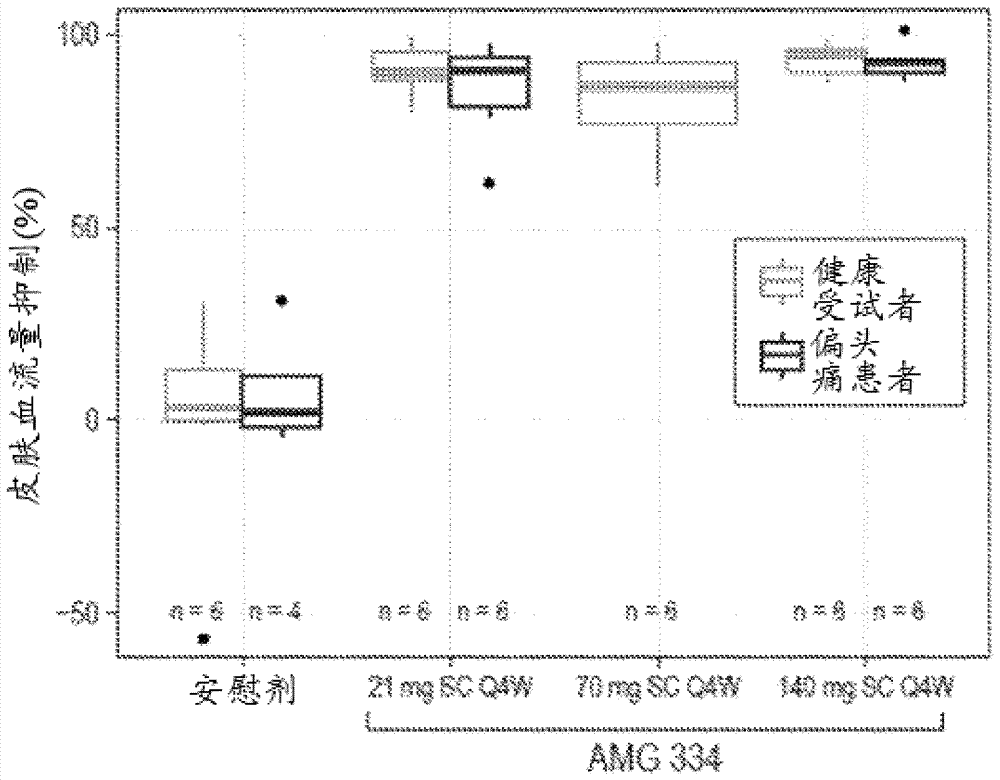
本申请要求2015年4月24日提交的美国临时申请号62/152,708的权益,该案以全文引用的方式并入本文中。以电子方式提交的文本文件的说明本申请含有序列表,所述序列表已以ASCII格式以电子方式提交并且以全文引用的方式并入本文中。所述序列表的计算机可读格式复本于2015年8月3日创建,命名为A-1945-WO-PCT_ST25.txt并且大小为134千字节。发明领域本发明涉及神经学和生物制药学领域。具体地说,本发明涉及使用选择性抑制人类降钙素基因相关肽(CGRP)受体的抗体预防性治疗偏头痛。发明背景偏头痛为一种复杂、常见的神经病状,其特征为头痛和相关特征的剧烈、阵发性发作,所述相关特征可包括恶心、呕吐、对光、声音或移动敏感。在一些患者中,头痛之前出现或伴随出现感官警示征象或症状(即,先兆)。在某些患者中,头痛可为剧烈的并且还可为单侧的。偏头痛发作对于日常生活具有破坏性并且每年在错过工作日和性能削弱方面花费数十亿美元(Modi和Lowder,Am.Fam.Physician,第73卷:72-78,2006)。偏头痛为全世界一种非常流行的疾病,约15%的欧洲人口和12%的美国人口遭受偏头痛发作之苦(Lipton等人,Neurology,第68卷:343-349,2007)。另外,已经发现偏头痛与多种精神和医学共患病有关,诸如抑郁症和血管病症(Buse等人,Neurol.Neurosurg.Psychiatry,第81卷:428-432,2010;Bigal等人,Neurology,第72卷:1864-1871,2009)。通常主要用镇痛剂和一类称为曲普坦(triptan)的药物对偏头痛进行急性治疗(Humphrey等人,AnnNYAcadSci.,第600卷:587-598,1990;Houston和Vanhoutte,Drugs,第31卷:149-1631986)。曲普坦为选择性血清素5-HT1B/1D激动剂,是用于急性偏头痛的有效药物并且一般具有良好耐受性,但由于可能引起冠状动脉血管收缩而在心血管疾病存在下禁忌使用。此外,许多偏头痛患者对曲普坦不具有有利反应。在关于53次试验的整合分析(meta-analysis)中,在所有患有偏头痛的人中有多达三分的一并且在所有偏头痛发作中有40%对曲普坦不起反应(Ferrari等人,Lancet,第358卷:1668-1675,2001)。偏头痛预防为一个迫切需要满足的领域。偏头痛患者群中有约40%将得益于预防性疗法(Lipton等人,Neurology,第68卷:343-349,2007)。然而,仅约12%的患者接受任何预防性疗法,这部分归因于可用预防性疗法的功效有限以及显著耐受性和安全性问题。在美国,托吡酯(Topiramate),一种阻断电压依赖性钠通道和某些谷氨酸受体(AMPA-海人草酸)的抗惊厥剂,为最常用于偏头痛预防的药物。托吡酯是经由随机安慰剂对照试验证实在发作性与慢性偏头痛患者中具有功效的唯一偏头痛预防药剂(Diener等人,Cephalalgia,第27卷:814-823,2007;Silberstein等人,Headache,第47卷:170-180,2007)。然而,有约50%的患者无法对托吡酯起反应并且其耐受性较差。与托吡酯治疗相关的常见不良事件包括感觉异常、食欲不振以及认知不良事件,包括精神运动迟缓、嗜睡、语言困难以及记忆与集中困难(Brandes等人,JAMA,第291卷:965-973,2004;Adelman等人,PainMed.,第9卷:175-1852008;Silberstein等人,ArchNeurol.,第61卷:490-495,2004)。在一项开放标记、可变剂量研究中,20%的患者由于不良作用而取消使用托吡酯(Nelles等人,Headache,第49卷:1454-1465,2009)。因此,偏头痛患者迫切需要更有效和/或可耐受的治疗选择。发明概要本发明部分基于鉴别出一种用于有效降低有需要的患者的偏头痛的频率、严重程度和/或持续时间,同时不具有或具有极少不良副作用的治疗方案。因此,在一个实施方案中,本发明提供一种用于预防或减少有需要的患者偏头痛的发生的方法,所述方法包括向患者施用每月约35mg至约210mg剂量的抗CGRP受体抗体或其抗原结合片段。在一些实施方案中,本发明提供一种用于预防性治疗患者的偏头痛的方法,所述方法包括向患者施用每月约35mg至约210mg剂量的抗CGRP受体抗体或其抗原结合片段。在所述方法的一些实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使患者所经历的每月偏头痛天数相较于治疗之前的每月偏头痛天数或未接受抗CGRP受体抗体或其结合片段的患者所经历的每月偏头痛天数有所减少。在一些实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使患者的每月偏头痛天数相较于治疗之前的天数或未接受抗CGRP受体抗体或其结合片段的患者所经历的天数减少至少50%。在所述方法的某些实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使患者所经历的每月偏头痛小时数相较于治疗之前的每月偏头痛小时数或未接受抗CGRP受体抗体或其结合片段的患者所经历的每月偏头痛小时数有所减少。在所述方法的某些其他实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使患者所经历的每月偏头痛特异性药物使用天数相较于治疗之前的每月偏头痛特异性药物使用天数或未接受抗CGRP受体抗体或其结合片段的患者所经历的每月偏头痛特异性药物使用天数有所减少。在所述方法的一些实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使患者由于偏头痛引起的身体受损天数相较于治疗之前的天数或未接受抗CGRP受体抗体或其结合片段的患者所经历的天数有所减少。在其他实施方案中,向患者施用的抗CGRP受体抗体或其结合片段的剂量足以使偏头痛对日常活动的影响相较于治疗之前的影响或未接受抗CGRP受体抗体或其结合片段的患者所经历的影响有所减少。可使用如本文中所描述的多种经过验证的调查表对由于偏头痛引起的身体受损和偏头痛对日常活动的影响进行评估。在所述方法的某些实施方案中,足以减少有需要的患者的每月偏头痛天数、每月偏头痛小时数、每月偏头痛特异性用药天数、由于偏头痛引起的身体受损和/或偏头痛对日常活动的影响的剂量为每月约35mg至约210mg。在一些实施方案中,充足剂量为每月约70mg至约140mg。在一个特定实施方案中,充足剂量为每月约70mg。在另一特定实施方案中,充足剂量为每月约140mg。在这些和其他实施方案中,每月一次(QM)施用抗CGRP受体抗体或其结合片段的剂量。在所述方法的一些实施方案中,施用本文中所描述的剂量的抗CGRP受体抗体或其结合片段不会在患者中实质上引起不良副作用。具体地说,施用本文所描述的剂量的抗CGRP受体抗体或其结合片段不会实质上引起与其他偏头痛预防治疗有关的不良副作用,包括与抗癫痫药、β-阻断剂以及抗抑郁剂有关的不良副作用。在某些实施方案中,施用抗CGRP受体抗体或结合片段所伴随的不良副作用的数目和类型与施用安慰剂所伴随的不良副作用的数目和类型在统计学上并无不同。在本文所描述的方法的某些实施方案中,肠胃外向患者施用抗CGRP受体抗体或其结合片段。在特定实施方案中,通过皮下注射向患者施用抗CGRP受体抗体或其结合片段。在一个实施方案中,皮下注射为每月一次向患者施用的快速注射。可用含有每月剂量的抗CGRP受体抗体或其结合片段的预填注射器或自动注射器将皮下注射递送给患者。在一些实施方案中,要根据本发明的方法施用抗CGRP受体抗体或其结合片段的患者患有或已被诊断患有发作性偏头痛。发作性偏头痛可为低频率发作性偏头痛或高频率发作性偏头痛。在其他实施方案中,要根据本发明的方法施用抗CGRP受体抗体或其结合片段的患者患有或已被诊断患有慢性偏头痛。在本发明的方法的某些实施方案中,要施用抗CGRP受体抗体或其结合片段的患者过去未接受过偏头痛的任何预防疗法(即,患者为未经过治疗的)。在本发明的方法的其他实施方案中,要施用抗CGRP受体抗体或其结合片段的患者用至少另一种偏头痛预防疗法失败或对其不耐受。因此,在一些实施方案中,要施用抗CGRP受体抗体或其结合片段的患者用至少一种抗癫痫药(例如,托吡酯、丙戊酸)、三环抗抑郁剂(例如阿米替林(amitriptyline))、β-阻断剂(例如,普萘洛尔(propranolol)、噻吗洛尔(timolol))或肉毒杆菌毒素A(botulinumtoxinA)失败或对其不耐受。在一个实施方案中,患者对两种先前的偏头痛预防疗法来说为失败的或对其不耐受。在另一实施方案中,患者对三种先前的偏头痛预防疗法来说为失败的或对其不耐受。在本文所公开的方法的任何实施方案中,抗CGRP受体抗体或其抗原结合片段特异性结合至由人类CGRP受体的人类CRLR和人类RAMP1多肽组分中的氨基酸形成的表位,并且相较于人类AM1、AM2和/或淀粉素受体,选择性抑制人类CGRP受体。在一些实施方案中,抗CGRP受体抗体或抗原结合片段特异性结合至人类CGRP受体并且KD≤100nM。在其他实施方案中,抗CGRP受体抗体或抗原结合片段特异性结合至人类CGRP受体并且KD≤10nM。在一个实施方案中,根据本发明的方法向患者施用的抗CGRP受体抗体或其抗原结合片段包含具有SEQIDNO:14的序列的CDRH1、具有SEQIDNO:23的序列的CDRH2、具有SEQIDNO:34的序列的CDRH3、具有SEQIDNO:44的序列的CDRL1、具有SEQIDNO:55的序列的CDRL2以及具有SEQIDNO:65的序列的CDRL3。在另一实施方案中,根据本发明的方法向患者施用的抗CGRP受体抗体或其抗原结合片段包含具有SEQIDNO:15的序列的CDRH1、具有SEQIDNO:29的序列的CDRH2、具有SEQIDNO:35的序列的CDRH3、具有SEQIDNO:45的序列的CDRL1、具有SEQIDNO:61的序列的CDRL2以及具有SEQIDNO:66的序列的CDRL3。适用于本发明的方法中的抗CGRP受体抗体或其结合片段可包括含SEQIDNO:92的序列的重链可变区和含SEQIDNO:80的序列的轻链可变区。在一些实施方案中,用于本发明的方法中的抗CGRP受体抗体或其结合片段包括含SEQIDNO:98的序列的重链可变区和含SEQIDNO:84的序列的轻链可变区。在某些实施方案中,抗CGRP受体抗体具有人类IgG1恒定区或人类IgG2恒定区。在一个实施方案中,抗CGRP受体抗体包括含SEQIDNO:105的序列的重链和含SEQIDNO:123的序列的轻链。在另一实施方案中,抗CGRP受体抗体包括含SEQIDNO:111的序列的重链和含SEQIDNO:127的序列的轻链。本文在表7中所描述的特异性抗体或其抗原结合片段中的任一种均可用于本发明的方法中。在某些实施方案中,根据本发明的方法向患者施用的抗CGRP受体抗体或结合片段为4E4抗体或其结合片段。在其他实施方案中,根据本发明的方法向患者施用的抗CGRP受体抗体或结合片段为9F5抗体或其结合片段。本发明还提供用于本文所描述的方法中的抗CGRP受体抗体或其结合片段的药物组合物。药物组合物可包含一种或多种药学上可接受的稀释剂、载体或赋形剂,包括缓冲剂、表面活性剂以及稳定剂。在某些实施方案中,药物组合物包含抗CGRP受体抗体或其结合片段、缓冲剂、表面活性剂以及稳定剂。在一个实施方案中,药物组合物包含抗CGRP受体抗体或其结合片段、乙酸盐缓冲剂、聚山梨醇酯20或聚山梨醇酯80以及蔗糖。可将本文所描述的药物组合物中的任一种均掺入至自施用装置中,诸如预填注射器或自动注射器中以根据本文所描述的方法向患者施用(例如皮下施用)。因此,本发明还包括一种用于预防性治疗有需要的患者的偏头痛的预填注射器或自动注射器,所述预填注射器或自动注射器包括含抗CGRP受体抗体或其结合片段、乙酸盐缓冲剂、蔗糖以及聚山梨醇酯的药物组合物。在一些实施方案中,预填注射器或自动注射器包含的药物组合物包含约70mg/ml至约140mg/ml抗CGRP受体抗体或其结合片段、约10mM至约15mM乙酸钠、约0.008%至约0.012%w/v聚山梨醇酯以及约8%至约9%w/v蔗糖,pH值为约4.8至约5.5。在某些实施方案中,预填注射器或自动注射器的注射体积为约1ml或更小。在一些实施方案中,本发明还提供试剂盒,所述试剂盒包含本文所公开的药物组合物或自施用装置以及有关使用药物组合物或自施用装置,例如通过皮下注射来递送治疗有效剂量以预防性治疗有需要的患者的偏头痛的说明书。在以冻干或干粉形式提供药物组合物的实施方案中,试剂盒可包含稀释剂以及有关在施用之前复原药物组合物的说明书。特别涵盖抗CGRP受体抗体或其结合片段的用途,所述抗CGRP受体抗体或其结合片段是用于本文所公开的方法中的任一种中或用于制备用以根据本文所公开的方法中的任一种来施用的药物。举例来说,本发明包括用于预防或减少有需要的患者的偏头痛的发生的方法中的抗CGRP受体抗体或其结合片段,其中所述方法包括向患者施用每月约35mg至约210mg剂量的抗CGRP受体抗体或其结合片段。本发明还包括用于预防性治疗患者的偏头痛的方法中的抗CGRP受体抗体或其结合片段,其中所述方法包括向患者施用每月约35mg至约210mg剂量的抗CGRP受体抗体或其结合片段。本发明还包括抗CGRP受体抗体或其结合片段用于制备用以预防或减少有需要的患者的偏头痛的发生的药物的用途,其中抗CGRP受体抗体或结合片段的剂量为每月约35mg至约210mg。本发明进一步包括抗CGRP受体抗体或其结合片段用于制备用以预防性治疗患者的偏头痛的药物的用途,其中抗CGRP受体抗体或结合片段的剂量为每月约35mg至约210mg。附图简述图1展示在健康人类受试者和偏头痛患者中辣椒碱诱导的皮肤血流量(DBF)抑制百分比随AMG334单克隆抗体的血清浓度的变化。图2示出了在向健康人类受试者和偏头痛患者皮下(SC)施用单次剂量和重复剂量(每四周一次;Q4W)的AMG334之后,辣椒碱诱导的皮肤血流量(DBF)抑制百分比以及AMG334单克隆抗体的血清浓度随时间的变化。最大DBF抑制的持续时间符合剂量浓度-DBF关系。图3A展示在皮下(SC)或静脉内(IV)接受单次递增剂量的AMG334或匹配安慰剂的健康人类受试者(HS)和偏头痛患者(MP)中的平均血清AMG334浓度-时间曲线。图3B展示在第1天、第29天以及第57天皮下(SC)接受多次剂量的AMG334或安慰剂的健康人类受试者(HS)和偏头痛患者(MP)中的平均血清AMG334浓度-时间曲线。图4A示出了在单次递增剂量研究中在皮下(SC)施用单次剂量的AMG334或安慰剂之后四天健康受试者和偏头痛患者中辣椒碱诱导的皮肤血流量抑制百分比。图4B示出了在多剂量研究中在皮下(SC)施用三剂AMG334中的第一剂或安慰剂之后八天健康受试者和偏头痛患者中辣椒碱诱导的皮肤血流量抑制百分比。图5示出了接受安慰剂或三种每月皮下剂量(7mg、21mg或70mg)的AMG334(一种针对CGRP受体的人类单克隆抗体)中的一种的发作性偏头痛患者的平均每月偏头痛天数相对于基线的变化。图6示出了接受安慰剂或三种每月皮下剂量(7mg、21mg或70mg)针对CGRP受体的人类单克隆抗体(AMG334)中的一种的发作性偏头痛患者的每月急性偏头痛特异性药物(例如曲普坦、麦角胺(ergotamines))使用天数相对于基线的变化。图7A展示接受安慰剂或每月一次皮下注射70mg抗CGRP受体抗体(AMG334)的低频率发作性偏头痛患者(在基线时偏头痛少于8天)和高频率发作性偏头痛患者(在基线时偏头痛8天或更多天)的平均每月偏头痛天数相对于基线的变化。图7B展示未经过治疗或先前预防性偏头痛治疗失败并且接受安慰剂或每月一次皮下注射70mg抗CGRP受体抗体(AMG334)的发作性偏头痛患者的平均每月偏头痛天数相对于基线的变化。图8示出了接受安慰剂或三种每月皮下剂量(7mg、21mg或70mg)抗CGRP受体抗体(AMG334)中的一种的发作性偏头痛患者的平均每月偏头痛天数相对于基线的变化。在研究的12周双盲期之后,四个治疗组各自的患者在研究的开放标记延伸期期间每月接受70mg皮下剂量的抗CGRP受体抗体。以在双盲期期间的最小均方值和标准误差以及在开放标记延伸期期间的平均值和标准误差的形式示出数据。图9A示出了接受安慰剂或三种每月皮下剂量(7mg、21mg或70mg)抗CGRP受体抗体(AMG334)中的一种的发作性偏头痛患者的平均每月头痛天数相对于基线的变化。在研究的12周双盲期之后,四个治疗组各自的患者在研究的开放标记延伸期期间每月接受70mg皮下剂量的抗CGRP受体抗体。以在双盲期期间的最小均方值和标准误差以及在开放标记延伸期期间的平均值和标准误差的形式示出数据。图9B示出了接受安慰剂或三种每月皮下剂量(7mg、21mg或70mg)抗CGRP受体抗体(AMG334)中的一种的发作性偏头痛患者的每月偏头痛特异性药物(例如曲普坦、麦角胺)使用天数相对于基线的变化。在研究的12周双盲期之后,四个治疗组各自的患者在研究的开放标记延伸期期间每月接受70mg皮下剂量的抗CGRP受体抗体。以在双盲期期间的最小均方值和标准误差以及在开放标记延伸期期间的平均值和标准误差的形式示出数据。详细说明当前可用于治疗人类患者的偏头痛的疗法由于许多患者无法忍受或拒绝忍受的不良副作用而具有较差的风险-效益型态。本发明部分通过提供新颖的抗CGRP受体抗体方案解决了此问题,所述方案提供有效的偏头痛预防并且不具有或具有极小副作用。本文所描述的本发明方法可有效地降低罹患发作性偏头痛以及慢性偏头痛的患者的偏头痛频率、严重程度和/或减少持续时间。偏头痛为持续约4至约72小时的反复出现的头痛,其特征为单侧、脉动和/或中度至重度疼痛和/或由于身体活动而加剧的疼痛。偏头痛通常伴随恶心、呕吐和/或对光(畏光)、声音(畏声)或气味敏感。在一些患者中,在偏头痛发作之前出现先兆。先兆通常为提示头痛不久将发生的视觉、感官、语言或运动紊乱。本文所描述的方法在存在和不存在先兆的情况下预防、治疗或改善人类患者的偏头痛的一种或多种症状。在一个实施方案中,本发明提供一种预防或减少有需要的患者偏头痛的发生的方法,所述方法包括向患者施用包含治疗有效量的抗CGRP受体抗体或其抗原结合片段的药物组合物。术语“患者”包括人类患者。如本文所使用,“预防或减少偏头痛的发生”是指使偏头痛的频率、持续时间或严重程度相较于施用组合物之前的偏头痛频率、持续时间或严重程度或相较于未施用组合物的患者(即,对照受试者)的偏头痛频率、持续时间或严重程度有所减少。因此,在某些实施方案中,本发明提供一种预防性治疗患者的偏头痛的方法,所述方法包括向患者施用包含治疗有效量的抗CGRP受体抗体或其抗原结合片段的药物组合物。“预防性治疗”是指被设计以在偏头痛发作之前采用从而减少患者偏头痛的频率、严重程度和/或持续时间的治疗。在一些实施方案中,预防性治疗可增加急性偏头痛特异性药物的有效性或患者对急性偏头痛特异性药物的反应。在本发明的方法的一些实施方案中,施用抗CGRP受体抗体或其结合片段使患者在一个月内所经历的偏头痛天数相较于施用抗CGRP受体抗体或结合片段之前的天数(即,治疗前基线)和/或相较于未接受抗CGRP受体抗体或结合片段的患者所经历的天数有所减少。“偏头痛天数”包括在存在或不存在持续超过30分钟的先兆情况下患者经历”偏头痛”发作、持续或复发的任何日历天数。“偏头痛”为伴随恶心或呕吐或者对光或声音敏感的头痛,和/或以下列疼痛特征中的至少两种为特征的头痛:单侧疼痛、抽痛、中度至重度疼痛强度或由于身体活动而加剧的疼痛。可通过在施用抗CGRP受体抗体或结合片段之前一个月、两个月、三个月、四个月、五个月或六个月或更长时间中测定相关参数(例如偏头痛天数)来建立治疗前基线。在一些实施方案中,基于施用抗CGRP受体抗体或结合片段之前三个月中特定参数的测量值来建立治疗前基线。在某些实施方案中,患者在施用抗CGRP受体抗体或结合片段之后所经历的每月偏头痛天数相较于治疗前基线和/或对照受试者(即,未接受抗体或结合片段的患者)减少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%或约60%。在一些实施方案中,患者在施用抗CGRP受体抗体或结合片段之后所经历的每月偏头痛天数相较于治疗前基线和/或对照受试者减少65%或更多,例如至少约70%、至少约75%或至少约80%。在一个实施方案中,患者在施用抗CGRP受体抗体或结合片段之后所经历的每月偏头痛天数减少至少50%。在另一实施方案中,患者在施用抗CGRP受体抗体或结合片段之后所经历的每月偏头痛天数减少至少75%。还可以患者在一个月内所经历的偏头痛小时数相较于治疗前基线和/或未接受抗CGRP受体抗体或结合片段的患者所经历的小时数的减少来评估偏头痛发生的减少。“偏头痛小时数”为在存在或不存在先兆的情况下患者经历“偏头痛”发作、持续或复发的任何小时数。在某些实施方案中,施用抗CGRP受体抗体或其结合片段使患者所经历的每月偏头痛小时数相较于治疗前基线和/或未接受抗CGRP受体抗体或结合片段的对照受试者的数目减少至少约20%、至少约30%、至少约40%、至少约50%、至少约60%或至少约70%。还可根据患者需要用偏头痛特异性药物进行急性治疗的天数、患者因偏头痛而在身体上或功能上受到损伤的天数或患者所经历的偏头痛发作次数来评估本文所描述的治疗方案的功效。举例来说,在一些实施方案中,施用抗CGRP受体抗体或其结合片段使患者在一个月内需要使用急性偏头痛治疗的天数相较于治疗前基线和/或未接受抗CGRP受体抗体或结合片段的患者所经历的天数有所减少。如本文所使用,术语“急性偏头痛特异性药物治疗天数”或“急性偏头痛特异性药物使用天数”是指患者服用偏头痛特异性药物的任何日历天数。急性偏头痛特异性药物包括(但不限于)曲普坦(例如阿莫曲普坦(almotriptan)、夫罗曲普坦(frovatriptan)、利扎曲普坦(rizatriptan)、舒马曲普坦(sumatriptan)、那拉曲普坦(naratriptan)、依来曲普坦(eletriptan)以及佐米曲普坦(zolmitriptan))、麦角胺(例如双氢麦角胺(dihydroergotamine)和含咖啡碱的麦角胺)、非类固醇消炎药(例如乙酰水杨酸、布洛芬(ibuprofen)、萘普生(naproxen)、吲哚美辛(indomethacin)以及双氯芬酸(diclofenac))以及阿片类药物(例如可待因(codeine)、吗啡碱(morphine)、氢可酮(hydrocodone)、芬太尼(fentanyl)、哌替啶(meperidine)以及羟考酮(oxycodone))。在施用抗CGRP受体抗体或其结合片段之后,每月急性偏头痛特异性药物治疗天数可减少至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约75%、至少约80%或至少约85%。在某些实施方案中,施用抗CGRP受体抗体或其结合片段完全消除对使用急性偏头痛特异性药物的需要。在一些实施方案中,相较于治疗前基线和/或未接受抗CGRP受体抗体的患者,根据本文所描述的方法施用抗CGRP受体抗体或其结合片段可以减少由患者报告的身体受损或生活质量影响评分。偏头痛通常影响患者的生活质量并且阻止其参加休闲和日常活动,并且引起患者工作效率的损失。可使用经过验证的调查表和调查评估,诸如修改过的偏头痛残疾程度评估调查表(MIDAS)、头痛影响测试-6(HIT-6)、偏头痛特异性生活质量调查表(MSQ)、偏头痛功能影响调查表(MFIQ)以及偏头痛身体功能影响日记(MPFID)来评估这些影响。因此,如通过这些调查表中的一个或多个所评估,本发明的方法改善患者生活质量的一个或多个方面和/或减少偏头痛对患者身体、社会或情感功能的一个或多个方面的影响。MIDAS为一种5项自施用调查表,所述调查表概括了在过去一个月中在工作场所和家中所损失的生产天数。MIDAS还评估在家庭、社会以及休闲活动中的残疾程度。MIDAS评分为以下天数的总和:由于头痛而错失有偿工作、家务以及非工作(家庭、社会、休闲)活动的天数;以及在有偿工作或家务时效率降低至少一半的天数。所述评分被分成4个严重程度等级:I级=0-5分(定义为极小或不频繁的残疾)、II级=6-10分(轻度或不频繁残疾)、III级=11-20(中度残疾)以及IV级=21分和更高分(重度残疾)。在某些实施方案中,相较于治疗之前患者的评分或未接受抗CGRP受体抗体或结合片段的患者的评分,根据本发明的方法施用抗CGRP受体抗体或其结合片段使患者的MIDAS评分降低(即,降低严重程度等级/降低由偏头痛引起的残疾的频率或严重程度)。MSQ为一种14项自施用工具,所述工具测量(i)偏头痛如何限制患者的日常社会和工作相关活动(角色功能限制性)、(ii)偏头痛如何阻止这些活动(角色功能阻止性)以及(iii)与患者的偏头痛有关的情感(情感功能)。患者使用6点量表对项目作出反应:“没有时间”、“极少时间”、“一些时间”、“很多时间”、“大部分时间”以及“所有时间”,分别指定为1至6分。以项目反应的总和形式来计算原始维度评分(Rawdimensionscore),并且将其重新按比例调整为0至100分量表以使得较高评分指示更佳的生活质量。在一些实施方案中,相较于治疗之前患者的评分或未接受抗CGRP受体抗体或结合片段的患者的评分,根据本发明的方法施用抗CGRP受体抗体或其结合片段使患者在MSQ上的评分增加(即,改善患者的生活质量)。MFIQ为一种26项自施用工具,所述工具测量偏头痛对较广泛功能的影响。具体地说,它测量患者的偏头痛对身体功能、常见活动、社会功能以及情感功能的影响。受试者使用被指定1至5分的5点量表对项目作出反应,其中5分表示最大负担。以项目反应的总和来计算评分,并且依据0-100分量表将总和重新按比例调整,其中较高评分表示较大负担。在某些实施方案中,相较于治疗之前患者的评分或未接受抗CGRP受体抗体或结合片段的患者的评分,根据本发明的方法施用抗CGRP受体抗体或其结合片段使患者在MFIQ上的评分降低(即,降低偏头痛对患者的功能的影响)。MPFID为一种13项自施用工具,所述工具测量身体功能。它评估对日常活动和身体受损的影响。受试者使用5点量表对项目作出反应,其中困难项从“无任何困难”变化到“无法进行”,而频率项从“没有时间”变化到“所有时间”。将这些项指定为1至5分,其中5分表示最大负担。以项目反应的总和来计算评分,并且依据0-100分量表将总和重新按比例调整,其中较高评分表示偏头痛的影响较大(即,负担较高)。在一些实施方案中,相较于治疗之前患者的评分或未接受抗CGRP受体抗体或结合片段的患者的评分,根据本发明的方法施用抗CGRP受体抗体或其结合片段使患者在MPFID上的评分降低(即,使偏头痛对患者的身体功能或日常活动的影响减小)。在一个特定实施方案中,相较于治疗之前患者的评分或对照受试者(即,未接受抗CGRP受体抗体或结合片段的受试者),向患者施用抗CGRP受体抗体或其结合片段使患者的身体受损评分降低至少约50%。在一些实施方案中,如通过MPFID所测量,患者在施用抗CGRP受体抗体或其结合片段之后的平均每月身体受损天数相较于治疗之前的天数或对照受试者的平均每月身体受损天数有所减少。在另一特定实施方案中,如通过MPFID所测量,向患者施用抗CGRP受体抗体或其结合片段使患者的日常活动评分影响相较于治疗之前患者的评分或对照受试者的评分降低至少约50%。在一些实施方案中,如通过MPFID所测量,患者在施用抗CGRP受体抗体或其结合片段之后的对日常活动具有影响的平均每月天数相较于治疗之前的天数或对照受试者的对日常活动具有影响的平均每月天数有所减少。在本发明的方法的某些实施方案中,相较于治疗之前患者所经历的偏头痛发作次数或对照受试者所经历的偏头痛发作次数,在施用抗CGRP受体抗体或其结合片段之后患者所经历的偏头痛发作次数减少。如本文所使用,术语“偏头痛发作”是指如本文所定义的任何偏头痛事件。一般将间杂睡眠或暂时缓和并且然后在48小时内再发生的偏头痛发作视为单次发作。类似地,也将用急性偏头痛特异性药物成功地治疗但在48小时内复发的偏头痛发作视为单次发作。在一些实施方案中,相较于治疗之前的发作次数或对照受试者的发作次数,在施用抗CGRP受体抗体或其结合片段之后患者的偏头痛发作次数减少至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%或至少约75%。在一些实施方案中,本发明的治疗方案改善有需要的患者的一种或多种与偏头痛有关的症状。举例来说,相较于对照受试者(即,未接受抗CGRP受体或结合片段的受试者),根据本文所描述的方法向患者施用抗CGRP受体抗体或其结合片段减少患者的一种或多种症状的发生或治疗一种或多种症状。可用本发明的方法改善或治疗的症状包括(但不限于)血管运动症状(例如热潮红、面部潮红、出汗以及盗汗)、畏光(对光敏感)、畏声(对声音敏感)、对气味敏感、头晕、眩晕、恶心、呕吐以及头痛。在一些方面中,本发明的方法包括向患者施用包含治疗有效量的抗CGRP受体抗体或其抗原结合片段的药物组合物。“治疗有效量”是指足以补救偏头痛或症状,特别是与偏头痛相关的状态或症状,或以其他方式预防、妨碍、扼止或逆转偏头痛或以无论任何方式与偏头痛相关的任何其他不合需要的症状的发展的量。在某些实施方案中,治疗有效量为足以预防或延迟偏头痛发作或复发,或者减少偏头痛或其症状发作或复发的可能性的量。因此,在一些实施方案中,向患者施用每月约35mg至约210mg总剂量的抗CGRP受体抗体或其抗原结合片段。举例来说,抗CGRP受体抗体或其结合片段的剂量可为每月约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg或约210mg。还涵盖在这些终点中的任一个与全部之间的范围,例如每月约35mg至约70mg、约40mg至约90mg、约50mg至约80mg、约35mg至约140mg、约70mg至约140mg、约50mg至约100mg、约70mg至约210mg、约140mg至约210mg或约150mg至约200mg。在一些此类实施方案中,患者间的抗CGRP受体抗体或其结合片段的每月剂量类似,不管体重如何。换句话说,在这些实施方案中,抗CGRP受体抗体或其结合片段的每月剂量为总剂量并且未针对患者的体重进行调整。在一个实施方案中,向患者施用总剂量为每月约70mg至约140mg的抗CGRP受体抗体或其结合片段。在本文所描述的方法的某些实施方案中,向患者施用总剂量为每月约70mg的抗CGRP受体抗体或其结合片段。在其他实施方案中,向患者施用总剂量为每月约140mg的抗CGRP受体抗体或其结合片段。在某些实施方案中,抗CGRP受体抗体或其结合片段的每月剂量可以患者的体重计。举例来说,在一些实施方案中,抗CGRP受体抗体或其结合片段的每月剂量可在每千克体重约0.3mg至约3.5mg、每千克体重约0.5mg至约3mg或每千克体重约1mg至约2.5mg的范围内。举例来说,抗CGRP受体抗体或其结合片段的每月剂量可为每千克体重约0.3mg、约0.4mg、0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约1.1mg、约1.2mg、约1.3mg、约1.4mg、约1.5mg、约1.6mg、约1.7mg、约1.8mg、约1.9mg、约2mg、约2.1mg、约2.2mg、约2.3mg、约2.4mg、约2.5mg、约2.6mg、约2.7mg、约2.8mg、约2.9mg、约3mg、约3.2mg、约3.3mg、约3.4mg或约3.5mg。在一个实施方案中,抗CGRP受体抗体或其结合片段的每月剂量为每千克体重约0.8mg至约1.2mg。在另一实施方案中,抗CGRP受体抗体或其结合片段的每月剂量为每千克体重约1.6mg至约2.2mg。可以单次施用或在给药频率周期内分多次施用来施用抗CGRP受体抗体或其抗原结合片段的剂量。举例来说,在某些实施方案中,在每一频率周期内以单次施用来施用治疗有效剂量的抗CGRP受体抗体或其结合片段。因此,在一些实施方案中,可每月向患者施用一次本文所描述的抗CGRP受体抗体或其结合片段的剂量中的任一者(QM给药)。依据QM给药方案,通常每24至36天,优选每28至35天,更优选每28至31天或甚至更优选每28天或每30天向患者施用抗CGRP受体抗体或其结合片段。在这些和其他实施方案中,例如使用如本文中所描述的自注射装置通过快速注射向患者施用每月剂量。举例来说,可任选用含有70mg剂量的自动注射器、笔式注射器或预填注射器,通过单次快速注射70mg来向患者施用70mg的每月剂量。在某些实施方案中,以两次或更多次连续注射来给与每月剂量。举例来说,可任选用含有35mg剂量的两个注射装置(例如自动注射器、笔式注射器或预填注射器),通过两次连续注射35mg来向患者施用70mg的每月剂量。类似地,可任选用含有70mg剂量的两个注射装置(例如自动注射器、笔式注射器或预填注射器),通过两次连续注射70mg来向患者施用140mg的每月剂量。将在一天时间内给与的连续注射视为单次施用。换句话说,举例来说,将在一天时间内单次快速注射70mg与两次连续注射35mg均视为单次施用70mg剂量。在替代实施方案中,将抗CGRP受体抗体或其结合片段的剂量分成在给药频率周期过程内两次或更多次施用。举例来说,对于一个月的给药频率周期,可将每月剂量分成四剂并且每周施用一次,或分成两剂并且每两周施用一次。可将本文所描述的抗CGRP受体抗体或结合片段的剂量中的任一者分成两次或更多次施用。可视偏头痛(例如发作性或慢性)的类型和严重程度、患者的年龄、患者的身体健康状况、与其他药物的同时治疗和/或其他病状的存在而定针对具体患者对施用次数和中间时间间隔进行调整。在某些实施方案中,本文所描述的抗CGRP受体抗体或其结合片段的剂量的给药频率周期为每月进行。换句话说,抗CGRP受体抗体或其结合片段的剂量为每月剂量,但可以单次施用(即每月一次;QM给药)来施用,或在该月过程内分成多次施用(例如每两周施用每月剂量的½)。在一些实施方案中,给药频率为每2个月一次(Q2M给药)。在其他实施方案中,给药频率为每3个月一次(Q3M给药)。在本发明的方法的一些实施方案中,在固定治疗时间段内向患者施用抗CGRP受体抗体或结合片段。“治疗时间段”在施用第一剂抗CGRP受体抗体或结合片段时开始并且在施用最后一剂抗CGRP受体抗体或结合片段时结束。治疗时间段可包含约1个月至约36个月,诸如约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约18个月、约21个月、约24个月、约27个月、约30个月或约33个月。在一些实施方案中,治疗时间段为约6个月。在其他实施方案中,治疗时间段为约7个月。在其他实施方案中,治疗时间段为约12个月。在某些实施方案中,治疗时间段可超过36个月,诸如为48或60或64个月或更长时间。在一个特定实施方案中,治疗时间段为至少约6个月并且相较于未治疗受试者,使患者偏头痛的频率、持续时间或严重程度产生统计学上显著的降低。根据本发明的方法施用抗CGRP受体抗体或其结合片段优选在患者中引起极少或不引起不良副作用。如本文所使用,术语“不良副作用”是指可能由服用药物引起的任何异常、缺陷、突变、损伤、变性、有害或不合需要的反应、症状或损伤。在一些实施方案中,施用抗CGRP受体抗体或其结合片段不会实质上引起其他偏头痛预防性治疗(例如阿米替林、双丙戊酸(divalproex)、丙戊酸、普萘洛尔、噻吗洛尔、托吡酯及肉毒杆菌毒素A)所伴随的一种或多种不良副作用。伴随其他偏头痛预防性治疗的副作用包括(但不限于)疲劳、恶心、眩晕、失眠、抑郁、运动耐量减少、颤抖、感觉异常、致畸性以及认知困难。在其他实施方案中,相较于与其他偏头痛预防性治疗所伴随的不良副作用的比率或数目,施用抗CGRP受体抗体或其结合片段伴随较低的不良副作用比率或数目。在其他实施方案中,相较于由于其他偏头痛预防性治疗所伴随的不良副作用而中止治疗的比率,施用抗CGRP受体抗体或其结合片段伴随较低的由于不良副作用而中止治疗的比率。在某些实施方案中,施用抗CGRP受体抗体或结合片段所伴随的不良副作用的数目和类型与施用安慰剂所伴随的不良副作用的数目和类型在统计学上并无不同。在一些实施方案中,如通过不良事件常用术语标准v4.0(CommonTerminologyCriteriaforAdverseEvents(CTCAE))所评估,施用抗CGRP受体抗体或其结合片段不会伴随超过2级的不良事件。在其他实施方案中,如通过CTCAE所评估,施用抗CGRP受体抗体或其结合片段不会伴随超过1级的不良事件。在某些实施方案中,要根据本发明的方法治疗的患者具有、患有或被诊断为患有发作性偏头痛。当有偏头痛史(例如寿命中至少五次偏头痛发作)的患者每月具有14天或更少的如本文所定义的偏头痛天数时,诊断为发作性偏头痛。在一些实施方案中,具有、患有或被诊断患有发作性偏头痛的患者平均每月具有至少四天但少于15天的偏头痛天数。在相关实施方案中,具有、患有或被诊断为患有发作性偏头痛的患者平均每月具有少于15天的头痛天数。如本文所使用,“头痛天数”为患者经历如本文所定义的偏头痛或持续超过30分钟或需要急性头痛治疗的任何头痛的任何日历天数。在一些实施方案中,可将患者归类为具有或患有高频率发作性偏头痛。高频率发作性偏头痛可以每月8至14天偏头痛为特征。在其他实施方案中,可将患者归类为具有或患有低频率发作性偏头痛。低频率发作性偏头痛可以每月少于8天偏头痛为特征。在一些实施方案中,要根据本发明的方法治疗的患者具有、患有或被诊断为患有慢性偏头痛。当偏头痛患者(即,寿命中有至少五次偏头痛发作的患者)每月有15天或更多头痛天数并且头痛天数中至少8天为偏头痛天数时,诊断为慢性偏头痛。在一些实施方案中,具有、患有或被诊断为患有慢性偏头痛的患者平均每月具有15天或更多偏头痛天数。在本文所描述的方法的某些实施方案中,施用抗CGRP受体抗体或其结合片段预防、降低或延迟患者的发作性偏头痛发展至慢性偏头痛。在本文所描述的方法的某些实施方案中,患者为未进行过治疗的。在一个实施方案中,如果患者过去未曾接受过偏头痛治疗,那么患者为未进行过治疗的。在另一实施方案中,如果患者未施用过治疗偏头痛的治疗剂,那么患者为未进行过治疗的。在一些实施方案中,如果患者过去未曾接受过偏头痛预防性疗法,那么患者为未进行过治疗的。举例来说,在某些实施方案中,未进行过治疗的患者未接受过先前疗法或未曾施用过预防性治疗发作性偏头痛的治疗剂。在某些其他实施方案中,未进行过治疗的患者未接受过先前疗法或未曾施用过预防性治疗慢性偏头痛的治疗剂。在本文所描述的方法的一些实施方案中,患者用至少一种其他偏头痛预防性疗法失败了或对其不耐受。举例来说,在一个特定实施方案中,患者对用至少一种偏头痛预防性药剂的先前疗法不起反应。如本文所使用,“不起反应”或“治疗失败”是指在预防性药剂标准治疗方案之后,药剂在降低患者偏头痛的频率、持续时间和/或严重程度方面缺乏功效。举例来说,在一个实施方案中,先前用偏头痛预防性药剂治疗失败的患者为在施用偏头痛预防性药剂之后所经历的每月偏头痛天数与用所述药剂治疗之前的每月偏头痛天数相同或比其更多的患者。在另一实施方案中,先前用偏头痛预防性药剂治疗失败的患者为在施用偏头痛预防性药剂之后所经历的每月急性偏头痛特异性药物治疗天数与用所述药剂治疗之前的每月急性偏头痛特异性药物治疗天数相同或比其更多的患者。在另一实施方案中,先前用偏头痛预防性药剂治疗失败的患者为在施用偏头痛预防性药剂之后所经历的偏头痛发作次数与用所述药剂治疗之前的偏头痛发作次数相同或比其更多的患者。在另一实施方案中,先前用偏头痛预防性药剂治疗失败的患者为如通过MPFID所测量,在施用偏头痛预防性药剂之后所经历的身体受损程度(例如平均每月具有身体受损的天数)与用所述药剂治疗之前身体受损的程度相同或比其更严重的患者。对先前用偏头痛预防性药剂治疗不起反应还可包括无法耐受偏头痛预防性药剂。举例来说,在一些实施方案中,先前用偏头痛预防性药剂治疗失败的患者为无法耐受所述药剂伴随的副作用的患者。在此类实施方案中,所述药剂伴随的副作用会加重患者所患另一医学病状或可能与另一医学病状不相容。举例来说,具有致畸副作用的偏头痛预防性药剂在怀孕患者中将禁忌使用。在某些实施方案中,先前用偏头痛预防性药剂治疗失败的患者为由于相关副作用而中止所述偏头痛预防性药剂治疗的患者。在这些和其他实施方案中,先前用偏头痛预防性药剂治疗失败的患者为由于副作用的影响超过偏头痛预防性药剂的治疗效益而选择终止治疗、改变治疗方案或改用不同预防性药剂的患者。偏头痛预防性药剂包括(但不限于)β-阻断剂(例如普萘洛尔、噻吗洛尔、阿替洛尔(atenolol)、美托洛尔(metoprolol)以及纳多洛尔(nadolol))、抗癫痫药(例如双丙戊酸、丙戊酸钠、丙戊酸、托吡酯以及加巴喷丁(gabapentin))、三环抗抑郁剂(例如阿米替林、去甲替林(nortriptyline)、多塞平(doxepin)及氟西汀(fluoxetine))以及A型肉毒杆菌毒素。因此,在某些实施方案中,根据本发明的方法治疗的患者用这些偏头痛预防性药剂中的一种或多种失败或对其不耐受。在一些实施方案中,患者用至少两种偏头痛预防性药剂治疗失败或对其不耐受。在其他实施方案中,患者用至少三种偏头痛预防性药剂治疗失败或对其不耐受。在某些实施方案中,患者用选自普萘洛尔、噻吗洛尔、双丙戊酸、丙戊酸、托吡酯、阿米替林或A型肉毒杆菌毒素中的一种或多种药剂治疗失败或对其不耐受。在一个特定实施方案中,患者用托吡酯治疗失败或对其不耐受。在另一特定实施方案中,患者用普萘洛尔治疗失败或对其不耐受。在另一特定实施方案中,患者用阿米替林治疗失败或对其不耐受。在一些实施方案中,患者用至少两种不同种类的偏头痛预防性药剂治疗失败或对其不耐受。举例来说,在一个实施方案中,患者可能用抗癫痫药(例如托吡酯)和β-阻断剂(例如普萘洛尔)治疗失败或对其不耐受。在另一实施方案中,患者可能用抗癫痫药(例如托吡酯)和抗抑郁剂(例如阿米替林)治疗失败或对其不耐受。在另一实施方案中,患者可能用β-阻断剂(例如普萘洛尔)和抗抑郁剂(例如阿米替林)治疗失败或对其不耐受。在某些实施方案中,患者用至少三种不同种类的偏头痛预防性药剂治疗失败或对其不耐受。在此类实施方案中,患者用抗癫痫药(例如托吡酯)、β-阻断剂(例如普萘洛尔)以及抗抑郁剂(例如阿米替林)治疗失败或对其不耐受。本文所描述的方法还适用于其他类型的头痛病症,诸如紧张型头痛、丛集型头痛、偏瘫性偏头痛以及视网膜性偏头痛。因此,本发明还提供通过以本文所描述的剂量方案中的任一种向有需要的患者施用抗CGRP受体抗体或其结合片段来治疗(包括预防性治疗)或预防前述头痛病症中的任一种的方法。本文所描述的方法包括向患者施用抗CGRP受体抗体或其结合片段。如本文所使用,术语“抗体”是指任何同型的完整免疫球蛋白或其可与完整抗体竞争特异性结合至靶抗原的抗原结合片段,并且包括例如嵌合抗体、人源化抗体、完全人类抗体、双特异性抗体以及多价抗体。抗体的结构单元通常包含一个或多个四聚体,各自由相同的两对多肽链构成,不过一些哺乳动物物种还产生仅具有单一重链的抗体。在典型抗体中,每一对包括一条全长“轻”链(在某些实施方案中为约25kDa)和一条全长“重”链(在某些实施方案中为约50-70kDa)。每一个别免疫球蛋白链由若干个“免疫球蛋白域”构成,各域由约90至110个氨基酸组成并且表达特征性折叠模式。这些域为构成抗体多肽的基本单元。每条链的氨基末端部分通常包括负责抗原识别的可变域。羧基末端部分在演化上比链的另一端更保守并且被称为“恒定区”或“C区”。一般将人类轻链分类为κ轻链和λ轻链,并且这些链各自含有一个可变域和一个恒定域。通常将重链分类为μ、δ、γ、α或ε链,并且这些链分别将抗体的同型定义为IgM、IgD、IgG、IgA以及IgE。IgG具有若干亚型,包括(但不限于)IgG1、IgG2、IgG3以及IgG4。IgM亚型包括IgM和IgM2。IgA亚型包括IgA1和IgA2。在人类中,IgA和IgD同型含有四条重链和四条轻链;IgG和IgE同型含有两条重链和两条轻链;而IgM同型含有五条重链和五条轻链。重链C区通常包含可负责效应子功能的一个或多个域。重链恒定区结构域的数目将取决于同型。举例来说,IgG重链各含有三个C区结构域,称为CH1、CH2以及CH3。可用于本发明的方法中的抗体可具有这些同型和亚型中的任一种。在某些实施方案中,抗CGRP受体抗体属于IgG1、IgG2或IgG4亚型。在一个特定实施方案中,抗CGRP受体抗体为IgG2抗体(例如包含人类IgG2恒定域)。在另一特定实施方案中,抗CGRP受体抗体为IgG1抗体(例如人类IgG1恒定域)。在全长轻链和重链中,可变区和恒定区由具有约十二个或更多个氨基酸的“J”区接合,其中重链还包括具有约十个或更多个氨基酸的“D”区。参见例如FundamentalImmunology,第2版,第7章(Paul,W.编)1989,NewYork:RavenPress(出于所有目的以全文引用的方式并入本文中)。各轻链/重链对的可变区通常形成抗原结合位点。免疫球蛋白链的可变区一般展现相同整体结构,包含由三个更常称为“互补决定区”或CDR的高变区接合的相对保守构架区(FR)。每一重链和轻链对的两条链中的CDR通常由构架区对准以形成特异性结合至在靶蛋白(例如CGRP受体)上的特异性表位的结构。从N末端至C末端,天然存在的轻链和重链可变区通常遵循这些元件的以下次序:FR1、CDR1、FR2、CDR2、FR3、CDR3以及FR4。已设计出对占据这些域中的每一个中的位置的氨基酸分配编号的编号系统。KabatSequencesofProteinsofImmunologicalInterest(1987和1991,NIH,Bethesda,MD)或Chothia和Lesk,1987,J.Mol.Biol.196:901-917;Chothia等人,1989,Nature342:878-883中定义了此编号系统。术语“结合片段”与术语“抗原结合片段”在本文中可互换使用并且指抗体中缺乏存在于全长重链和/或轻链中的至少一些氨基酸,但能够特异性结合至抗原的部分(不管所述部分是如何获得或合成的)。此类片段具有生物活性,因为它们特异性结合于靶抗原并且可与其他抗原结合蛋白(包括完整抗体)竞争特异性结合于指定表位。在一个方面中,此类片段将保留至少一个存在于全长轻链或重链中的CDR,并且在一些实施方案中,将包含单一重链和/或轻链或其部分。这些生物活性片段可通过重组DNA技术来产生,或可通过抗原结合蛋白(包括完整抗体)的酶促或化学裂解来产生。免疫功能性免疫球蛋白片段包括(但不限于)Fab、Fab'、F(ab')2、Fv、域抗体以及单链抗体,并且可来源于任何哺乳动物来源,包括(但不限于)人类、小鼠、大鼠、骆驼或兔。抗体结合片段可为合成或基因工程改造的蛋白质。举例来说,抗体结合片段包括由轻链可变区组成的分离片段、由重链和轻链的可变区组成的“Fv”片段,以及通过肽接头连接轻链和重链可变区的重组单链多肽分子(scFv蛋白质)。抗体结合片段的另一种形式为包含抗体的一个或多个互补决定区(CDR)的肽。通过例如构建编码所关注CDR的聚核苷酸来获得CDR(也称为“最小识别单元”或“高变区”)。例如通过使用聚合酶链反应,使用抗体产生细胞的mRNA作为模板合成可变区来制备此类聚核苷酸(参见例如,Larrick等人,Methods:ACompaniontoMethodsinEnzymology,2:106(1991);Courtenay-Luck,“GeneticManipulationofMonoclonalAntibodies”,MonoclonalAntibodiesProduction,EngineeringandClinicalApplication,Ritter等人(编),第166页,CambridgeUniversityPress(1995);以及Ward等人,“GeneticManipulationandExpressionofAntibodies”,MonoclonalAntibodies:PrinciplesandApplications,Birch等人(编),第137页,Wiley-Liss,Inc.(1995))。用于本发明的方法中的抗CGRP受体抗体或其结合片段特异性结合至人类CGRP受体。人类CGRP受体为异二聚体,所述异二聚体包含人类降钙素受体样受体(CRLR)多肽和人类受体活性修饰蛋白质1(RAMP1)多肽。在一些实施方案中,抗CGRP受体抗体或其结合片段特异性结合至CRLR和RAMP1的胞外域的区域。下表中提供了人类CRLR和RAMP1的示例性胞外域和全长蛋白质的氨基酸序列。表1.人类CRLR和人类RAMP1多肽的序列当解离常数(KD)≤10-6M时,认为抗体或结合片段“特异性结合”至其靶标。当KD≤1×10-8M时,抗体或结合片段以“高亲和力”特异性结合靶抗原。在一个实施方案中,抗体或结合片段以KD≤5×10-7M结合至人类CGRP受体。在另一实施方案中,抗体或结合片段以KD≤1×10-7M结合至人类CGRP受体。在另一实施方案中,抗体或结合片段以KD≤5×10-8M结合至人类CGRP受体。在另一实施方案中,抗体或结合片段以KD≤1×10-8M结合至人类CGRP受体。在另一实施方案中,抗体或结合片段以KD≤5×10-9M结合至人类CGRP受体。在某些实施方案中,抗体或结合片段以KD≤1×10-9M结合至人类CGRP受体。在其他实施方案中,抗体或结合片段以KD≤5×10-10M结合至人类CGRP受体。在另其他实施方案中,抗体或结合片段以KD≤1×10-10M结合至人类CGRP受体。使用多种技术来测定亲和力,其实例为亲和力ELISA分析。在各种实施方案中,通过BIAcore分析来测定亲和力。在一些实施方案中,通过动力学方法来测定亲和力。在其他实施方案中,通过平衡/溶解方法来测定亲和力。在某些实施方案中,通过FACS结合分析来测定亲和力。WO2010/075238(以全文引用的方式并入本文中)描述了适用于测定抗CGRP受体抗体的亲和力的亲和力分析。在某些实施方案中,本文所描述的方法中采用的抗CGRP受体抗体或其结合片段特异性结合至人类CRLR和人类RAMP1多肽中的残基或残基序列或区域。在一个特定实施方案中,抗CGRP受体抗体或其结合片段特异性结合至由人类CRLR和人类RAMP1多肽中的氨基酸形成的表位。“表位”是指能够特异性结合至抗体或其结合片段或T细胞受体的任何决定簇。表位可为相连或不相连的(例如,(i)在单链多肽中,在多肽序列中彼此不相连,但在分子的背景内由抗原结合蛋白结合的氨基酸残基,或(ii)在例如包含两种或更多种个别组分的多聚体蛋白质中,存在于所述个别组分中的两种或更多种之上,但在多聚体蛋白质的背景内由抗体或结合片段结合的氨基酸残基)。在一些实施方案中,由人类CRLR和人类RAMP1多肽中的氨基酸形成的表位包含AspN蛋白酶的一个或多个裂解位点,所述蛋白酶在天冬氨酸残基和氨基端处的一些谷氨酸残基之后裂解肽。在某些实施方案中,用于本发明的方法中的抗CGRP受体抗体或结合片段特异性结合至包含氨基酸序列SEQIDNO:3的人类CRLR多肽的胞外域。或者或另外,抗CGRP受体抗体或结合片段特异性结合至包含氨基酸序列SEQIDNO:4的人类RAMP1多肽的胞外域。在一些实施方案中,抗CGRP受体抗体或结合片段特异性结合至人类CRLR多肽内的选自以下序列的至少一个序列:SEQIDNO:5(DSIQLGVTRNKIMTAQY;对应于SEQIDNO:3的氨基酸8-24)、SEQIDNO:6(DVAAGTESMQLCP;对应于SEQIDNO:3的氨基酸55-67)、SEQIDNO:7(DGNWFRHPASNRTWTNYTQCNVNTH;对应于SEQIDNO:3的氨基酸86-110)、SEQIDNO:8(ECYQKIMQ;对应于SEQIDNO:3的氨基酸25-32)或SEQIDNO:9(DGWLCWN;对应于SEQIDNO:3的氨基酸48-54)。举例来说,在一些实施方案中,抗CGRP受体抗体结合具有SEQIDNO:3(包含SEQIDNO:5-9)的人类CRLR多肽的子区域,其任选呈其天然三维构象。或者或另外,抗CGRP受体抗体或结合片段特异性结合至人类RAMP1多肽内的选自以下序列的至少一个序列:SEQIDNO:10(RELADCTWHMAE;对应于SEQIDNO:4的氨基酸41-52)、SEQIDNO:11(DWGRTIRSYRELA;对应于SEQIDNO:4的氨基酸32-44)、SEQIDNO:12(ELCLTQFQV;对应于SEQIDNO:4的氨基酸12-20)或SEQIDNO:13(DCTWHMA;对应于SEQIDNO:4的氨基酸45-51)。在一些实施方案中,抗CGRP受体抗体结合具有SEQIDNO:4(包含SEQIDNO:10-13)的人类RAMP1多肽的子区域,其任选呈其天然三维构象。在某些实施方案中,抗CGRP受体抗体或结合片段特异性结合至具有SEQIDNO:6、SEQIDNO:7、SEQIDNO:8以及SEQIDNO:9的氨基酸序列的人类CRLR多肽,其中SEQIDNO:6和7由参照SEQIDNO:3在氨基酸位置66和105处的二硫键接合,而SEQIDNO:8和9由参照SEQIDNO:3在氨基酸位置26和52处的二硫键接合,任选其中多肽保持具有SEQIDNO:3的人类CRLR相应多肽区域的三级结构。在一些实施方案中,抗CGRP受体抗体或结合片段特异性结合至具有SEQIDNO:12和SEQIDNO:13的氨基酸序列的人类RAMP1多肽,其中所述序列由参照SEQIDNO:4在氨基酸位置14和46处的二硫键接合,任选其中多肽保持具有SEQIDNO:4的人类RAMP1相应多肽区域的三级结构。在特定实施方案中,抗CGRP受体抗体或结合片段特异性结合至人类CRLR多肽和人类RAMP1多肽,其中人类CRLR多肽具有SEQIDNO:6、SEQIDNO:7、SEQIDNO:8以及SEQIDNO:9的氨基酸序列,其中SEQIDNO:6和7由参照SEQIDNO:3在氨基酸位置66和105处的二硫键接合,而SEQIDNO:8和9由参照SEQIDNO:3在氨基酸位置26和52处的二硫键接合,并且其中人类RAMP1多肽具有SEQIDNO:12和SEQIDNO:13的氨基酸序列,其中SEQIDNO:12和13由参照SEQIDNO:4在氨基酸位置14和46处的二硫键接合。在此类实施方案中,人类CRLR和人类RAMP1多肽分别保持具有SEQIDNO:3和4的人类CRLR和人类RAMP1多肽相应区域的三级结构。在相关实施方案中,人类CRLR和人类RAMP1多肽形成异二聚体。适用于本发明的方法中的抗CGRP受体抗体或结合片段优选抑制、干扰或调节人类CGRP受体的一种或多种生物活性。人类CGRP受体的生物活性包括(但不限于)诱导CGRP受体信号转导路径、诱导血管扩张、抑制血管收缩以及诱发炎症(例如神经性炎症)。在一些实施方案中,抗CGRP受体或其抗原结合片段实质上抑制人类CGRP受体与CGRP配体的结合。当例如通过在体外竞争性结合分析中测量结合,过量抗体或其结合片段使人类CGRP受体与CGRP的结合或CGRP与人类CGRP受体的结合的量减少至少约20%、约30%、约40%、约50%、约60%、约70%、约80%、约85%、约90%、约95%、约97%、约99%或更多时,发生“基本结合抑制”。在某些实施方案中,如与人类肾上腺髓素1(AM1)、肾上腺髓素2(AM2)或淀粉素受体(例如人类AMY1受体)相比较,用于本文所描述的方法中的抗CGRP受体抗体或结合片段选择性抑制人类CGRP受体。人类AM1受体包含人类CRLR多肽和RAMP2多肽,而人类AM2受体包含人类CRLR多肽和RAMP3多肽。因此,预期仅结合CRLR(而不结合RAMP1)的抗体或其他结合蛋白将不会选择性抑制CGRP受体,因为CRLR多肽也为AM1和AM2受体的组分。人类淀粉素(AMY)受体包含人类降钙素受体(CT)多肽以及RAMP1、RAMP2或RAMP3亚基中的一种。具体地说,人类AMY1受体由CT多肽和RAMP1多肽构成,人类AMY2受体由CT多肽和RAMP2多肽构成,而人类AMY3受体由CT多肽和RAMP3多肽构成。因此,预期仅结合RAMP1(而不结合CRLR)的抗体或其他结合蛋白将不会选择性抑制CGRP受体,因为RAMP1多肽也为人类AMY1受体的组分。当抗体或其抗原结合片段在特异性受体的抑制分析中的IC50值比在另一“参考”受体的抑制分析中的IC50值低至少50倍时,所述抗体或其抗原结合片段相对于其他受体“选择性抑制”所述特异性受体。“IC50”为将指定生物过程抑制一半所需的药物或物质的量。可通过构建剂量-反应曲线并且检查不同浓度的药物或拮抗剂在特定功能分析中逆转激动剂活性的作用来确定任何特定物质或拮抗剂的IC50值。可通过测定抑制激动剂的最大生物反应的一半所需的浓度来计算指定拮抗剂或药物的IC50值。因此,可通过在任何功能分析中测定抑制CGRP配体使CGRP受体活化的最大生物反应的一半所需的抗体或结合片段的浓度来计算任何抗CGRP抗体或结合片段的IC50值。“选择性比率”为参考受体的IC50值除以特异性受体的IC50值的比值。如果在诸如环状AMP(cAMP)分析等功能性CGRP受体分析中,抗CGRP受体抗体或其抗原结合片段的IC50值比所述抗体或其抗原结合片段在人类AM1、AM2或淀粉素受体(例如AMY1)抑制分析中的IC50值低至少50倍,那么所述抗体或其抗原结合片段选择性抑制人类CGRP受体。作为非限制性实例,如果特异性抗CGRP受体抗体在人类CGRP受体的cAMP分析中的IC50值例如在0.1nM与20nM之间,而所述抗体在人类AM1、人类AM2或人类AMY1受体的cAMP分析中的IC50值为1000nM或更高,那么所述抗体将被视为选择性抑制人类CGRP受体。可使用任何适合的CGRP受体功能分析,诸如WO2010/075238的实施例4中所描述的cAMP分析(以全文引用的方式并入本文中)来确定选择性抑制的程度。选择性抑制特异性受体的抗体或其抗原结合片段还应被理解为针对所述受体的中和抗体或抗原结合片段。在某些实施方案中,相对于人类AM1、AM2和/或AMY1受体,抗CGRP受体抗体或其结合片段可选择性抑制人类CGRP受体,例如其选择性比率为100或更高、250或更高、500或更高、750或更高、1,000或更高、2,500或更高、5,000或更高或10,000或更高。在一个实施方案中,相对于人类AM1、AM2和/或AMY1受体,抗CGRP受体抗体或其结合片段选择性抑制人类CGRP受体,其选择性比率为100或更高。在另一实施方案中,相对于人类AM1、AM2和/或AMY1受体,抗CGRP受体抗体或其结合片段选择性抑制人类CGRP受体,其选择性比率为500或更高。在一些实施方案中,抗CGRP受体抗体或其结合片段特异性结合至人类CRLR和人类RAMP1多肽,而不特异性结合至人类AM1、人类AM2和/或人类淀粉素受体(例如AMY1或AMY2)。举例来说,抗CGRP受体抗体或其结合片段可特异性结合人类CGRP受体,并且KD≤1μM、≤100nM、≤10nM或≤5nM。在一些实施方案中,如使用FACS结合分析所测定并且例如使用Rathanaswami等人,BiochemicalandBiophysicalResearchCommunications334(2005)1004-1013中所描述的方法分析,抗CGRP受体抗体或其结合片段特异性结合至人类CGRP受体,并且KD≤100nM、≤10nM或≤5nM。在某些实施方案中,抗CGRP受体抗体或其结合片段特异性结合至人类CGRP受体,并且KD≤100nM。在其他实施方案中,抗CGRP受体抗体或其结合片段特异性结合至人类CGRP受体,并且KD≤10nM。在某些实施方案中,在CGRP结合竞争分析中,抗CGRP受体抗体或其结合片段的Ki≤100nM、≤10nM、≤1nM、≤0.5nM或≤0.1nM。“Ki”是指在抑制研究中所测定的配体的平衡解离常数。通常在竞争性放射性标记配体结合研究中,通过在平衡条件下测量所关注的竞争物质抑制参考放射性标记配体的结合来测定指定配体的Ki。用于评估配体/受体相互作用的抑制剂的结合竞争分析为本领域技术人员已知的并且可包括使用放射性标记配体(例如放射性标记的CGRP)和表达受体(例如人类CGRP受体)的细胞的分析。在一些实施方案中,使用放射性标记的125I-CGRP结合竞争分析来测定抗CGRP受体抗体或其结合片段的Ki,其中评估了放射性标记的配体与表达人类CGRP受体的细胞的膜的结合。以全文引用的方式并入本文中的WO2010/075238的实施例5中描述了用于进行此类分析的示例性方案。在一个实施方案中,抗CGRP受体抗体或其结合片段在CGRP结合竞争分析中的Ki小于10nM。在另一实施方案中,抗CGRP受体抗体或其结合片段在CGRP结合竞争分析中的Ki小于1nM。以全文引用的方式并入本文中的WO2010/075238中描述了适用于本发明的方法中的抗CGRP受体抗体或其结合片段的实例。在一个实施方案中,本文所描述的方法中采用的抗CGRP受体抗体或其结合片段交叉阻断抗体1E11、1H7、2E7、3B6、3C8、4E4、4H6、5F5、9D4、9F5、10E4、11D11、11H9、12E8、12G8、13H2以及32H7(在本文和WO2010/075238中描述了所有这些抗体)中的至少一种与人类CGRP受体的结合。或者或另外,抗体1E11、1H7、2E7、3B6、3C8、4E4、4H6、5F5、9D4、9F5、10E4、11D11、11H9、12E8、12G8、13H2以及32H7(本文中描述了所有这些抗体)中的至少一种交叉阻断抗CGRP受体抗体或其结合片段与人类CGRP受体的结合。已确定所有这些抗体均为人类CGRP受体的中和抗体,并且结合至人类CGRP受体的大体上相同的区域,所述区域不同于受体中非中和抗体所结合的区域。参见WO2010/075238的实施例7。术语“交叉阻断(cross-block)”、“被交叉阻断(cross-blocked)”以及“交叉阻断着(cross-blocking)”在本文中可互换使用,意指抗体干扰其他抗体或结合片段与人类CGRP受体结合的能力。可使用竞争结合分析确定抗体或结合片段能够干扰另一抗体与人类CGRP受体结合的程度,并且因此确定是否可称其为交叉阻断。在一些实施方案中,交叉阻断抗体或其结合片段使人类CGRP受体与参考抗体的结合减少约40%与100%之间,诸如在约60%与约100%之间,具体地说在约70%与100%之间,并且更具体地说在约80%与100%之间。特别适合检测交叉阻断的定量分析为使用Biacore机器,所述Biacore机器使用表面等离子体共振技术来测量相互作用的程度。另一适合的定量交叉阻断分析为使用基于FACS的方法,依据抗体与人类CGRP受体的结合来测量抗体之间的竞争。用于本文所公开的方法中的抗CGRP受体抗体及其结合片段可以包含一个重链CDR1(“CDRH1”)和/或一个重链CDR2(“CDRH2”)和/或一个重链CDR3(“CDRH3”),和/或一个轻链CDR1(“CDRL1”)和/或一个轻链CDR2(“CDRL2”)和/或一个轻链CDR3(“CDRL3”)。在一些实施方案中,抗CGRP受体抗体或结合片段包含至少一个包含CDRH1、CDRH2以及CDRH3的重链可变区和至少一个包含CDRL1、CDRL2以及CDRL3的轻链可变区。表2和3中分别列出了具体重链和轻链CDR。可使用Kabat等人在SequencesofProteinsofImmunologicalInterest,第5版,USDept.ofHealthandHumanServices,PHS,NIH,NIH出版号91-3242,1991中所描述的系统来鉴别指定抗体的互补决定区(CDR)和构架区(FR)。本文所公开的某些抗体和结合片段包含一个或多个与表2(重链CDR,即CDRH)和表3(轻链CDR,即CDRL)中所呈现的CDR中的一种或多种的氨基酸序列相同或具有基本序列同一性的氨基酸序列。表2.示例性重链CDR氨基酸序列表3.示例性轻链CDR氨基酸序列在一些实施方案中,抗CGRP受体抗体或其结合片段包含一个或多个选自以下的重链CDR:(i)选自由SEQIDNO:14至22组成的群组的CDRH1;(ii)选自由SEQIDNO:23至33组成的群组的CDRH2;(iii)选自由SEQIDNO:34至43组成的群组的CDRH3;以及(iv)(i)、(ii)以及(iii)中含有一个或多个,例如一个、两个、三个、四个或更多个氨基酸取代(例如保守氨基酸取代)、缺失或插入不超过五个、四个、三个、两个或一个氨基酸的CDRH。在这些和其他实施方案中,抗CGRP受体抗体或其结合片段包含一个或多个选自以下的轻链CDR:(i)选自由SEQIDNO:44至54组成的群组的CDRL1;(ii)选自由SEQIDNO:55至64组成的群组的CDRL2;(iii)选自由SEQIDNO:65至74组成的群组的CDRL3;以及(iv)(i)、(ii)以及(iii)中含有一个或多个,例如一个、两个、三个、四个或更多个氨基酸取代(例如保守氨基酸取代)、缺失或插入不超过五个、四个、三个、两个或一个氨基酸的CDRL。在某些实施方案中,抗CGRP受体抗体或其结合片段可以包含表2和3中所列CDR的1、2、3、4、5或6种变体形式,所述变体形式各自与表2和3中所列CDR序列具有至少80%、85%、90%或95%序列同一性。一些抗CGRP受体抗体或其结合片段包括表2和3中所列CDR中的1、2、3、4、5或6种,它们各自有不超过1、2、3、4或5个氨基酸与所述表中所列的CDR不同。在一些实施方案中,抗CGRP受体抗体或结合片段包括含CDRH1、CDRH2以及CDRH3的重链可变区,其中:(a)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:14、23以及34的序列;(b)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、24以及35的序列;(c)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:16、25以及36的序列;(d)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:17、26以及37的序列;(e)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:18、27以及38的序列;(f)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、29以及35的序列;(g)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:20、30以及40的序列;(h)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、31以及35的序列;(i)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:14、23以及41的序列;(j)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:21、32以及42的序列;(k)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:22、33以及43的序列;或(l)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:19、28以及39的序列。在一些实施方案中,抗CGRP受体抗体或结合片段包括含CDRL1、CDRL2以及CDRL3的轻链可变区,其中:(a)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:44、55以及65的序列;(b)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:45、56以及66的序列;(c)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:46、57以及67的序列;(d)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:47、58以及68的序列;(e)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:48、59以及69的序列;(f)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:49、60以及70的序列;(g)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:50、59以及69的序列;(h)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:45、61以及66的序列;(i)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:51、62以及71的序列;(j)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:52、59以及69的序列;(k)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:53、63以及72的序列;(l)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:54、64以及73的序列;或(m)CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:54、64以及74的序列。在某些实施方案中,抗CGRP受体抗体或结合片段包括含CDRH1、CDRH2以及CDRH3的重链可变区和含CDRL1、CDRL2以及CDRL3的轻链可变区,其中:(a)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:14、23以及34的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:44、55以及65的序列;(b)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:14、23以及41的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:44、55以及65的序列;(c)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、24以及35的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:45、56以及66的序列;(d)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、29以及35的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:45、61以及66的序列;(e)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:15、31以及35的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:45、61以及66的序列;(f)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:16、25以及36的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:46、57以及67的序列;(g)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:17、26以及37的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:47、58以及68的序列;(h)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:18、27以及38的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:48、59以及69的序列;(i)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:18、27以及38的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:50、59以及69的序列;(j)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:19、28以及39的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:49、60以及70的序列;(k)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:20、30以及40的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:51、62以及71的序列;(l)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:21、32以及42的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:53、63以及72的序列;(m)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:22、33以及43的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:54、64以及73的序列;或(n)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:22、33以及43的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:54、64以及74的序列;或(o)CDRH1、CDRH2以及CDRH3分别具有SEQIDNO:18、27以及38的序列,并且CDRL1、CDRL2以及CDRL3分别具有SEQIDNO:52、59以及69的序列。在一些实施方案中,用于本发明的方法中的抗CGRP受体抗体或其结合片段包含具有SEQIDNO:14的序列的CDRH1、具有SEQIDNO:23的序列的CDRH2、具有SEQIDNO:34的序列的CDRH3、具有SEQIDNO:44的序列的CDRL1、具有SEQIDNO:55的序列的CDRL2以及具有SEQIDNO:65的序列的CDRL3。在其他实施方案中,用于本发明的方法中的抗CGRP受体抗体或其结合片段包含具有SEQIDNO:15的序列的CDRH1、具有SEQIDNO:29的序列的CDRH2、具有SEQIDNO:35的序列的CDRH3、具有SEQIDNO:45的序列的CDRL1、具有SEQIDNO:61的序列的CDRL2以及具有SEQIDNO:66的序列的CDRL3。在本文所描述的方法的某些实施方案中,抗CGRP受体抗体或其结合片段包含选自由VH1、VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12以及VH13组成的群组的重链可变区,和/或选自由VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16及VL17组成的群组的轻链可变区(如下表4中所示),以及这些轻链和重链可变区的免疫功能片段、衍生物、突变蛋白质以及变体。表4.示例性VL和VH链氨基酸序列表4中所列的重链可变区各自可与表4中所示的轻链可变区中的任一个组合以形成适用于本发明的方法中的抗CGRP受体抗体或结合片段。此类组合的实例包括VH1与VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17中的任一个组合;VH2与VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17中的任一个组合;VH3与VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17中的任一个组合;等等。在一些实施方案中,抗CGRP受体抗体或其结合片段包括来自表4中所列的那些可变区的至少一个重链可变区和/或至少一个轻链可变区。在某些实施方案中,抗CGRP受体抗体或结合片段包括来自表4中所列的那些可变区的至少两个不同重链可变区和/或轻链可变区。此类抗CGRP受体抗体或结合片段的实例包含(a)一个VH1,以及(b)VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12或VH13中的一个。另一实例包含(a)一个VH2,以及(b)VH1、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12或VH13中的一个。另一实例包含(a)一个VH3,以及(b)VH1、VH2、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12或VH13中的一个,等等。此类抗CGRP受体抗体或结合片段的另一实例包含(a)一个VL1,以及(b)VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17、VL18、VL19、VL20或VL21中的一个。此类抗CGRP受体抗体或结合片段的另一实例包含(a)一个VL2,以及(b)VL1、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17、VL18、VL19、VL20或VL21中的一个。此类抗CGRP受体抗体或结合片段的另一实例包含(a)一个VL3,以及(b)VL1、VL2、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17、VL18、VL19、VL20或VL21中的一个,等等。本领域技术人员显而易知,重链可变区的各种组合可与轻链可变区的各种组合中的任一个组合。在其他实施方案中,抗CGRP受体抗体或结合片段含有两个相同的轻链可变区和/或两个相同的重链可变区。举例来说,抗CGRP受体抗体或结合片段包括呈如表4中所列的轻链可变区对和重链可变区对的组合形式的两个轻链可变区和两个重链可变区。在本文所描述的方法的某些实施方案中,抗CGRP受体抗体或其结合片段包括所含氨基酸序列在仅1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基处不同于选自VH1、VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12以及VH13的重链可变域序列的重链可变域,其中每一此类序列差异独立地为一个氨基酸的缺失、插入或取代,并且所述缺失、插入和/或取代导致相对于前述可变域序列存在不超过15个氨基酸的变化。一些抗CGRP受体抗体或其结合片段中的重链可变区包含的氨基酸序列与VH1、VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12以及VH13的重链可变区的氨基酸序列具有至少70%、75%、80%、85%、90%、95%、97%或99%序列同一性。在本文所描述的方法的一些实施方案中,抗CGRP受体抗体或其结合片段包括所含氨基酸序列在仅1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基处不同于选自VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17的轻链可变域序列的轻链可变域,其中每一此类序列差异独立地为一个氨基酸的缺失、插入或取代,并且所述缺失、插入和/或取代导致相对于前述可变域序列存在不超过15个氨基酸的变化。一些抗CGRP受体抗体或其结合片段中的轻链可变区包含的氨基酸序列与VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16或VL17的轻链可变区的氨基酸序列具有至少70%、75%、80%、85%、90%、95%、97%或99%序列同一性。在某些实施方案中,适用于本发明的方法中的抗CGRP受体抗体或其抗原结合片段包含轻链可变区(VL)和重链可变区(VH),其中:(a)VL包含SEQIDNO:75的序列并且VH包含SEQIDNO:92的序列;(b)VL包含SEQIDNO:76的序列并且VH包含SEQIDNO:93的序列;(c)VL包含SEQIDNO:77的序列并且VH包含SEQIDNO:94的序列;(d)VL包含SEQIDNO:78的序列并且VH包含SEQIDNO:95的序列;(e)VL包含SEQIDNO:79的序列并且VH包含SEQIDNO:96的序列;(f)VL包含SEQIDNO:80的序列并且VH包含SEQIDNO:92的序列;(g)VL包含SEQIDNO:81的序列并且VH包含SEQIDNO:97的序列;(h)VL包含SEQIDNO:82的序列并且VH包含SEQIDNO:96的序列;(i)VL包含SEQIDNO:83的序列并且VH包含SEQIDNO:92的序列;(j)VL包含SEQIDNO:84的序列并且VH包含SEQIDNO:98的序列;(k)VL包含SEQIDNO:85的序列并且VH包含SEQIDNO:99的序列;(l)VL包含SEQIDNO:86的序列并且VH包含SEQIDNO:100的序列;(m)VL包含SEQIDNO:86的序列并且VH包含SEQIDNO:101的序列;(n)VL包含SEQIDNO:87的序列并且VH包含SEQIDNO:96的序列;(o)VL包含SEQIDNO:88的序列并且VH包含SEQIDNO:102的序列;(p)VL包含SEQIDNO:89的序列并且VH包含SEQIDNO:103的序列;(q)VL包含SEQIDNO:90的序列并且VH包含SEQIDNO:104的序列;或(r)VL包含SEQIDNO:91的序列并且VH包含SEQIDNO:104的序列。在一些实施方案中,抗CGRP受体抗体结合片段可包含与上述配对中所说明的可变域具有70%、75%、80%、85%、90%、95%、97%或99%序列同一性的氨基酸序列。在一个特定实施方案中,用于本文所描述的方法中的抗CGRP受体抗体或其结合片段包括含SEQIDNO:92的序列的重链可变区和含SEQIDNO:80的序列的轻链可变区。在另一特定实施方案中,用于本文所描述的方法中的抗CGRP受体抗体或其结合片段包括含SEQIDNO:98的序列的重链可变区和含SEQIDNO:84的序列的轻链可变区。表5和6中概述了可用于本发明的方法中的抗CGRP受体抗体的一些全长轻链和重链以及其相应氨基酸序列的具体实例。表5示出了示例性重链序列,而表6示出了示例性轻链序列。表5.示例性抗体重链氨基酸序列表6.示例性抗体轻链氨基酸序列例如为了促进重链和轻链序列在某些类型宿主细胞中的表达,可使信号肽序列与表5和6中所列的重链和轻链序列中的任一个的氨基末端附接/融合。举例来说,在一些实施方案中,具有氨基酸序列MDMRVPAQLLGLLLLWLRGARC(SEQIDNO:135)的信号肽与表5和6中的重链和轻链序列中的任一个的氨基末端融合。在其他实施方案中,具有氨基酸序列METPAQLLFLLLLWLPDTTG(SEQIDNO:136)的信号肽与表5和6中的重链和轻链序列中的任一个的氨基末端融合。其他信号肽为本领域技术人员已知的并且可与表5和6中所列的重链和/或轻链中的任一个融合,例如以促进或优化在特定宿主细胞中的表达。表5中所列的示例性重链(H1、H2、H3等)各自可与表6中所示的示例性轻链中的任一个组合以形成适用于本文所描述的方法中的抗CGRP受体抗体。此类组合的实例包括H1与L1至L17中的任一个的组合;H2与L1至L17中的任一个的组合;H3与L1至L17中的任一个的组合等等。在一些实施方案中,抗CGRP受体抗体包括表5和6中所列那些的至少一个重链和一个轻链。在一些实施方案中,抗CGRP受体抗体包含表5和6中所列的两个不同重链和两个不同轻链。在其他实施方案中,抗CGRP受体抗体含有两个相同轻链和两个相同重链。举例来说,抗CGRP受体抗体或其结合片段可以包括如表5和6中所列的两个H1重链和两L1轻链,或两个H2重链和两个L2轻链,或两个H3重链和两个L3轻链,以及其他轻链对和重链对的类似组合。本发明的方法中采用的抗CGRP受体抗体可为通过表5和6中所示的重链和轻链的组合形成的抗体变体,并且包含的轻链和/或重链各自与这些链的氨基酸序列具有至少70%、75%、80%、85%、90%、95%、97%或99%同一性。在一些情况下,此类抗体包括至少一个重链和一个轻链,而在其他情况下,变体形式含有两个相同轻链和两个相同重链。在本文所描述的方法的一些实施方案中,抗CGRP受体抗体包含:(a)包含SEQIDNO:105的序列的重链和包含SEQIDNO:118的序列的轻链;(b)包含SEQIDNO:106的序列的重链和包含SEQIDNO:119的序列的轻链;(c)包含SEQIDNO:107的序列的重链和包含SEQIDNO:120的序列的轻链;(d)包含SEQIDNO:108的序列的重链和包含SEQIDNO:121的序列的轻链;(e)包含SEQIDNO:109的序列的重链和包含SEQIDNO:122的序列的轻链;(f)包含SEQIDNO:105的序列的重链和包含SEQIDNO:123的序列的轻链;(g)包含SEQIDNO:110的序列的重链和包含SEQIDNO:124的序列的轻链;(h)包含SEQIDNO:109的序列的重链和包含SEQIDNO:125的序列的轻链;(i)包含SEQIDNO:105的序列的重链和包含SEQIDNO:126的序列的轻链;(j)包含SEQIDNO:111的序列的重链和包含SEQIDNO:127的序列的轻链;(k)包含SEQIDNO:112的序列的重链和包含SEQIDNO:128的序列的轻链;(l)包含SEQIDNO:113的序列的重链和包含SEQIDNO:129的序列的轻链;(m)包含SEQIDNO:114的序列的重链和包含SEQIDNO:129的序列的轻链;(n)包含SEQIDNO:109的序列的重链和包含SEQIDNO:130的序列的轻链;(o)包含SEQIDNO:115的序列的重链和包含SEQIDNO:131的序列的轻链;(p)包含SEQIDNO:116的序列的重链和包含SEQIDNO:132的序列的轻链;(q)包含SEQIDNO:117的序列的重链和包含SEQIDNO:133的序列的轻链;或(r)包含SEQIDNO:117的序列的重链和包含SEQIDNO:134的序列的轻链。在一个特定实施方案中,用于本发明的方法中的抗CGRP受体抗体包括含SEQIDNO:105的序列的重链和含SEQIDNO:123的序列的轻链。在另一特定实施方案中,用于本发明的方法中的抗CGRP受体抗体包括含SEQIDNO:111的序列的重链和含SEQIDNO:127的序列的轻链。用于本发明的方法中的示例性抗CGRP受体抗体包括(但不限于)抗体1E11、1H7、2E7、3B6、3C8、4E4、4H6、5F5、9D4、9F5、10E4、11D11、11H9、12E8、12G8、13H2以及32H7。表7概述了这些抗体中的每一种的结构特征。表7.示例性抗CGRP受体抗体用于本文所描述的方法中的抗CGRP受体抗体可为单克隆抗体、多克隆抗体、重组抗体、人类抗体、人源化抗体、嵌合抗体、多特异性抗体或其抗原结合片段。在某些实施方案中,抗CGRP受体抗体为单克隆抗体。在此类实施方案中,抗CGRP受体抗体可为人类单克隆抗体。在一些实施方案中,抗CGRP受体抗体为人类抗体并且可属于IgG1、IgG2、IgG3或IgG4类型。因此,在一些实施方案中,抗CGRP受体抗体可具有人类IgG1或人类IgG2恒定域。在一个实施方案中,抗CGRP受体抗体为单克隆IgG1抗体。在另一实施方案中,抗CGRP受体抗体为单克隆IgG2抗体。在完成免疫时程后,可使用本领域中已知的任何技术,例如通过使从转基因动物收集的脾细胞永生化来产生单克隆抗体。可使用本领域中已知的任何技术,例如通过使脾细胞与骨髓瘤细胞融合以产生杂交瘤来使脾细胞永生化。产生杂交瘤的融合程序中所用的骨髓瘤细胞优选不产生抗体,具有高融合效率并且具有使其不能在仅支持所要融合细胞(杂交瘤)生长的特定选择性培养基中生长的酶缺陷。小鼠融合中所用的适合细胞系的实例包括Sp-20、P3-X63/Ag8、P3-X63-Ag8.653、NS1/1.Ag41、Sp210-Ag14、FO、NSO/U、MPC-11、MPC11-X45-GTG1.7以及S194/5XXOBul;大鼠融合中所用的细胞系的实例包括R210.RCY3、Y3-Ag1.2.3、IR983F以及4B210。其他适用于细胞融合的细胞系为U-266、GM1500-GRG2、LICR-LON-HMy2以及UC729-6。在一些情况下,如下产生杂交瘤细胞系:用CGRP受体免疫原对动物(例如具有人类免疫球蛋白序列的转基因动物)进行免疫;从已免疫的动物收集脾细胞;使所收集的脾细胞与骨髓瘤细胞系融合,由此产生杂交瘤细胞;从杂交瘤细胞建立杂交瘤细胞系,并且鉴别产生与CGRP受体结合的抗体的杂交瘤细胞系。可使用本领域中已知的任何技术来纯化由杂交瘤细胞系分泌的单克隆抗体。可例如使用cAMP分析,例如如本文中所描述,对杂交瘤或mAb进一步筛选以鉴别具有特定特性,诸如能够结合表达CGRP受体的细胞、能够阻断或干扰CGRP配体或CGRP8-37肽的结合或能够在功能上阻断所述受体的mAb。在一些实施方案中,用于本发明的方法中的抗CGRP受体抗体为基于前述序列的嵌合抗体或人源化抗体。嵌合抗体为由来自不同抗体的蛋白质区段共价接合以产生功能性免疫球蛋白轻链或重链或其免疫功能部分而构成的抗体。重链和/或轻链的一部分一般与来源于特定物种或属于特定抗体类别或子类的抗体中的相应序列同一或同源,而链的其余部分与来源于另一物种或属于另一抗体类别或子类的抗体中的相应序列同一或同源。对于与嵌合抗体有关的方法,参见例如美国专利号4,816,567;以及Morrison等人,1985,Proc.Natl.Acad.Sci.USA81:6851-6855,这些参考文献以引用的方式并入本文中。例如美国专利号6,180,370、5,693,762、5,693,761、5,585,089以及5,530,101中描述了CDR移植。一般来说,制造嵌合抗体的目的为产生嵌合体,在所述嵌合体中来自预定物种的氨基酸数目为最大化的。一个实例为“CDR移植”抗体,其中抗体包含来自特定物种或属于特定抗体类别或子类的一个或多个CDR,而抗体链的其余部分与来源于另一物种或属于另一抗体类别或子类的抗体中的相应序列同一或同源。用于人类时,通常将来自啮齿动物抗体的可变区或所选CDR移植于人类抗体中,代替人类抗体的天然存在的可变区或CDR。一种有用类型的嵌合抗体为“人源化”抗体。人源化抗体一般是由最初在非人类动物中产生的单克隆抗体制造。此单克隆抗体中的某些氨基酸残基(通常来自抗体的非抗原识别部分)通常被修饰成与相应同型的人类抗体中的相应残基同源。可例如使用各种方法,通过用至少一部分啮齿动物可变区代替人类抗体的相应区域来进行人源化(参见例如,美国专利号5,585,089和5,693,762;Jones等人,1986,Nature321:522-525;Riechmann等人,1988,Nature332:323-27;Verhoeyen等人,1988,Science239:1534-1536)。在一个方面中,将本文所提供的抗体的轻链和重链可变区的CDR(参见表2和3)移植于来自相同或不同系统发育物种的抗体的构架区(FR)。举例来说,可将重链和轻链可变区VH1、VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12以及VH13和/或VL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16以及VL17的CDR移植于共同人类FR。为产生共同人类FR,可比对来自若干人类重链或轻链氨基酸序列的FR以鉴别共同氨基酸序列。在其他实施方案中,将本文公开的重链或轻链的FR用来自不同重链或轻链的FR置换。在一个方面中,未对抗CGRP受体抗体的重链和轻链的FR中的稀有氨基酸进行置换,而是对其余FR氨基酸进行了置换。“稀有氨基酸”为位于某一位置中的特定氨基酸,在FR的所述位置中通常未发现此特定氨基酸。或者,从一个重链或轻链移植的可变区可与不同于如本文公开的所述特定重链或轻链的恒定区的恒定区一起使用。在其他实施方案中,移植的可变区为单链Fv抗体的一部分。在特定实施方案中,用于本发明的方法中的抗CGRP受体抗体或其抗原结合片段为完全人类抗体。可获得在不使人类接触抗原的情况下制备对于指定抗原具有特异性的完全人类抗体(“完全人类抗体”)的方法。被提供用于实施完全人类抗体制造的一种特定方法为小鼠体液免疫系统的“人源化”。将人类免疫球蛋白(Ig)基因座引入内源性Ig基因已失活的小鼠体内为一种在小鼠(一种可用任何所需抗原进行免疫的动物)体内产生完全人类单克隆抗体(mAb)的手段。使用完全人类抗体可使有时会因向人类施用小鼠或小鼠来源的mAb作为治疗剂所引起的免疫原性和过敏性反应减至最少。可通过对能够在不产生内源性免疫球蛋白情况下产生人类抗体谱系的转基因动物(通常为小鼠)进行免疫来制造完全人类抗体。出于此目的,抗原通常具有六个或更多个相连氨基酸,并且任选结合至载体(诸如半抗原)。参见例如,Jakobovits等人,1993,Proc.Natl.Acad.Sci.USA90:2551-2555;Jakobovits等人,1993,Nature362:255-258;以及Bruggermann等人,1993,YearinImmunol.7:33。在此类方法的一个实例中,如下产生转基因动物:使其中编码小鼠免疫球蛋白重链和轻链的内源性小鼠免疫球蛋白基因座失能,以及向小鼠基因组中插入含有编码人类重链和轻链蛋白质的基因座的人类基因组DNA大片段。然后对具有少于一整套人类免疫球蛋白基因座的部分修饰过的动物进行杂交育种以获得具有所有所需免疫系统修饰的动物。当施用免疫原时,这些转基因动物产生对免疫原具有免疫特异性但具有人类而非鼠类氨基酸序列(包括可变区)的抗体。有关此类方法的其他细节,参见例如WO96/33735和WO94/02602。以下专利中描述了有关用于制造人类抗体的转基因小鼠的另外的方法:美国专利号5,545,807、6,713,610、6,673,986、6,162,963、5,545,807、6,300,129、6,255,458、5,877,397、5,874,299以及5,545,806;PCT公开案WO91/10741、WO90/04036;以及EP546073B1和EP546073A1。上述转基因小鼠(本文中称为“HuMab”小鼠)含有编码未重排的人类重链([μ]和[γ])和[κ]轻链免疫球蛋白序列的人类免疫球蛋白基因微型基因座,以及所靶向的使内源性[μ]和[κ]链基因座失活的突变(Lonberg等人,1994,Nature368:856-859)。因此,小鼠展现降低的小鼠IgM或[κ]表达以及对免疫作用的反应,并且所引入的人类重链和轻链转基因经历类别转换和体细胞突变以产生高亲和力人类IgG[κ]单克隆抗体(Lonberg等人,同前文献;Lonberg和Huszar,1995,Intern.Rev.Immunol.13:65-93;Harding和Lonberg,1995,Ann.N.YAcad.Sci.764:536-546)。以下文献中详细描述了HuMab小鼠的制备:Taylor等人,1992,NucleicAcidsResearch20:6287-6295;Chen等人,1993,InternationalImmunology5:647-656;Tuaillon等人,1994,J.Immunol.152:2912-2920;Lonberg等人,1994,Nature368:856-859;Lonberg,1994,HandbookofExp.Pharmacology113:49-101;Taylor等人,1994,InternationalImmunology6:579-591;Lonberg和Huszar,1995,Intern.Rev.Immunol.13:65-93;Harding和Lonberg,1995,Ann.N.YAcad.Sci.764:536-546;Fishwild等人,1996,NatureBiotechnology14:845-851;前述参考文献出于所有目的以全文引用的方式并入本文中。另外参见美国专利号5,545,806、5,569,825、5,625,126、5,633,425、5,789,650、5,877,397、5,661,016、5,814,318、5,874,299以及5,770,429,以及美国专利号5,545,807;国际公布号WO93/1227、WO92/22646以及WO92/03918,所有这些专利的公开内容出于所有目的以全文引用的方式并入本文中。WO98/24893和Mendez等人,1997,NatureGenetics15:146-156中也公开了用于在这些转基因小鼠中制造人类抗体的技术,这些方法以引用的方式并入本文中。举例来说,可使用HCo7和HCo12转基因小鼠品系来产生抗CGRP受体抗体。可用于本文所描述的方法中的抗CGRP受体抗体或结合片段中有一些为以上所公开的抗CGRP受体抗体(例如具有表2-7中所列序列的那些抗体)的变体形式。举例来说,抗CGRP受体抗体或结合片段可在表2-7中所列重链或轻链、可变区或CDR中的一个或多个中具有一个或多个保守氨基酸取代。保守氨基酸取代可涉及氨基酸与具有共同侧链特性(例如疏水性、中性亲水性、酸性、碱性以及芳香性)的另一氨基酸的交换。举例来说,保守取代包括疏水性氨基酸(例如正亮氨酸、甲硫氨酸、丙氨酸、缬氨酸、亮氨酸或异亮氨酸)用另一疏水性氨基酸取代。保守性氨基酸取代可涵盖非天然存在的氨基酸残基,所述非天然存在的氨基酸残基通常是通过化学肽合成而非通过生物系统中的合成而掺入的。这些物质包括肽模拟物和氨基酸部分的其他颠倒或反转形式。在进行此类改变时,根据某些实施方案,可考虑氨基酸的亲水指数。通过为每一氨基酸指定数值(“亲水指数”)并且然后沿肽链重复计算这些值的平均值来计算蛋白质的亲水型态。已基于疏水性和电荷特征为每一氨基酸指定亲水指数。它们是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);以及精氨酸(-4.5)。在本领域中,已了解亲水型态在赋予对蛋白质的相互作用生物功能方面的重要性(参见例如,Kyte等人,1982,J.Mol.Biol.157:105-131)。已知某些氨基酸可取代具有类似亲水指数或评分的其他氨基酸并且仍然保留类似生物活性。在基于亲水指数进行改变时,在某些实施方案中,纳入亲水指数在±2以内的氨基酸的取代。在一些方面中,纳入在±1内的那些氨基酸,而在其他方面中,纳入在±0.5内的那些氨基酸。在本领域中还应了解,可基于亲水性有效地进行类似氨基酸的取代,尤其如在本发明的情况中当由此产生的生物功能性蛋白质或肽是要用于免疫学实施方案中时。在某些实施方案中,蛋白质的最大局部平均亲水性(取决于其相邻氨基酸的亲水性)与其免疫原性和抗原结合或免疫原性(即,蛋白质的生物特性)有关。已为这些氨基酸残基指定以下亲水性值:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5)以及色氨酸(-3.4)。在基于类似亲水性值作出变化时,在某些实施方案中,纳入亲水性值在±2内的氨基酸的取代,在其他实施方案中,纳入在±1内的那些氨基酸,而在其他实施方案中,纳入在±0.5内的那些氨基酸。在一些情况下,还可基于亲水性由一级氨基酸序列鉴别表位。这些区域也称为“表位核心区”。表8中阐述了示例性保守氨基酸取代。表8:保守氨基酸取代原始残基示例性取代AlaSerArgLysAsnGln、HisAspGluCysSerGlnAsnGluAspGlyProHisAsn、GlnIleLeu、ValLeuIle、ValLysArg、Gln、GluMetLeu、IlePheMet、Leu、TyrSerThrThrSerTrpTyrTyrTrp、PheValIle、Leu本领域技术人员将能够使用熟知技术确定如本文所阐述的抗CGRP受体抗体的适合变体。本领域技术人员可通过靶向据信对于活性不重要的区域来鉴别分子中可被改变而不会破坏活性的适合区域。本领域技术人员还将能够鉴别分子中在类似多肽中具有保守性的残基和部分。在其他实施方案中,甚至对生物活性或对结构可谓重要的区域也可经受保守氨基酸取代,而不会破坏生物活性或不会不利地影响多肽结构。另外,本领域技术人员可回顾鉴别类似多肽中对于活性或结构重要的残基的结构-功能研究。鉴于此类比较,可预测蛋白质中对应于类似蛋白质中对活性或结构重要的氨基酸残基的氨基酸残基的重要性。本领域技术人员可选择化学上类似的氨基酸取代此类被预测重要的氨基酸残基。本领域技术人员还可与类似多肽的结构相联系来对三维结构和氨基酸序列进行分析。鉴于此类信息,本领域技术人员可就抗体的三维结构来预测其氨基酸残基的排列。本领域技术人员可选择对被预测位于蛋白质表面上的氨基酸残基不作出根本变化,因为此类残基可能参与其他分子的重要相互作用。此外,本领域技术人员可产生在每一所需氨基酸残基处含有单一氨基酸取代的测试变体。然后,可使用针对CGRP受体中和活性的分析来筛选这些变体,由此得到关于哪些氨基酸可改变而哪些不得改变的信息。换句话说,基于从此类常规实验收集的信息,本领域技术人员可容易地确定应避免单独地或与其他突变组合进行进一步取代的氨基酸位置。其他优选的抗体变体包括半胱氨酸变体,其中亲本或天然氨基酸序列中的一个或多个半胱氨酸残基缺失或用另一氨基酸(例如丝氨酸)取代。半胱氨酸变体为适用的,尤其当抗体必须再折叠成生物学活性构象时。与天然抗体相比,半胱氨酸变体可具有较少半胱氨酸残基,并且通常为偶数个以使由不配对半胱氨酸产生的相互作用减到最小。可使用子类交换方法使属于一个子类的抗CGRP受体抗体或其结合片段变成来自不同子类的抗体或结合片段。因此,IgG抗体可来源于例如IgM抗体,并且反之亦然。此类技术允许制备新抗体,所述新抗体具有指定抗体(亲本抗体)的抗原结合特性,并且也展现与不同于亲本抗体的抗体同型或子类相关的生物特性。可采用重组DNA技术。此类程序中可采用编码特定抗体多肽的克隆DNA,例如编码所需同型的抗体的恒定域的DNA。参见例如Lantto等人,2002,MethodsMol.Biol.178:303-316。因此,本文所描述的抗CGRP受体抗体包括包含例如具有所需同型(例如IgA、IgG1、IgG2、IgG3、IgG4、IgE以及IgD)的上文所描述的可变域组合的那些抗体以及其Fab或F(ab')2片段。此外,如果需要IgG4,那么还可能如Bloom等人,1997,ProteinScience6:407(以引入的方式并入本文中)中所述,要在铰链区中引入点突变(CPSCP->CPPCP),以缓解形成H链内二硫键的倾向,所述H链内二硫键可在IgG4抗体中引起非均质性。此外,还已知用于产生具有不同特性(即,对所结合的抗原呈现不同亲和力)的抗体的技术。一种此类技术称为链改组,涉及在丝状噬菌体表面上展示免疫球蛋白可变域基因谱,通常称为噬菌体展示。如由Marks等人,1992,BioTechnology,10:779描述,链改组已用于制备针对半抗原2-苯基噁唑-5-酮的高亲和力抗体。可对表4中所描述的重链和轻链可变区或表2和3中所描述的CDR进行保守修饰(并且对编码核酸进行相应修饰)以制造出具有某些所需功能和生物化学特征的CGRP受体抗体或其结合片段。上文中描述了实现此类修饰的方法。可通过多种常规技术中的任一种来制备用于本发明的方法中的抗CGRP受体抗体或其结合片段。举例来说,可通过重组表达系统,使用本领域中已知的任何技术来制造本文所描述的抗CGRP受体抗体。参见例如,MonoclonalAntibodies,Hybridomas:ANewDimensioninBiologicalAnalyses,Kennet等人(编)PlenumPress,NewYork(1980);以及Antibodies:ALaboratoryManual,Harlow和Lane(编),ColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.(1988)。抗CGRP受体抗体或其结合片段可在杂交瘤细胞系中表达(例如具体地说,抗体可在杂交瘤中表达)或在除杂交瘤外的细胞系中表达。可使用编码抗体的表达构建体来转化哺乳动物、昆虫或微生物宿主细胞。可使用将聚核苷酸引入宿主细胞中的任何已知方法来进行转化,包括例如如由美国专利号4,399,216;4,912,040;4,740,461;4,959,455所例示,将聚核苷酸包装于病毒或噬菌体中并且通过本领域中已知的转染程序,用构建体转导宿主细胞。所用最佳转化程序将取决于所转化的宿主细胞的类型。用于将异源聚核苷酸引入哺乳动物细胞中的方法为本领域中熟知的,并且包括(但不限于)葡聚糖介导的转染、磷酸钙沉淀、凝聚胺(polybrene)介导的转染、天然质体融合、电穿孔、聚核苷酸封装于脂质体中、将核酸与带正电的脂质混合以及将DNA直接显微注射至细胞核中。重组表达构建体通常包含编码多肽的核酸分子,所述多肽包含以下中的一种或多种:一个或多个本文提供的CDR;轻链恒定区;轻链可变区;重链恒定区(例如CH1、CH2和/或CH3);重链可变区;和/或抗CGRP受体抗体的另一支架部分。使用标准连接技术将这些核酸序列插入适当表达载体中。在一个实施方案中,将重链或轻链恒定区附接至抗CGRP受体特异性重链或轻链可变区的C末端并且与表达载体连接。通常选择在所用特定宿主细胞中有功能的载体(即,载体与宿主细胞机构相容,从而允许进行基因的扩增和/或表达)。在一些实施方案中,所用载体使用蛋白质报道物(诸如二氢叶酸还原酶),采用蛋白质片段互补分析(参见例如,美国专利号6,270,964,该专利以引用的方式并入本文中)。可从例如InvitrogenLifeTechnologies或BDBiosciences(过去称为“Clontech”)购买合适的表达载体。用于克隆和表达抗体和片段的其他适用载体包括以引用的方式并入本文中的Bianchi和McGrew,2003,Biotech.Biotechnol.Bioeng.84:439-44中所描述的那些载体。例如MethodsEnzymol.,第185卷(D.V.Goeddel编),1990,NewYork:AcademicPress中论述了其他合适的表达载体。通常,用于任何宿主细胞中的表达载体将含有用于质粒维持和用于克隆和表达外源性核苷酸序列的序列。在某些实施方案中,此类序列(统称为“侧接序列”)通常将包括以下核苷酸序列中的一种或多种:启动子、一个或多个增强子序列、复制起点、转录终止序列、含有供体和受体剪接位点的完整内含子序列、编码用于多肽分泌的前导序列的序列、核糖体结合位点、聚腺苷酸化序列、用于插入编码所要表达的多肽的核酸的聚合接头区域和可选择的标记元件。以下论述这些序列中的每一种。任选地,载体可含有“标签”编码序列,即,位于抗CGRP受体抗体编码序列的5'或3'端的寡核苷酸分子;该寡核苷酸序列编码多聚组氨酸(诸如六聚组氨酸)或另一“标签”,诸如FLAG®、HA(血球凝集素流感病毒)或myc,针对所述标签存在可商购获得的抗体。此标签通常在多肽表达后与多肽融合,并且可充当用于亲和纯化或检测来自宿主细胞的抗CGRP受体抗体的手段。亲和纯化可例如通过柱色谱法,使用针对标签的抗体作为亲和基质实现。任选地,可随后通过各种手段,诸如使用某些用于裂解的肽酶,将标签从纯化过的抗CGRP受体抗体移除。侧接序列可为同源(即,来自与宿主细胞相同的物种和/或品系)、异源(即,来自不同于宿主细胞物种或品系的物种)、杂合的(即,来自超过一种来源的侧接序列的组合)、合成或天然的。因此,侧接序列的来源可为任何原核或真核生物体、任何脊椎动物或无脊椎动物生物体,或任何植物,其限制条件为侧接序列在宿主细胞机构中具有功能并且可由宿主细胞机构活化。可通过本领域中熟知的若干方法中的任一种来获得可用于载体中的侧接序列。通常,将预先通过定位(mapping)和/或通过限制性核酸内切酶消化来鉴别适用于本文中的侧接序列,并且因此可使用适当限制性核酸内切酶从适当组织来源中分离。在一些情况下,侧接序列的完整核苷酸序列可为已知的。在本文中,可使用本文所述的用于核酸合成或克隆的方法来合成侧接序列。无论是全部还是仅一部分的侧接序列为已知的,它均可使用聚合酶链反应(PCR)和/或通过用适合探针(诸如来自相同或另一物种的寡核苷酸和/或侧接序列片段)筛选基因组文库来获得。当侧接序列未知时,可从可含有例如编码序列或甚至其他基因的较大DNA片段分离含有侧接序列的DNA片段。可通过限制性核酸内切酶消化以产生适当DNA片段,随后使用琼脂糖凝胶纯化、Qiagen®柱色谱法(Chatsworth,CA)或本领域技术人员已知的其他方法进行分离来实现分离。选择适合的酶来实现此目的对于一般技术者将为显而易知的。复制起点通常为可商购的那些原核表达载体的一部分,并且所述起点有助于载体在宿主细胞中扩增。如果所选载体不含复制起点位点,那么可基于已知序列以化学方法来合成复制起点,并且连接于载体中。举例来说,来自质体pBR322(NewEnglandBiolabs,Beverly,MA)的复制起点适合于大部分革兰氏阴性细菌(gram-negativebacteria),而各种病毒起点(例如SV40、多瘤病毒、腺病毒、水泡性口炎病毒(VSV)或乳头状瘤病毒(诸如HPV或BPV))适用于在哺乳动物细胞中克隆载体。哺乳动物表达载体一般不需要复制起点组件(例如通常仅使用SV40起点,因为它也含有病毒早期启动子)。转录终止序列通常位于多肽编码区的3'端并且用以终止转录。通常,原核细胞中的转录终止序列为富含G-C的片段,其后为聚T序列。尽管易于从文库克隆或甚至商购所述序列作为载体的一部分,但也可使用已知用于核酸合成的方法容易地合成所述序列。可选择标记基因编码在选择性培养基中生长的宿主细胞存活和生长所必需的蛋白质。典型选择标记基因编码如下蛋白质,所述蛋白质:(a)赋予对于抗生素或其他毒素(例如对于原核宿主细胞来说为安比西林(ampicillin)、四环素(tetracycline)或卡那霉素(kanamycin))的抗性;(b)补充细胞的营养缺陷;或(c)供应无法从复合培养基或限定培养基获得的关键营养物。特定可选择标记为卡那霉素抗性基因、安比西林抗性基因以及四环素抗性基因。有利的是,新霉素(neomycin)抗性基因也可用于在原核与真核宿主细胞中的选择。可使用其他可选择基因来扩增将被表达的基因。扩增为使产生对于生长或细胞存活来说至关重要的蛋白质所需的基因在连续数代重组细胞的染色体中串联重复的过程。适合于哺乳动物细胞的可选择标记的实例包括二氢叶酸还原酶(DHFR)和无启动子胸苷激酶基因。将哺乳动物细胞转化体置于选择压力下,其中由于载体中存在可选择基因而使得仅转化体唯一适应而存活。通过在培养基中选择剂浓度连续增加的条件下培养转化细胞来施加选择压力,由此使得可选择基因与编码另一基因(诸如抗CGRP受体抗体)的DNA扩增。因此,由扩增的DNA合成增加数目的多肽,诸如抗CGRP受体抗体。核糖体结合位点通常为mRNA的翻译起始所必需的,并且特征为夏因-达尔加诺序列(Shine-Dalgarnosequence)(原核生物)或克扎克序列(Kozaksequence)(真核生物)。所述元件通常位于启动子的3'端和所要表达的多肽的编码序列的5'端。在一些情况下,诸如在真核宿主细胞表达系统中需要糖基化的情况下,可操纵各种前序列或原序列来改善糖基化或产量。举例来说,可改变特定信号肽的肽酶裂解位点,或添加原序列,此举也可能会影响糖基化。最终蛋白质产物可能在-1位置(相对于成熟蛋白质的第一氨基酸)具有一个或多个意外表达的额外氨基酸,所述额外氨基酸可能未完全移除。举例来说,最终蛋白质产物可能有存在于在肽酶裂解位点中的一个或两个氨基酸残基连接于氨基末端。或者,如果酶在成熟多肽中的所述区域进行切割,那么使用一些酶裂解位点可能产生所需多肽的稍微截短的形式。表达和克隆通常将含有由宿主生物体识别并且可操作地连接至编码抗CGRP受体抗体或结合片段的分子的启动子。启动子为位于结构基因的起始密码子上游(即,5'端)(一般在约100至1000bp内)的非转录序列,所述非转录序列控制结构基因的转录。通常将启动子归为两种类别之一:诱导型启动子和组成型启动子。诱导型启动子响应于培养条件的一些变化(诸如存在或不存在营养物或温度变化)而引发在其控制下的DNA的转录量增加。另一方面,组成型启动子均一地转录其可操作地连接的基因,即,对基因表达的控制极小或无控制。已熟知由多种潜在宿主细胞识别的大量启动子。通过用限制酶消化从源DNA移除启动子,并且将所需启动子序列插入载体中,来将适合的启动子可操作地连接至编码构成抗CGRP受体抗体或结合片段的重链或轻链的DNA。适用于酵母宿主的启动子也是本领域中熟知的。酵母增强子宜与酵母启动子一起使用。适合用于哺乳动物宿主细胞的启动子为熟知的,并且包括(但不限于)从诸如多瘤病毒、禽痘病毒、腺病毒(诸如腺病毒2)、牛乳头状瘤病毒、鸟肉瘤病毒、巨细胞病毒、反转录病毒、B型肝炎病毒以及猴病毒40(SV40)等病毒的基因组获得的启动子。其他适合的哺乳动物启动子包括异源哺乳动物启动子,例如热休克启动子和肌动蛋白启动子。其他所关注的启动子包括(但不限于):SV40早期启动子(Benoist和Chambon,1981,Nature290:304-310);CMV启动子(Thornsen等人,1984,Proc.Natl.Acad.U.S.A.81:659-663);包含在劳斯氏肉瘤病毒(Roussarcomavirus)的3'长末端重复序列中的启动子(Yamamoto等人,1980,Cell22:787-797);疱疹胸苷激酶启动子(Wagner等人,1981,Proc.Natl.Acad.Sci.U.S.A.78:1444-1445);来自金属硫蛋白基因的启动子和调控序列(Prinster等人,1982,Nature296:39-42);以及诸如β内酰胺酶启动子等原核启动子(Villa-Kamaroff等人,1978,Proc.Natl.Acad.Sci.U.S.A.75:3727-3731);或tac启动子(DeBoer等人,1983,Proc.Natl.Acad.Sci.U.S.A.80:21-25)。所关注的也为展现组织特异性并且已用于转基因动物中的以下动物转录控制区:在胰腺腺泡细胞中有活性的弹性蛋白酶I基因控制区(Swift等人,1984,Cell38:639-646;Ornitz等人,1986,ColdSpringHarborSymp.Quant.Biol.50:399-409;MacDonald,1987,Hepatology7:425-515);在胰腺β细胞中有活性的胰岛素基因控制区(Hanahan,1985,Nature315:115-122);在淋巴细胞中有活性的免疫球蛋白基因控制区(Grosschedl等人,1984,Cell38:647-658;Adames等人,1985,Nature318:533-538;Alexander等人,1987,Mol.Cell.Biol.7:1436-1444);在睾丸、乳房、淋巴以及肥大细胞中有活性的小鼠乳腺肿瘤病毒控制区(Leder等人,1986,Cell45:485-495);在肝脏中有活性的白蛋白基因控制区(Pinkert等人,1987,GenesandDevel.1:268-276);在肝脏中有活性的α-胎蛋白基因控制区(Krumlauf等人,1985,Mol.Cell.Biol.5:1639-1648;Hammer等人,1987,Science253:53-58);在肝脏中有活性的α1抗胰蛋白酶基因控制区(Kelsey等人,1987,GenesandDevel.1:161-171);在骨髓细胞中有活性的β球蛋白基因控制区(Mogram等人,1985,Nature315:338-340;Kollias等人,1986,Cell46:89-94);在大脑中的少突细胞中有活性的髓鞘碱性蛋白基因控制区(Readhead等人,1987,Cell48:703-712);在骨胳肌肉中有活性的肌球蛋白轻链-2基因控制区(Sani,1985,Nature314:283-286);以及在丘脑下部中有活性的促性腺素释放激素基因控制区(Mason等人,1986,Science234:1372-1378)。可将增强子序列插入载体中以增加高等真核生物中编码构成抗CGRP受体抗体或其结合片段的轻链或重链的DNA的转录。增强子为DNA的顺式作用元件,通常长度为约10-300bp,它作用于启动子以增加转录。增强子相对不依赖于取向和位置,已被发现位于转录单元的5'与3'端的位置。可从哺乳动物基因获得的若干个增强子序列为已知的(例如球蛋白、弹性蛋白酶、白蛋白、α-胎蛋白以及胰岛素)。然而,通常使用来自病毒的增强子。本领域中已知的SV40增强子、巨细胞病毒早期启动子增强子、多瘤病毒增强子以及腺病毒增强子为用于活化真核启动子的示例性增强元件。虽然增强子可位于载体中编码序列的5'或3'端,但是它通常位于启动子5'端的位点。可将编码适当天然或异源信号序列(前导序列或信号肽)的序列掺入至表达载体中以促进抗体的细胞外分泌。信号肽或前导序列的选择取决于要产生抗体的宿主细胞的类型,并且异源信号序列可置换天然信号序列。在哺乳动物宿主细胞中具有功能的信号肽的实例包括以下信号肽:美国专利号4,965,195中所述的介白素-7(IL-7)的信号序列;Cosman等人,1984,Nature312:768中所述的介白素-2受体的信号序列;EP专利号0367566中所述的介白素-4受体信号肽;美国专利号4,968,607中所述的I型介白素-1受体信号肽;EP专利号0460846中所述的II型介白素-1受体信号肽。用于表达本文所描述的抗CGRP受体抗体或结合片段的其他有用的信号肽为具有SEQIDNO:135或SEQIDNO:136中所阐述的序列的信号肽。可由诸如可商购获得的载体等起始载体构建用于重组制造本文所描述的抗CGRP受体抗体或其结合片段的表达载体。此类载体可能含有或可能不含所有所需侧接序列。当载体中不存在本文所述的一个或多个侧接序列时,可个别地获得所述一个或多个侧接序列并且连接至载体中。用于获得每一侧接序列的方法为本领域技术人员所熟知的。在已构建载体并且已将编码构成抗CGRP受体抗体或结合片段的轻链、重链或轻链和重链的核酸分子插入载体的适当位点中之后,可将完成的载体插入适合的宿主细胞中进行扩增和/或多肽表达。可通过包括以下各项的熟知方法完成将用于抗原结合蛋白的表达载体转化至所选宿主细胞中:转染、感染、磷酸钙共沉淀、电穿孔、显微注射、脂质转染法、DEAE-葡聚糖介导的转染或其他已知技术。所选方法将部分与所要使用的宿主细胞类型有关。这些方法和其他适合的方法为本领域技术人员所熟知的,并且在例如Sambrook等人,2001,同前文献中有阐述。当在适当条件下培养时,宿主细胞合成抗原结合蛋白(例如抗体或结合片段),所述抗原结合蛋白可以是随后从培养基收集(如果宿主细胞将它分泌至培养基中)或直接从产生它的宿主细胞收集(如果它未被分泌)。适当宿主细胞的选择将取决于各种因素,诸如所需表达水平、活性所需或必需的多肽修饰(诸如糖基化或磷酸化)以及折叠成生物活性分子的容易性。可用作表达宿主的哺乳动物细胞系为本领域中熟知的并且包括(但不限于)购自美国典型培养物保藏中心(AmericanTypeCultureCollection,ATCC)的永生化细胞系,包括(但不限于)中国仓鼠卵巢(CHO)细胞、海拉细胞(HeLacell)、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人类肝细胞癌细胞(例如HepG2)以及许多其他细胞系。在某些实施方案中,可通过测定哪些细胞系具有高表达水平并且组成型地产生具有CGRP受体结合特性的抗体或结合片段来选择细胞系。在另一实施方案中,可选择来自自身不产生抗体但具有制造和分泌异源抗体的能力的B细胞谱系的细胞系。一般以药物组合物形式向患者施用抗CGRP受体抗体或其结合片段,所述药物组合物可包括药学上可接受的载体、赋形剂或稀释剂。“药学上可接受”是指分子、化合物以及组合物在所用剂量和浓度下对人类接受者无毒和/或当向人类施用时不会产生过敏性或不良反应。在某些实施方案中,药物组合物可含有用于修饰、维持或保存例如组合物的pH、容积渗透浓度、粘度、澄清度、颜色、等张性、气味、无菌性、稳定性、溶出或释放速率、吸附或穿透的配制材料。在此类实施方案中,适合的配制材料包括(但不限于)氨基酸(诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗微生物剂;抗氧化剂(诸如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(诸如硼酸盐、碳酸氢盐、Tris-HCl、柠檬酸盐、磷酸盐或其他有机酸);膨胀剂(诸如甘露醇或甘氨酸);螯合剂(诸如乙二胺四乙酸(EDTA));络合剂(诸如咖啡碱、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);填充剂;单糖;双糖;以及其他碳水化合物(诸如葡萄糖、甘露糖或糊精);蛋白质(诸如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂以及稀释剂;乳化剂;亲水性聚合物(诸如聚乙烯吡咯烷酮);低分子量多肽;成盐反离子(诸如钠);防腐剂(诸如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定(chlorhexidine)、山梨酸或过氧化氢);溶剂(诸如甘油、丙二醇或聚乙二醇);糖醇(诸如甘露醇或山梨醇);助悬剂;表面活性剂或润湿剂(诸如普洛尼克(pluronic)、PEG、脱水山梨糖醇酯、聚山梨醇酯(诸如聚山梨醇酯20、聚山梨醇酯80)、曲拉通(triton)、缓血酸胺、卵磷脂、胆固醇、泰洛沙泊(tyloxapal));稳定性增强剂(诸如蔗糖或山梨醇);张力增强剂(诸如碱金属卤化物(优选为氯化钠或氯化钾)、甘露醇山梨醇);递送媒介物;稀释剂;赋形剂和/或医药佐剂。用于配制供治疗应用的分子的方法和适合的材料为制药技术中已知的并且在例如REMINGTON'SPHARMACEUTICALSCIENCES,第18版(A.R.Genrmo编),1990,MackPublishingCompany中有描述。在一些实施方案中,对用于掺入至药物组合物中的载体和赋形剂的选择影响抗CGRP受体抗体或其结合片段的物理状态、稳定性、体内释放速率以及体内清除速率。在某些实施方案中,药物组合物中的主要媒介物或载体可为水性或非水性的。举例来说,适合的媒介物或载体可为可能补充有供肠胃外施用的组合物中常见的其他材料的注射用水、生理盐水溶液或人工脑脊液。在本文所描述的方法的某些实施方案中,肠胃外向患者施用抗CGRP受体抗体或其结合片段。肠胃外施用包括腹膜内、肌肉内、静脉内、动脉内、皮内、皮下、脑内、脑室内以及鞘内施用。在一个特定实施方案中,皮下向患者施用包含治疗有效量的抗CGRP受体抗体或其结合片段的药物组合物。在通过肠胃外注射施用药物组合物的这些和其他实施方案中,可用注射器向患者施用药物组合物。在一些实施方案中,注射器预填充有药物组合物。在通过肠胃外注射(诸如皮下注射)向患者施用药物组合物的其他实施方案中,用注射装置(包括用于自施用的装置)施用药物组合物。此类装置为可商购获得的并且包括(但不限于)自动注射器、给药笔、微量输注泵以及预填注射器。根据本发明的方法施用包含治疗有效量的抗CGRP受体抗体或其结合片段的药物组合物的示例性装置包括自动注射器(例如SureClick®、EverGentle®、Avanti®、DosePro®、Molly®以及Leva®)、笔式注射装置(例如Madie®笔式注射器、DCPTM笔式注射器、BDVystraTM一次性笔式注射器、BDTM可重复使用笔式注射器)以及预填注射器(BDSterifillTM、BDHypakTM、来自Baxter的预填注射器)。在一些实施方案中,用预填注射器向患者施用包含治疗有效量的抗CGRP受体抗体或结合片段的药物组合物。在其他实施方案中,用自动注射器向患者施用包含治疗有效量的抗CGRP受体抗体或结合片段的药物组合物。在某些相关实施方案中,注射体积为约1mL或更低。在一个实施方案中,以每月约70mg的剂量向患者施用抗CGRP受体抗体或其结合片段以预防或减少患者偏头痛的发生,其中通过单次皮下注射递送所述剂量。在相关实施方案中,用预填注射器递送单次皮下注射。在其他相关实施方案中,用自动注射器递送单次皮下注射。在某些实施方案中,患者可患有或被诊断为患有发作性偏头痛。在其他实施方案中,患者可患有或被诊断为患有慢性偏头痛。在另一实施方案中,以每月约140mg的剂量向患者施用抗CGRP受体抗体或其结合片段以预防或减少患者偏头痛的发生,其中通过单次皮下注射递送所述剂量。在此类实施方案中,可用预填注射器或自动注射器递送单次注射。在一个实施方案中,通过两次连续注射向患者施用每月140mg剂量的抗CGRP受体抗体或其结合片段,每次注射包含70mg剂量。在此类实施方案中,可使用两个预填注射器或两个自动注射器来递送两次连续注射,每次注射含有70mg剂量。在一些实施方案中,患者可患有或被诊断为患有发作性偏头痛。在其他实施方案中,患者可患有或被诊断为患有慢性偏头痛。适合于肠胃外注射的说明性药物形式包括无菌水溶液或分散液以及用于临时制备无菌可注射溶液或分散液的无菌粉末。优选地,药物形式为无菌的并且具有足够流动性以允许经由注射器递送(即,制剂的粘性不会过高而阻止通过注射器)。可通过经无菌过滤膜过滤来实现灭菌。当组合物为冻干形式时,可在冻干和复原之前或之后使用此方法进行灭菌。可以冻干形式或溶液形式储存用于肠胃外施用的组合物。可将肠胃外组合物置放于具有无菌存取孔的容器中,例如具有可通过皮下注射针刺穿的塞子的静脉内溶液袋或小瓶中。还可将肠胃外组合物储存于适合与此类注射装置一起使用的注射器、自动注射器装置或笔式注射装置或卡匣中。在某些实施方案中,要根据本发明的方法施用的药物组合物的制备可涉及将抗CGRP受体抗体或其结合片段与,诸如可注射微球体、生物可侵蚀粒子、聚合物化合物(诸如聚乳酸或聚乙醇酸)、珠粒或脂质体等物质一起调配,所述物质可使可经由积存注射递送的抗体或结合片段控制或持续释放。在某些实施方案中,还可使用玻尿酸,玻尿酸具有促进循环的持久性持续的作用。在某些实施方案中,可使用可植入药物递送装置来递送抗CGRP受体抗体或结合片段。在一些实施方案中,要根据本发明的方法向患者施用的包含治疗有效量的抗CGRP受体抗体或其结合片段的药物组合物另外包含缓冲剂。缓冲剂用于将组合物维持在生理pH或略微较低的pH,通常在约4.5至约6.5的pH值范围内。适合的缓冲剂包括(但不限于)谷氨酸、乙酸盐、Tris、柠檬酸盐、组氨酸、琥珀酸盐以及磷酸盐缓冲剂。在某些实施方案中,根据本文所描述的方法施用的药物组合物包含乙酸盐缓冲剂。乙酸盐缓冲剂可由例如乙酸钠的乙酸盐制成。可使用其他盐,例如钾、铵、钙或镁的乙酸盐。包含乙酸盐缓冲剂的药物组合物的pH值通常为约4.5至约5.5,或约4.8至约5.2,包括约4.5、约4.6、约4.7、约4.8、约4.9、约5.0、约5.1、约5.2、约5.3、约5.4以及约5.5。包含治疗有效量的抗CGRP受体抗体或其结合片段的药物组合物可进一步包含表面活性剂。如本文所使用,术语“表面活性剂”是指如下物质,所述物质用于减少使其溶解的液体的表面张力。表面活性剂可包括在药物组合物中用于多种目的,包括例如在液体制剂中防止或控制聚集、粒子形成和/或表面吸附,或者在冻干和/或冻干制剂复原过程期间防止或控制这些现象。表面活性剂包括例如在有机溶剂和水溶液中展现部分溶解性的两亲性有机化合物。表面活性剂的一般特征包括它们减小水的表面张力、减小油与水之间的界面张力以及形成胶束的能力。可掺入至用于本发明的方法中的药物组合物中的表面活性剂包括非离子和离子表面活性剂。适合的非离子表面活性剂包括(但不限于)烷基聚(氧化乙烯)、烷基聚葡萄糖苷(诸如辛基葡糖苷和癸基麦芽糖苷)、脂肪醇(诸如鲸蜡醇和油醇)椰油酰胺MEA、椰油酰胺DEA以及椰油酰胺TEA。非离子表面活性剂的具体实例包括聚山梨醇酯,包括例如聚山梨醇酯20、聚山梨醇酯28、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81、聚山梨醇酯85等;泊洛沙姆(poloxamer),包括例如泊洛沙姆188(又称为聚羟亚烃(poloxalkol)或聚(氧化乙烯)-聚(氧化丙烯))、泊洛沙姆407或聚乙烯-聚丙二醇等;以及聚乙二醇(PEG)。适合的离子表面活性剂包括例如阴离子、阳离子以及两性离子表面活性剂。阴离子表面活性剂包括(但不限于)基于磺酸盐或基于羧酸盐的表面活性剂,诸如肥皂、脂肪酸盐、十二烷基硫酸钠(SDS)、月桂基硫酸铵以及其他烷基硫酸盐。阳离子表面活性剂包括(但不限于)基于季铵的表面活性剂,诸如溴化鲸蜡基三甲基铵(CTAB)、其他烷基三甲基铵盐、氯化鲸蜡基吡锭、聚乙氧基化牛脂胺(POEA)以及苯扎氯铵。两性离子或两性表面活性剂包括例如十二烷基甜菜碱、十二烷基二甲胺氧化物、椰油酰氨基丙基甜菜碱以及椰油基两性甘氨酸盐。在某些实施方案中,根据本文所描述的方法施用的药物组合物包含非离子表面活性剂。在一个实施方案中,非离子表面活性剂为聚山梨醇酯20。在另一实施方案中,非离子表面活性剂为聚山梨醇酯80。在某些实施方案中,包含治疗有效量的抗CGRP受体抗体或其结合片段的药物组合物另外包含稳定剂。如本文所使用,术语“稳定剂”是指使多肽或抗体的天然构象稳定和/或防止或减少多肽或抗体的物理或化学降解的赋形剂。适合的稳定剂包括(但不限于)多元醇(例如山梨醇、甘油、甘露醇、木糖醇、麦芽糖醇、乳糖醇、赤藻糖醇以及苏糖醇)、糖(例如果糖、葡萄糖、甘油醛、乳糖、阿拉伯糖、甘露糖、木糖、核糖、鼠李糖、半乳糖麦芽糖、蔗糖、海藻糖、山梨糖、蔗糖素、松三糖以及棉子糖)以及氨基酸(例如甘氨酸、甲硫氨酸、脯氨酸、赖氨酸、精氨酸、组氨酸或谷氨酸)。在一些实施方案中,药物组合物包含糖作为稳定剂。在这些和其他实施方案中,糖为蔗糖。在某些实施方案中,可用于根据本文所描述的方法预防性治疗偏头痛的药物组合物包含约35mg/ml至约210mg/ml抗CGRP受体抗体或其结合片段、约8mM至约20mM乙酸钠、约0.002%至约0.015%(重量/体积;w/v)聚山梨醇酯以及约7%至约10%w/v蔗糖。在其他实施方案中,药物组合物包含约70mg/ml至约140mg/ml抗CGRP受体抗体或其结合片段、约10mM至约15mM乙酸钠、约0.008%至约0.012%w/v聚山梨醇酯以及约8%至约9%w/v蔗糖。这些组合物的pH值在约4.8至约5.5范围内(例如pH值为约4.8、约5.0、约5.2或约5.4)。在一个实施方案中,要根据本发明的方法施用的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.004%w/v聚山梨醇酯20以及约9%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.004%w/v聚山梨醇酯80以及约9%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.004%w/v聚山梨醇酯20以及约9%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体其结合片段、约10mM乙酸钠、约0.004%w/v聚山梨醇酯80以及约9%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约9%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约9%w/v蔗糖,pH值为5.2±0.2。在一个特定实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约9%w/v蔗糖,pH值为5.2±0.2。在另一特定实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约10mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约9%w/v蔗糖,pH值为5.2±0.2。在某些实施方案中,要根据本发明的方法施用的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.2%w/v蔗糖,pH值为5.2±0.2。在一个特定实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一特定实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在一些实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.5%w/v蔗糖,pH值为5.2±0.2。在其他实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.5%w/v蔗糖,pH值为5.2±0.2。在一些实施方案中,要根据本发明的方法施用的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.2%w/v蔗糖,pH值为5.2±0.2。在一个实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约20mM乙酸钠、约0.010%w/v聚山梨醇酯20以及约8.5%w/v蔗糖,pH值为5.2±0.2。可将本文所描述的抗CGRP受体抗体或结合片段中的任一种,包括表7中所描述的特定抗CGRP受体抗体,掺入至上文所描述的药物组合物中的任一种中,并且根据本文所描述的方法向患者施用。在某些实施方案中,抗CGRP受体抗体为表7中所描述的4E4抗体或其结合片段。在其他特定实施方案中,抗CGRP受体抗体为表7中所描述的9F5抗体或其结合片段。可将上文所描述的药物组合物中的任一种掺入至自施用注射装置中。因此,本发明还包括适合于预防性治疗有需要的患者的偏头痛的注射装置。在某些实施方案中,本发明提供一种包含药物组合物的预填注射器,药物组合物包含抗CGRP受体抗体或其结合片段、乙酸盐缓冲剂、蔗糖以及聚山梨醇酯。在一个实施方案中,预填注射器包含的药物组合物包含约70mg/ml抗CGRP受体抗体其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,预填注射器包含的药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,预填注射器包含的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,预填注射器包含的药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在某些实施方案中,预填注射器的注射体积为约1ml或更低(例如0.5ml)。在一些实施方案中,本发明提供一种包含药物组合物的自动注射器,药物组合物包含抗CGRP受体抗体或其结合片段、乙酸盐缓冲剂、蔗糖以及聚山梨醇酯。在一个实施方案中,自动注射器包含的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,自动注射器包含的药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.2%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,自动注射器包含的药物组合物包含约70mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在另一实施方案中,自动注射器包含的药物组合物包含约140mg/ml抗CGRP受体抗体或其结合片段、约15mM乙酸钠、约0.010%w/v聚山梨醇酯80以及约8.5%w/v蔗糖,pH值为5.2±0.2。在某些实施方案中,自动注射器的注射体积为约1ml或更低(例如0.5ml)。本发明还包括向患者施用抗CGRP受体抗体或其结合片段与适合于急性或预防性治疗偏头痛或本文所描述的其他头痛病症的一种或多种药剂的组合。如本文所使用,术语“组合疗法”涵盖以连续方式(即,在不同时间按任何次序施用每一化合物)施用两种化合物(例如抗CGRP受体抗体或结合片段和另外的药剂)以及以实质上同时的方式施用两种化合物。实质上同时施用包括并行施用并且可通过施用包含两种化合物的单一制剂(例如,包含固定比率的两种化合物的单一胶囊或其他制剂,或具有固定比率的每一化合物的预填注射器)或并行施用含有所述化合物中的每一种的独立制剂来实现。在一些实施方案中,本发明的方法包括施用抗CGRP受体抗体或其结合片段和调节CGRP受体信号传导的第二药剂。举例来说,可将抗CGRP受体抗体或结合片段与第二CGRP受体拮抗剂组合施用以预防性治疗有需要的患者的偏头痛。其他CGRP受体拮抗剂包括CGRP受体的小分子抑制剂,诸如美国专利公布号20060142273以及美国专利号7,842,808、7,772,244、7,754,732、7,569,578、8,685,965、8,569,291、8,377,955、8,372,859、8,143,266、7,947,677以及7,625,901中所描述的那些抑制剂,这些专利全部以全文引用的方式并入本文中。CGRP受体拮抗剂还可包括受体的肽拮抗剂,诸如美国专利号8,168,592中所描述的那些拮抗剂,该专利以全文引用的方式并入本文中。在一些实施方案中,可将抗CGRP受体抗体或结合片段与干扰CGRP配体与CGRP受体的结合的药剂组合施用以预防性治疗有需要的患者的偏头痛。干扰CGRP配体与CGRP受体的结合的药剂可为诱饵或可溶性CGRP受体,或者结合至CGRP配体的其他蛋白质,诸如抗CGRP抗体。抗CGRP抗体为本领域中已知的并且在例如WO2007/054809;WO2007/076336;WO2011/156324;以及WO2012/162243中有描述,这些专利全部以全文引用的方式并入本文中。在某些实施方案中,本发明的方法包括施用抗CGRP受体抗体或其结合片段和第二抗偏头痛药剂。第二抗偏头痛药剂可为用于急性治疗偏头痛的药剂,例如曲普坦(例如阿莫曲普坦、夫罗曲普坦、利扎曲普坦、舒马曲普坦、那拉曲普坦、依来曲普坦以及佐米曲普坦)、麦角胺(例如双氢麦角胺和含咖啡碱的麦角胺)、非类固醇消炎药(例如乙酰水杨酸、布洛芬、萘普生、吲哚美辛以及双氯芬酸)以及阿片类药物(例如可待因、吗啡碱、氢可酮、芬太尼、哌替啶以及羟考酮)。在一些实施方案中,第二抗偏头痛药剂为用于预防性治疗偏头痛的药剂,诸如抗癫痫药(例如托吡酯)、β-阻断剂(例如普萘洛尔)或抗抑郁剂(例如阿米替林)。在其他实施方案中,第二抗偏头痛药剂为调节垂体I型腺苷酸环化酶活化多肽受体(PAC1受体)的活性的药剂。调节PAC1受体的活性的药剂包括结合至PAC1受体的抗体或其他结合蛋白,诸如以全文引用的方式并入本文中的WO2014/144632中所描述的那些抗体。本发明还包括用于预防性治疗有需要的患者的偏头痛的试剂盒。在一个实施方案中,试剂盒包含具有本文所描述的抗CGRP受体抗体或结合片段的药物组合物以及提供关于药物组合物的使用的说明的包装材料。试剂盒中的药物组合物可存在于容器中,诸如小瓶或注射器中。可以溶液、悬浮液、凝胶、乳液、固体、晶体或以脱水或冻干粉末形式提供药物组合物。在以粉末形式提供药物组合物的实施方案中,试剂盒还可包含使药物组合物复原所需的稀释剂(例如水、生理盐水、磷酸盐缓冲的生理盐水)以及有关制备供施用的组合物的说明书。在一些实施方案中,试剂盒包含用于预填充如本文中所描述的药物组合物的用于自施用的注射装置(例如预填注射器或自动注射器)。试剂盒中可包括上文所描述的预填注射器和自动注射器中的任一种。以下实施例(包括所进行的实验和所得到的结果)仅是出于说明性目的而提供,而不应理解为限制随附权利要求的范围。实施例实施例1.建立单克隆抗体AMG334的药代动力学/药效学模型以表征在健康受试者和偏头痛患者中浓度与辣椒碱诱导的皮肤血流量增加的关系AMG334(在本文中也被称为抗体4E4)为以高体外效力结合至人类CGRP受体的完全人类IgG2单克隆抗体。已广泛使用辣椒碱(CAP)诱导的皮肤血流量(DBF)增加的抑制作为表征CGRP受体拮抗剂的药理学作用的转化模型。此经过验证的模型用于在健康受试者(HS)和偏头痛患者(MP)中施用单次和多次剂量的AMG334之后,表征AMG334的药理学作用并且定量AMG334对CAP诱导的DBF增加的抑制作用。分析数据集包括每4周接受单次皮下(SC)剂量的AMG334(1、7、21、70、140或210mg)或安慰剂的52位受试者(40HS、12MP),以及接受3次连续SC剂量的AMG334(21、70或140mg)或安慰剂的40位受试者(24HS、16MP)。参见下表9。在多次研究访视时,使用激光多普勒成像(laserDopplerimaging)在相同受试者内进行重复CAP攻击和DBF测量以估计在CAP施用之前和之后AMG334对DBF的抑制作用。在DBF测量的相应时间点测定血清AMG334浓度,并且在其他时间点收集另外的样品用于药代动力学表征。实施群体药代动力学-药效学(PK-PD)建模方法以评价AMG334浓度-DBF关系。在模型中评估体重(44.6-104kg)、性别(男性与女性)、年龄(18-53岁)以及疾病群(MP与HS)对PK和PD参数的影响。通过受体介导的药物处置模型最佳地表征AMG334PK,所述模型解释了AMG334清除和分布的浓度/剂量相关性。在给药之后约10天时出现完全SC吸收。对于接受70mgSC剂量的典型受试者(70kg),所估计的消除半衰期为21天,这是单克隆抗体所特有的。当AMG334的浓度为约<700ng/mL时,可能由于大部分AMG334由靶受体结合,而留下较少的循环、非结合AMG334可供消除,故其半衰期缩短(即,<21天)并且抗体快速消除。AMG334明显抑制CAP后DBF,但对CAP前DBF无显著影响。PK-PD模型估计出390AU的平均基线CAP诱导的DBF增加和90%的最大DBF抑制。最大抑制作用的50%(EC50)和99%(EC99)所需的AMG334浓度分别为218ng/mL和1140ng/mL。参见图1。因此,所有>7mg的剂量均产生超过EC99或最大DBF抑制的浓度;最大抑制作用的持续时间随剂量增加而增加并且在重复给药之后持续。参见图2。AMG334暴露量随体重增加而降低,但DBF不然。在针对体重进行调整之后,在HS与MP之间未观察到PK和PD的差异。AMG334引起对CAP诱导的DBF的强效且可再现的抑制,表明在HS和MP中存在完全外周CGRP受体阻断。体重为影响PK的唯一共变量,但不影响PD。AMG334的长半衰期和稳定的浓度-DBF关系指示CGRP受体的长期抑制。表9.群体PK/PD模型中所纳入的受试者的特征实施例2.在健康受试者和偏头痛患者中进行的有关AMG334的1期、随机分组、双盲、安慰剂对照、单次剂量以及多次剂量研究偏头痛是被认为涉及降钙素基因相关肽(CGRP)的使人失能的头痛。AMG334(4E4抗体)为针对CGRP受体的完全人类单克隆抗体。在这些1期、随机分组、安慰剂对照、单次剂量(SD)以及多次剂量(MD)研究中,评价了AMG334在健康受试者和偏头痛患者(migraineur)中的药代动力学(PK)、药效学(PD)以及安全性。在SD研究中,受试者接受1至210mgSC、140mgIV的单次递增剂量的AMG334(n=42),或匹配安慰剂(n=18)。在MD研究中,受试者在第1天、第29天以及第57天接受21至280mgSC的多剂AMG334(n=35)或安慰剂(n=12)。在两项研究中评价PK和安全性;PK测量包括最大浓度(C最大)、从时间零至最后一个可定量浓度的浓度-时间曲线下面积(AUC最后)以及达到最大浓度的时间(t最大)。在两项研究中使用AMG334对辣椒碱诱导的皮肤血流量(DBF)的抑制来测量CGRP受体拮抗作用;E最大表示最大抑制百分比。在SD研究中,应用S形E最大PK/PD模型来分析AMG334血清暴露量与对辣椒碱诱导的DBF增加的抑制之间的关系。在MD研究中,在每次给药后约7天,进行连续24小时的动态血压监测(ABPM)。在SD研究中,42位受试者接受AMG334(36位健康受试者、6位偏头痛受试者);18位接受安慰剂(12位健康受试者、6位偏头痛受试者)。在给药后30至160天,观察可检测的AMG334血清水平,其中70mg和更高剂量在给药后100天或更长时间里产生可检测的水平。参见图3A。在单次SC施用之后,AMG334展现非线性PK;AMG334暴露量从1至70mg以超过剂量比例增加并且从70至210mg大致以剂量比例增加。参见下表10。在剂量从70至210mg增加3倍之后,平均AUC最后从每天171至652μg/mL增加3.8倍并且平均C最大从6.25至15.2μg/mL增加2.4倍(表10)。在整个剂量范围内,中值t最大范围为4至11天(表10)。对于140-mgAMG334剂量,SC施用的相对暴露量浓度时间曲线下面积(AUC)为IV施用的约54%。健康受试者与偏头痛患者的PK之间无明显差异。表10.在单次施用AMG334之后群体的药代动力学参数估计值数据表示为平均值(SD或范围)。AUC无限,从时间零至无限时间的浓度-时间曲线下面积;AUC最后,从时间零至最后一个可定量浓度的时间的浓度-时间曲线下面积;C最大,最大浓度;IV,静脉内;NR,未报告;SC,皮下;SD,标准差;t最大,达到C最大的时间。第4天为在SD研究中评估对辣椒碱诱导的DBF的抑制的第一时间点。第4天,对于≥21mg的SC剂量,在健康受试者中,与安慰剂相比较,对辣椒碱诱导的DBF增加的抑制百分比范围在整个剂量范围内为75%至95%(在偏头痛受试者中为91%)。参见图4A。应用S形E最大PK/PD模型分析AMG334血清暴露量与对辣椒碱诱导的DBF增加的抑制之间的关系得到94.2%的E最大(并且标准误差为2.85%)和286ng/mL(并且标准误差为37.2ng/mL)的与半数最大作用(EC50)有关的血清AMG334浓度。在MD研究中,36位受试者(24位健康受试者、12位偏头痛受试者)接受总共3种剂量的AMG334(21至280mg);12位受试者(8位健康受试者、4位偏头痛受试者)接受安慰剂。在SC施用3种单次剂量之后,AMG334累积量范围在整个剂量范围内在健康受试者中为1.42至1.69倍并且在整个剂量范围内在偏头痛患者中为1.50至1.78倍。参见图3B。对于所有剂量范围,T最大值范围在第一次SC剂量之后为约3至13天并且在第三次剂量之后为约6至14天(图3B)。与SD研究的结果类似,健康受试者与偏头痛患者的PK参数之间无明显差异。第8天为在MD研究中评估对辣椒碱诱导的DBF的抑制的第一时间点。在第8天,在健康受试者和偏头痛患者中,在所有AMG334群体中观察到相对于安慰剂的显著抑制作用,并且患者群之间的药物作用无显著差异。参见图4B。在任一患者群中,在AMG334组中不存在明显剂量依赖性。在第57天和第85天(健康受试者)或在第57天、第86天以及第169天(偏头痛患者)的结果与第8天的发现相符。随后的时间点(113天或更长时间)显示相对于安慰剂,在AMG334组中无显著抑制作用。在MD研究中的DBF抑制作用与SDDBF结果相符并且在重复给药时间间隔期间维持最大抑制作用。24小时的ABPM揭示BP昼夜节律无变化并且BP不随AMG334剂量的增加而增加。在健康受试者中,未观察到所有AMG334组与安慰剂在最小均方24小时和夜间BP方面存在统计学上显著的差异。在偏头痛患者中,所有AMG334组与安慰剂在最小均方24小时舒张和夜间舒张BP方面也不存在统计学上显著的差异。在治疗组之间和在健康受试者与偏头痛患者之间,治疗出现的不良事件在类型和频率方面类似。AMG334剂量与治疗出现的不良事件的总体发生率之间不存在明显关系。未观察到生命体征或实验室值在临床上有意义的差异。AMG334PK曲线与其他人类IgG2抗体的曲线相符。在单次施用之后,PK暴露量从1至70mg以超过剂量比例增加并且从70至210mg大致以剂量比例增加,并且健康受试者与偏头痛患者之间无明显差异。在SC施用三种单次剂量之后,在两个群体中,在整个剂量范围内观察到类似PK倾向。在健康受试者和偏头痛患者中,相对于安慰剂,施用AMG334引起对辣椒碱诱导的DBF增加的显著抑制,指示CGRP受体拮抗作用。在健康受试者与偏头痛患者之间对辣椒碱诱导的DBF增加的抑制作用类似。单次和多次剂量的AMG334为良好耐受的并且在血清AMG334浓度与血压之间不存在关联性。实施例3.用于评价AMG334预防发作性偏头痛的功效和安全性的随机分组、双盲、安慰剂对照、2期研究的结果在此2期、双盲、安慰剂对照试验中,评价AMG334(即,4E4抗体)预防发作性偏头痛的作用。将发作性偏头痛(每月≥4天并且≤14天的偏头痛天数)的患者以3:2:2:2比率分别随机分到皮下、每月(QM)安慰剂组或AMG334(7mg、21mg或70mg)组。主要终点为在第12周时每月偏头痛天数相对于基线的变化。次要终点包括每月偏头痛天数减少≥50%的受试者的比例(即,50%反应者比率)、每月偏头痛发作减少以及安全性/耐受性。关键探索性终点包括每月头痛天数和每月急性偏头痛特异性药物(例如曲普坦、麦角胺)使用天数减少。将483位受试者随机分到安慰剂组(n=160)、AMG3347mg组(n=108)、21mg组(n=108)或70mg组(n=107)。受试者主要为女性(80.5%);平均(SD)年龄为41.1(10.8)岁。相对于安慰剂(-2.28),在70mgAMG334(-3.40)情况下观察到每月平均偏头痛天数在统计学上显著减少。参见图5。事后分析显示早在第2周时就存在显著治疗作用。在AMG334的较低剂量(7mg:-2.18和21mg:-2.39)下每月偏头痛天数减少相较于安慰剂组(-2.28)在统计学上不显著。参见图5。在第12周时,对于70mg,50%反应者比率为46.5%,而安慰剂为29.9%(P=0.011)。还观察到每月头痛天数(70mg:-3.54,而安慰剂:-2.39;P=0.022)和每月急性偏头痛特异性药物使用天数(70mg:-1.64,而安慰剂:-0.69;P=0.004;图6)在统计学上显著减少。每月偏头痛发作的变化在统计学上不显著。小组分析证实,AMG334的功效类似,不管性别(数据未图示)、基线偏头痛频率(图7A)或先前预防性药物使用史(图7B)如何。对于各种终点,在表11中示出了有关70mg剂量AMG334和安慰剂的数据的概述。未报告主要安全性发现。AMG334与安慰剂的安全性/耐受性型态为类似的。在AMG334治疗组与安慰剂的不良事件发生率中未观察到明显差异。未观察到不良事件发生率的AMG334剂量依赖性。在双盲治疗期期间,六位(1.9%)接受AMG334的受试者与2位(1.3%)接受安慰剂的个体由于不良事件而中断研究性产品。表11.AMG334在发作性偏头痛中的功效a在研究的12周双盲(DB)治疗期之后,患者适合在开放标记延伸(OLE)期期间接受每月一次(QM)AMG33470mg,持续长达256周。在OLE期期间,患者继续完成日常日记直至第64周。对于此中期分析,患者接受AMG33470mgQM直至第76周。每月评价安全性和耐受性。分析两个组的功效终点直至第64周:第1组:在DB期中接受安慰剂、AMG3347mg或AMG33421mg(即,DB无效剂量)之后转变成AMG33470mgQM的患者;第2组:在OLE期期间继续接受AMG33470mgQM(即,DB有效剂量)的患者。功效终点为:每月偏头痛天数相对于基线的变化、50%反应者比率、75%反应者比率、100%反应者比率、每月偏头痛发作、每月偏头痛特异性药物(例如曲普坦、麦角胺)使用天数以及每月头痛天数。395位患者中有总共383位(97%)合格进入OLE的患者接受开放标记AMG33470mgQM。在OLE期中暴露于AMG33470mg的中值持续时间为239天(34.1周),并且患者一年的总暴露量为263.7天。图8展示DB期和OLE期前十个月每月偏头痛天数相对于基线的变化。结果显示,每月施用70mgAMG334使先前接受安慰剂、7mgAMG334或21mgAMG334的患者的每月偏头痛天数减少。具体地说,相较于DB期的第12周(主要终点),在OLE期(第16周至第64周)期间观察到平均每月偏头痛天数相对于基线进一步减少,不管接受的DB治疗如何(第1组:在第12周时的-2.4天相对于在第16周时的-4.0天;第2组:在第12周时的-3.5天相对于在第16周时的-3.9天)。治疗作用在OLE期(第16周至第64周)期间持续,并且每月偏头痛天数相对于基线的变化范围对于第1组为-4.0至-6.2天,而对于第2组为-3.7至-4.9天。对于50%反应者比率、75%反应者比率以及100%反应者比率、每月偏头痛发作、每月头痛天数以及偏头痛特异性药物使用,观察到类似结果。在第52周时,62%的患者经历50%或更高百分比的偏头痛天数减少,38%经历75%或更高百分比的偏头痛天数减少,并且19%经历100%的偏头痛天数减少。相较于DB期的第12周,在OLE期期间观察到每月头痛天数(图9A)和偏头痛特异性药物使用天数(图9B)相较于研究基线进一步减少。在383位患者中有243位(63%)报告不良事件(AE)。最常见AE(≥3%)为鼻咽炎、上呼吸道感染、关节痛、流感、背痛以及鼻窦炎。大部分AE为1或2级CTCAE。13位患者(3%)报告严重AE,其中有1位(<1%)被认为与治疗相关(根据研究者)。十一位患者(2%)由于AE而中断OLE期。关于生命体征或实验室测试(包括肝功能测试)不存在临床上重要的发现。2期研究结果显示,当以70mg的每月剂量施用AMG334时在预防发作性偏头痛方面有效,并且AMG334具有与安慰剂类似的安全性/耐受性型态。继续在OLE期接受AMG33470mgQM的患者显示偏头痛天数的临床上有意义的且持续的减少。安全性和耐受性与DB期中所观察到的结果相符并且未观察到新的安全性信号。实施例4.用于评价AMG334预防慢性偏头痛的功效和安全性的随机分组、双盲、安慰剂对照、2期研究在此2期研究中,评价AMG334(即,4E4抗体)相较于安慰剂在预防慢性偏头痛方面的作用。将慢性偏头痛(每月≥15天的头痛天数和每月≥8天的偏头痛天数)的患者以3:2:2随机分到接受安慰剂、每月(QM)70mgAMG334皮下(SC)或140mgAMG334SCQM,持续12周的双盲治疗期。主要终点为在第12周时每月偏头痛天数相对于基线的变化。次要终点包括每月偏头痛天数减少≥50%的受试者的比例(即,50%反应者比率)、每月偏头痛发作减少以及安全性/耐受性。关键探索性终点包括每月头痛天数减少、每月累积头痛小时数相对于基线的变化、每月平均偏头痛严重程度相对于基线的降低以及每月急性偏头痛特异性药物(例如曲普坦、麦角胺)使用天数。在签署知情同意书之后,受试者进入筛选期(最多3周),在此期间评估受试者的合格性。合格受试者包括年龄在18岁与65岁之间并且具有存在或不存在先兆的至少5次偏头痛发作史,并且在筛选之前三个月中的每个月,每月有至少15天的头痛史,其中至少8天头痛为偏头痛天数的成人。存在曲普坦、麦角碱衍生物、镇痛剂以及组合药物使用的共用药物过度使用(MO)的受试者符合试验的条件。将由筛选期得到的所有合格受试者招收至4周基线期中。在基线期期间满足纳入标准的受试者被允许继续进行治疗期。基线期的纳入标准包括:●≥15天的头痛天数,其中≥8天的头痛天数满足基线期期间偏头痛天数的标准;●≥4次明显头痛发作,每次持续≥4小时或如果较短,那么与在基线期期间同一日历日使用曲普坦或麦角碱衍生物有关;以及●与电子日记展现至少80%一致性(例如,在基线期期间的28天中有至少23天必须完成电子日记项目)。在第1天访视时,将来自基线期的合格受试者随机分到12周双盲治疗期中,并且开始接受双盲研究性产品QMSC。将合格且被招收的受试者以3:2:2比率随机分到安慰剂组、AMG33470mg组或AMG334140mg组,其中安慰剂组中有约210位受试者,AMG33470mg组中有约140位受试者,并且AMG334140mg组中有约140位受试者。通过在基线时的区域(北美相对于其他)和药物过度使用(MO相对于非MO)进行分层来随机分组。在12周双盲治疗期期间(即,在第1天以及第4周和第8周)施用双盲AMG33470mg、AMG334140mg或安慰剂。在双盲治疗期期间,对于每一研究性产品施用(即,第1天、第4周以及第8周)给与2次SC注射。在研究完成后12周或早期终止时(即,在最后一剂研究性产品之后16周)进行安全性随访访视。最终分析的目的是评价在患有慢性偏头痛的受试者中AMG33470mg和AMG334140mg的功效和安全性。在试验结束时进行研究的最终分析。由双盲治疗组分析并报告来自整个研究时间段的功效和安全性数据。预期结果显示,在患有慢性偏头痛的受试者中,相较于安慰剂,每月偏头痛天数以AMG334剂量依赖性方式相对于基线减少,并且AMG334的不良事件型态与安慰剂类似。在研究的12周双盲治疗期之后,开始开放标记期。完成12周双盲治疗期的所有受试者适合招收入开放标记期中,在开放标记期期间,受试者接受每月70mg剂量的AMG334SC,持续13个月,随后为12周的安全性随访访视。受试者在第1天与第3个月访视之间、在第5个月与第6个月访视之间、在第9个月与第10个月访视之间以及在第12个月与第13个月访视之间每日使用电子日记报告有关其偏头痛和非偏头痛性头痛以及急性药物使用的信息。开放标记期的目的为表征长期施用AMG334的安全性、耐受性以及功效。关键终点包括:●患有慢性偏头痛的受试者的每月偏头痛天数相对于基线的变化;●每月偏头痛天数相对于基线减少至少50%的受试者的比例;●患有慢性偏头痛的受试者的每月偏头痛发作相对于基线的减少;●如通过偏头痛身体功能影响日记(MPFID)所测量的身体受损随时间的变化;以及●如通过MPFID所测量的对日常活动的影响随时间的变化。预期开放标记研究结果显示,患有慢性偏头痛的受试者长期暴露于AMG334为安全且良好耐受的,并且每月一次70mgSC剂量有效减少患有慢性偏头痛的受试者的偏头痛天数。实施例5.用于评价AMG334在预防偏头痛方面的功效和安全性的3期、随机分组、双盲、安慰剂对照研究本研究的主要目的为评价AMG334(即,4E4抗体)相较于安慰剂对患有发作性偏头痛的受试者平均每月偏头痛天数相对于基线的变化的影响。研究的次要目的包括平均每月偏头痛天数相对于基线减少至少50%的受试者的比例、平均每月急性偏头痛特异性药物治疗天数相对于基线的变化、如通过偏头痛身体功能影响日记(MPFID)所测量的身体受损相对于基线的变化以及如通过MPFID所测量的对日常活动的影响相对于基线的变化。在本研究中评价两种剂量的AMG334,即70mg和140mg。受试者在双盲治疗期中每月一次(QM)皮下(SC)接受AMG334140mg、AMG33470mg或安慰剂,持续24周,随后为28周的活性剂治疗期,在此期间他们将接受AMG334140mg或AMG70mgQMSC。将约852位患有发作性偏头痛(每月≥4天至<15天的偏头痛天数)的受试者以1:1:1随机分到安慰剂组、AMG33470mg组或AMG334140mg组。通过区域(北美相对于其他)和用偏头痛预防性药物的先前治疗(先前偏头痛预防性药物治疗相对于无先前偏头痛预防性药物治疗)分层来随机分组。在签署知情同意书之后,受试者进入筛选期。筛选期由初始筛选期(最多3周)随后4周的基线期构成。在筛选期和/或基线期期间,评价受试者的合格性。合格受试者包括年龄在18岁至65岁并且在≥12个月里具有存在或不存在先兆的偏头痛史,并且经历每月≥4天至<15天的偏头痛天数,其中在筛选之前3个月里平均每月有<15天的头痛天数的成人。在第1天访视时,将合格受试者招收(即,随机分组)至24周双盲治疗期中并且开始接受双盲研究性产品QMSC。在第24周访视时,将每一治疗组中的受试者以1:1再随机分到AMG33470mg组或AMG334140mg组,持续28周的活性剂治疗期,并且开始接受研究性产品QMSC,保持仅对剂量水平不知情。通过在双盲期期间指定的治疗组分层来再随机分组。在24周双盲治疗期期间(即,在第1天以及第4周、第8周、第12周、第16周以及第20周)施用双盲AMG33470mg、AMG334140mg或安慰剂,并且在28周的活性剂治疗期期间(即,在第24周、第28周、第32周、第36周、第40周、第44周以及第48周)施用活性剂AMG33470mg或AMG334140mg。在整个双盲治疗期和活性剂治疗期中,每次研究性产品施用给与2次SC注射。在最后一剂研究性产品之后16周时进行安全性随访访视。受试者在整个基线期、双盲治疗期以及活性剂治疗期中每日使用电子日记报告有关其偏头痛和非偏头痛性头痛以及急性头痛药物使用的信息。受试者从第-4周至活性剂治疗期结束每月预约临床研究访视。预期3期研究结果显示,在患有发作性偏头痛的受试者中,相较于安慰剂,AMG334使平均每月偏头痛天数相对于基线减少较大。相较于安慰剂,预期AMG334治疗作用对于70mg和140mg为每月偏头痛天数相对于基线平均减少1.12天和1.30天。本文所论述和引用的所有出版物、专利以及专利申请均以全文引用的方式并入本文中。应了解,所公开的发明不局限于所描述的特定方法、方案以及材料,因为这些可以变化。还应了解,本文中所用的术语仅用于描述特定实施方案的目的并且并不旨在限制随附权利要求书的范围。本领域技术人员仅仅使用常规实验就将认识到或能够确定本文所述的本发明特定实施方案的多个等效形式。所述等效形式旨在由以下权利要求书涵盖。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1