一种制备高光学纯度阿普斯特的方法与流程
本发明属于医药合成领域,具体涉及一种制备高光学纯度的阿普斯特、尤其是b晶型阿普斯特的新方法。
背景技术:
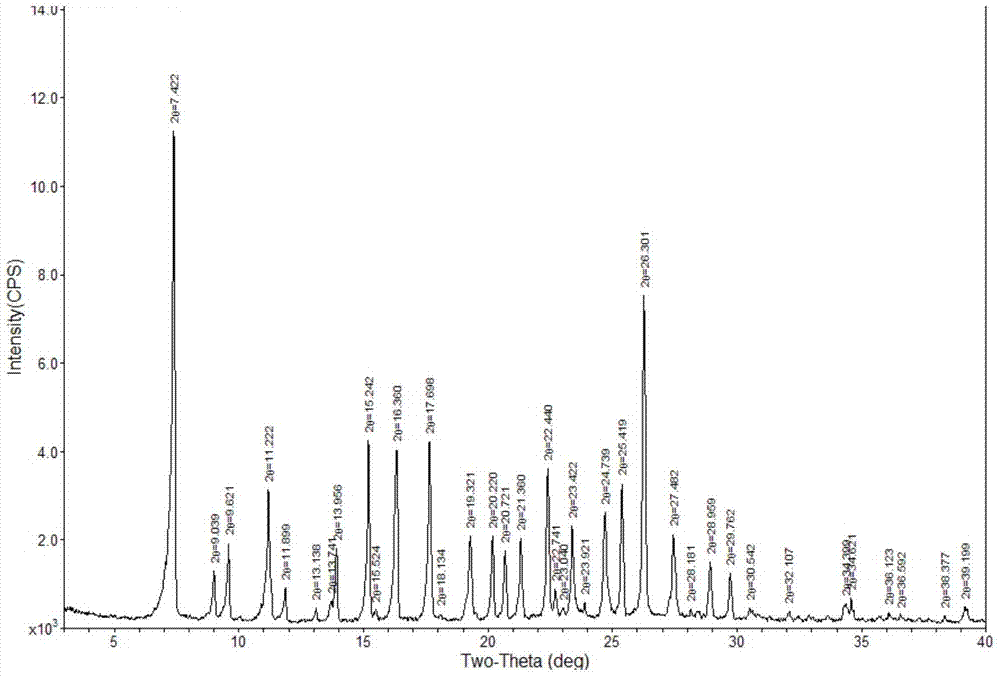
:阿普斯特(apremilast)化学名称为:(s)-n-(2-(1-(3-乙氧基-4-甲氧基苯基)-2-(甲基磺基)乙基)-1-3-二氧代异吲哚啉-4-基)乙酰胺、或者(s)-2-[1-(3-乙氧基-4-甲氧基苯基)-2-甲磺酰基乙基]-4-乙酰氨基异吲哚啉-1,3-二酮,其具有如下结构式i:阿普斯特(apremilast)是一种小分子磷酸二酯酶4(pde4)抑制剂,对环单磷酸腺苷(camp)具有特异性。pde4抑制作用会导致细胞内camp水平增加。2014年3月,celgene公司开发的治疗关节炎药物apremilast获得了fda的批准,商品名为otezla。fda批准其作为治疗银屑病性关节炎的口服药物上市,上市晶型为晶型b。有关阿普斯特制备方法已有研究报道,细胞基因公司的中国专利申请号03811093.8报道了阿普斯特合成方法。该方法先通过n-乙酰基-l-亮氨酸拆分得到手性胺(中间体ii)的n-乙酰基-l-亮氨酸盐,并合成得到酸酐(中间体iii),然后中间体ii与中间体iii在乙酸溶剂中发生胺化反应制得阿普斯特(i)。该专利报道制备获得的阿普斯特中(r)异构体的含量为1.2%。另外,细胞基因公司的专利申请wo2013126495、wo2013126360报道了多种手性合成中间体ii的方法。中国专利申请cn103864670a通过手性合成手性胺中间体ii,再在乙酸溶剂中与中间体iii发生胺化反应,制得阿普斯特(i)。中国专利申请cn105218428a报道了一种制备高手性纯度的阿普斯特的方法,其先制备出中间体ii的n-乙酰基-l-亮氨酸盐,经过对该盐进行纯化,再与中间体iii在甲苯和乙酸的混合溶剂中发生胺化反应,其中乙酸作为催化剂,得到手性纯度高达99.8%的阿普斯特,但未报道产物的晶型。上述的阿普斯特合成方法的缺陷在于,胺化反应制备阿普斯特过程中手性选择性较差;对于作为原料的中间体ii或其盐的光学纯度要求很高,过多的纯化步骤增加了生产成本;且工艺中存在大量废酸溶剂,给后处理带来极大麻烦,同时给环境带来压力。另外,作为医药领域的公知常识,手性药物的光学纯度、或称手性纯度越高,晶型越单一,药物的疗效就越好,副作用越小。因此,有必要进一步提高阿普斯特的光学纯度。技术实现要素:为了克服上述现有技术中阿普斯特合成方法的缺陷,本发明对b晶型阿普斯特的合成工艺进行了深入研究。发明人意外地发现,当中间体ii或其盐与中间体iii进行胺化反应制备阿普斯特时,若以芳烃作为溶剂,阿普斯特中含有的r-构型异构体含量可以降低到0.1%以下。因此,本发明提供了一种制备阿普斯特的新方案。具体为:一种制备式i所示阿普斯特的方法,包括如下步骤:在芳烃溶剂中,使式ii所示(s)-2-(3-乙氧基-4-甲氧基苯基)-1-(甲磺酰基)-乙-2-基胺或其盐与式iii所示3-乙酰氨基邻苯二甲酸酐发生胺化反应,制得阿普斯特。其中,上述芳烃溶剂选自苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、氯苯、2-氯甲苯、3-氯甲苯、4-氯甲苯、2,3-二氯甲苯、2,4-二氯甲苯、或者它们两种以上的混合物;上述的盐可以是有机酸盐或者无机酸盐,其中所述无机酸盐是盐酸盐、磷酸盐、或者硫酸盐,所述有机酸盐是n-乙酰基-l-亮氨酸盐、琥珀酸盐、或者酒石酸盐。为方便起见,在本说明书中将式ii所示(s)-2-(3-乙氧基-4-甲氧基苯基)-1-(甲磺酰基)-乙-2-基胺称为中间体ii、手性胺ii或者手性胺;在本说明书中将式iii所示3-乙酰氨基邻苯二甲酸酐称为中间体iii、酸酐中间体iii或者酸酐。优选地,所述芳烃溶剂是甲苯或者二甲苯,所述二甲苯选自邻二甲苯、间二甲苯、对二甲苯;更优选甲苯或者对二甲苯;最优选甲苯。优选地,所述的盐是n-乙酰基-l-亮氨酸盐。上述的胺化反应的反应温度为80-110℃,优选80-100℃,更优选90-100℃。上述的胺化反应中,中间体ii或其盐与中间体iii的摩尔比为1:1~1.2。发明人还意外地发现,中间体ii或其盐与中间体iii的胺化反应可以不使用酸类比如乙酸作为溶剂或者催化剂,这就免去了反应后除去废酸溶剂后处理工艺,有利于环境保护,从而降低了生产成本。另一方面,中间体ii或其盐与中间体iii在芳烃溶剂中进行的胺化反应还可以在有机碱 存在下进行,所述有机碱选自dipea(n,n-二异丙基乙胺、或称n-乙基二异丙胺)、三乙胺、或者它们的混合物,更优选有机碱是dipea。研究发现,当中间体ii或其盐与中间体iii在甲苯溶剂中进行胺化反应后,得到的直接产物不是作为药物使用的b晶型阿普斯特,而是阿普斯特甲苯溶剂化物。该阿普斯特甲苯溶剂化物是c晶型,即晶型c的阿普斯特。如果使用某些有机溶剂通过共沸将阿普斯特甲苯溶剂化物中的甲苯成分携带除去,则甲苯溶剂化物可发生晶型转变,获得晶型b的阿普斯特。这些有机溶剂主要是醇类,比如甲醇、乙醇、丙醇、2-丙醇、正丁醇、仲丁醇、异丁醇、叔丁醇、正戊醇、1,2-丁二醇、1,4-丁二醇、1,3-丁二醇、异戊二醇或者它们两种以上的混合物;更优选乙醇。本发明提供的合成阿普斯特的方法生产成本低,产物收率高,纯度好,简便易行,适合工业化生产。使用该方法制备的b晶型阿普斯特光学纯度可以到达99.9%以上。附图说明图1为晶型b的阿普斯特的x-射线衍射(xrd)图谱;图2为晶型c的阿普斯特的x-射线衍射(xrd)图谱。具体实施方式以下结合具体实施例及附图,对本发明作进一步说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本文中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。本文的实施例中,如果对于反应温度或操作温度没有做出具体说明,则该温度通常指室温(20-25℃)。在本发明中,术语“中间体ii”、“手性胺ii”、“手性胺”、“手性胺中间体ii”、“手性胺中间体”和“化合物ii”表示相同的意义,都是指式ii所示的(s)-2-(3-乙氧基-4-甲氧基苯基)-1-(甲磺酰基)-乙-2-基胺。类似地,术语“中间体iii”、“酸酐iii”、“酸酐”、“酸酐中间体iii”、“酸酐中间体”、和“化合物iii”表示相同的意义,都是指式iii所示的3-乙酰氨基邻苯二甲酸酐。类似地,术语“阿普斯特(i)”、“阿普斯特i”、“阿普斯特”表示相同的意义,都是指式i所示的(s)-n-(2-(1-(3-乙氧基-4-甲氧基苯基)-2-(甲基磺基)乙基)-1-3-二氧代异吲哚 啉-4-基)乙酰胺。本文中,有时将“晶型b”称为“b晶型”,它们表示相同的意义;类似地,有时将“晶型c”称为“c晶型”,它们表示相同的意义。相对应地,有时将“转变晶型”或者“晶型转变”称为“转晶”。本文中,术语“胺化反应”和“胺化”表示相同的意义,都是指中间体ii分子上的游离氨基与中间体iii分子的邻苯二甲酸酐部分的羟基氧发生取代、形成邻苯二甲酰亚胺的反应。胺化反应将中间体ii分子与中间体iii分子结合起来,形成了阿普斯特分子。众所周知,光学活性化合物中含有至少一个手性碳原子,手性碳原子连接的4个取代基按原子序数依次排列,从大到小基团按顺时针方向排列的称为r型(右旋体),通常在化合物名前加(r)-或r-来表示;反之,手性碳原子连接的4个取代基按原子序数依次排列,从大到小基团按逆时针方向排列的称为s型(左旋体),通常在化合物名前加(s)-或s-来表示。外消旋体(racemate)是指r型(右旋体)与s型(左旋体)的等摩尔混合物,通常在化合物名前加(r,s)-或r,s-表示。显而易见,r型与s型互为异构体。比如,阿普斯特的异构体是(r)-n-(2-(1-(3-乙氧基-4-甲氧基苯基)-2-(甲基磺基)乙基)-1-3-二氧代异吲哚啉-4-基)乙酰胺;中间体ii的异构体是(r)-2-(3-乙氧基-4-甲氧基苯基)-1-(甲磺酰基)-乙-2-基胺。由于100%光学纯度或称手性纯度的化合物很难获得,通常会用作为杂质的异构体的含量来表示该化合物的光学纯度。异构体含量越低,则该化合物的光学纯度越高,其经济价值和生理活性也越高。作为本发明人的一个重要发现,中间体ii或其盐与中间体iii在某些芳烃溶剂中进行胺化反应时,无需酸类比如甲酸、乙酸等作为催化剂。而且,所得到的阿普斯特光学纯度更高,可以到达99.9%以上,即r-异构体含量低于0.1%。由于阿普斯特的制备反应中不使用酸类作为溶剂或者催化剂,在后处理工艺中就不需要进行废酸溶剂的除去,这有利于环境保护,从而降低了生产成本,因此相对于现有技术在经济上和环保上都是有优势的。作为本发明人的另一个重要发现,当中间体ii或其盐与中间体iii在某些芳烃溶剂中进行的胺化反应来制备高光学纯度的阿普斯特时,对于作为反应原料的中间体ii或其盐的光学纯度具有较大的宽容性,即,不需要对中间体ii或其盐做过多的提纯处理来刻意提高其光学纯度。由于简化了原料的过多纯化步骤,从而降低了生产成本,因此在经济上相对于现有技术是有优势的。本发明中,中间体ii或其盐与中间体iii的胺化反应的温度范围为80~110℃。反应温度的下限为80℃,优选为82、84、86、88、或90℃;其上限为110℃,优选为108、106、104、102或100℃。如果反应温度低于80℃,则反应速度过慢,或者反应不完全,影响生产效率;另一方面,如果反应温度超过110℃,则反应速度过快,有可能导致阿普斯特的异构体的产生,影响产物阿普斯特的光学纯度。作为本发明人的另一个重要发现,当中间体ii或其盐与中间体iii在甲苯溶剂中进行胺化反应后,得到的直接产物不是b晶型阿普斯特(i),而是阿普斯特甲苯溶剂化物,该阿普斯特甲苯溶剂化物是c晶型。阿普斯特的晶型可通过x-射线衍射(xrd)图谱来确定。关于晶型分类,可参考专利文献cn102046167a。由于本发明的目标产物是晶型b的阿普斯特,必须对阿普斯特甲苯溶剂化物的晶型进行转变,即由晶型c转变为晶型b。然而,阿普斯特甲苯溶剂化物比较稳定,不容易转晶。为此,发明人进行了大量的探索,包括使用多种有机溶剂对阿普斯特甲苯溶剂化物进行重结晶,然而,实验发现大多数有机溶剂重结晶方法并未改变晶型c,仅某些醇类比如乙醇重结晶方法实现了晶型改变,由晶型c转晶为晶型b,如下述表1所示。表1.甲苯溶剂化物使用不同溶剂的结晶结果结晶前晶型重结晶溶剂xrd分析结果晶型c乙醇/丙酮晶型c晶型c乙酸乙酯晶型c晶型c二氯甲烷晶型c晶型c乙酸丁酯晶型c晶型c乙醇晶型b通过进一步的研究,发明人开发出了有机溶剂共沸的转晶方法。通过共沸,有机溶剂可以将甲苯溶剂化物中的甲苯携带除去,并且实现由晶型c转变为晶型b的晶型转变。上述转晶的机制有待于进一步研究。这些有机溶剂主要是醇类,比如甲醇、乙醇、丙醇、2-丙醇、正丁醇、仲丁醇、异丁醇、叔丁醇、正戊醇、1,2-丁二醇、1,4-丁二醇、1,3-丁二醇、异戊二醇或者它们两种以上的混合物;更优选乙醇,因为其廉价易得,容易回收利用,在经济上是有利的。与现有技术的阿普斯特制备工艺相比,本发明的合成工艺有效地降低了生产成本低,产物光学纯度高,具有显著的经济效益和环保效益。实施例一、试剂试剂:本发明实施例中使用的中间体ii、中间体ii的n-乙酰基-l-亮氨酸盐和中间体iii根据专利文献cn03811093.8、wo2013126495、或wo2013126360制备;有机溶剂等均为分析纯,均购自中国医药(集团)上海化学试剂公司,直接使用。二、检测方法1hnmr核磁共振仪型号:brukeravanceiii400mhz旋光仪型号:rudolphautopolv多晶x射线衍射仪型号:brukerd8advance异构体含量的测定:采用高效液相色谱(hplc)法,手性色谱柱为chiralpakas-rh柱4.6×150mm,5μm,柱温为35℃,检测波长为230nm,流动相为乙腈:水=30:70,流速为1ml/min)。晶型确定:通过xrd进行分析确定。实施例1将148.7g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、71.38g酸酐中间体iii、1487ml甲苯加入反应瓶中;升温至90±5℃,保温反应5小时,减压浓缩除去甲苯;加入到3000ml乙醇中,升温;蒸出乙醇,直至蒸干;加入1000ml乙醇、500ml丙酮,升温回流,溶解至澄清,加入1.5g活性炭脱色,缓慢降温到15℃;在10±5℃保温6小时;过滤,用200ml乙醇洗涤滤饼。在50±5℃真空烘干4小时,得到阿普斯特(i)139.1克,收率91.5%。经检测,阿普斯特纯度为99.94%,异构体含量为0.05%,晶型为晶型b(参见图1)。1h-nmr(cdcl3):δ9.72(s,1h),8.45(d,1h),7.93-7.66(m,1h),7.57(d,1h),7.09(d,1h),6.98(dt,2h),5.80(dd,1h),4.37(dd,1h),4.16(dd,1h),4.03(q,2h),3.74(s,3h),3.04(s,3h),2.20(s,3h),1.33(t,3h).实施例2将5.0g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、2.4g酸酐中 间体iii、50ml乙酸加入反应瓶中;回流过夜,减压浓缩除去乙酸;加入50ml乙醇、25ml丙酮;升温回流,溶解至澄清,降温到10±5℃保温;过滤。在50±5℃真空烘干,得到阿普斯特(i)4.33克,收率85.5%,纯度为99.68%,异构体含量为0.35%。实施例3将5.0g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、2.4g酸酐中间体iii、50ml乙腈加入反应瓶中;回流过夜,减压浓缩除去乙腈;加入50ml乙醇、25ml丙酮;升温回流,溶解至澄清,降温到10±5℃保温;过滤。在50±5℃真空烘干,得到阿普斯特(i)4.06克,收率80.2%,纯度为99.98%,异构体含量为0.43%。实施例4将5.0g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、2.4g酸酐中间体iii、50ml乙酸乙酯加入反应瓶中;回流过夜,减压浓缩除去乙酸乙酯;加入50ml乙醇、25ml丙酮;升温回流,溶解至澄清,降温到10±5℃保温;过滤。在50±5℃真空烘干,得到阿普斯特(i)3.65克,收率72.1%,纯度为99.74%,异构体含量为0.41%。实施例5将5.0g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、2.4g酸酐中间体iii、50ml对二甲苯加入反应瓶中;升温至90±5℃,保温反应5小时,减压浓缩除去对二甲苯;加入50ml乙醇、25ml丙酮;升温回流,溶解至澄清,降温到10±5℃保温;过滤。在50±5℃真空烘干,得到阿普斯特(i)4.23克,收率83.5%,纯度为99.96%,异构体含量为0.08%。实施例6将5.0g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、0.05g手性胺ii消旋体、2.4g酸酐中间体iii、50ml甲苯加入反应瓶中;升温至90±5℃,保温反应5小时,减压浓缩除去甲苯;加入50ml乙醇、25ml丙酮;升温回流,溶解至澄清,降温到10±5℃保温;过滤。在50±5℃真空烘干,得到阿普斯特(i)4.64克,收率89.2%。产物中的异构体含量为0.12%。实施例6的产物中的异构体含量略高于实施例5,可能是由于手性胺ii的消旋体作为原料参与胺化反应,导致产物中异构体含量略高之故;另一方面,也表明芳烃溶剂比如甲苯或对二甲苯对于反应原料和产物的立体构型保持是有利的。实施例7将148.7g手性胺中间体ii的n-乙酰基-l-亮氨酸盐(异构体含量为0.4%)、71.38g酸 酐中间体iii、47.6gdipea、1487ml甲苯加入反应瓶中;升温至90±5℃,保温反应5小时,减压浓缩除去甲苯;加入乙醇1500ml,升温回流30分钟;缓慢冷却至20℃以下,在5~20℃保温3小时;过滤,用200ml乙醇洗涤滤饼;在50±5℃真空烘干4小时,得到阿普斯特甲苯溶剂化物163.5g,晶型为晶型c(参见图2),收率106.6%,纯度为99.87%,异构体含量为0.05%。将上述阿普斯特甲苯溶剂化物加入到3000ml乙醇中,升温;蒸出乙醇,直至蒸干;依次加入1000ml乙醇、500ml丙酮;升温回流,溶解至澄清,回流30分钟;缓慢降温至50℃,加入1.5g活性炭,在45~50℃保温15分钟;过滤;滤液升温回流,溶解至澄清,回流30分钟;缓慢降温到15℃(约4小时);在10±5℃保温6小时;过滤,用200ml乙醇洗涤滤饼。在50±5℃真空烘干4小时,得到阿普斯特(i)139.1克,收率91.5%,纯度为99.94%,异构体含量为0.05%,晶型为晶型b(参见图1)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1