一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与流程
本发明属于体外核酸检测领域,尤其涉及一种用于检测样品中牛凸隆病毒(Porcine Torovirus,PToV)的荧光RT-PCR引物和探针和试剂盒及检测方法,可用于牛活畜和肉品检疫时牛凸隆病毒的快速诊断和流行病学研究。
背景技术:
凸隆病毒(Torovirus)作为套式病毒目(Nidovirairs)冠状病毒科(Coronaviridae)家族的重要成员,包括马凸隆病毒(Equine Torovirus,EToV,最初称为伯尔尼病毒)、牛凸隆病毒(Bovine Torovirus,BToV,最初称为布雷达病毒)、猪凸隆病毒(Porcine Torovirus,PToV)和人凸隆病毒(Human Torovirus,HToV)等四种标准型。凸隆病毒有囊膜病毒,表现为圆形,椭圆形、线形或者肾形,也有呈现杆状和小圆盘状的记载,最大直径为120~140nm,基因组为单股正链RNA,全长28,473kb。该病毒感染人和动物,主要引起消化道和呼吸道疾病。自1982年,美国爱荷华州爆发一场由牛凸隆病毒引发的严重腹泻以来,迄今已有30余年的历史,期间瑞士、英国、德国、南非、巴西、印度、加拿大、荷兰、澳大利亚、日本、韩国等全球不同国家和地区均有报道由凸隆病毒感染马、牛、猪、人等引起的腹泻事件,相关流行病学研究发现,该病毒在世界范围内流行,在宿主间呈现高水平的阳性率,目前我国还没有关于牛凸隆病毒相关研究的报道,及时研发出检测牛凸隆病毒快速、准确的检测试剂盒对于防止外境相关病毒的侵入具有重大意义。
凸隆病毒是肠道病原体,可以感染各年龄的易感动物,包括猪、牛、马、人等,主要引起被感染动物的胃肠炎。目前被报道的检测手段包括抗原捕获-没联免疫吸附试验、反转录聚合酶链式反应(RT-PCR)和免疫电镜(IEM)。ELISA方法虽然是一个快速且廉价方法,但是由于目前凸隆病毒不能在细胞中培养,导致在以发病动物的排泄物或肠道内容物作为抗原来源时,实验产生较高背景,大大降低了ELISA方法的特意性和敏感性。
四川农业大学于2012年申请了专利《一种猪环曲病毒RT-PCR检测试剂盒及其检测方法》,申请号:201210398440.8,该专利采用RT-PCR方法,扩增需要采用凝胶电泳技术才能观察结果,实验周期长,操作复杂,同时采取开盖处理容易产生气溶胶污染,并不适合开发快速,便捷产品。
IEM方法是一个流行病学诊断中非常重要的方法,但是由于其需要高度精密设备和较长的检测时间,加之检测成本较高,所以很难做到大范围推广和商业化。
实时荧光PCR技术,通过引入特异性探针和荧光信号的动态监测使PCR产物的扩增及分析的全过程可以在单管内封闭完成,并且可以对PCR扩增产物进行实时动态监测及自动分析结果,具有实时、准确、快速、简便等特点,是一种先进的分子检测技术。目前还没有基于实时荧光PCR技术建立的牛凸隆病毒核酸检测方法及试剂盒。
技术实现要素:
本发明目的之一是提供一种用实时荧光RT-PCR技术检测牛凸隆病毒的荧光RT-PCR引物和荧光探针。其是针对于牛凸隆病毒多聚蛋白(M蛋白)基因编码区的特异保守区域为靶标区域,设计一对特异性引物及荧光探针。
本发明目的之二是提供一种包括上述荧光RT-PCR引物和荧光探针的试剂盒。
本发明的目的之三是提供一种使用上述荧光RT-PCR引物和荧光探针对牛凸隆病毒的检测方法,该检测方法可以快速、定性检测样本中的牛凸隆病毒。
为实现上述目的,本发明所采用的技术方案是:
一种用于检测牛凸隆病毒的荧光RT-PCR引物和荧光探针,其特征在于,所述荧光RT-PCR引物和荧光探针为针对牛凸隆病毒多聚蛋白(M蛋白)的保守序列设计的牛凸隆病毒特异性正向、反向引物和荧光探针。
作为本发明的进一步改进,所述牛凸隆病毒正向、反向引物和荧光探针序列分别是:
正向引物:5'-GCAATAAACCAYTAACAGCTGCTC-3'
反向引物:5'-CTTTAGCGGCGCTGGTAGTAG-3'
荧光探针:5'-TGCTGCGTTGCGGATTTGTGTTGG-3';
所述荧光探针中的3’端标记有荧光淬灭基团,5’端分别标记有不同的荧光报告基团。
上述引物和探针的衍生序列也为本发明的保护范围,所述衍生序列包括引物序列的互补链序列,同时还可以向5'端和3'端方向延伸一至十个碱基或删减一至十个碱基得到的序列。
在本发明的一个优选实施例中,所述荧光报告基团选自FAM、JOE或ROX、TET、TAMRA、HEX、VIC、CY3、CY5或Texas Red;所述荧光淬灭基团选自BHQ、TAMRA、Eclipse、Dabcyl、Lowa BlackTM RQ或Lowa BlackTM FQ。
一种TaqMan探针法荧光RT-PCR检测牛凸隆病毒的试剂盒,其包含RT-PCR反应液、酶混合液、内标溶液、阴性质控品、阳性质控品,其中RT-PCR反应液含有dATP、dUTP、dGTP、dCTP四种核苷酸、内标正向、反向引物、内标探针和上述检测牛凸隆病毒的牛凸隆病毒特异性正向、反向引物和荧光探针、含有镁离子的缓冲液。
在本发明的一个优选实施例中,所述内标正向、反向引物和内标探针序列分别是:
内标正向引物:5'-GCCTCCTGGTCTGTGATCCTC-3'
内标反向引物:5'-GAAGTGGGCACATCCATAGAGC-3'
内标探针:5'-TTCTTGACACCCTGCATCCATTACCTCC-3';
所述内标探针的5’端标记有荧光报告基团,3’端标记有荧光淬灭基团。
在本发明的一个优选实施例中,所述荧光报告基团选自FAM、NEX、ROX、TET、TAMRA、JOE、VIC、CY3、CY5或Texas Red;所述荧光淬灭基团选自BHQ、TAMRA、Eclipse、Dabcyl、Lowa BlackTM RQ或Lowa BlackTM FQ。
在本发明的一个优选实施例中,所述的酶混合液为包含有热启动的Taq DNA聚合酶、M-MLV逆转录酶、RNA酶抑制剂(RNasin)的缓冲液。
在本发明的一个优选实施例中,所述的阳性质控品为含有插入牛凸隆病毒特异型保守序列的pUC57载体质粒的无菌TE缓冲液,所述阳性质控品的浓度为1.0×106copies/ml。
在本发明的一个优选实施例中,所述的阳性质控品为含有插入牛凸隆病 毒特异型保守序列的pUC57载体质粒的无菌TE缓冲液是将含有插入牛凸隆病毒特异型保守序列的pUC57载体质粒转化到大肠杆菌DH5α中增殖后经提取纯化用分光光度计测定浓度和纯度后用无菌TE缓冲液稀释后得到。
在本发明的一个优选实施例中,所述牛凸隆病毒特异型保守序列为:
TGCAATAAACCACTAACAGCTGCTCAGGTTGCTGCGTTGCGGATTTGTGTTGGTGGACAATGGTTTGCCTATTCGCGATCAACTACTACCAGCGCCGCTAAAGT。
在本发明的一个优选实施例中,所述的无菌TE缓冲液采用DEPC水配制。
在本发明的一个优选实施例中,所述的内标溶液为含有插入人RNP基因特异型保守序列的pUC57载体质粒质粒。
在本发明的一个优选实施例中,所述的人RNP基因特异型保守序列为:
GAAGTGGGCACATCCATAGAGCACCCCAGGGAGGCAGAGGAGGTAATGGATGCAGGGTGTCAAGAATCGGCAGGGCCTGAGAGGATCACAGACCAGGAGGC。
本试剂盒保存于-20℃,尽量减少反复冻融。
一种用于非诊断、治疗目的的检测牛凸隆病毒的荧光RT-PCR方法,包括以下步骤:
(1)样本RNA的提取:所述样本RNA可以采用深圳市易瑞生物技术有限公司生产病毒RNA磁珠提取试剂盒,按照试剂盒说明书进行提取;
(2)以待检测样本RNA为模板,采用上述的RT-PCR反应液、酶混合液、内标溶液与待检测样本RNA一起配制RT-PCR反应体系,对RNA模板进行扩增,反应条件为:第一阶段:50℃15min,95℃2min,1个循环;第二阶段:95℃10s,60℃30s,40个循环;第二阶段每个循环结束后收集荧光信号;所述荧光探针和内标探针分别对应两个荧光检测通道,分别为目标荧光通道和内标荧光通道;
(3)反应结束后,读取并记录检测通道扩增曲线及扩增循环数Ct,根据扩增曲线和扩增循环数进行检测结果的判断:当FAM通道和NEX通道均有扩增曲线,且Ct值均≤37,可判定牛凸隆病毒阳性;当FAM通道无扩增曲线,且Ct值显示为Undet或No Ct,NEX通道有扩增曲线,且Ct值均≤37时可判定牛凸隆病毒阴性;当FAM通道有扩增曲线,但37<Ct值≤40,NEX通道有扩增曲线,且Ct值均≤37时建议重复一次实验,如果结果同上,可判定为阳 性,如果无扩增,可判定为阴性;当FAM通道和NEX通道均无扩增曲线,且Ct值显示为Undet或No Ct,实验无效、建议更换一批试剂重新实验。
在本发明的一个优选实施例中,所述RT-PCR反应体系中,RT-PCR反应液18μl、酶混合液1μl、内标溶液1μl、RNA模板5μl。
在本发明的一个优选实施例中,步骤(3)中的分析条件设置如下:根据分析后图像调节基线(Baseline)的Start值、Stop值以及阈值(Threshold)的Value值(用户可根据实际情况自行调整,Start值可以在3-15、end值可以在5-20,调整阴性对照的扩增曲线平直或低于阈值线),使仪器给出正确的结果。
在本发明的一个优选实施例中,步骤(3)中的质量控制条件如下:
1).阴性对照:FAM通道无扩增曲线,NEX通道有扩增曲线,且Ct值均≤32;
2).阳性对照:FAM通道和NEX通道均有扩增曲线,且Ct值均≤32;
以上两个要求需在同一次实验中同时满足,否则,本次实验无效,需要重新进行实验。
Ct值(cycle threshold,Ct)的定义为:每个反应管内荧光信号达到设定阈值时所经历的循环数。阈值的设定一般是将其设定为恰好可以覆盖住阴性对照和空白对照的荧光值处,因此可以很好的去除反应管荧光值即背景。
本发明可以实现快速、特异的单管检测样本中是否含有牛凸隆病毒,与其它检测技术相比具有以下优点:
1、全封闭反应,实时监控荧光数据,无需后续处理,避免污染,保证检测结果的可靠性。
2、快速,操作简单,全程3个小时即可出诊断结果,大大缩短检测时间。
3、实现单管双重检测,同时引入了内标质控,提高了检测人员的检测效率,监控抽提效率和排除抑制剂干扰。
4、探针法荧光定量PCR技术特有的优势,即特异性更强、灵敏度更高,完全满足牛凸隆病毒流行病学诊断和疫情监控,为降低病死率以及控制疫情争取时间。
附图说明
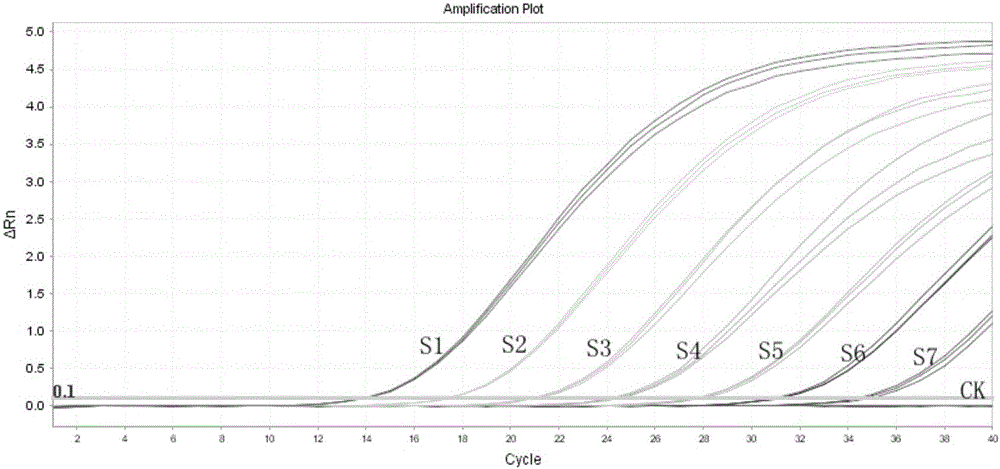
图1为牛凸隆病毒检测试剂盒的FAM通道线性实验数据。图中S1-S7表示浓度为1.0×109copies/ml、1.0×108copies/ml、1.0×107copies/ml、1.0×106copies/ml、1.0×105copies/ml、1.0×104copies/ml、1.0×103copies/ml的阳性质控品扩增曲线,各3个重复数据,CK为阴性质控品,横坐标cycle表示扩增循环数,纵坐标△Rn表示荧光强度。通过该图可以说明该试剂盒的在1.0×109copies/ml至1.0×103copies/ml之间具有很好的线性关系。
图2为牛凸隆病毒核酸检测试剂盒的FAM通道标准曲线示意图。该试剂盒拟合的线性方程为:Y=-3.4412x+44.938,相关系数R2=0.99991,其中Y代表Ct值,x代表阳性参考品的对数值
图3为牛凸隆病毒检测试剂盒的检出限实验示意图。其中S6-S8分别为1.0×104copies/ml、1.0×103copies/ml、1.0×102copies/ml,各20次重复数据,该图说明该试剂盒的检测限达到5copies/反应。
图4为牛凸隆病毒检测试剂盒的精密度实验示意图。其中S4和S6分别为1.0×106copies/ml、1.0×104copies/ml,各10次重复数据。
图5为牛凸隆病毒检测试剂盒的特异性实验数据。图中横坐标cycle表示扩增循环数,纵坐标△Rn表示荧光强度,CK代表阴性质控品,A代表BToV阳性质控品FAM通道扩增曲线,B代表内标阳性质控品NEX通道扩增曲线,特异性参考品分别为牛轮状病毒、牛病毒性腹泻病毒、牛细小病毒、布鲁氏杆菌、牛结核分支杆菌、沙门氏菌、大肠杆菌、粪肠球菌。这8种特异性参考品均未有典型的“S”型扩增曲线,说明该试剂盒特异性良好。
具体实施方式
本发明具有用于检测牛凸隆病毒的荧光RT-PCR引物和荧光探针的试剂盒及检测方法采用Taqman探针法荧光PCR检测技术,快速检测样品中牛凸隆病毒特有序列,从而判断样品中是否存在牛凸隆病毒。下面结合具体实施例来进一步描述本发明,本发明的优点和特色将会随着描述而更加清楚。这些实施例仅是示范性,并不对本发明的范围构成任何限制。本领域技术人员应该 理解的是,凡是利用本发明内容所做的等效结构或等效流程变换,直接或间接运用于其他相关技术领域,均同理包括在本发明的专利保护范围内。试剂盒在检测牛凸隆病毒的使用方法即检测方法,下面以试剂盒为例进行线性实验、最低检出限实验、精密度实验和特异性实验。
实施例1试剂盒的线性实验
目标靶标探针标记为FAM荧光基团,该试剂盒的FAM通道的线性参比品,由含有牛凸隆病毒目的片段的质粒组成,采用TE缓冲液将阳性质粒进行10倍的梯度稀释得到下列梯度溶液(S1:1.0×109copies/ml、S2:1.0×108copies/ml、S3:1.0×107copies/ml、S4:1.0×106copies/ml、S5:1.0×105copies/ml、S6:1.0×104copies/ml、S7:1.0×103copies/ml)作为的线性参比品,通过该实验表明该试剂盒的在1.0×109copies/ml至1.0×103copies/ml之间具有很好的线性关系,同时该试剂盒拟合的线性方程为:Y=-3.4412x+44.938,相关系数R2=0.99991,其中Y代表Ct值,x代表阳性参考品的对数值。实验结果参考图1,标准曲线参考图2。
实施例2试剂盒的最低检出限实验
该实验验证试剂盒的最低检出限,采用线性参比品中的S6:1.0×104copies/ml、S7:1.0×103copies/ml、S8:1.0×102copies/ml等浓度的阳性质粒作为检出限参比品,每个浓度进行20个重复样品,其中检出限参比品S6和S7全部表现为扩增曲线,为阳性数据,S8参比品仅有9个样品扩增出S型曲线,不满足要求,因此通过该实验表明该试剂盒的检出限为1.0×103copies/ml,即达到5copies/反应,实验结果参考图3。
实施例3试剂盒的精密度实验
该实验验证试剂盒的批内精密度,采用线性参比品中的S4:1.0×106copies/ml、S6:1.0×104copies/ml等两个高低浓度的阳性质粒作为精密度参比品,各做10个重复样本,结果两个浓度数据变异系数均小于5%,实验结果参考图4。
实施例4试剂盒的特异性实验
该实验选择与牛凸隆病毒具有相同感染感染部位的常见病原体作为特异性参考品,采用的是灭活阳性样本。特异性参考品分别为牛轮状病毒、牛病毒性腹泻病毒、牛细小病毒、布鲁氏杆菌、牛结核分支杆菌、沙门氏菌、大肠杆菌、粪肠球菌。利用深圳市易瑞生物技术有限公司研发的通用性病毒DNA/RNA提取试剂盒提取以上灭活样本中的RNA作为模板进行实验,实验数据表明这8种特异性参考品均未有典型的“S”型扩增曲线,说明该试剂盒特异性良好,实验结果参考图5。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程