一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其核苷酸序列及应用的制作方法
本发明涉及一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其编码基因及其在催化底物尿苷-5’-二磷酸木糖为尿苷-5’-二磷酸阿拉伯糖,催化底物尿苷-5’-二磷酸阿拉伯糖为尿苷-5’-二磷酸木糖,催化底物尿苷-5’-二磷酸葡萄糖为尿苷-5’-二磷酸半乳糖,催化底物尿苷-5’-二磷酸半乳糖为尿苷-5’-二磷酸葡萄糖四种反应中的应用,属于基因工程领域。
背景技术:
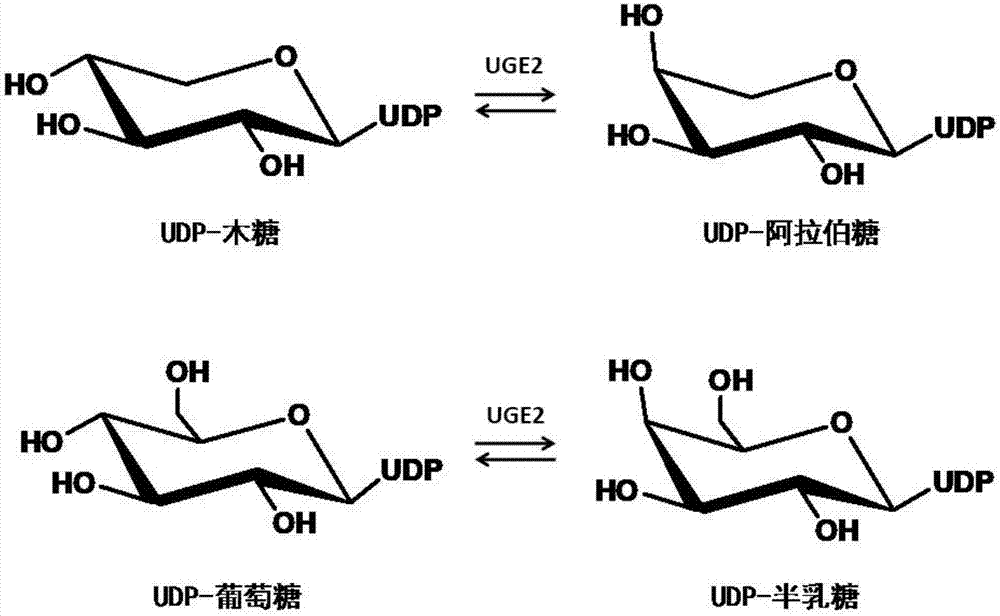
:尿苷-5’-二磷酸半乳糖差向异构酶(uge)是生物体内催化尿苷-5’-二磷酸半乳糖(udp-半乳糖)和尿苷-5’-二磷酸葡萄糖(udp-葡萄糖)相互转化的关键酶。uge能将尿苷-5’-二磷酸半乳糖(udp-半乳糖)吡喃糖环上的4位羟基差向异构化而形成udp-葡萄糖(图1)。udp-半乳糖是一个在糖蛋白、多糖和各种经过糖基修饰的次生代谢产物,如黄酮苷、三萜皂苷、甾体皂苷等生物合成中重要的糖基供体,它广泛存在于动物、植物、真菌、细菌中。许多糖基化的化合物与其苷元相比具有更好的水溶性,可以使化合物的成药性增加。但udp-半乳糖含量低,合成困难,导致价格昂贵,不利于阿拉伯糖苷的合成,给创新药物的研制带来了很大的困难。通过uge对udp-葡萄糖的催化,一步反应就能将udp-葡萄糖转化为udp-半乳糖,从而可以给天然产物的糖苷化提供稳定而廉价的糖基供体,这可以带来很大的经济利益。因此,克隆uge基因并对其进行功能鉴定对于酶催化合成udp-半乳糖这一化合物或者通过合成生物学技术规模化制备葡萄糖苷天然产物,减少由于化学合成以及植物提取葡萄糖苷类天然产物等传统方法对环境和物种造成的压力,从而促进社会可持续发展具有很重要的意义。迄今为止,已在植物如十字花科植物拟南芥(arabidopsisthaliana),禾本科植物大麦(hordeumvulgare),豆科植物豌豆(pisumsativum)细菌如草木樨中华根瘤菌(sinorhizobiummeliloti)中发现并克隆得到udp-半乳糖差向异构酶基因,而尚没有从天门冬科植物虎眼万年青(ornithogalumcaudatum)中分离得到该蛋白的报道。本发明通过对虎眼万年青进行转录组测序,获得了虎眼万年青udp-半乳糖差向异构酶ocuge2序列信息。通过提取虎眼万年青rna,利用rt-pcr,从虎眼万年青无菌鳞茎中克隆得到ocuge2基因,并对其进行了功能鉴定,这是首次从虎眼万年青植物中克隆得到这个基因。技术实现要素:本发明解决的技术问题是提供一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶、编码该酶的核苷酸序列、含有该核苷酸序列的表达载体、含有该核苷酸序列或表达载体的宿主细胞,以及其在催化底物尿苷-5’-二磷酸木糖、尿苷-5’-二磷酸阿拉伯糖、尿苷-5’-二磷酸葡萄糖、尿苷-5’-二磷酸半乳糖反应中的应用。为解决本发明的技术问题,采用如下技术方案:本发明技术方案的第一方面提供了一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其特征在于:a)seqidno.1所示的氨基酸序列;b)seqidno.1所示的氨基酸序列经替换,缺失或添加1-36个氨基酸形成的具有同等功能的氨基酸序列。以上所述的尿苷-5’-二磷酸半乳糖差向异构酶,其特征在于,在尿苷-5’-二磷酸半乳糖差向异构酶上可进行常规修饰;或者在尿苷-5’-二磷酸半乳糖差向异构酶上还连接有用于检测或纯化的标签。其中,所述的常规修饰包括乙酰化、酰胺化、环化、糖基化、磷酸化、烷基化、生物素化、荧光基团修饰、聚乙二醇peg修饰、固定化修饰;所述的标签包括his6、gst、egfp、mbp、nus、ha、igg、flag、c-myc、profinityexact。本发明技术方案的第二方面提供了一种编码第一方面所述尿苷-5’-二磷酸半乳糖差向异构酶的核酸分子,其核苷酸序列如seqidno.3所示。本发明技术方案的第三方面提供了一种含有第二方面所述核酸分子的表达载体。本发明技术方案的第四方面提供了一种含有第三方面所述表达载体的宿主细胞,其中所述宿主细胞优选大肠杆菌,酿酒酵母,毕赤酵母,链霉菌和植物细胞,更优选的宿主细胞选自大肠杆菌。本发明技术方案的第五方面提供了第一方面所述的尿苷-5’-二磷酸半乳糖差向异构酶或第二方面所述核酸分子或第三方面所述表达载体或第四方面所述宿主细胞在催化底物尿苷-5’-二磷酸木糖、尿苷-5’-二磷酸阿拉伯糖、尿苷-5’-二磷酸葡萄糖、尿苷-5’-二磷酸半乳糖反应中的应用。其中的催化底物分别为尿苷-5’-二磷酸木糖、尿苷-5’-二磷酸阿拉伯糖、尿苷-5’-二磷酸葡萄糖、尿苷-5’-二磷酸半乳糖;产物分别为尿苷-5’-二磷酸阿拉伯糖、尿苷-5’-二磷酸木糖、尿苷-5’-二磷酸半乳糖、尿苷-5’-二磷酸半乳糖。有益技术效果:udp-半乳糖糖在生物体中含量低,合成困难,导致价格昂贵,不利于半乳糖苷的合成,给创新药物的研制带来了很大的困难。尿苷-5’-二磷酸半乳糖差向异构酶能够催化udp-葡萄糖与udp-半乳糖的相互转化,一步反应就能将udp-葡萄糖转化为udp-半乳糖,从而可以给天然产物的糖苷化提供稳定而廉价的半乳糖基供体,在构建的工程菌中,其能够起到将udp-葡萄糖转化为udp-半乳糖的作用,从而增加半乳糖苷的产量,可以带来很大的经济利益。同时uge2还能催化,udp-阿拉伯糖、udp-葡萄糖、udp-半乳糖形成相应的糖基供体,为天然产物糖基化提供了多样化的糖基工体。附图说明图1:尿苷-5’-二磷酸半乳糖差向异构酶所参与的催化反应。图2:ocuge2基因的pcr分析结果,其中m是dna分子量标准;1是ocuge2基因pcr结果。图3:重组质粒pet28a-ocuge2示意图。图4:ocuge2重组蛋白sds-page分析银染结果,其中m为蛋白分子标准;1为ocuge2;2为空载体对照。图5:ocuge2重组蛋白免疫印迹结果,其中ck为对照;1为ocuge2。图6:咪唑洗脱纯化后ocuge2蛋白sds-page分析银染结果,其中1为目的蛋白;m为蛋白分子标准。图7:ocuge2重组酶催化udp-木糖hplc-uv检测结果,其中a为实验组;b为对照组(灭活的酶)图8:ocuge2重组酶催化udp-阿拉伯糖hplc-uv检测结果,其中a为实验组;b为对照组(灭活的酶)图9:ocuge2重组酶催化udp-葡萄糖hplc-uv检测结果,其中a为实验组;b为对照组(灭活的酶)图10:ocuge2重组酶催化udp-半乳糖hplc-uv检测结果,其中a为实验组;b为对照组(灭活的酶)图11:ocuge2重组酶催化udp-木糖产物1hnmr图。具体实施方式本发明通过如下实施例进行进一步的说明,这些实施例仅用于说明性的,而不是以任何方式限制本发明权利要求的范围。实施例1虎眼万年青转录组测序及序列分析提取虎眼万年青无菌鳞茎总rna后,以mrna为模板,用六碱基随机引物(randomhexamers)合成第一条cdna链,然后加入缓冲液、dntps、rnaseh和dnapolymerasei合成第二条cdna链,在经过qiaquickpcr试剂盒纯化并加eb缓冲液洗脱之后做末端修复、加poly(a)并连接测序接头,然后用琼脂糖凝胶电泳进行片段大小选择,最后进行pcr扩增,建好的测序文库用illuminahiseqtm2000进行测序。测序得到的原始图像数据经basecalling转化为序列数据,即rawdata或rawreads。对rawreads进行数据过滤,去掉带接头的,重复的,测序质量很低的reads,得到cleanreads。使用短reads组装软件trinity将具有一定长度overlap的cleanreads连成更长的片段,即contig。然后,将cleanreads比对回contig,通过paired-endreads能确定来自同一转录本的不同contig以及这些contig之间的距离,trinity将这些contig连在一起,得到两端不能再延长的序列,这些序列称之为unigene。通过blastx将unigene序列比对到蛋白数据库nr、swiss-prot、kegg和cog(evalue<0.00001),并通过blastn将unigene比对到核酸数据库nt(evalue<0.00001),得到跟给定unigene具有最高序列相似性的蛋白,从而得到该unigene的蛋白功能注释信息。通过功能注释,从虎眼万年青转录组序列中发现一个长为1083bp的,具有udp-半乳糖差向异构酶基因保守序列的contig,即9803(seqidno.2)。实施例2ocuge2基因克隆取100mg虎眼万年青无菌鳞茎于液氮中速冻,研钵研成细粉状,trizol提取法,提取虎眼万年青无菌鳞茎总rna。使用rt-pcrkit(revertra-plus-,toyobo公司)将虎眼万年青无菌鳞茎总rna反转录成cdna。反转录体系和程序如下:在20μl体系中加入总rna1μg,rnasefreeh2o4μl,oligo(dt)201μl,65℃保温5min后,立刻置于冰上冷却,然后在上述管中再依次加入5×rtbuffer4μl,rnaseinhibitor(10u/μl)1μl,dntpmixture(10mm)和revertraace1μl,30℃保温10min,42℃温育60min,85℃变性5min,冰上5min,完成cdna的合成。cdna置于-20℃备用。以虎眼万年青无菌鳞茎cdna为模板,设计两对ocuge2特异引物,通过巢式pcr的方法扩增ocuge2基因。第一轮pcr,50μl体系中含10×pcrbuffer5μl,2mmdntps5μl,25mmmgso43μl,10μm的引物f9803-1(5’-tctcgctcttgattcttgatttcg-3’,seqidno.4)和r9803-1(5’-tggtttgggttcctcctttaagt-3’,seqidno.5)各1.5μl,kod-plus-neo1μl,cdna2μl,ddh2o补足。pcr程序:94℃预变性5min;98℃变性30s,53℃复性45s,每一个循环递减1℃,68℃延伸120s,共15循环;98℃变性30s,38℃复性45s,68℃延伸120s,共15循环;68℃延伸7min,4℃保温。第二轮pcr,50μl体系中含10×pcrbuffer5μl,2mmdntps5μl,25mmmgso43μl,10μm的引物f9803-2(5’-atggcgggtttgaacatcatggtga-3’,seqidno.6)和r9803-2(5’-ctaattattcactagtattttagcttcc-3’,seqidno.7)各1.5μl,kod-plus-neo1μl,第一轮pcr产物2μl,ddh2o补足。pcr程序:94℃预变性5min;98℃变性30s,45℃复性45s,68℃延伸120s,共30个循环;68℃延伸7min,4℃保温。0.8%琼脂糖凝胶电泳分析pcr产物,结果表明,扩增得到了一条长约为1.1kb的条带(图2)。pcr产物与peasytm-t1simple(transgen公司)载体连接,转化到trans1-t1(transgen公司)菌株,在含有100μg/ml羧苄青霉素的lb平板上培养,挑取单克隆进行菌落pcr,筛选阳性克隆送样测序。结果表明,扩增得到的pcr产物与转录组测序结果完全一样,长为1083bp(即seqidno.3),含有该基因的载体命名为peasy-ocuge2。实施例3ocuge2表达载体的构建根据in-fusion(clontech公司)同源重组的原理,以测序正确的质粒peasy-ocuge2为模板,pet28auge2(5’-cgcggatccgaattcatggcgggtttgaaca-3’,seqidno.8)和pet28auge2(5’-tgcggccgcaagcttctaattattcactagt-3’,seqidno.9)为引物,通过如下程序和体系进行pcr,50μl体系中含10×pcrbuffer5μl,2mmdntps5μl,25mmmgso43μl,10μm的引物pet28auge2和retduetuge2各1.5μl,kod-plus-neo1μl,质粒1μl,ddh2o补足。pcr程序:94℃预变性5min;98℃变性30s,63℃复性45s,68℃延伸120s,共30个循环;68℃延伸7min,4℃保温。扩增得到长为1kb的ocuge2基因。将该基因通过in-fusion的方法连接到ecorⅰ和hindⅲ双酶切处理的pet-28a中,重组产物转化到trans1-t1菌株,在含有50μg/ml的卡那霉素lb平板上培养,挑取单克隆进行菌落pcr,筛选阳性克隆进行测序。结果表明载体构建正确,命名为pet28a-ocuge2(图3)。实施例4重组ocuge2蛋白的诱导表达和检测将构建好的质粒pet28a-ocuge2用热激法转化表达宿主菌transetta(de3),转化产物涂布于含卡那霉素(50μg/ml)及氯霉素(35μg/ml)的lb固体培养基(10g胰蛋白胨,5g酵母粉,10g氯化钠溶于1l蒸馏水中,加入15g琼脂粉,而后调节ph为7.0)上,37℃倒置培养过夜,直至长出单克隆。挑取单克隆转接于20ml含卡那霉素(50μg/ml)及氯霉素(35μg/ml)的lb液体培养基(10g胰蛋白胨,5g酵母粉,10g氯化钠溶于1l蒸馏水中,而后调节ph为7.0),37℃,200rpm培养至od600为1.0左右,按1:50比例转接入50ml含卡那霉素(50μg/ml)及氯霉素(35μg/ml)的lb培养基(10g胰蛋白胨,5g酵母粉,10g氯化钠溶于1l蒸馏水中,而后调节ph为7.0),至od600为0.6时,加入iptg(终浓度为0.5mm),在25℃,160rpm条件下,诱导培养12小时。取1ml菌液,12000rpm,离心2min收集菌体。加入1ml预冷裂解缓冲液(25mm,ph为8.0的磷酸钠缓冲液),重悬菌体,菌体采用超声破碎法破碎(超声5s,停10s,总共超声破碎6min)。破碎液通过12000rpm,离心20min,吸取上清。取10μl上清进行sds-page分析。结果如图4所示,从图中可以看出,和对照相比,实验菌的诱导产物中出现了一条长约为39kda的特异性条带。与ocuge2的理论大小一致,表明ocuge2在大肠杆菌中成功表达。为进一步确证ocuge2基因的表达,进行了免疫印迹分析。离心收集e.coli[pet28a-ocuge2]的菌体,用超声破碎液进行sds-page电泳,采用westernblot进行检测。所用一抗为抗his-tag的小鼠单克隆抗体,二抗为山羊抗小鼠igg(1:5000)。结果表明,与对照相比,e.coli[pet28a-ocuge2]经免疫印迹后,在相应的位置上出现了一条相应的杂交带(图5)。因此,确认重组的ocuge2蛋白具有特异的免疫活性,表明ocuge2基因在e.coli中得到了表达。实施例5重组ocuge2蛋白的纯化和定量e.coli[pet28a-ocuge2]在25℃,160rpm条件下,经0.5mmiptg诱导培养12小时后,12000rpm,离心2min收集菌体,大量菌体采用细胞破碎仪(800mpa)破碎,12000rpm,离心2min,收集破碎液上清,上清经0.22μm滤膜过滤后,通过镍胶亲和层析进行纯化。用涮洗缓冲液(ph8.0,25mm磷酸钠,300mm氯化钠,20mm咪唑)冲洗杂蛋白,直到a280小于0.010。紧接着用40ml洗脱缓冲液(ph8.0,含25mm磷酸钠,300mm氯化钠,100mm咪唑)将结合在镍胶上的重组ocuge2洗脱下来,收集洗脱等分,进行sds-page分析。结果如图6所示,从结果可以看出,ocuge2纯化效果较好,几乎看不到杂带。采用2l含25mm磷酸钠(ph8.0)缓冲液透析纯化的重组ocuge2蛋白,换液4次,而后将透析液加入甘油10ml,蛋白保存于-20℃环境中。使用bio-radproteinassay试剂盒对纯化的ocuge2蛋白进行定量,按其说明书有部分修改。首先按1:4的比例将染料和ddh2o稀释混匀,而后通过0.22μm滤膜过滤备用。标准bsa蛋白及待测蛋白按一定梯度稀释,涡旋混匀,而后蛋白按如下体系(100μl:dryreagentdilutionbuffer;10μl:protein)同染料作用,室温中至少震荡孵育5min。酶标仪测量各蛋白的a595值,对不同bsa标准蛋白浓度及对应的a595值线性回归分析,获得标准bsa蛋白的浓度方程,根据得到的方程测得催化实验中所用的ocuge2蛋白浓度为0.436mg/ml。实施例6ocuge2蛋白功能鉴定本实验以udp-木糖、udp-阿拉伯糖、udp-葡萄糖、udp-半乳糖为底物,探讨ocuge2对该底物的差向异构化作用,结果表明,ocuge2能催化udp-木糖形成udp-阿拉伯糖,催化udp-阿拉伯糖形成udp-木糖,催化udp-葡萄糖形成udp-半乳糖,催化udp-半乳糖形成udp-葡萄糖。ocuge2催化udp-木糖形成的产物鉴定以纯化的ocuge2蛋白作为催化剂,建立50μl反应体系(1m磷酸缓冲液(ph7.0)5μl,加入5μl浓度为10mm的底物udp-木糖,10μl纯化的蛋白,20μl灭菌水)。30℃反应30min后,用40μl氯仿终止反应。利用0.22μm尼龙膜过滤反应液,进样20μl进行hplc分析。色谱柱为shodex公司的wa-pak阴离子交换柱。hplc条件表1所示,其中a相为h2o;b相为700mm的醋酸铵-醋酸缓冲液,ph为5.2。检测波长为261nm。表1时间a相%b相%流速ml/min0982120505013201001339821409821hplc结果(图7)表明,ocuge2能催化udp-木糖,实验组底物峰消耗较多,同时在底物峰之前出现了一个新的产物峰,该产物的最大吸收波长为261nm,为尿嘧啶的特征吸收峰。为进一步确证新产物的结构,通过液相制备样品,样品冷干后用氘代水溶解,用1hnmr(600m)进行结构解析(图9)。归属各氢信号,结果如下:arabinose:h1”5.35(1h,dd)h2”3.57(1h,dt)h3”3.67(1h,t)h4”3.78(1h,dt)h5a”3.85(1h,d)h5b”3.47(1h,m)rib:h1’5.72(1h,d)h2’4.12(2h,m)h4’4.05(1h,m)h5a’(1h,m)h5b’(1h,m)uridine:h55.70(1h,d)h67.69(1h,d)综合以上分析,可以确证ocuge2催化udp-葡萄糖醛酸所形成的新产物为udp-阿拉伯糖。从而表明,ocuge2具有udp-半乳糖差向异构酶的功能。按照同样的催化条件和液相分离条件,本实验还以udp-阿拉伯糖、udp-葡萄糖、udp-半乳糖为底物进行了催化反应,并从液相结果(图8、9、10)可以得出结论,ocuge2同样能以这些化合物作为底物进行差向异构化形成对应的糖基供体。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1