含有双硫键的阳离子型聚酰胺、制备方法及其应用与流程
本发明涉及生物医用聚合物领域,具体涉及含有双硫键的阳离子型聚酰胺、制备方法及其作为转染试剂转染细胞株或干细胞的应用。
背景技术:
基因治疗的成功依赖高效、低毒的可将外源基因导入靶细胞内的基因载体。目前基于聚合物的非病毒基因载体(转染试剂)因其更高的安全性、生产成本低、基因载药量大等优点,倍受研究关注。基于阳离子型的聚合物基因载体,如可降解的聚赖氨酸、聚乙烯亚胺和聚酰胺等已经被广泛研究。但它们因不可降解的原因,转染过程中导致较大的细胞毒性。生物可降解的双硫键是设计可降解聚合物基因载体的重要分子构建。含有双硫键的阳离子型聚合物因其在进入细胞后便会被降解,对细胞产生较弱的毒性。因此将双硫键引入阳离子型聚合物是设计高效、低毒基因载体的重要方法。
聚酰胺是一类在主链上含有酰胺键(amide linkage)的聚合物。在过去十年里,聚酰胺在生物医学领域,特别是药物缓释和组织工程方面得到广泛的应用。目前,含有双硫键的聚酰胺有大量的报道,主要是通过N,N'-双(丙稀酰)胱胺和伯胺通过麦克加成反应制备的聚(酰胺-胺)。但麦克加成反应原理表明,该类聚(酰胺-胺)分子链上介于酰胺键(-NH-C=O)和叔胺(N-R)基团之间的碳原子个数不可变,只能是两个碳原子。如下式所示:
目前报道的阳离子型聚酰胺,其介于酰胺键(-NH-C=O)和双硫键(SS)之间的碳原子个数只是两个。这些因素限制了制备分子结构多样性的阳离子型聚酰胺,进而影响了后续转染效率的优化。
参考文献:
1.Thomas CE, Ehrhardt A, Kay MA. Progress and problems with the use of viral vectors for gene therapy. Nat Rev Genet 2003;4: 346-358.
2. Li S, Huang L. Non-viral gene therapy: promises and challenges. Gene Ther 2000;7: 31-34.
3. Pack DW, Hoffman AS, Pun S, Stayton PS. Design and development of polymers for gene delivery. Nat Rev Drug Discov 2005;4: 589-593
4. Lin C, Zhiyuan Zhong, Martin C. Lok, Xulin Jiang, Wim E. Hennink, Feijen J, et al. Novel bioreducible poly(amido amine)s for highly efficient gene delivery. Bioconjuate Chem 2007;18: 138-145.
5. Son S, Namgung R, Kim J, Singha K, Kim WJ. Bioreducible polymers for gene silencing and delivery. Acc Chem Res 2012;45: 1100-1112。
技术实现要素:
本发明的目的是提供一种含有双硫键的阳离子型聚酰胺、制备方法及其作为转染试剂转染细胞株或干细胞的应用。
本发明提出的含有双硫键的阳离子型聚酰胺,其结构式如式(1)所示:
(1)
其中,R1基团选自: 或中任一种;
R2基团选自:或;
聚合度n为20-100。
本发明提出的含有双硫键的阳离子型聚酰胺的制备方法,首先合成二对硝基苯基二硫代二丙(丁)酸酯,将其和含有叔胺基团的二伯胺化合物通过逐步缩合,得到含有双硫键和可质子化胺基的聚酰胺;具体步骤如下:
(1)将二硫代二丙酸或二硫代二丁酸与氯化亚砜一起搅拌,进行酯化反应,得到二对硝基苯基二硫代二丙(丁)酸酯;其中:二硫代二丙(丁)酸与氯化亚砜的摩尔比为1:(3~ 5);
(2)将步骤(1)得到的产物旋转蒸发,去除未反应的氯化亚砜,残余物与对硝基苯酚在有机溶剂中反应;
(3)将步骤(2)得到的产物旋转蒸发,除去未反应的有机溶剂,残余物在冰水中重结晶,得到二对硝基苯基二硫代二丙(丁)酸酯:
(4)制备含有双硫键的聚酰胺
将二对硝基苯基二硫代二丙(丁)酸酯与二伯胺化合物加入到有机溶剂中在室温下进行反应;二对硝基苯基二硫代二丙(丁)酸酯与二伯胺化合物的摩尔比为1:1;
(5)反应完毕后,向步骤(4)所得产物中加入去离子水稀释,每1g反应物加入10mL ddH2O(重蒸水), 用4M 盐酸调节pH值到5-6,然后用透析袋透析、冷冻干燥,得到含有双硫键的聚酰胺。
本发明中,步骤(1)中所述酯化反应时间为4小时。
本发明中,步骤(2)中所述有机溶剂为丙酮,残余物与对硝基苯酚在有机溶剂中反应时间为24小时。
本发明中,步骤(4)中所述有机溶剂为二甲基亚砜,室温下反应时间为24-36小时。
本发明中,步骤(4)中所述二伯胺化合物选自氨基酸、1,4-双(3-氨基丙基)-哌嗪、N-甲基-2,2’-二氨基二乙胺、双(2 -氨基乙基)2 -(叔丁氧羰基氨基)乙基胺或1,4-哌嗪二乙胺等中任一种。
本发明中,步骤(5)中所述透析袋的截留分子量为1000-3000。
一种含有双硫键的阳离子型聚酰胺作为转染试剂转染细胞株和干细胞的应用,具体步骤如下:
(1)将培养至80-90%融合度的哺乳动物细胞株或干细胞用胰蛋白酶消化、计数,并以1-2×105/孔接种6孔板,置于培养箱中培养约24 h,至细胞达70%融合度,得到pCMV-GFP质粒;
(2)按N/P比值为20、40、80的不同浓度比例的含有双硫键的阳离子型聚酰胺与pCMV-GFP质粒进行复合,得到复合物,室温复合半个小时;
转染前,先用PBS缓冲液冲洗细胞,更换新鲜无血清培养基,培养1h后,随后向孔板中滴加复合物,充分混匀后,培养1-4 h;
(3)去除培养基,加入含10%胎牛血清和100U/ml双抗(青霉素和链霉素)的培养基,培养24 h,后用倒置荧光显微镜观察细胞绿色荧光表达情况并拍照。
通过上述方法制备的聚酰胺具有很低的细胞毒性和生物相容性。本发明提供的含有双硫键的聚酰胺基因转染试剂可适用于萤火虫荧光素酶、绿色荧光蛋白报告基因,以及其它功能基因质粒。
与现有技术相比,本发明有如下优点:1)本发明通过含有双硫键的对二硝基苯基二硫代二丙(丁)酸酯与二伯胺化合物通过逐步缩聚方法制备阳离子型聚酰胺。不同于传统的阳离子型聚酰胺的制备方法,即麦克加成方法。合成反应条件温和、副反应少。本方法便于引入双硫键和胺基官能团,可以得到结构多样性的聚酰胺;该方法得到的聚酰胺碳原子数目可调。2)本发明中制备的含有双硫键的聚酰胺相比普通聚酰胺能够有效的提高包裹基因的能力以及在胞浆内释放基因的能力。因此,该类新型的聚酰胺生物相容性好且细胞毒性低。经实验证明,该系聚酰胺与基因形成的复合物在多种哺乳细胞株(如SKOV3、MCF-7、HepG2和干细胞)的转染试验中,均表现出比商业化转染试剂(Lipofectamine2000)更高的转染效率和更低的细胞毒性。因此,本发明制备的含有双硫键聚酰胺在基因转染试剂领域具有良好的产业化前景。
附图说明
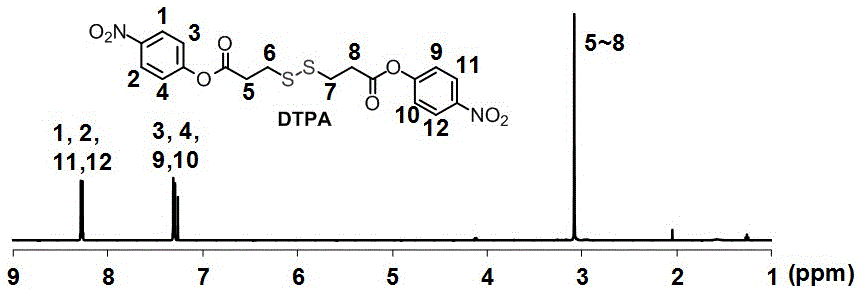
图1为二对硝基苯基二硫代二丙酸酯的1H NMR谱图。
图2为含有1,4-双(3-氨基丙基)-哌嗪的二硫代二丙基聚酰胺(DTPA-BAP)的1H NMR谱图。
图3为含有N-甲基-2,2’-二氨基二乙胺的二硫代二丙基聚酰胺(DTPA-MDE)的1H NMR谱图。
图4为含有双硫键聚酰胺和转染试剂Lipofectamine2000转染MCF-7和SKOV-3细胞表达绿色荧光蛋白(GFP)基因,荧光显微镜下观察所拍摄的照片。其中:a)为DTPA-BAP转染MCF-7细胞,b)为DTPA-BAP转染SKOV-3细胞,c)为Lipofectamine2000转染MCF-7细胞,d)为Lipofectamine2000转染SKOV-3细胞。
图5含有双硫键的聚酰胺在不同浓度下与MCF-7细胞共培养后的细胞存活率。
具体实施方式
下面结合实施例对本发明作进一步的说明
实施例1:合成二对硝基苯基二硫代二丙酸酯 (DTPA-PNC)
(1)先将二硫代二丙酸(5 g)和二氯亚砜 (20 mL)按摩尔比1:5称取,加入到反应器内,反应4小时;
(2)旋转蒸发二氯亚砜,并将残余固体溶解在丙酮中,加入对硝基苯酚固体(6.7 g),反应24小时;
(3)旋转蒸发丙酮,残余物在水(500 mL)中重结晶,得到针状晶体 (3.4 g)。
固体产物的核磁数据为:1HNMR(300 MHz, CDCl3, ppm):δ 7.3 和8.3 (aromatic protons, 8H); δ 3.1 (2×CH2CH2S, 8H)(见图1)。
实施例2:合成含有1,4-双(3-氨基丙基)-哌嗪的二硫代二丙基聚酰胺(DTPA-BAP)
(1)称取实施例1所得的DTPA-PNC(0.5 g)和1,4-双(3-氨基丙基)-哌嗪(0.22 g)与反应瓶中,加入3 mL二甲基亚砜,混合均匀后,40℃油浴环境下反应5天;
(2)在反应器内加入1,4-双(3-氨基丙基)-哌嗪(0.02 g)和1 mL的二甲基亚砜终止反应,油浴环境下继续反应2天;
(3)将反应瓶内的液体全部转移到透析装置中,用4 M的盐酸将pH调至5,用截留分子量为1000的透析袋透析、冷冻干燥,得到固体产物(0.34 g)。
固体产物的核磁数据为:1HNMR(300 MHz, D2O, ppm):δ1.95 (4H, 2×N-CH2CH2CH2); 2.66 (4H, 2×N-CH2CH2CH2); 2.92 (4H, 2×N-CH2CH2CH2); 3.28 (8H, CH2CH2SSCH2CH2); 3.3-4.1 (8H, 2×N-CH2CH2-N) (见图2) 。
实施例3:N-甲基-2,2’-二氨基二乙胺的二硫代二丙基聚酰胺(DTPA-MDE)
(1)将N-甲基-2,2’-二氨基二乙胺(1 g )和实施例1所得的DTPA-PNC(0.2 g)放入烧瓶中;
(2)用5 mL二甲基亚砜溶解,在室温下反应5天;
(3)反应结束后,用10 mL去离子水溶解产物,用盐酸将pH值调到6,
(4)用分子截留量为1000 g/mol的透析袋透析;
(5)冷冻干燥,得到固体产物(0.3 g)。
固体产物的核磁数据为:1HNMR(300 MHz, D2O, ppm):δ 2.66 (4H, 2×N-CH2CH2CH2); 2.92 (4H, 2×N-CH2CH2CH2, 3H, CH3); 3.1-3.6 (8H, 2×N-CH2CH2-N) (见图3)。
实施例4:含有双硫键的聚酰胺转染MCF-7细胞株
(1)培养至85-90%融合的所需细胞用胰蛋白酶消化、计数,并以6×104细胞/孔的浓度接种24孔板,置于培养箱中培养约24h,至细胞达50-70%融合;
(2)对细胞进行分组,每亚组设平行的3个复孔,并设空白对照组,及以树枝状的PEI(25万分子量)或lipofectamine 2000作为转染试剂的阳性对照组;
(3)配置不同浓度比例的实施例1或实施例2所得的聚氨酯与pCMV-GFP质粒的混合物。并按PEI或lipofectamine 2000的说明书要求,配置质粒复合物;
(4)将孔板中的细胞培养基吸除,以PBS冲洗细胞,更换新鲜无血清培养基于培养箱中培养0.5 h;
(5)按照不同组别向孔板中滴加质粒复合物,充分混匀后置培养箱培养1 h;(6)吸除孔板中的液体,以PBS冲洗细胞,更换新鲜的含10%胎牛血清和100 U/mL(1%)双抗的培养基,置培养箱培养,24 h后用倒置荧光显微镜观察细胞绿色荧光表达情况并拍照。(见图4)。
实施例5:含有双硫键的阳离子型聚酰胺的细胞毒性的评价
(1)配置 10:1的RPMI 1640(无酚红)与 Alamar Blue混合液,充分混匀,预热至37 ºC;
(2)吸除孔板中的培养基,PBS冲洗细胞后,每孔加入500 μL上述混液,于培养箱中培养2 h ;
(3) 每孔吸取200μL上清液,按分组顺序依次加入一个新的96孔板;(4)将96孔板置于酶标仪上,以630 nm为参考波长,570 nm为试验波长,测定各孔吸光度;
(4)细胞存活率(%)=各组细胞吸光度/阴性对照组细胞吸光度×100% (见图5)。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于这里的实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!