人雌激素受体α亚型单克隆抗体杂交瘤细胞株、单克隆抗体、制备方法、应用与流程
本发明涉及生物技术领域,具体涉及人雌激素受体α亚型单克隆抗体杂交瘤细胞株、人雌激素受体α亚型单克隆抗体、制备方法、应用。
背景技术:
雌激素受体(estrogen receptor,ER)是一类甾类激素超家族的核受体,在人与动物体内通常介导雌激素的分泌作用。1967年,Jensen等在乳腺癌组织中首先发现了ER,1996年,Mosselman等在睾丸组织中发现了一种结构与之相似的核受体,现称之为ERβ亚型,并将前者称为ERα亚型,上述雌激素受体的两个亚型具有共同的结构框架,由三个独立但又相互影响的功能区构成:氨基末端(A/B区)、DNA结合区(C区)、羟基末端的配体结合区(D/E/F区)。雌激素受体与相应的配体结合,引起雌激素受体构型的改变,与相应的调节因子相互作用,进而雌激素受体与相应的应答基因结合,这一系列的过程都与这三个结构功能区密切相关。雌激素(17β-estradiol,E2)位于脑浆或胞核内,是雌激素受体的主要配体,具有转绿基子的作用。E2一旦与雌激素结合,就会发生变构形成二聚体,然后与雌激素受体反应元件(estrogen response element,ERE)集合,刺激靶基因转绿,从而调节雌激素促进细胞增生,分化和维持正常的生理功能。
作为其中的一个亚型,ERα受体主要分布在一些通常认为有雌激素效应的组织,如子宫、乳腺、胎盘、肝脏、中枢神经系统、心血管系统和骨组织、这些组织含有较多的ERα,可以诱导E2反应基因的表达,因此检测ERα在组织中的表达情况,被作为判断乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌、卵巢癌等 肿瘤细胞的标志之一。目前临床上主要通过免疫组织化学(IHC)的方法在实际病理检测当中针对肿瘤组织中ERα的表达情况进行检测,进而评价病理组织中雌激素水平的高低,为肿瘤细胞病变情况的诊断提供依据。因此上述方法中使用的ERα单克隆抗体的品质决定了整个检测结果的准确度,因此研制开发出一种特异性强、灵敏度高的人雌激素受体α亚型单克隆抗体,对于临床上针对乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌、卵巢癌等疾病的诊断具有重要的意义。
技术实现要素:
本发明的目的之一是提供人雌激素受体α亚型单克隆抗体杂交瘤细胞株,该细胞株能够稳定分泌特异性强、灵敏度高的人雌激素受体α亚型单克隆抗体。
本发明的目的之二是提供人雌激素受体α亚型单克隆抗体,该抗体与ERα特异性结合,与细胞内ERβ、PR、P53、AFP等蛋白无交叉反应。
本发明的目的之三是提供本发明人雌激素受体α亚型单克隆抗体在制备用于检测ERα蛋白的免疫检测工具中的应用,显著提高了ERα免疫检测的特异性、准确性和可靠性,真实反应肿瘤细胞内ERα蛋白的表达情况,可应用于对乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌、卵巢癌等相关肿瘤组织中ERα蛋白表达情况的检测。
本发明的目的之四是提供本发明人雌激素受体α亚型单克隆抗体在制备用于标记组织细胞的试剂或试剂盒中的应用。
本发明的目的之五是提供人雌激素受体α亚型单克隆抗体杂交瘤细胞株的制备方法。
为了实现以上目的,本发明所采用的技术方案是:
人雌激素受体α亚型单克隆抗体杂交瘤细胞株,由以下方法制备获得:依次包括以下操作步骤:ERα重组蛋白表达质粒的构建、ERα重组蛋白的表达与纯化、ER α重组蛋白免疫的小鼠脾脏细胞与骨髓瘤细胞融合、细胞筛选与克隆;其中细胞筛选与克隆的具体方法为:培养融合后的细胞,初步筛选出上清液中与ERα抗原呈现阳性反应的细胞,取初步筛选出的细胞的上清液,利用收集获得的ERα阳性组织蜡块,对初步筛选出的细胞的上清液进行免疫组化验证,筛选获得与ERα阳性组织蜡块的实际临床检测结果相符的细胞株,然后对该细胞株按照有限稀释法进行亚克隆,即得所述的人雌激素受体α亚型单克隆抗体杂交瘤细胞株。
上述免疫组化验证是指以初步筛选出的细胞上清液为一抗,对人乳腺癌组织细胞ERα阳性蜡块进行免疫检测。
所述ERα重组蛋白表达质粒的构建的具体方法为:根据人雌激素受体α亚型蛋白序列所对应的核苷酸序列,设计引物,扩增从第901bp至1788bp的基因序列,在基因序列两端分别引入限制性内切酶位点BamHI和XhoI,将扩增后的基因插入表达载体pET-28a中,即得所述的ERα重组蛋白表达质粒;其中人雌激素受体α亚型的核苷酸序列如SEQ ID NO.1所示,888bp;ERα蛋白序列如SEQ ID NO.2所示;所述引物的
上游引物序列:SEQ ID NO.3:CGCCATATGTCTAAGAAGAACAGC;
下游引物序列:SEQ ID NO.4:CCGGTGCTCTCAGACCGTGGCAGG。其中下划线表示基因插入位点。
所述ERα重组蛋白的表达与纯化的具体方法为:将ERα重组表达质粒转化E.coli细胞,筛选出阳性菌体,诱导后裂解离心收集上清液,将上清液经0.22μm滤器过滤,利用含2%咪唑的0.01M pH7.2的PBS过His纯化镍柱,清洗平衡,然后用不含咪唑的PBS平衡镍柱,将过滤后的上清液上样平衡后的镍柱,控制流速为0.5~1mL/min,然后经50mM、100mM、200mM、350mM、500mM咪唑进行梯度洗脱,分别收集洗脱馏分,进行凝胶电泳验证,筛选与ERα原核部分表达蛋白理论分 子量大小相同、条带单一的一组馏分,4℃条件下利用上述含2%咪唑的0.01M pH7.2的PBS过夜透析,即完成ERα重组蛋白的纯化。
所述将ERα重组表达质粒转染E.coli细胞,筛选出阳性菌体,诱导后裂解离心收集上清液的具体方法为:将重组质粒取10μL加入E.coil菌感受态细胞中,混匀后冰上放置30~50min,然后立即放入42℃水浴中热激90s,冰上静止3~5min,再加入0.8~1mL的LB无抗性培养液,37℃摇床摇45~60min,接种在含Kana抗生素的LB半固体培养板中,倒置放入37℃温箱中过夜培养12~14小时;挑取培养皿上的单克隆菌落与LB培养液中,37℃摇菌至OD值为0.6~0.8,加入IPTG诱导剂至终浓度1~1.5mM,37℃下诱导4h,离心收集菌体,超声破碎离心收集上清液。
所述ERα重组蛋白免疫的小鼠脾脏细胞由以下方法制备而得:取纯化后的ERα重组蛋白免疫小鼠,进行二次免疫,第二次免疫与第一次免疫间隔3周,第二次免疫后2周取尾血进行效价ELISA评价,取抗体效价较高的小鼠的脾脏细胞进行后续的细胞融合。
所述ERα重组蛋白免疫的小鼠脾脏细胞与骨髓瘤细胞融合的具体方法为:将免疫后的小鼠脾脏细胞进行研磨后与骨髓瘤细胞按照5~10:1的比例混匀、离心,37℃下用50%的PEG-4000融合,融合后加入RPMI-1640培养基终止,1200rpm条件下离心10min,利用含HAT的10%FBS培养基重悬后按照10~20万/孔的总细胞密度进行铺板,置于二氧化碳培养箱中培养。
初步筛选出上清液中与ERα抗原呈现阳性反应的细胞的具体方法为:待孔板上细胞团生长至可进行检测的数目时,按照200ng/孔的包被量,4℃条件下过夜包被ERα蛋白,第二日拍干后,每孔加入120~150μL的含5%BSA的PBST封闭液,置于37℃下孵育2h。后拍干,加入待检测的细胞培养上清,后面实验按照ELISA间接法检测上清中有无与ERα抗原反应的抗体,筛选保留与ERα有免疫反应的细胞株。
人雌激素受体α亚型单克隆抗体,由上述人雌激素受体α亚型单克隆抗体杂交瘤细胞株分泌制得。
上述人雌激素受体α亚型单克隆抗体,由以下方法制备而得:将人雌激素受体α亚型单克隆抗体杂交瘤细胞株进行体外细胞培养瓶中扩大培养,后植入小鼠腹腔,收集腹水,分离、纯化得人雌激素受体α亚型单克隆抗体;其中纯化的具体方法为:将分离后的待纯化腹水经过平衡完全的Protein G层析柱中,利用pH3.0的柠檬酸缓冲液进行洗脱,峰值处收集流出相,调整pH值至7.0~7.6之间,经0.01M pH 7.2的PBS透析收集即得到所述抗体。
所述纯化过程中腹水流经Protein G层析柱后的流速为0.5~1mL/min。
上述人雌激素受体α亚型单克隆抗体在制备用于检测人雌激素受体α亚型蛋白的免疫检测工具中应用。
所述免疫检测工具为试剂、试剂盒、芯片、试纸或磁微粒。
上述人雌激素受体α亚型单克隆抗体在制备用于标记组织细胞的试剂、试剂盒或芯片中的应用。
所述组织细胞为乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌或卵巢癌的组织细胞。
本发明人雌激素受体α亚型单克隆抗体杂交瘤细胞株,将初步筛选出的与ERα抗原呈现阳性反应的细胞,进一步的利用收集获得的人乳腺癌ERα阳性组织蜡块,对其进行免疫组化验证,筛选获得与人乳腺癌ERα阳性组织蜡块的临床预期符合的细胞株,该杂交瘤细胞株分泌人雌激素受体α亚型单克隆抗体与ERα蛋白特异性结合,而与细胞内其他蛋白无交叉反应,显著提高了ERα免疫检测的特异性、准确性和可靠性,真实反映肿瘤细胞内ERα蛋白表达情况,可用于乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌、卵巢癌或相关肿瘤组织中ERα表达情况的检 测。
进一步的,本发明人雌激素受体α亚型单克隆抗体杂交瘤细胞株的制备方法,在人ERα重组蛋白表达制粒的构建过程中,根据人雌激素受体α亚型蛋白序列所对应的核苷酸序列,设计引物,扩增从第901bp至1788bp的基因序列,提高杂交瘤细胞株制备和筛选过程的目的性,提高制备效率。
附图说明
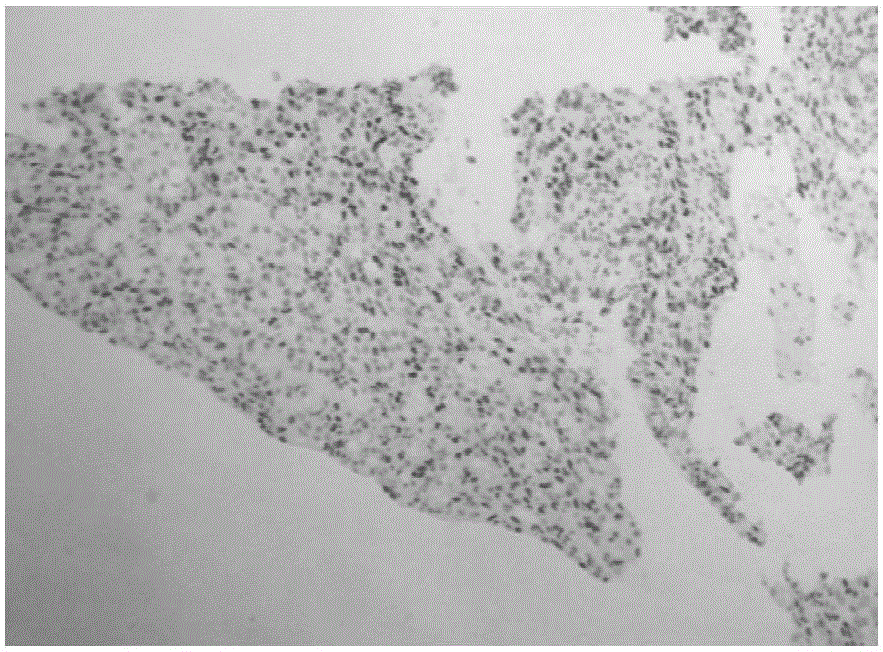
图1是以实施例2制备的抗体C3A8为一抗的人乳腺癌免疫组化结果图;
图2是以实施例2制备的抗体C3A8为一抗的人宫颈癌免疫组化结果图;
图3是以实施例2制备的抗体C3A8为一抗的人子宫内膜癌免疫组化结果图;
图4是以实施例2制备的抗体C3A8为一抗的人结肠癌免疫组化结果图;
图5是以实施例2制备的抗体C3A8为一抗的人扁桃体免疫组化结果图;
图6是以对比例制备的抗体C6H7为一抗的人扁桃体免疫组化结果图;
图7是以实施例2制备的抗体C3A8为一抗的人睾丸免疫组化结果图;
图8是以对比例制备的抗体C6H7为一抗的人睾丸免疫组化结果图;
图9是以实施例2制备的抗体C3A8为一抗的人肾上腺免疫组化结果图;
图10是以对比例制备的抗体C6H7为一抗的人肾上腺免疫组化结果图;
图11是以实施例2制备的抗体C3A8为一抗的人食管免疫组化结果图;
图12是以对比例制备的抗体C6H7为一抗的人食管免疫组化结果图;
图13是以实施例2制备的抗体C3A8为一抗的人小脑免疫组化结果图;
图14是以对比例制备的抗体C6H7为一抗的人小脑免疫组化结果图;
图15是以实施例2制备的抗体C3A8为一抗的人子宫平滑肌瘤免疫组化结果图;
图16是以对比例制备的抗体C6H7为一抗的人子宫平滑肌瘤免疫组化结果图。
具体实施方式
本发明公开了一种人雌激素受体α亚型单克隆抗体杂交瘤细胞株、人雌激素受体α亚型单克隆抗体和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
下面通过具体实施例对本发明的技术方案进行详细说明。
下述实施例中采用的试剂和原料均为市售商品。
实施例1
本实施例人雌激素受体α亚型单克隆抗体杂交瘤细胞株,由以下方法制备而得,具体操作步骤为:
1)构建ERα重组蛋白表达质粒:以从北京傲锐东源生物科技有限公司购得的质粒RC213277为模板,根据人雌激素受体α亚型的核苷酸序列(如SEQ ID NO.1所示),ERα蛋白序列(如SEQ ID NO.2所示),设计两条引物进行PCR扩增,分别引入酶切位点BamHI和XhoI,克隆ORF第901bp至1788bp到表达载体pET-28a,建立ERα重组蛋白表达质粒;克隆位点设计;所述引物的上游引物序列:SEQ ID NO.3:CGCCATATGTCTAAGAAGAACAGC;下游引物序列:SEQ ID NO.4:CCGGTGCTCTCAGACCGTGGCAGG;
2)ERα重组蛋白的表达与纯化:
A:转化E.coil细胞:将E.coil(BL-21)菌感受态从-80℃环境中取出,冰上拍打解冻,将ERα重组蛋白表达质粒取10μL加入感受态细胞中,混匀后冰上放置30~50min,后立即放入42℃水浴中热激90s,冰上静止3~5min,再加入0.8~1mL的LB培养液,37℃摇床摇45~60min,接种在含Kana抗生素的LB半固体培养板中, 倒置放入37℃温箱中过夜培养12~14小时;
B:裂解细胞:挑取培养皿上的单克隆菌落与LB培养液中,37℃摇菌至OD值为0.6~0.8,加入IPTG诱导剂至终浓度至1~1.5mM,诱导4h,离心收集菌体,超声破碎离心收集上清;
C:镍柱纯化:将收集的上清离心,将上清经0.22μm滤器过滤,利用含2%咪唑的0.01M pH 7.2的PBS过His纯化镍柱,清洗平衡,然后用不含咪唑的相同PBS平衡His纯化镍柱,将过滤后的上清液上样平衡后的镍柱,控制流速为0.5~1mL/min,然后经50mM、100mM、200mM、350mM、500mM咪唑进行梯度洗脱,分别收集洗脱馏分,进行凝胶电泳验证,筛选与ERα原核部分表达蛋白理论分子量大小相同、条带单一的一组馏分,4℃条件下利用上述含2%咪唑的0.01M pH7.2的PBS过夜透析,即完成ERα重组蛋白的纯化,紫外分光光度计下测量蛋白浓度,调整至1mg/mL;
3)ERα重组蛋白免疫的小鼠脾脏细胞与骨髓瘤细胞融合:
A:蛋白免疫:利用从北京博奥龙免疫技术有限公司购买的Quickantibody快免佐剂(五周)与步骤2)中纯化后的ERα重组蛋白按照体积1:1混合进行Balb/c小鼠(河南省动物实验中心)腿部肌肉免疫,依次进行两次免疫,第二次免疫与第一次免疫间隔3周,第二次免疫后2周取尾血进行效价ELISA评价,取抗体效价达到要求的小鼠进行细胞融合;
B:细胞融合:
取步骤A中抗体效价达到要求的小鼠的脾脏细胞进行研磨后与SP2/0细胞数目按照5~10:1的比例关系混匀、离心,37℃下用50%的PEG-4000融合,融合后加入RPMI-1640培养基终止,1200rpm条件下离心10min,利用含HAT的10%FBS培养基重悬后按照10~20万/孔的总细胞密度进行铺板,置于二氧化碳培养箱中培养;
4)细胞筛选与克隆:
待步骤3)中孔板上融合细胞团生长至可进行检测的数目时,按照200ng/孔的包被量,4℃条件下过夜包被ERα抗原,利用ELISA间接法进行检测细胞上清中有无与ERα抗原反应的抗体,初步筛选保留与ERα有免疫反应的细胞;取初步筛选出的细胞的上清液,利用收集获得的人乳腺癌ERα阳性组织蜡块,对初步筛选出的细胞的上清液进行免疫组化验证,筛选获得与人组织细胞ERα阳性组织蜡块的实际临床检测结果相符细胞株,然后对该细胞株按照有限稀释法进行亚克隆,即得所述的人雌激素受体α亚型单克隆抗体杂交瘤细胞株,命名为C3A8。
实施例2
本实施例人雌激素受体α亚型单克隆抗体,由以下方法制备而得,具体操作步骤为:
1)腹水制备:取实施例1制备的人雌激素受体α亚型单克隆抗体杂交瘤细胞株进行扩大培养,待收集获得100~200万细胞后,植入预先已注入石蜡油的小鼠腹腔,适时收集获得腹水,然后将腹水经过5000rpm,2min离心分离去除红细胞和上层石蜡油,并按照1:1体积比计入0.01M pH7.2的PBS稀释分离纯化后的腹水;
2)抗体纯化:将Protein G柱利用上述PBS平衡,然后通过上样环将步骤1)纯化后的腹水加入平衡后的Protein G柱上,流速调至0.5~1mL/min,待上样结束后,利用pH 3.0的柠檬酸缓冲液进行洗脱,峰值处收集流出相,利用pH 8.0Tris缓冲液接收峰值处流出的抗体蛋白,调整pH值至7.0~7.6之间,经0.01M pH 7.2的PBS透析收集即得人雌激素受体α亚型单克隆抗体,命名为C3A8抗体。
对比例
该对比例人雌激素受体α亚型单克隆抗体杂交瘤细胞株为《生物技术通讯》Vol.26 No.2Mar,2015刊登名称为《雌激素受体α型抗体的制备及临床应用研究》,作者为刘玲玲、翟晋豫、齐华,的论文中记载的分泌抗体C6H7的杂交瘤细胞株。
试验例1
取相同数目实施例1制备的人雌激素受体α亚型单克隆抗体杂交瘤细胞株与对比例制备的人雌激素受体α亚型单克隆抗体杂交瘤细胞株在相同条件下培养分泌抗体,通过ELISA间接法检测对两者分泌抗体的能力和抗体效价进行检测,结果如下表1所示:
表1
由上述表1所示的结果可知,本发明实施例1制备的杂交瘤细胞株分泌抗体能力强,分泌的抗体效价明显高于对比例制备的杂交瘤细胞株。
试验例2本发明实施例2制备的人雌激素受体α亚型单克隆抗体C3A8抗体的特异性和灵敏性检测
试验方法:取人雌激素受体α亚型单克隆抗体与ERβ、PR、P53、AFP、ERα蛋白进行交叉反应验证,采用间接ELISA检测(波长450nm,参考波长630nm),试验组采用实施例2制备的C3A8抗体,对照组采用市售的徕卡6F11抗体,检测结果如下表2所示:
表2 C3A8抗体与各抗原交叉反应结果
由上述表2所示的结果可知,本发明人雌激素受体α亚型单克隆抗体与ERα蛋白特异性结合,而与细胞内其他蛋白无交叉反应,显著提高了ERα免疫检测的特异性、准确性和可靠性。
试验例2本发明实施例2制备的单克隆抗体C3A8抗体为一抗的免疫组化检测
1、试验方法:具体操作步骤如下:
(1)取由河南省人民医院收集获得的乳腺癌ERα阳性蜡块,置于-20℃冰箱中低温放置30~60min,使用Leica组织切片机进行切片,组织厚度3μm,置于粘附载玻片上;
(2)烤片:将切片获得的粘附载玻片置于60℃烘片机中烤片20min;
(3)脱蜡:将步骤2处理后的切片置于二甲苯I、二甲苯II中各10min;二甲苯I、II均为分析纯二甲苯;
(4)洗二甲苯:将切片分别置于分析纯无水乙醇I、II各5min,95%浓度、80%浓度、70%浓度、50%浓度乙醇中各5min;
(5)抗原修复:将抗原修复液预热,并将洗二甲苯后的切片放入其中,加热20min。后至室温约30℃;去离子水洗涤浸泡5min,洗涤一次;
(6)内源性过氧化物酶封闭:用Leica试剂过氧化物酶封闭剂中和切片组织内源性过氧化物酶5min,TBS洗涤(冲洗浸泡)10min;
(7)蛋白封闭剂封闭:利用Leica试剂蛋白封闭剂封闭切片组织孵育5min,TBS洗涤(冲洗浸泡)10min;
(8)一抗:加C3A8抗体(1:500比例稀释),37℃孵育60min,TBS洗涤(冲洗浸泡)10min;
(9)二抗:加leica的NovoLink聚合物(二抗)孵育30min,TBS洗涤(冲洗浸泡)10min;
(10)DAB显色:利用leica中DAB(1:20比例配置)显色5min,利用去离子水冲洗浸泡5min;
(11)苏木精复染:利用Leica中的苏木精复染5min,利用去离子水冲洗浸泡5min;
(12)脱水与透明:依次经过50%、70%、80%、95%浓度的乙醇及无水乙醇I、II各2min,二甲苯II、I各2min;
(13)封闭:待切片组织二甲苯挥发完毕后,利用中性树胶封片,置于镜下观察,如图1所示。
按照上述同样的方法分别取由河南省人民医院收集获得的人宫颈癌ERα阳性蜡块、子宫内膜癌ERα阳性蜡块、人结肠癌ERα阳性蜡块,进行免疫组化检测,结果如图2、图3、图4所示。
2、实验结果:
由图2-5所示,在人乳腺癌、子宫内膜癌、胃癌、宫颈癌组织中可以见到特异性细胞质与核染色,结果与ERα在细胞内的定位及组织表达一致,表明实施例2制备的C3A8抗体可用于免疫组织化学检测ERα细胞内表达水平。
上述试验结果也表明本发明制备的上述人雌激素受体α亚型单克隆抗体可用于制备用于检测人雌激素受体α亚型蛋白的剂、试剂盒、芯片、试纸或磁微粒等免疫检测工具。同样的也可用于制备用于标记乳腺癌、肺癌、胃癌、结肠癌、宫颈癌、子宫肌瘤、膀胱癌或卵巢癌等组织细胞的试剂、试剂盒或芯片。
试验例3免疫组化对比验证试验
试验方法:按照试验例2所述的免疫组化检测方法分别以实施例2制备的抗体C3A8和对比例所述的抗体C6H7为一抗,对河南省人民医院收集获得的扁桃体ERα阳性蜡块、睾丸ERα阳性蜡块、肾上腺ERα阳性蜡块、食管ERα阳性蜡块、小 脑ERα阳性蜡块、子宫平滑肌瘤ERα阳性蜡块,进行免疫组化对比检测,结果如图5~图16所示,由图中的同一组织顺序切片免疫组化结果可知,C6H7抗体免疫组化结果的一组中均不同程度出现了非特异染色,即在非阳性部位外(细胞膜、细胞质)出现了染色。由此可知,实施例2制备的抗体C3A8在扁桃体、睾丸、肾上腺、食管、小脑、子宫平滑肌瘤组织中与ERα在细胞内的定位及组织表达一致,无非特异性结合,而对比例所述的抗体C6H7出现了非特异性结合,表明本发明制备人雌激素受体α亚型单克隆抗体杂交瘤细胞株分泌抗体的特异性明显优于对比例所述杂交瘤细胞株分泌抗体的特异性。
- 还没有人留言评论。精彩留言会获得点赞!
- 作为AXL抑制剂的杂环化合物的制作方法与工艺
- HPTP‑β抑制剂的制作方法与工艺
- 作为LSD1抑制剂的环丙胺的制作方法与工艺
- KRAS G12C的抑制剂的制作方法与工艺
- 调节雌激素受体突变体的方法和组合物与流程
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 新型雌激素相关受体α抑制剂及其医学用途的制作方法与工艺
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗骨质疏松药物中的应用
- 鉴定嗅觉受体调节剂的方法
- 用于治疗局部晚期或转移性雌激素受体阳性乳腺癌的雌激素受体调节剂的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的组合物在抗骨质疏松药物中的应用
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受体调节剂的晶形的制作方法
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法