一种高精氨酸混合肽的制备方法及其在乳腺癌治疗中的应用与流程
本发明涉及一种高精氨酸混合肽的制备方法及其在乳腺癌治疗中的应用,具体涉及一种以核桃粕、蛋清蛋白为原料制备富含精氨酸的混合肽的方法及其在乳腺癌治疗中的应用。
背景技术:
癌症是恶性肿瘤的统称,特点是机体细胞失去正常的调节控制,过度增殖,同时有不同程度的分化障碍,并常侵犯邻近组织或转移到远离部位。它严重威胁全人类健康,位居非正常死亡原因之首。世界卫生组织(who)2014年发布的《全球癌症报告》显示,2012年中国的新增癌症病例高居全球第一位。2015年,国家卫计委、国家发改委等16个部门联合发布的《中国癌症防治三年行动计划(2015-2017年)》中明确指出,我国的癌症防治要以最高发、危害最大的8项癌症为重点,而乳腺癌即是我国八大癌之一,为女性常发癌之一。
针对恶性肿瘤,传统的治疗方法包括手术切除、化疗、放疗等。这些方法在一定程度上起到了治疗肿瘤的作用,但一旦发生癌细胞局部扩散或潜在转移,治疗往往以失败告终。且这些传统疗法不可避免地会对人体正常细胞、自身免疫系统造成不同程度的伤害,引起呕吐、食欲不振、头痛失眠、脱发溃疡、糜烂发炎、血象下降等不良反应,病人常因身体难以承受而无法继续接受治疗,严重影响癌症患者生存质量。
现代科学研究发现,许多天然生物活性肽对抑制肿瘤细胞增殖和转移具有良好功效,且选择性高、毒副作用小。这些活性肽通过诱导肿瘤分化、抑制肿瘤细胞生长、抑制肿瘤新生血管生成、提高肿瘤细胞对药物的敏感性、降低化疗损伤、增强药物对肿瘤细胞的杀伤力、干扰肿瘤细胞dna合成、提高机体免疫力等作用达到治疗或辅助治疗恶性肿瘤的目的。近年来不断有研究证实,增量精氨酸对肿瘤细胞的抑制及诱导凋亡作用显著。肿瘤细胞中多胺代谢活跃,多胺是其迅速分裂、增殖必需物质,增量精氨酸能通过抑制鸟氨酸脱羧酶活性来抑制多胺的生物合成,从而抑制癌细胞增殖;精氨酸经一氧化氮合酶作用后生成no,no可阻断肿瘤细胞的能量代谢和dna复制,或者引起肿瘤细胞dna损伤,从而抑制肿瘤细胞的生长或引起肿瘤细胞死亡;同时,no可抑制细胞黏附分子的表达,从而阻止细胞的黏附,在肿瘤细胞脱离原发组织,转移至其它部位形成新病灶的过程中,这些黏附分子起着重要作用;此外,精氨酸还能增加t淋巴细胞的产生和功能,增加体内白介素il-2的生成及其受体表达,调节和激活体内巨噬细胞活性,从而提高肿瘤宿主自身免疫力。国外已有研究开始尝试对癌症患者采用不平衡氨基酸疗法,通过调整肿瘤宿主体内某些氨基酸的含量,干扰肿瘤细胞的代谢和功能,进而抑制肿瘤的生长或诱导其凋亡。另有报道称,富含精氨酸等亲水性氨基酸的亲水性多肽,可通过静电吸引方式,特异性作用于肿瘤细胞,导致细胞膜迅速破裂,细胞内容物渗漏,最终引起细胞死亡;也有研究称多肽分子结构中的碱性氨基酸(精氨酸、赖氨酸等)对其抗肿瘤活性有一定影响。这些都为本发明所述的高精氨酸混合肽的抑癌功效提供了坚实的理论基础。
核桃粕是核桃加工副产品,蛋白质消化率高、氨基酸含量丰富且种类齐全,但在我国主要用于饲料工业,深度加工不够而造成资源贬值;鸡蛋清蛋白不仅富含人体8种必需氨基酸,且组成与人体蛋白的氨基酸组成接近,人对其消化利用率极高。本发明首次使用来自鸡蛋和核桃的动、植物混合蛋白为原料,通过超高压-超声-微波辅助酶解、表面分子印迹膜分离纯化等手段,制备富含精氨酸的活性混合肽,并将其应用于乳腺癌治疗,在对患者进行营养补充的同时抑制癌细胞增殖,有效改善乳腺癌患者的生存质量。与之相关的应用研究至今未见报道。
技术实现要素:
本发明要解决的技术问题是提供一种新颖的高精氨酸混合肽的制备方法及其在肝癌治疗中的应用。该混合肽富含精氨酸,具有较强的抑制乳腺癌细胞增殖的作用。
为了解决上述技术问题,本发明提供了如下技术方案:
一种高精氨酸混合肽的制备方法,所述制备方法包括如下步骤:
(1):将经脱脂粉碎的核桃粕、鸡蛋清蛋白与水混匀,搅拌后超高压预处理,随后超声波-微波辅助酶解,酶解结束后升温灭酶,板框压滤收集清液;
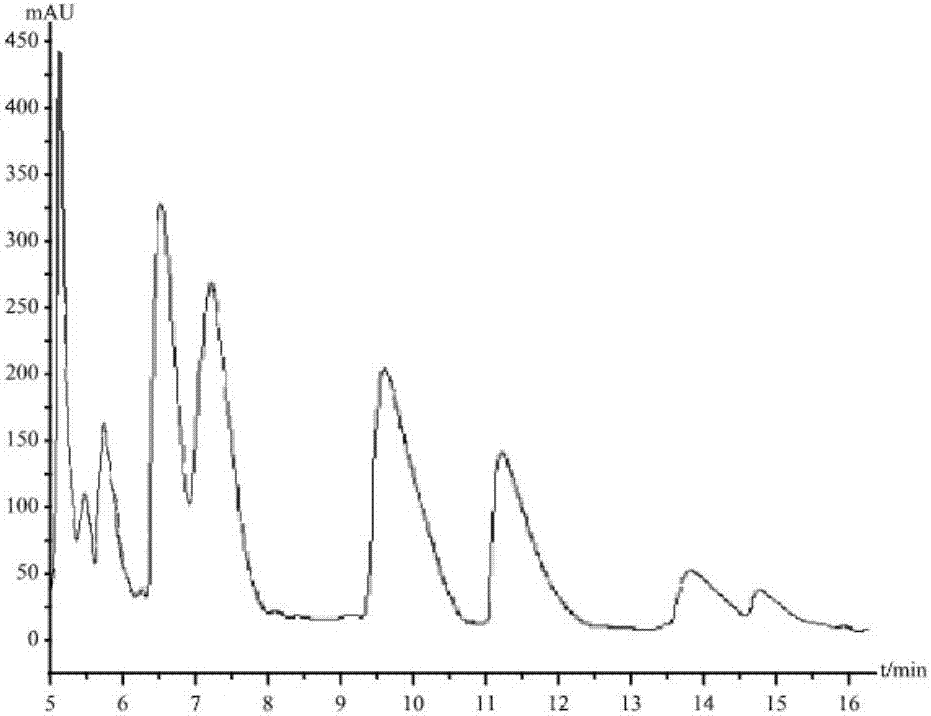
(2):清液冻干后,利用反相高效液相色谱法(rp-hplc)对冻干粗粉中的目标肽段进行分离。采用everestc18(4.6×250mm,5μm,238ev54)作为反相柱,乙腈水溶液作为流动相,三氟乙酸作为阴离子对试剂,检测波长214nm,上样前纯乙腈冲洗色谱柱,流动相溶解25mg冻干粉定容至25ml,0.45μm微孔滤膜过滤,进样体积20μl,柱温30℃,分离条件为乙腈浓度18%(v/v),三氟乙酸浓度0.09%(v/v),流速1.0ml/min,保留时间为9.64min、11.36min、13.80min,收集三个洗脱组分,冻干后即为高精氨酸混合肽粉;
优选地,所述高精氨酸混合肽的制备方法还包括表面印迹膜分离富集高精氨酸混合肽的步骤,所述步骤为:
(3):用piranha溶液(体积比3:1的浓硫酸和30%双氧水)浸没盖玻片和载玻片,超声清洗1.5~2.5h后,纯水洗净,氮气吹干待用;将洗净的盖玻片浸泡于高精氨酸混合肽水溶液中以获得混合肽固定化模板;将洗净的载玻片浸泡于0.5~1.5%(v/v)3-氨丙基三乙氧基硅烷(aptes)的甲醇溶液中,20~40rpm振荡15~45min后,甲醇漂洗晾干,获得硅烷化载玻片;将功能单体丙烯酸(aa)、甲基丙烯酸(maa),交联剂三乙二醇二甲基丙烯酸酯(tegdma)混匀,加入光引发剂异丙基硫杂蒽酮(itx)获得预聚混合液;向预聚混合液中通入氮气后将其平铺于硅烷化载玻片表面,载玻片经旋转后将混合肽固定化模板覆于其上,紫外光引发聚合完成后,将玻片浸泡于8~12%(m/v)sds:8~12%(v/v)hac溶液中,揭去盖玻片,80~160rpm振荡4~8h后,纯水振荡漂洗至中性,获得高精氨酸混合肽表面印迹膜;
(4):将步骤(3)获得的高精氨酸混合肽表面印迹膜浸没于步骤(1)获得的清液中,20~40rpm振荡1~6h后取出吸附了目标肽的印迹膜,浸没于0.6~2mol/lnacl溶液中,同时100~300w超声10~50min辅助洗脱;收集洗脱液,通过阳离子交换树脂去除nacl,透过液经低温喷雾干燥获得高精氨酸混合肽粉末;洗脱后的表面印迹膜经纯水漂洗,再次浸没于步骤(1)获得的新的清液中,重复后续步骤,用于分离高精氨酸混合肽。
优选地,步骤(1)中,将经脱脂粉碎的核桃粕与鸡蛋清蛋白按质量比2.5~6.5:1混合,将此蛋白粕混合物与水按质量体积比1:3~16混匀,室温搅拌1.5~2.5h后置于超高压主机系统中,处理压力200~600mpa,保压时间10~30min,获得经超高压预处理的混悬液;将混悬液控温至40~60℃,调ph至9~10,加入混悬液质量1.5%~6.5%的碱性蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率200~400w,超声时间10~20min,微波功率200~600w,微波时间5~15min,酶解1.5~2.5h后调ph至6~8,加入混悬液质量1.5%~6.5%的木瓜蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率200~400w,超声时间10~20min,微波功率200~600w,微波时间5~15min,酶解2~3h后升温灭酶,板框压滤后收集清液。
优选地,步骤(3)中,将洗净的盖玻片浸泡于2~10g/l高精氨酸混合肽水溶液中,20~40rpm振荡4~8h后,纯水漂洗晾干,获得混合肽固定化模板。
优选地,步骤(3)中,将功能单体丙烯酸(aa)、甲基丙烯酸(maa),交联剂三乙二醇二甲基丙烯酸酯(tegdma)按体积比1~3.5:0.5~2:4~11混匀,加入0.2~0.8体积1~4mmol/l的异丙基硫杂蒽酮(itx)的丙酮溶液作为光引发剂,获得预聚混合液。
优选地,步骤(3)中,向预聚混合液中通入氮气20~40min后,将其平铺在固定于旋转机上的硅烷化载玻片表面,旋转机100~400rpm旋转2~10s后,将混合肽固定化模板覆盖于载玻片上,365nm紫外光引发聚合3~6h。
优选地,步骤(4)中,高精氨酸混合肽表面印迹膜重复吸附-洗脱过程10次以上。
本发明还提供一种高精氨酸混合肽,所述高精氨酸混合肽通过上述制备方法制备。
优选地,所述混合肽中精氨酸含量在18%以上。
本发明还提供经上述制备方法得到的高精氨酸混合肽在制备与乳腺癌治疗相关的保健食品、特殊膳食用食品、普通食品及药品中的应用。
本发明的有益效果如下:
从功效角度考虑,本发明制备的高精氨酸混合肽,能明显抑制人乳腺癌细胞的增殖,藉由控制肿瘤的生长来延缓乳腺癌的恶化;癌症患者面临的一个主要问题是营养障碍,本发明制备的混合肽,有助于减轻肠道消化过程中游离氨基酸相互竞争共同吸收位点而产生的吸收抑制,大量科学研究已证实,当以肽形式作为氮源时,整体蛋白质沉积高于相应的游离氨基酸摄入或完整蛋白质摄入。本发明所述高精氨酸混合肽,在对患者进行营养补充的同时抑制癌细胞增殖,可有效改善乳腺癌患者的生存质量。
从安全角度考虑,在《gb29922-2013食品安全国家标准特殊医学用途配方食品通则》中规定,不得使用非食用的动植物水解原料作为单体氨基酸的来源,本发明制备的高精氨酸混合肽来源于核桃、鸡蛋等天然食材,符合现今推崇的天然健康的营养理念;而水解用酶亦符合《gb2760-2014食品安全国家标准食品添加剂使用标准》中的相关规定。
从制备角度考虑,本发明的制备方法条件温和,涉及仪器均为食药行业常用设备;表面印迹膜吸附-洗脱效果佳,重复利用率高;所述制备方法有利于降低生产成本,极具扩大化生产潜力,有助于加速实现产品的工业化量产。
附图说明
图1为本发明高精氨酸混合肽制备流程图;
图2为本发明高精氨酸混合肽高效液相色谱图;
图3为本发明高精氨酸混合肽表面印迹膜制备示意图;
图4为本发明高精氨酸混合肽固定化模板原子力显微镜图;
图5为本发明高精氨酸混合肽表面印迹膜扫描电镜图;
图6为本发明高精氨酸混合肽表面印迹膜重复利用性。
具体实施方式
以下通过具体的实施例进一步说明本发明,但以下实施例仅用于说明本发明而非用于限制本发明。
实施例1:
本发明所述高精氨酸混合肽的制备方法,包括以下步骤:
1、将经脱脂、粉碎的核桃粕与鸡蛋清蛋白按质量比4:1混合,将此蛋白粕混合物与水按质量体积比1:8混匀,室温搅拌2h后置于超高压主机系统中,处理压力400mpa,保压时间20min,获得经超高压预处理的混悬液;将混悬液控温至50℃,调ph至9,加入混悬液质量3.5%的碱性蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率300w,超声时间12min,微波功率400w,微波时间8min,酶解2h后调ph至7,加入混悬液质量3.5%的木瓜蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率300w,超声时间15min,微波功率400w,微波时间10min,酶解2.5h后升温灭酶,板框压滤后收集清液。其蛋白质含量为93.6%,肽含量为88.5%;
2、清液冻干后,利用反相高效液相色谱法(rp-hplc)对冻干粗粉中的目标肽段进行分离。采用everestc18(4.6×250mm,5μm,238ev54)作为反相柱,乙腈水溶液作为流动相,三氟乙酸作为阴离子对试剂,检测波长214nm,上样前纯乙腈冲洗色谱柱,流动相溶解25mg冻干粉定容至25ml,0.45μm微孔滤膜过滤,进样体积20μl,柱温30℃,分离条件为乙腈浓度18%(v/v),三氟乙酸浓度0.09%(v/v),流速1.0ml/min,保留时间为9.64min、11.36min、13.80min,收集三个洗脱组分,冻干后即为高精氨酸混合肽粉,目标肽含量占粗粉23.6%;
3、用piranha溶液(体积比3:1的浓硫酸和30%双氧水)浸没玻片(盖玻片和载玻片),超声清洗2h后,纯水洗净,氮气吹干待用;将洗净的盖玻片浸泡于5g/l高精氨酸混合肽水溶液中,20rpm振荡6h后,纯水漂洗晾干,获得混合肽固定化模板;将洗净的载玻片浸泡于1%(v/v)3-氨丙基三乙氧基硅烷(aptes)的甲醇溶液中,20rpm振荡30min后,甲醇漂洗晾干,获得硅烷化载玻片;将功能单体丙烯酸(aa)、甲基丙烯酸(maa),交联剂三乙二醇二甲基丙烯酸酯(tegdma)按体积比2:1:7混匀,加入0.5体积2.5mmol/l的异丙基硫杂蒽酮(itx)的丙酮溶液作为光引发剂,获得预聚混合液;向预聚混合液中通入氮气30min后,将其平铺在固定于旋转机上的硅烷化载玻片表面,旋转机200rpm旋转4s后,将混合肽固定化模板覆盖于载玻片上,365nm紫外光引发聚合4h;将聚合完成后的玻片浸泡于10%(m/v)sds:10%(v/v)hac溶液中,揭去盖玻片,120rpm振荡6h后,纯水振荡漂洗至中性,获得高精氨酸混合肽表面印迹膜;
4、将步骤3获得的高精氨酸混合肽表面印迹膜浸没于步骤1获得的清液中,20rpm振荡4h后取出吸附了目标肽的印迹膜,浸没于1mol/lnacl溶液中,同时200w超声30min辅助洗脱,洗脱液通过阳离子交换树脂去除nacl,透过液经低温喷雾干燥获得高精氨酸混合肽粉末。表面印迹膜吸附率为80.5%(见表1),喷雾干燥获得的混合肽中精氨酸含量为21.3%(见表2);洗脱后的表面印迹膜经纯水漂洗,再次浸没于步骤1获得的新的清液中,重复后续步骤,用于分离高精氨酸混合肽,20次重复利用,再生率为91.1%(见图6);
5、采用高效液相色谱法测定表面印迹膜对板框压滤后清液中目标肽的吸附率,平行测定三次,计算公式为:吸附率(%)=洗脱液中目标肽含量/清液中目标肽含量×100%,结果见表1:
表1高精氨酸混合肽表面印迹膜吸附率
高精氨酸混合肽表面印迹膜经吸附-洗脱-再吸附过程,重复利用20次后,其吸附量由最初的7.38mg/g降至6.72mg/g,再生率达91.1%,显示出极佳的重复利用性。
6、采用氨基酸分析仪对高精氨酸混合肽酸解后各氨基酸含量进行检测,结果见表2:
表2高精氨酸混合肽氨基酸分析结果
注:酸解后色氨酸、天冬酰胺、谷氨酰胺被破坏。
实施例2:
本发明所述混合肽的制备方法,包括以下步骤:
1、将经脱脂、粉碎的核桃粕与鸡蛋清蛋白按质量比3:1混合,将此蛋白粕混合物与水按质量体积比1:6混匀,室温搅拌1.5h后置于超高压主机系统中,处理压力300mpa,保压时间15min,获得经超高压预处理的混悬液;将混悬液控温至50℃,调ph至9,加入混悬液质量3%的碱性蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率200w,超声时间15min,微波功率300w,微波时间10min,酶解1.5h后调ph至7,加入混悬液质量3%的木瓜蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率200w,超声时间18min,微波功率300w,微波时间12min,酶解2h后升温灭酶,板框压滤后收集清液。其蛋白质含量为90.3%,肽含量为81.7%;
2、清液冻干后,利用反相高效液相色谱法(rp-hplc)对冻干粗粉中的目标肽段进行分离。采用everestc18(4.6×250mm,5μm,238ev54)作为反相柱,乙腈水溶液作为流动相,三氟乙酸作为阴离子对试剂,检测波长214nm,上样前纯乙腈冲洗色谱柱,流动相溶解25mg冻干粉定容至25ml,0.45μm微孔滤膜过滤,进样体积20μl,柱温30℃,分离条件为乙腈浓度18%(v/v),三氟乙酸浓度0.09%(v/v),流速1.0ml/min,保留时间为9.64min、11.36min、13.80min,收集三个洗脱组分,冻干后即为高精氨酸混合肽粉,目标肽含量占粗粉19.8%;
3、用piranha溶液(体积比3:1的浓硫酸和30%双氧水)浸没玻片(盖玻片和载玻片),超声清洗1.5h后,纯水洗净,氮气吹干待用;将洗净的盖玻片浸泡于3g/l高精氨酸混合肽水溶液中,30rpm振荡4h后,纯水漂洗晾干,获得混合肽固定化模板;将洗净的载玻片浸泡于0.8%(v/v)3-氨丙基三乙氧基硅烷(aptes)的甲醇溶液中,30rpm振荡18min后,甲醇漂洗晾干,获得硅烷化载玻片;将功能单体丙烯酸(aa)、甲基丙烯酸(maa),交联剂三乙二醇二甲基丙烯酸酯(tegdma)按体积比1.5:0.8:7混匀,加入0.3体积3mmol/l的异丙基硫杂蒽酮(itx)的丙酮溶液作为光引发剂,获得预聚混合液;向预聚混合液中通入氮气20min后,将其平铺在固定于旋转机上的硅烷化载玻片表面,旋转机100rpm旋转6s后,将混合肽固定化模板覆盖于载玻片上,365nm紫外光引发聚合5h;将聚合完成后的玻片浸泡于8%(m/v)sds:8%(v/v)hac溶液中,揭去盖玻片,160rpm振荡4h后,纯水振荡漂洗至中性,获得高精氨酸混合肽表面印迹膜;
4、将步骤3获得的高精氨酸混合肽表面印迹膜浸没于步骤1获得的清液中,30rpm振荡5h后取出吸附了目标肽的印迹膜,浸没于0.8mol/lnacl溶液中,同时100w超声40min辅助洗脱,洗脱液通过阳离子交换树脂去除nacl,透过液经低温喷雾干燥获得高精氨酸混合肽粉末。表面印迹膜吸附率为71.3%,20次重复利用再生率为84.2%,喷雾干燥获得的混合肽中精氨酸含量为18.9%。
实施例3:
本发明所述混合肽的制备方法,包括以下步骤:
1、将经脱脂、粉碎的核桃粕颗粒与鸡蛋清蛋白按质量比5:1混合,将此蛋白粕混合物与水按质量体积比1:10混匀,室温搅拌2.5h后置于超高压主机系统中,处理压力500mpa,保压时间25min,获得经超高压预处理的混悬液;将混悬液控温至50℃,调ph至9,加入混悬液质量4%的碱性蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率400w,超声时间20min,微波功率500w,微波时间5min,酶解2.5h后调ph至7,加入混悬液质量4%的木瓜蛋白酶并搅拌均匀,同时超声波-微波辅助酶解,超声功率400w,超声时间20min,微波功率500w,微波时间8min,酶解3h后升温灭酶,板框压滤后收集清液。其蛋白质含量为92.1%,肽含量为84.7%;
2、清液冻干后,利用反相高效液相色谱法(rp-hplc)对冻干粗粉中的目标肽段进行分离。采用everestc18(4.6×250mm,5μm,238ev54)作为反相柱,乙腈水溶液作为流动相,三氟乙酸作为阴离子对试剂,检测波长214nm,上样前纯乙腈冲洗色谱柱,流动相溶解25mg冻干粉定容至25ml,0.45μm微孔滤膜过滤,进样体积20μl,柱温30℃,分离条件为乙腈浓度18%(v/v),三氟乙酸浓度0.09%(v/v),流速1.0ml/min,保留时间为9.64min、11.36min、13.80min,收集三个洗脱组分,冻干后即为高精氨酸混合肽粉,目标肽含量占粗粉21.9%;
3、用piranha溶液(体积比3:1的浓硫酸和30%双氧水)浸没玻片(盖玻片和载玻片),超声清洗2.5h后,纯水洗净,氮气吹干待用;将洗净的盖玻片浸泡于4g/l高精氨酸混合肽水溶液中,40rpm振荡8h后,纯水漂洗晾干,获得混合肽固定化模板;将洗净的载玻片浸泡于1.2%(v/v)3-氨丙基三乙氧基硅烷(aptes)的甲醇溶液中,40rpm振荡40min后,甲醇漂洗晾干,获得硅烷化载玻片;将功能单体丙烯酸(aa)、甲基丙烯酸(maa),交联剂三乙二醇二甲基丙烯酸酯(tegdma)按体积比3:1.5:8混匀,加入0.6体积4mmol/l的异丙基硫杂蒽酮(itx)的丙酮溶液作为光引发剂,获得预聚混合液;向预聚混合液中通入氮气40min后,将其平铺在固定于旋转机上的硅烷化载玻片表面,旋转机300rpm旋转3s后,将混合肽固定化模板覆盖于载玻片上,365nm紫外光引发聚合6h;将聚合完成后的玻片浸泡于10%(m/v)sds:8%(v/v)hac溶液中,揭去盖玻片,140rpm振荡8h后,纯水振荡漂洗至中性,获得高精氨酸混合肽表面印迹膜;
4、将步骤3获得的高精氨酸混合肽表面印迹膜浸没于步骤1获得的清液中,40rpm振荡6h后取出吸附了目标肽的印迹膜,浸没于1.2mol/lnacl溶液中,同时300w超声20min辅助洗脱,洗脱液通过阳离子交换树脂去除nacl,透过液经低温喷雾干燥获得高精氨酸混合肽粉末。表面印迹膜吸附率为77.5%,20次重复利用再生率为88.0%,喷雾干燥获得的混合肽中精氨酸含量为20.4%。
实施例4:采用mtt法评价高精氨酸混合肽对人乳腺癌细胞增殖的抑制作用
1、仪器与材料
metertech∑960酶标仪为台湾metertech公司产品;(mco-15ac)co2细胞培养箱为日本三洋公司公司产品;1300seriesa2生物安全柜为美国thermofisher公司产品;tdl-50b低速台式离心机为上海安亭科学仪器厂产品;d-1型自动蒸汽灭菌锅为北京发恩科贸有限公司产品。
人乳腺癌mcf-7细胞购自中国科学院细胞库;rpmi-1640培养基购自美国gibco公司;胎牛血清购自天津市川页生化制品有限公司;细胞增殖及细胞毒性检测试剂盒(mtt)购自上海翊圣生物科技有限公司;高精氨酸混合肽为实施例1制备所得。
2、实验方法
取对数生长期的人乳腺癌mcf-7细胞,配成5×104个/ml浓度的单细胞悬液接种于96孔板中,100μl/孔,置于37℃、5%co2培养箱中培养24h贴壁后弃培养液。设对照组和实验组,实验组分别加入实施例1制备得到的不同浓度的高精氨酸混合肽(10mg/ml、15mg/ml和20mg/ml,用rpmi-1640培养基稀释),对照组加入等体积rpmi-1640培养基。培养24h后加入mtt工作液(5mg/ml、10μl/孔),4h后沿培养液上部吸去100μl上清液,加入100μl甲臜溶解液,继续培养4h后用酶标仪测定吸光度(波长570nm),计算高精氨酸混合肽对细胞增殖的抑制率,每组设4个重复孔。
抑制率(%)=(对照组a570—实验组a570)/对照组a570×100%
3、实验结果
由表3可知,3个不同浓度(10mg/ml、15mg/ml和20mg/ml)的高精氨酸混合肽作用mcf-7细胞后,对mcf-7细胞的增殖均具有明显的抑制,并且随着混合肽浓度增加,抑制率也随之增加。
表3高精氨酸混合肽对人乳腺癌mcf-7细胞的抑制率(n=4,
4、实验结论
本发明高精氨酸混合肽具有较强的抑制乳腺癌细胞增殖的作用,且在一定浓度范围内呈剂量依赖性。
应该理解,尽管参考其示例性的实施方案,已经对本发明进行具体地显示和描述,但是本领域的普通技术人员应该理解,在不背离由权利要求所定义的本发明的精神和范围的条件下,可以在其中进行各种形式和细节的变化,可以进行各种实施方案的任意组合。
- 还没有人留言评论。精彩留言会获得点赞!