一种生产高活性物质酵母自溶物的自溶工艺方法及由此制得的酵母产品与流程
本发明涉及酵母自溶
技术领域:
。
背景技术:
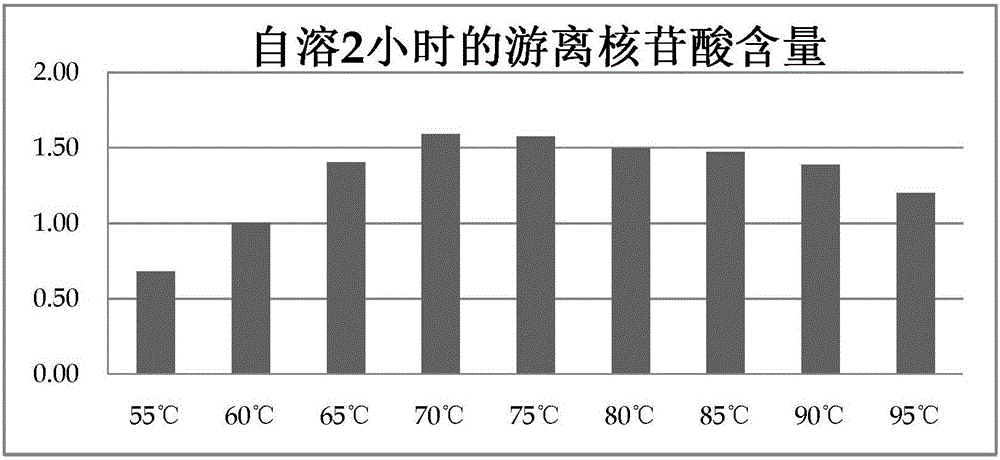
:酵母广泛应用于面包发酵、啤酒发酵、动物饲料等领域,其种类繁多,包括面包酵母、啤酒酵母、糖蜜酵母等。很多现有的食物原料,如糖蜜、玉米淀粉、玉米糖浆以及甜菜等,均能够通过发酵的方式培养出大量的酵母。酵母的营养丰富,含有蛋白质、碳水化合物、人体必需的8种氨基酸和14种矿物质,含有几乎所有种类的维生素、核酸以及谷胱甘肽等营养物质。酵母经过破壁、酶解、自溶等工艺后可将内部营养物质释放,从而具有浓郁的香味,大量的营养物质如小肽及呈味氨基酸、游离核苷酸、维生素等也能从内部释放,从而可以直接被人及动物吸收,因此从上世纪九十年代开始,在食品和饲料领域不断研究采用酶解、自溶等方式进行破壁和降解酵母蛋白质,从而生产各种酵母自溶物、提取物和抽提物等。利用酵母自溶技术生产酵母自溶物、酵母膏、食品调味料已有很好的应用,自溶的目的就是获得价值更高的产品,获得营养价值更高的内溶物,酵母自溶后可产生游离核苷酸、小肽及游离氨基酸等,核苷酸具有显著的鲜味及免疫功能,如酵母水解物,就是指以酵母为菌种,经液体发酵得到的菌体,经自溶或外源酶催化水解后浓缩或干燥获得的产品。酵母水解物比原先的酵母在动物营养领域具有更好的营养价值。因此,如何提高自溶效率提高自溶后产品的价值就成为一个主要技术研究方向。现有工业领域对此已有较多研究与应用。发明专利CN101513247B【一种高蛋白质含量的酵母抽提物的生产方法及产品】公开了一种使用自溶技术生产酵母抽提物的方法,文中公开的抽提物自溶条件主要为pH保持4~7,温度保持在45~55℃,反应时间3~12小时。并且需要添加自溶促进剂和外源酶。其自溶包括酶解及升温反应两个步骤,分别耗时5~30小时,及3~10小时。并且在说明书及实施例中介绍了自溶过程耗时更长的生产参数。发明专利CN102051381B【一种利用啤酒酵母生产酵母抽提物的方法】,介绍的自溶方法的参数为:在木瓜蛋白酶存在下使用55~65℃自溶20~50小时。发明专利CN101686720A【酵母自溶物】公开了另一种使用自溶技术进行生产的方法,公开的主要自溶参数包括:温度保持在30~70℃情况下,使用外添加蛋白酶进行自溶,自溶时间长达20小时。发明专利CN102293356A【酵母自溶物及其制备方法】公开了一种较为具体的酵母自溶物制备方法,所涉及到的自溶条件为温度50~70℃,pH4.5~7.0,添加0.1%-1.0%酶制剂。在实施例中提到了这样的参数需要的自溶时间达到了10~28小时。发明专利CN101050427A【一种产阮假丝酵母自溶物的制备方法】,介绍了一种使用酵母自溶物作为风味调味料的生产方法,其主要的自溶条件为pH4.5~6.8,温度范围45~55℃,添加氯化钠、黄酒等调味料,搅拌自溶24小时。发明专利CN101779722B【一种酵母培养物及其制配方法】中酵母培养物的主要自溶参数则为50~60℃条件下自溶30~40小时。发明专利CN102031275A【利用废弃酵母制备酵母膏的方法】,在介绍抽提工艺时提到了两种方法,一是酶法抽提,添加特定抽提酶的情况下在45~55℃保温酶解8~24小时;二是自溶抽提则是在48~55℃条件下保温24~48小时。发明专利CN103184153A【无沉淀酵母浸膏的制备方法】介绍的工艺总自溶的步骤为添加表面活性剂至培养物中,调节温度至40~60℃,pH4~6,自溶时间为18~24小时。上述专利都是使用自溶来实现酵母价值的提升,目的是获得酵母的内溶物、核苷酸、小肽、风味物质、免疫物质和其他一些高价值营养物,并将此应用于动物营养、微生物培养、食品添加剂。这些专利公开的方法中自溶前后的生产方式各有不同,但自溶工艺的参数都有一些共同点:酵母自溶适合的参数大致是温度在30~70℃范围内,更细化的范围包括:45~55℃,50~60℃,50~70℃等。另一个共同点是自溶所需的时间都相对较长,综合文献来看所需时间在3~50小时,在未使用外源酶和自溶促进剂情况下大概需要的时间约为24~48小时,使用外源酶或表面促进剂或表面活性剂等情况自溶时间可以缩短至24小时以内,甚至是12小时以内。从现有技术来看虽然时间已经大幅缩小至12小时以内,但这是在使用各种外部手段才实现的,看来酵母本身依靠自溶的内源酶自溶仍然需要较长的时间并且难以达到工业高效生产的要求。从工业生产角度来看,现有自溶技术主要的两个特点相对的低温和耗时长会导致很多问题产生:1.低温状态会导致腐败微生物生长,因为现有自溶温度全部都低于巴氏灭菌的温度(68~70℃),也就是说当物料在低于68℃时,自溶的同时会伴随有腐败微生物的生长。在不使用外源酶的情况下,从自溶开始腐败微生物会一直伴随自溶进行生长并且会以指数级生长,在使用外源酶情况下,虽然在自溶初期自溶酶可以抑制腐败微生物,但在酶解后期细菌仍会继续生长,因此,在自溶后期都会可能发生腐败微生物大量生长的情况出现,这就会对生产控制造成困扰。2.低温和长时间自溶会产生较高含量的有害物质,包括有害碱基、无机氮和生物胺,有害微生物的生长必然会导致有害物质的产生,同时高价值的营养物质会相应的减少,如自溶产生的核苷酸会被微生物利用并产生碱基,氨基酸则会微生物转化为无机氮。从而影响最终产品品质、营养价值及安全性。3.自溶工序的耗时较长但前后的工序一般的物料处理能力强,这就需要设计大容量的自溶设备,比如大容量的酶解罐和反应釜等,这会造成成本上升。4.从现有公开的自溶技术来看,在大部分情况下都使用了外源酶和自溶促进剂来提高自溶效率,外源酶的添加又会显著提高生产成本。5.在添加外源酶的情况下就会对自溶时物料的含水率有具体要求,在大部分情况下需要有较高的含水率且具有很高的流动性,这才能提高外源酶的效率。而这又会提高后续干燥的成本。以下表1为市售自溶酵母产品的核苷酸含量:表1从上述描述的缺点及提供的数据可以看出,和现代酶解工艺的高效率相比,酵母自溶同样作为酶解工艺其效率要低很多,原因是酵母本身所具有的内源酶并不丰富,从而导致需要使用外部手段进行自溶强化,这包括延长时间、提高含水率、严控pH等参数、添加外源酶。另一方面,现有公开的技术中在使用外源酶和自溶促进剂的情况下,自溶的时间仍然较长,可以看出出于成本的原因,外源酶无法大量添加,在现有公开技术中提到的添加量来说效率仍然不高。因此,使用新的思路来提高酵母的自溶效率具有非常重要的意义。单细胞蛋白(Singlecellprotein简称SCP)又称微生物蛋白或菌体蛋白,是利用工业废水、废气、天然气、石油烷烃类、农副加工产品以及有机垃圾等作为培养基,培养酵母、非病源性细菌、微型菌、真菌等单细胞生物体,然后经过净化干燥处理后制成,是食品工业和饲料工业重要的蛋白质来源。单细胞蛋白与其它蛋白相比的一大优点就是其较少的细胞培养时间,微生物有机体蛋白产品的产率比其它传统蛋白产率要高。单细胞蛋白(SCP)与传统蛋白相比具有不受环境和气候的影响、原料易得、可连续生产、易于控制、污染小等优势。单细胞蛋白产品含有丰富的蛋白质,氨基酸的种类齐全,比例适当。单细胞蛋白还含有丰富的脂肪、碳水化合物、核酸、维生素和无机盐,并含有钙、磷、钾、铁、镁、钠、锰等矿物质元素,还含有多种酶。出于有害微生物、有害化学物质、重金属等对产品质量安全造成危害的考虑,目前已经或正在进行产业化开发的单细胞蛋白产品的品种较少,主要集中于安全风险低、来自于食品工业的产品或副产品作为原料进行单细胞蛋白的培养及生产。如应用于动物饲料的味精渣,是由异亮氨酸、缬氨酸和谷氨酰胺、支链氨基酸生产过程中通过陶瓷膜过滤离交生产出来的蛋白原料,经烘干成品,富含多种氨基酸、微量元素、消化酶和丰富的生长因子。在饲料中可替代部分鱼粉、玉米蛋白粉等高蛋白原料,被饲料企业广泛应用。另一个示例是啤酒酵母,啤酒在生产时需要达到严格的食品安全标准,由其产生的有机质副产物和酵母蛋白的生物、化学、物理危害都达到最低,从而为饲料工业的应用提供可靠的安全保证。单细胞蛋白所含的蛋白、氨基酸等营养物质除了可以直接应用于动物饲料外还可以应用其所含的内源酶进行深加工。单细胞蛋白所含有的内源酶大致包括溶菌酶、蛋白酶及核酸酶,这些酶既可以进行提取也可以进行自溶以生产小肽、核苷酸等高价值产品。工业上使用的大部分酶来自于单细胞蛋白的提取,而提取过程总会对酶的活性产生负面影响,因此可以考虑到的如果直接使用含内源酶的单细胞蛋白作为粗品的酶源进行工业生产可能会具有良好的效果。可以发现除了酵母以外的单细胞蛋白种类中有很多菌体会含有丰富的内源酶,并且这些内源酶的种类和活性都是酵母自溶过程所特别需要的,如核酸酶可以酶解酵母的RNA,溶菌酶则可以提高酵母破壁率。因此,可以考虑到的如果利用内源酶丰富的单细胞蛋白和酵母一起进行自溶的话可能会提高酵母自溶的效率。技术实现要素:本发明的目的在于解决现有酵母自溶效率底下的缺陷,提供一种高效、富含活性成分的使用内源酶丰富的特定单细胞蛋白与酵母混合自溶的生产方法。为了实现上述目的,本发明提供了以下技术方案:一种生产高活性物质酵母自溶物的自溶工艺方法,以未经灭菌处理保持原有内源酶活性的特定单细胞蛋白与酵母按干物质质量(2:8)~(8:2)的比例进行混合自溶然后干燥、灭菌,自溶分为低温段及高温段,低温段在45~60℃保持20~60分钟,高温段在75~95℃保持30~120分钟,所述特定单细胞蛋白包括地衣芽孢杆菌、枯草芽孢杆菌、两歧双歧杆菌、粪肠球菌、屎肠球菌、乳酸肠球菌、嗜酸乳杆菌、干酪乳杆菌、沼泽红假单胞菌、长双歧杆菌、短双歧杆菌中的一种或两种以上的混合菌种的培养物。所述的特定单细胞蛋白含水率为90%~98%,自溶混合物的水分含量不低于75%。所述特定单细胞蛋白是通过有机废水培养的复合菌群,所述有机废水是指饮料工厂的不含有毒有害物质的工艺废水,优选啤酒工厂废水或果汁厂废水。自溶混合物中特定单细胞蛋白与酵母的混合比例为(3:7)~(7:3),优选特定单细胞蛋白与酵母的质量含量比例为1:1。所述的特定单细胞蛋白为地衣芽孢杆菌和枯草芽孢杆菌的复合菌群,所述的复合菌群的干物质中蛋白含量为30%~60%。所述酵母包括啤酒酵母、面包酵母、糖蜜酵母中的一种或两种以上的混合,且酵母未经过核酸提取工艺,优选的是未经干燥的啤酒酵母浓缩液和酵母泥,所述啤酒酵母的干物质蛋白含量为40%~55%。干燥后物料水分为12%~20%。本发明的另一目的在于提供了采用上述任一方法所制得的酵母产品。其中,酵母产品中的水分质量含量为5.0%-10.0%、游离核苷酸质量含量为1.40%-3.00%、游离碱基质量含量为0-0.20%、蛋白质量含量为40.0%-60.0%,其中蛋白中的小肽质量含量为15.00%~40.00%、蛋白中的游离氨基酸质量含量为2.0%-8.0%。本发明创新的直接将含有丰富内源酶的特定单细胞蛋白作为外源酶应用于酵母自溶,和普通纯品的工业用酶相比单细胞蛋白的内源酶有以下优点:酶的活性要高于工业酶,因没有经过提取、干燥、储存等破坏酶活的工序。由于单细胞蛋白的内源酶丰富,在合适的条件下对自身自溶后又可以作用于酵母,本身被溶菌酶裂解后核酸酶和蛋白酶又可以作用于酵母。内源酶的结构和种类显著区别于工业酶,基于成本的考虑,现有的酵母自溶使用的外源酶大多为蛋白酶,如中性蛋白酶、碱性蛋白酶和木瓜蛋白酶等,这些主要是用于酶解酵母中的蛋白,对酵母中的核酸作用很小,所以现有酵母的自溶产生的核苷酸仍然是靠酵母自溶是核酸酶来产生,因此,核苷酸的产量并不高。工业的蛋白酶作为外源酶的另一个缺点是会产生苦味肽,这是由于蛋白酶作用的位切点的特点,当蛋白水解时,肽链中的疏水性氨基酸充分暴露出来,接触味蕾产生味苦,这在酵母自溶时也会出现,只是酵母所含的鲜味物质较多掩盖了这一现象,但是这会降低酵母本身的鲜味。相反的使用单细胞蛋白的内源酶作用于酵母就不会产生上述问题,本专利中的单细胞蛋白含有三种酶溶菌酶、核酸酶及蛋白酶,溶菌酶可以充分裂解单细胞蛋白的细胞壁和酵母的细胞壁,从而使得内源酶和底物(酵母内溶物)可以充分接触,同时单细胞蛋白的核酸酶及蛋白酶再充分酶解酵母的核酸和蛋白,从而产生高含量的核苷酸及小肽,菌体蛋白中的蛋白酶酶解时产生的苦味肽会显著的少于常规的工业蛋白酶。本专利将含内源酶的单细胞蛋白与酵母的比例通过实验优化到了最佳的比例范围,使得酶和底物可以充分反应,从而可以产生比两者单独自溶情况下更好的核苷酸及小肽含量。直接使用含有内源酶的单细胞蛋白酶解酵母在生产工艺上的一个显著优点是自溶时对水分含量要求要比工业的酶宽松且低很多,现有的酵母自溶在使用工业酶如中性蛋白酶时会要求自溶的水分含量要非常高,且需要具有很高的流动性。会导致大部分情况下自溶物料的水分含量需要高于95%,基于此,现有的酵母自溶大多使用酶解罐进行生产。本专利使用的单细胞蛋白在未自溶时会含有大量的细胞内水分,自溶时随着细胞破裂,细胞内水分会流出细胞外,从而提高自溶是物料的流动性,因此,在使用单细胞蛋白时的一个重要优势是工艺上不需要确保酵母自溶时的特别高的水分含量,生产时水分含量只需控制在70%~95%即可,因此,只需使用能够充分进行搅拌自溶的设备即可。工艺上自溶的水分降低可以节省大量的干燥成本,从而降低最终产品的成本。本专利提供的自溶技术的温度范围要高于现有的自溶技术,且温度控制的范围高于巴氏灭菌的68℃,可以不用担心有害微生物的繁殖,从而降低了温度的控制难度。这是因为本专利中内源酶种类和现有的工业蛋白酶的最适反应温度有较大区别,本专利的单细胞蛋白的最适温度要显著高于普通的蛋白酶。本专利提供的酵母自溶参数中自溶时间要显著低于现有的所有自溶方法,原因也是和单细胞蛋白的酶活性高有关。自溶时间的缩短也可以节省大量的生产成本。使用本专利的自溶技术会使得酵母的核苷酸含量会比已有技术得到更大的提升,产品的游离核苷酸、小肽、游离氨基酸要显著高于已有的酵母自溶物。由于自溶成本、干燥成本的显著降低,产品的成本也和现有的酵母产品要显著降低,从而使得酵母产品可以有更大范围的应用。制成的酵母产品由于核苷酸等有效成分进一步提高,使得产品的适口性、气味得到更大的加强。核苷酸含量提高也有助于产品在提高动物免疫提高生产性能方面有了更大的效果。因此,和现有酵母自溶物、水解物相比在应用于动物饲料时就会有更好的表现。本专利中的单细胞蛋白对酵母虽然发挥着类似于外源酶的作用,但由于添加量高,客观上又对最终产品贡献了一部分营养成分,也贡献了相当比例的蛋白成分,从而也提高最终产品的产量。下面结合附图对本发明作进一步说明,这种方法的原理和采用的设备对本专业的人来说是非常清楚的。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。附图说明图1是本发明的自溶混合物在自溶1小时后的游离核苷酸含量的柱形图。图2是本发明的自溶混合物在自溶2小时后的游离核苷酸含量的柱形图。图3是本发明的自溶混合物在自溶3小时后的游离核苷酸含量的柱形图。图4是本发明的自溶混合物在自溶1小时后的游离碱基含量的柱形图。图5是本发明的自溶混合物在自溶2小时后的游离碱基含量的柱形图。图6是本发明的自溶混合物在自溶3小时后的游离碱基含量的柱形图。图7是本发明的自溶混合物在70℃自溶温度下的游离碱基及核苷酸含量图。图8是本发明的自溶混合物在85℃自溶温度下的游离碱基及核苷酸含量图。图9是本发明的自溶混合物在不同混合比例下的自溶结果图。具体实施方式实施例1本例是原料选取、自溶生产的制造例本例使用啤酒工厂的有机废水实时培养的富含内源酶的复合菌群作为特定单细胞蛋白的原料,复合菌群培养后通过沉淀离心的工序出去大部分细胞外水分,沉淀后菌群含水率为90%~98%,离心脱水后含水率降低至80%~85%,复合菌群的蛋白含量(干基)高于50%,通过可计量螺杆泵输送至自溶设备。酵母使用市售普通经干燥的未自溶啤酒酵母,蛋白含量为50%。将准备好的复合菌群与酵母按干物质50%/50%比例进行添加,比例的添加实现方式是通过螺杆输送泵及输送蛟龙的电机频率来实现。自溶混合物除了复合菌群有酵母外,还可以添加载体辅料。将物料根据固定比例输送至自溶设备进行自溶处理。本实施例的自溶设备由双螺杆空心桨叶设备所提供。自溶的温度要求为:低温段物料温度保持在55℃,时间是30分钟高温段物料温度保持在70℃,时间是60分钟,自溶物料水分要求为:混合物料水分含量不低于75%,当混合物料水分含量达不到要求时通过喷头往物料喷洒清水。自溶后的物料输送至干燥设备进行干燥,所述干燥设备为单滚筒干燥机,干燥后物料水分为12%~20%。经干燥后的物料通过气流提升设备输送至隧道式微波灭菌设备进行灭菌,灭菌时间5~15分钟,灭菌后物料水分含量为5%~15%。灭菌后的物料的霉菌总数、细菌总数符合《GB13078-2001》饲料卫生标准。灭菌后的物料经气流式超微粉碎设备进行超微粉碎。粉碎后的物料细度为:100%过80目,90%过100目。粉碎合格的物料包装成成品。所述超微粉碎设备可以是辊式磨粉机,也可以是气流式粉碎机。选用上述原料和使用上述生产工艺制成的酵母自溶物具有质量指标如表2所示:表2实施例2本例是原料选取、自溶生产工艺及产品的实施例本例使用啤酒工厂的有机废水实时培养的富含内源酶的复合菌群作为原料,在培养过程中使用了吐温80作为产酶促进剂。复合菌群培养后通过沉淀离心的工序出去大部分细胞外水分,蛋白含量高于50%,通过可计量螺杆泵输送至自溶设备。酵母使用来自于啤酒工厂通过压滤获得的脱水新鲜酵母,未经干燥处理,蛋白(干基)高于50%将准备好的复合菌群与酵母按干物质50%/50%比例进行添加,比例的添加实现方式是通过螺杆输送泵及输送蛟龙的电机频率来实现。将物料根据固定比例输送至自溶设备进行自溶处理。自溶的温度要求为:低温段物料温度保持在55℃,时间为30分钟,高温段物料温度保持在75℃,时间为30~40分钟。自溶的低温段使用喷头向物料喷洒蛋白酶,添加量为自溶物料(干基)的1.5%。自溶物料水分要求为:混合物料水分含量不低于75%,当混合物料水分含量达不到要求时通过喷头往物料喷洒清水。自溶后的物料输送至干燥设备进行干燥,干燥设备为旋风式气流干干燥机,干燥后物料水分为15%~25%。经干燥后的物料通过输送设备输送至隧道式微波灭菌设备进行灭菌,灭菌时间5~15分钟,灭菌后物料水分含量为5%~15%。灭菌后的物料的霉菌总数、细菌总数符合《GB13078-2001》饲料卫生标准。灭菌后的物料经气流式超微粉碎设备进行超微粉碎。粉碎后的物料细度为:100%过80目,95%过100目。粉碎合格的物料包装成成品。选用上述原料和使用上述生产工艺制成的酵母自溶物具有以下表3中的质量指标:表3实施例3实施例3是对本发明所制得的样品中的小肽及游离氨基酸的测定实施例原理与方法以小肽含量及游离氨基酸的含量来验证酵母自溶后蛋白的水解程度,用于对比分析自溶前后的水解程度及营养价值。使用反相C18色谱柱,乙腈和乙酸钠的缓冲盐体系进行氨基酸洗脱。样品小肽含量等于高氯酸处理后上清液的总氨基酸量减去上清液中游离氨基酸含量。试剂和溶液配制12mol/L盐酸(含0.2%苯酚):称取苯酚1000mg于500ml浓度为38%12mol/l的浓盐酸中,混匀。1.5mol/L高氯酸溶液:量取有效含量为71%的高氯酸106.13ml于500ml容量瓶中,加水定容至刻度。2mol/L的碳酸钾溶液:称取138.21克碳酸钾加水定容至500ml。0.1mol/L盐酸溶液:量取9.0mL浓盐酸,加水稀释至1000mL。醋酸钠溶液:称取7.6克醋酸钠,加水925mL,溶解后用冰醋酸调pH值至6.5。三乙胺乙腈溶液:取三乙胺1.4mL,加乙腈8.6mL,混匀。异硫氰酸苯酯乙腈溶液:取异硫氰酸苯酯25uL,加乙腈2mL于5mL离心管中,混匀。18AA标准溶液(0.2mM):准确量取氨基酸标准品0.8mL于10mL容量瓶,加盐酸溶液(0.1mol/L)定容至刻度。仪器与设备高效液相色谱仪系统(梯度洗脱、紫外检测、可控柱温)。色谱柱:SepaxAA专用柱,4.6×250mm。分析天平。pH计。离心机。2mL塑料离心管。10mL塑料离心管。1mL一次性注射器。0.45um一次性有机相过滤器。0.5ml离心管。200ul移液器。1000ul移液器。40ml耐压螺盖玻璃瓶。16ml耐压螺盖玻璃瓶。测定步骤样品处理准确称取1.000克样品于40毫升离心管中添加10毫升水,混合,漩涡震荡5分钟。添加4毫升1.5M高氯酸溶液,使之充分混合,离心5分钟。取上清液10毫升,缓慢加入1.43毫升的2M碳酸钾溶液,加入57微升的12M的盐酸溶液,充分混合。600G离心5分钟,取上清液,充分混匀。移取上清液1ml添加2ml0.1M盐酸溶液稀释混合,分析游离氨基酸,移取6.0ml上清液进行水解,分析水解氨基酸。小肽为水解氨基酸减去游离氨基酸水解准确量取6.0ml上清液置于16ml螺盖玻璃瓶中。加入6ml含0.2%苯酚的12mol/L盐酸。置110±1℃烘箱中水解24小时。将水解液全部转移到50ml容量瓶中定容至50ml。取6.94ml已定容的溶液到100ml容量瓶中定容至刻度。摇匀,过滤取上清液供衍生使用。衍生准确量取氨基酸标准溶液、样品溶液400μl,置2ml塑料离心管中,加入三乙胺乙腈溶液200μl,异硫氰酸苯酯乙腈溶液200μl,混匀,室温放置1小时,然后加入正己烷800μl,振摇后放置10分钟,用一次性注射器吸取下层溶液,用0.45μm针式有机相过滤器过滤。色谱条件色谱柱:SepaxAA专用柱,4.6*250mm。检测波长:254nm。柱温:35℃。流动相A:醋酸钠溶液:乙腈=93:7(V/V)。流动相B:乙腈:水=4:1(V/V)。进样量:10ul流速:1mL/min表4梯度洗脱程序时间/min流动相A/%流动相B/%01000210001593730703033505034010040010040.011000501000结果计算试样中水解氨基酸含量ω1,以质量分数标识,数值以%表示,按公式(1)计算,游离氨基酸ω2按公式(2)计算:ω1=c×100×506.94×10+1.436×10+410m×1000×1000×100...(1)]]>ω2=c×(10+1,43)×10+410×3m×1000×1000×100...(2)]]>小肽含量ω,:ω=ω1-ω2………………………………………………………………(3)式中:c——氨基酸浓度ug/ml;m——样品重量(g);测定结果用平行测定的算术平均值表示,保留2位有效数字。精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。检测结果使用上述测定方法测得的酵母产品的小肽及游离氨基酸的含量见下表5,表中可以看出使用本专利自溶技术的产品可以产生较高含量的小肽及游离氨基酸的含量,并且要高于市售酵母产品。表5其中,自溶酵母1指的是特定单细胞蛋白含量50%,原料采用培养过程添加产酶促进剂的复合菌群,工艺采用实施例2的方法所制得的产品;自溶酵母2指的是特定单细胞蛋白含量50%,工艺及原料采用实施例1的方法所制得的产品;市售未自溶酵母指的是未经酶解或自溶的普通干燥啤酒酵母;市售酵母自溶物指的是原料采用普通蛋白酶作为外源酶进行酶解所制得的产品;市售自溶酵母原料指的采用原有自溶技术生产的酵母产品。实施例4本例是游离核苷酸与游离碱基的测定例。原理与方法酵母中含有核苷酸,经水溶液提取后的试样进入高效液相色谱分析,经反相C18柱,紫外检测器、缓冲盐作流动相,可使用外标法对5种核苷酸、5种核苷及5种碱基作定量测定。游离核苷酸是指5种核苷酸及5种核苷的总和,包括胞苷酸、尿苷酸、鸟苷酸、肌苷酸、腺苷酸、胞苷、尿苷、肌苷、鸟苷、腺苷。游离碱基是指5种核酸碱基的总和,具体包括胞嘧啶、尿嘧啶、鸟嘌呤、胸腺嘧啶、腺嘌呤。游离核苷酸及游离碱基的测定方法参考BrendonD.Gill,HarveyE.Indyk(2007).Developmentandapplicationofaliquidchromatographicmethodforanalysisofnucleotidesandnucleosidesinmilkandinfantformulas.InternationalDairyJournal,17,596–605.所述样品处理方法及色谱条件。试剂和溶液20%w/v氢氧化钾溶液:称取氢氧化钾100克,溶解于500ml水中,保存于容量瓶内。流动相A:0.1M磷酸二氢钾溶液,称取磷酸二氢钾27.2克,溶解于1000ml水中,添加20%氢氧化钾溶液1.0ml,加水定容至2升。流动相B:25%甲醇溶液,量取甲醇250ml溶解于750ml水中,搅拌混匀后0.45um有机系滤膜过滤后备用。80%乙腈溶液:量取乙腈800ml,溶解于200ml水中,充分搅拌混匀。核苷酸混合标准液:使用标准品配制对应的标准品储备液后配制混合标准液,配制的表品浓度:5种核苷酸的浓度为20ug/ml,5种核苷的浓度为10ug/ml。碱基混合标准液:配制碱基混合标准液,混合标准液的碱基目标浓度为15.0~20.0ug/ml。仪器与设备高效液相色谱仪系统(梯度洗脱、紫外检测、可控柱温)。色谱柱:C18,4.6×150mm。分析天平。离心机。超声清洗器。1mL一次性注射器。100ml容量瓶。250ml容量瓶。40ml带盖螺盖玻璃管。1000ul移液器。5000ul移液器。样品处理准确称取0.1000克样品,置于40ml螺盖玻璃瓶中。加入10ml蒸馏水,漩涡震荡2次,每次1min。放入超声清洗器内超声20min,然后再漩涡震荡一次。将试液移入15ml塑料离心管内,3000g离心10min。0.45um水相过滤器过滤后液相上机使用。色谱条件表6色谱柱:AthenaC18,4.6×150mm。检测波长:260nm。柱温:30℃。流动相A:0.1mol/L磷酸二氢钾溶液。流动相B:80%乙腈溶液。进样量:20ul流速:0.5mL/min表7结果计算试样中核苷酸或碱基含量ω,以质量分数标识,数值以%表示,按公式(1)计算:ω=c×vm×1000×1000×100]]>式中:c——核苷酸、碱基的浓度ug/ml;V——溶解体积10ml;m——样品重量(g);测定结果用平行测定的算术平均值表示,保留2位有效数字。精确度及样品回收率在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。检测结果使用上述测定方法检测的自溶酵母的游离核苷酸与游离碱基的含量见下表5,可以看出在使用本专利的自溶技术后酵母的核苷酸含量得到了巨大的提升,同时游离碱基也因为高温自溶而获得了抑制。表8实施例5本例是高温段自溶最佳温度值的实验例本专利所指的单细胞蛋白中所含的内源酶的最适反应温度范围由梯度实验获得,参数的确定是以自溶后产品中的游离核苷酸及游离碱基的含量进行最终确定,因为内源酶发挥效率的高低最终反应在游离核苷酸及游离碱基这两个核心指标上。小肽及游离氨基酸也是自溶及酶解的产物,但并不适合作为自溶的评估指标,因为大量添加蛋白酶就可以获得很高含量的小肽及游离氨基酸,但只有游离核苷酸才会在合适的自溶条件核酸酶作用下产生。获得高温段最佳自溶温度的实验方案为:本例中的单细胞蛋白为啤酒废水培养的复合菌群,干物质蛋白含量达到50%。选取刚培养结束复合菌群放置于烧杯中,用于单独自溶,查看其自溶条件。将烧杯放置于恒温水浴锅内,自溶时使用电动搅拌机持续搅拌,物料的含水率不低于80%。自溶时间共180分钟,每隔1小时取出部分样品进行处理并用于测定。自溶的温度梯度见下表,物料在自溶后经微波灭菌干燥后测定游离核苷酸及游离碱基含量,其含量如下表6及表7。表9从上述表中可以看出单细胞蛋白的内源酶在65℃以上时发挥的效率开始提高,在70℃~85℃范围内获得的游离核苷酸含量最高。表10从上述的碱基数据及图表中可以看出,在低于70℃的情况下,自溶过程中的碱基增长较快,在70℃~95℃的各实验组数据可以看出,碱基的增长非常缓慢,说明了作为巴氏灭菌的关键温度,在自溶高于70℃时有害微生物的生长被显著抑制,也就不会将自溶产生的游离核苷酸降解为碱基。综合游离核苷酸及碱基的数据可以看出,温度在60℃时自溶效率开始逐步提高,70℃时自溶效率达到最高,可以看出60℃~70℃的温度范围自溶效率并不低,但主要的缺点是此温度范围是有害微生物的最适生长温度,从而导致大量的游离核苷酸被有害微生物降解。另一方面,85℃~95℃仍有较高含量的游离核苷酸含量可以看出,菌体内的溶菌酶、核酸酶最适反应温度范围广且温度高,并且显著高于现有的工业用蛋白酶。微生物的溶菌酶、核酸酶是属于耐高温酶,最适温度在60℃以上并且随着温度的升高酶活性并没有显著降低。因此,根据上述实验结果本发明将高温段自溶温度选定在巴氏灭菌温度(70℃)以上,既可以发挥内源酶活性又能阻止有害微生物的生长,从而生产出游离核苷酸含量更高的酵母产品。实施例6本例是高温段自溶最佳时间范围的实验例。本专利所指的单细胞蛋白所含的内源酶的高温段最适反应时间参数由梯度实验获得,参数的确定也是由自溶后产品中游离核苷酸及游离碱基的含量进行确定。获得高温段最佳自溶时间的实验方案为:本例所采用的特定单细胞蛋白为啤酒工厂有机废水培养复合菌群,特定单细胞蛋白的质量含量占自溶混合物的50%,选取刚培养结束的复合菌群至烧杯中用于实验。将烧杯放置于恒温水浴锅内,自溶时使用电动搅拌机持续搅拌,物料含水率不低于80%。自溶温度选取实施例5实验获得高温段最适自溶温度范围分别选取70℃,85℃两个温度进行梯度自溶时间梯度实验。自溶时间根据实验梯度设计,以1小时为单位测定自溶后的游离核苷酸及游离碱基含量,见下表。物料在自溶后需要经微波灭菌,干燥后备测。表11表12从上述数据与表中可以看出,在70℃和85温度两种温度情况下,游离核苷酸含量在自溶的最初2小时内上升最快,3小时以后持续保持稳定,核苷酸含量不再显著提高。说明内源酶在最初的2小时内持续的进行酶解反应,且反应完全。在70℃的情况下,游离核苷酸在3~4小时内达到最高,第5小时开始下降,说明有害微生物持续生长。在85℃情况下,3小时以后游离核苷酸与碱基含量持续保持稳定,说明在4小时后酶解反应基本结束且有害微生物并未繁殖。综合实验结果可以看出在70℃以上的温度进行自溶,自溶的理想时间为1~4小时,最佳的时间为2~3小时,这个自溶时间要显著少于现有的酵母自溶工艺,说明未经提取的单细胞蛋白的内源酶酶解效率要显著高于工业的蛋白酶。实施例7本例是特定单细胞蛋白与酵母最佳比例的试验例。将特定单细胞蛋白作为内源酶酶解酵母的最适比例通过实验获得,因为本专利提到的特定单细胞蛋白所含的内源酶的理论含量和实测值无法通过计算来和酵母进行精确配比,因为两者的酶解过程涉及到过程较为复杂,所以通过实验查看不同的混合比例自溶获得的游离核苷酸含量可以判定最适的比例。获得最佳混合比例的实验方案为:本例中的特定单细胞蛋白为啤酒工厂有机废水培养的复合菌群,也可以是枯草芽孢杆菌,干物质蛋白含量达到50%。所述酵母选取啤酒工厂通过压滤获得酵母,未经干燥及生化提取。比例是以两者的干物质含量进行配比。自溶的参数:温度70℃,自溶时间3小时,在恒温水浴锅内进行自溶,物料不断进行搅拌。物料在自溶后需要微波灭菌,干燥后备测。表13从上述实验数据及图表中可以看出,酵母在只依靠自身的情况下自溶只能产生含量较低的游离核苷酸,显著低于相同质量水平下的富含内源酶的单细胞蛋白。随着在酵母中添加的特定单细胞蛋白的比例逐步提高,自溶产生的游离核苷酸也逐步提高,当添加量提高到30%时混合物自溶的游离核苷酸的含量已经和使用100%单细胞蛋白自溶含量相同,继续提高比例是混合自溶的核苷酸产出率已经高出两者单独自溶。从结果可以分析的,酵母中所含的内源酶及核酸,相对的内源酶含量缺乏,相反的本专利所提到的特定单细胞蛋白的内源酶比核酸含量丰富,因此当两者混合自溶时可以起到酶解底物与酶制剂互补的作用。因此,从图表中可以看出的,当酵母中所含的单细胞蛋白达到60%时,自溶后的游离核苷酸含量最高,说明混合后酶解底物与酶制剂的比例正好合适。实施例8本例是采食量试验例。通过仔猪的双料槽偏好性试验评估使用本专利自溶工艺的酵母自溶物与市售普通酵母自溶物在诱食及采食量方面的差异。仔猪的双料槽模型试验可以测定仔猪对特定原料风味的偏好,对于仔猪来说采食其偏好的饲料可以提高采食量,进而提高生长速度。试验方案:评估原料:实施例2中的酵母自溶物含蛋白54.6%、游离核苷酸2.33%、小肽29.4%,普通市售酵母自溶物蛋白为51.3%,游离核苷酸为1.65%,小肽含量为26.8。试验饲料,基础日粮为市售断奶仔猪饲料,试验饲料配比见下表11。试验动物:选择断奶日龄、体重接近,采食正常、健康的断奶仔猪75头,随机分成5组。表14试验方法:在同一栏内放入料位和规格型号相同的料槽2个(要求每个料槽的料位必须与试验猪数量一致),分别在料槽内加入一定数量的试验饲料(要求饲料的数量必须充足,保证2小时内不会出现饲料不够的情况),A料槽加A料,B料槽加B料,让猪自由采食2小时后收集料槽中剩余的饲料并计量,然后在A料槽中加B料,B料槽中加A料进行上述相同的试验。在试验期间观察两个料槽采食饲料猪的数量,并用摄像机和照相机跟踪拍摄两个料槽猪采食情况和猪数量变化情况。要求:试验连续进行3~4次,每次3~4个重复。共3~5天,或某一饲料采食结束为止。结果计算:测定指标:采食量和偏嗜指数:A日粮偏食指数=A组总采食量/B组总采食量表15试验结果显示,在实施例试验条件下,断奶仔猪对于本专利自溶技术生产的酵母自溶物配制的饲料具有偏好性,对于含有其成本饲料采食量更高,自溶产生的更高含量的游离核苷酸及小肽含量表现出了更好的诱食效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 二次电池用负极活性物质、二次电池用负极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制作方法
- 二次电池用负极活性物质、二次电池用负极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制作方法
- 非水电解质二次电池用负极材料以及负极活性物质颗粒的制造方法与流程
- 一种生产高活性物质酵母自溶物的自溶工艺方法及由此制得的酵母产品与流程
- 一种含有果蔬活性物质的护肤组合物及其制备方法与应用与流程
- SI/C电活性材料的组合物的制作方法与工艺
- 二次电池用负极活性物质及其制备方法与流程
- 一种活性物质原位生长电极片及其制备方法与流程
- 一种提炼中草药活性物质制备的肥料添加剂及其制备方法与流程
- 番石榴活性物质的提取工艺及其应用的制作方法与工艺
- 二次电池用负极活性物质、二次电池用负极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制作方法
- 二次电池用负极活性物质、二次电池用负极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制作方法
- 非水电解质二次电池用负极材料以及负极活性物质颗粒的制造方法与流程
- 一种生产高活性物质酵母自溶物的自溶工艺方法及由此制得的酵母产品与流程
- 一种含有果蔬活性物质的护肤组合物及其制备方法与应用与流程
- 二次电池用负极活性物质及其制备方法与流程
- 一种提炼中草药活性物质制备的肥料添加剂及其制备方法与流程
- 具有多个区域的含活性物质纤维结构的制造方法与工艺
- 二次电池用活性物质、二次电池用电极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制造方法
- 非水电解质二次电池用正极活性物质粒子粉末及其制造方法、和非水电解质二次电池与流程
- 一种含有果蔬活性物质的护肤组合物及其制备方法与应用与流程
- 二次电池用负极活性物质及其制备方法与流程
- 二次电池用活性物质、二次电池用电极、二次电池、电池组、电动车辆、蓄电系统、电动工具及电子装置的制造方法
- 非水电解质二次电池用正极活性物质粒子粉末及其制造方法、和非水电解质二次电池与流程
- 非水电解质二次电池用正极活性物质粒子粉末及其制造方法、和非水电解质二次电池与流程
- 用于将活性物质包封于液滴和其它隔室内的方法与流程
- 正极活性物质、正极、二次电池、电池组以及电动车辆的制造方法与工艺
- 二次电池用负极活性物质及其制造方法、使用其的负极以及锂离子电池与流程
- 一种人体尿液中新精神活性物质的快速SERS检测方法与流程
- 用于促进损伤的身体组织再生的包含活性物质的组合物的制造方法与工艺