一种产木聚糖酶的重组菌及其应用的制作方法
本发明涉及一种产木聚糖酶的重组菌及其应用,属于酶工程领域。
背景技术:
木聚糖是植物细胞壁半纤维素的主要成分,是一种丰富的可再生生物资源。木聚糖酶是一类可以将木聚糖降解成低聚木糖或木糖的酶的总称。由于木聚糖主链的聚合度不同,支链上残基在主链上的结合位点也不同,化学性质比较复杂,所以多种酶协同作用才能完全降解木聚糖。
木聚糖酶在自然界中来源十分广泛,陆地和海洋的细菌、真菌和酵母、原生动物、甲壳动物中都存在木聚糖酶。微生物中厌氧菌、需氧菌、嗜温微生物、嗜热微生物和极端微生物都可产生木聚糖酶。目前研究和应用得最多的木聚糖酶主要来自曲霉、木霉和细菌,而商品酶应用最多的是丝状真菌来源的木聚糖酶。
木聚糖酶应用非常广泛,目前已经在食品、饲料、造纸、纺织等工业中成功应用,许多来源于木霉、曲霉以及芽孢杆菌等的木聚糖酶被商业化生产,但适用于不同需求,具有优良性质的木聚糖酶仍在不断开发之中。
Clostridium clariflavum是一种嗜热厌氧木质纤维素降解菌,对木质纤维素的降解率非常高,可降解42~59%的无预处理仅经高压灭菌的植物材料柳枝稷,而同属的C.thermocellum仅能降解33%的柳枝稷,但是对来源于Clostridium clariflavum的木聚糖酶的具体性质及相关应用鲜有报道。
技术实现要素:
本发明的第一个目的在于提供一种产木聚糖酶的重组菌,所述重组菌是以pET28a(+)为载体,以E.coli BL21(DE3)为表达宿主,表达如SEQ ID NO.1所示基因。
本发明的第二个目的在于提供构建木聚糖酶重组菌的方法,所述方法包括如下步骤:PCR扩增SEQ ID NO.1所示基因,与pET28a(+)连接并转化到E.coli BL21(DE3),获得重组菌。
本发明的第三个目的是提供一种诱导表达木聚糖酶的方法,所述方法是将所述重组大肠杆菌接种到培养基中,当OD600为1.0~1.9时加入IPTG诱导木聚糖酶的表达。
在本发明的一种实施方式中,所述诱导温度为20~30℃。
在本发明的一种实施方式中,所述诱导时间为4~12h。
在本发明的一种实施方式中,所述诱导剂IPTG的终浓度为0.1~0.9mmol·L-1。
在本发明的一种实施方式中,所述接种是以2~5%接种量进行接种。
在本发明的一种实施方式中,所述培养基配方为氯化钠10g/L,胰蛋白胨10g/L,酵母提取物5g/L,pH 7。
本发明的第四个目的是提供所述的重组菌在生产木聚糖酶中的应用。
有益效果:本发明成功地实现了Clostridium clariflavum来源的木聚糖酶的异源表达,并通过IPTG诱导的方法提高了木聚糖酶的表达量,使木聚糖酶的酶活是未诱导的73倍。此外,本发明提供的木聚糖酶具有良好的pH稳定性,在pH3.5-9.5酶活性保持在80%以上,并可将木聚糖降解为木糖。
附图说明
图1为本发明的木聚糖酶的pH稳定性;
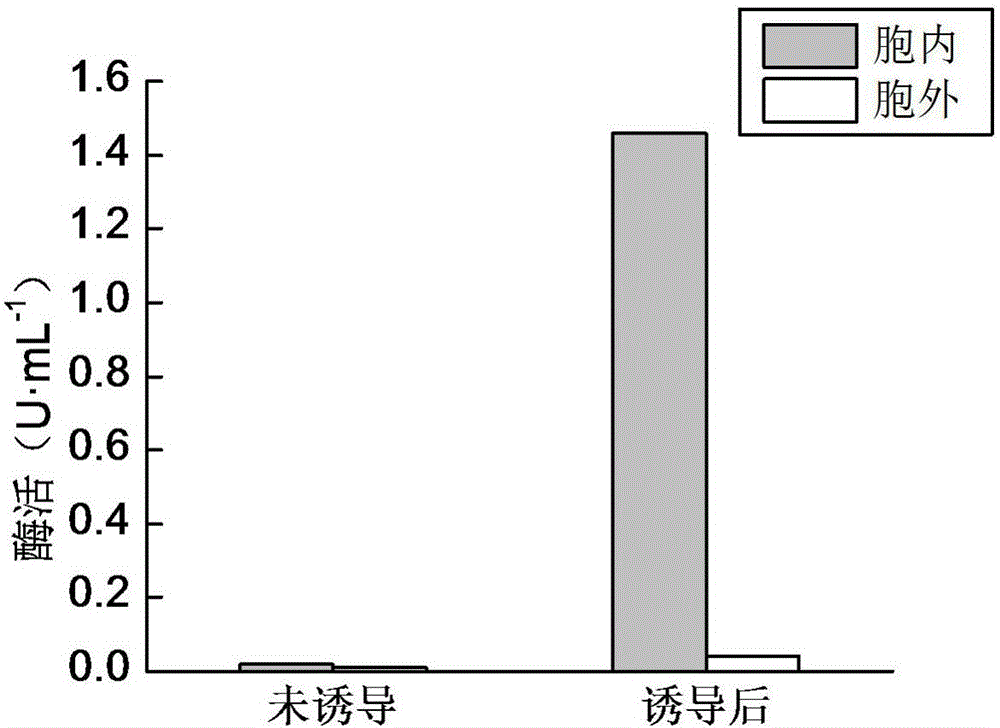
图2为诱导前后木聚糖酶酶活;
图3为本发明的HPLC检测木聚糖酶降解木聚糖的产物,峰7为木糖。
具体实施方式
酶液制备:将发酵液离心,上清液用于胞外酶活测定;沉淀用20mmol·L-1的pH 6.0磷酸钠缓冲液重悬细胞,超声波破碎10min,功率为390W,工作3s,间歇5s,破碎以后离心,上清液即为胞内酶液。
酶活测定方法:采用3,5-二硝基水杨酸比色法(DNS法),取500uL稀释后的酶液、500uL木聚糖底物于比色管中混匀(每种样品平行做3个样),在65℃水浴中保温10min,加入1mL DNS显色剂,沸水浴反应5min。取出,迅速冷却,用水定容至10mL,混匀,使用分光光度计,在波长540nm处测量吸光度,使测得的吸光值在0.2-0.5之间。根据标准曲线计算木聚糖酶酶活。酶活定义为每分钟降解木聚糖底物生成1μmol木糖所需的酶量为1U。
蛋白浓度的测定:Super-Bradford蛋白定量试剂盒与稀释好的蛋白质反应,用酶标仪测定595nm处的吸光值,根据蛋白标曲计算蛋白浓度。比酶活(U·mg-1)=酶活(U·mL-1)×[蛋白浓度(mg·mL-1)]-1。
实施例1
PCR扩增xyn基因,其序列如SEQ ID NO.1所示,将xyn基因和质粒载体pET28a(+)用限制性内切酶BamHⅠ和NotⅠ双酶切并连接转化至E.coli JM109感受态细胞中。提取转化子中重组质粒pET28a(+)-xyn,将此重组质粒转化至E.coli BL21(DE3)感受态细胞,获得重组E.coli BL21(DE3)/pET28a(+)-xyn。
实施例2
将重组大肠杆菌接种于含有100μg·mL-1硫酸卡那霉素的LB培养基(氯化钠10,胰蛋白胨10,Yeast Extract 5,pH 7)中,200r·min-137℃培养10h,然后以2%(v·v-1)接种量转接至50mL新鲜培养基中,添加诱导剂IPTG至0.1mmol·L-1,诱导5h后取样10mL,8000r·min-1离心10min收获细胞。测定细胞内外酶活情况,此时细胞内酶活达1.05U·mL-1,胞外酶活为0.01U·mL-1。
实施例3
在pH 6的磷酸氢二钠-柠檬酸缓冲液中,45~85℃范围内,每隔5℃,测定木聚糖酶酶活,确定最适反应温度为65℃。在最适反应温度条件下,pH 5~7.5范围内,每隔0.5,测定酶活,确定最佳反应pH为6~6.5。
温度稳定性:将酶液在pH为6.5时分别在50、55、60、65、70℃中处理不同时间,冷却后在最佳反应温度下测定剩余酶活,以未处理的酶活为100%。
pH稳定性:将酶液浓缩后以相同的稀释倍数分别稀释到pH 3.5、4.5、5.5、6.5、7.5、8.5、9.5,4℃放置5h,然后在最佳反应条件下测定剩余酶活,以未处理的酶活为100%。
结果显示,木聚糖酶在pH3.5-9.5酶活性保持在80%以上,具有良好的pH稳定性。
实施例4
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600达到1.1时添加诱导剂IPTG至0.1mmol·L-1,并于25℃诱导6h,测定细胞内外酶活情况,此时细胞内酶活达0.89U·mL-1,胞外酶活为0.04U·mL-1。
实施例5
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600达到1.5时添加诱导剂IPTG至0.1mmol·L-1,并于25℃诱导6h,测定细胞内外酶活情况,此时细胞内酶活达0.81U·mL-1,胞外酶活为0.02U·mL-1。
实施例6
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600达到0.8时添加诱导剂IPTG至0.1mmol·L-1,并于25℃诱导6h,测定细胞内外酶活情况,此时胞内酶活达0.65U·mL-1,胞外酶活为0.08U·mL-1。
实施例7
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时添加诱导剂IPTG至0.1mmol·L-1,并于20℃诱导6h,测定细胞内外酶活情况,此时,胞内酶活为1.27U·mL-1,胞外酶活为0.02U·mL-1。
实施例8
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时添加诱导剂IPTG至0.1mmol·L-1,并于20℃诱导4h,测定细胞内外酶活情况,此时,胞内酶活为0.93U·mL-1,胞外酶活为0.01U·mL-1。
实施例9
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时添加诱导剂IPTG至0.1mmol·L-1,并于20℃诱导12h,测定细胞内外酶活情况,此时,胞内酶活为1.22U·mL-1,胞外酶活为0.12U·mL-1。
实施例10
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时分别添加诱导剂IPTG0.1mmol·L-1,于20℃诱导9h,测定细胞内外酶活变化情况,结果显示,胞内酶活为1.31U·mL-1,胞外酶活为0.02U·mL-1。
实施例11
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时分别添加诱导剂IPTG0.7mmol·L-1,于20℃诱导9h,测定细胞内外酶活变化情况,结果显示,胞内酶活为1.36U·mL-1,胞外酶活为0.05U·mL-1。
实施例12
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时分别添加诱导剂IPTG0.9mmol·L-1,于20℃诱导9h,测定细胞内外酶活变化情况,结果显示,胞内酶活为1.25U·mL-1,胞外酶活为0.08U·mL-1。
实施例13
在重组菌E.coli BL21(DE3)/pET28a(+)-xyn菌体量OD600约为1.1时分别添加诱导剂IPTG0.4mmol·L-1,于20℃诱导9h,测定细胞内外酶活变化情况,并以未诱导的重组菌为对照。结果显示,诱导后的重组菌胞内酶活为1.46U·mL-1,比酶活为2.84U·mg-1,胞外酶活为0.04U·mL-1。不添加诱导剂IPTG时重组菌具有微量木聚糖酶酶活,胞内酶活0.02U·mL-1,胞外酶活0.01U·mL-1;添加诱导剂IPTG后重组菌木聚糖酶胞内酶活是未诱导的73倍(图2)。
实施例14
取1mL的1%(w·v-1)山毛榉木聚糖(溶解于20mmol·L-1磷酸钠缓冲液)分别与1mL初始酶活1U或10U的重组木聚糖酶反应不同时间,立即煮沸灭活10min,8000r·min-1离心10min,0.22μm滤膜过滤,采用HPLC法检测生成的木糖、木二糖、木三糖、木四糖、木五糖含量(图3),结果显示,重组木聚糖酶可以降解山毛榉木聚糖为寡聚糖和单糖木糖,从反应开始就有较多单糖生成,且反应初始产物以木糖和木三糖为主,随着反应的进行木三糖逐渐被降解,产物最终以木糖和木二糖为主,反应3h后分别占总还原糖含量的52.7%和43.2%。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!