象草维管组织特异性启动子及其应用的制作方法
本发明涉及植物生物
技术领域:
,具体涉及一种象草维管组织特异性启动子及其应用。
背景技术:
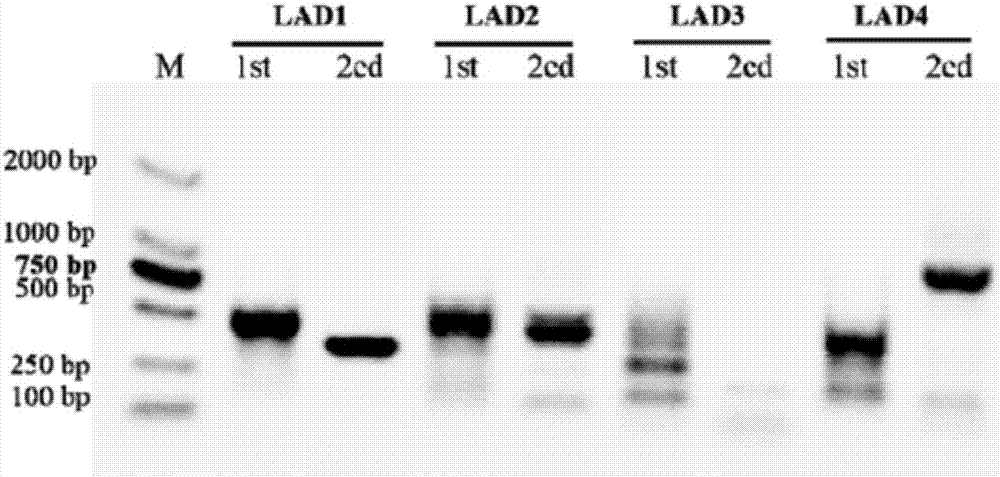
:启动子是指能与RNA聚合酶作用并能起始转录的一段DNA序列,被称为调控基因表达的枢纽,它能够控制基因的表达水平、表达部位及表达方式。为了克服组成性启动子,如花椰菜花叶病毒35S启动子(CaMV35spromoter)、激动蛋白启动子(Actinpromoter)和玉米泛素启动子(Ubiquitinpromoter),在植物体内持续、高效表达时,对植物造成生长发育造成的不利影响。组织特异性或诱导性启动子的研究和应用越来越受到科研工作者的重视,通过组织特异性或诱导性启动子,不仅能控制基因的精确表达,而且还能避免过量表达对转基因植株的负面影响。组织特异性启动子是在植物的绿色组织(叶片)、分生组织(茎尖、根尖、幼芽)、维管组织(韧皮部、木质部及块茎)、薄壁组织、花粉、种子、果实和胚乳等组织中特异表达的启动子。它能够驱动外源基因在特定时间、特定部位表达积累,增加区域表达量,往往表现出发育调节的特性。其中维管组织特异性启动子主要分为韧皮部特异性启动子和木质部特异性启动子。韧皮部在植物体内,是负责运输有机物质的主要部位,富含糖等,因此成为细菌、真菌、病毒等植物病源和刺吸式昆虫的侵害目标。韧皮部特异启动子可以为抗病虫作物的生物技术育种提供启动元件。木质部是运输水分、无机离子的主要部位,起到支撑植物的作用。木质部特异启动子在深入了解木材形成过程中的分子机制和材性改良的基因工程育种中有重要意义。象草是热带亚热带地区的优良饲草,适口性好,利用率高。而且还能代替煤炭石油发电,种植1公顷的象草燃料产生的能量可替代36桶石油。但是象草中,木质素含量过高,影响反刍动物,如牛的消化速率,从而不利于牲畜增重。木质素同时也是制浆造纸工业的限制因素,因为要将木质素去除之后,才能获得纯的纤维素和半纤维素进行造纸。因此,木质素的调控是牧草或能源草培育的方向之一。通过维管组织特异性启动子特异启动外源基因控制在维管中的表达具有重要的理论和实践意义。技术实现要素:本发明的首要目的在于克服现有技术的缺点与不足,提供一种象草维管组织特异性启动子,该启动子可应用于植物特定组织表达,从而为植物的转基因育种提供有效的手段和工具。本发明的另一目的在于提供所述的启动子的应用。本发明的目的通过下述技术方案实现:一种象草维管组织特异性启动子,选自如下任一序列:(a)含有如SEQIDNO.1~9任一所示的核苷酸序列,或具有与SEQIDNO.1~9任一所示序列互补的核苷酸序列;(b)凡是经过人工修饰的,与SEQIDNO.1~9任一所示的核苷酸序列具有至少75%同源性的核苷酸序列。所述的启动子从象草中克隆获得,或通过人工合成方法获得。所述的维管组织特异性表达启动子在植物维管组织特异性表达调控基因中的应用。所述的植物优选为烟草。所述的应用包括用所述的象草维管组织特异性启动子转化植物、并通过损伤和激素处理来鉴定该象草维管组织特异性启动子的调控机制,为该启动子的应用奠定了基础。一种表达载体,含有上述象草维管组织特异性启动子。所述的表达载体,是将上述象草维管组织特异性启动子替换双元表达载体pCAMBIA1305.1的CaMV35S启动子获得。一种转基因细胞,是将上述象草维管组织特异性启动子或上述表达载体转入宿主细胞获得。所述的宿主细胞为根癌农杆菌细胞。所述的根癌农杆菌细胞优选为EHA105细胞。本发明相对于现有技术具有如下的优点及效果:1、本发明提供一种从象草中克隆获得的维管组织特异性表达启动子,该启动子可应用于植物特定组织表达,并可以应用于调控植物基因表达中,从而为植物的转基因育种提供有效的手段和工具。该启动子主要能驱动基因在植株的成熟时期表达。其中,具有296bp启动子的片段的染色部位主要是初生木质部;随着片段长度的增加,染色部位向两端延展;由内向外,染色部位逐渐覆盖至维管形成层及韧皮部,自外向内染色效果蔓延至髓细胞中;具有1154bp启动子片段的GUS染色最深,且覆盖面积最广。2、本发明用构建好的植物表达载体转化烟草、并通过损伤和激素处理来鉴定该维管组织特异性启动子的调控机制,为该启动子的应用奠定了基础。附图说明图1为第一次hi-TAILPCR的第1轮TAILPCR和第2轮TAILPCR扩增得到的产物检测结果图;其中,M表示DNAmarkerDL2000,1st表示引物Hi-CADR1-1与AC1的第1轮TAILPCR扩增条带,2ed表示引物Hi-CADR1-2与AC1的第2轮TAILPCR扩增条带。图2为第二次hi-TAILPCR的第1轮TAILPCR和第2轮TAILPCR扩增得到的产物检测结果图;其中,M表示DNAmarkerDL2000,1st表示引物Hi-CADR2-1与AC1的第1轮TAILPCR扩增条带,2ed表示引物Hi-CADR2-2与AC1的第2轮TAILPCR扩增条带。图3为启动子缺失片段的克隆检测结果图;其中,M表示DNAmarkerDL5000;泳道1~9分别对应181~2054bp的启动子片段。图4为CADP-181启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有181bp启动子片段的阳性质粒。图5为CADP-296启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有296bp启动子片段的阳性质粒。图6为CADP-645启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有645bp启动子片段的阳性质粒。图7为CADP-758启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有758bp启动子片段的阳性质粒。图8为CADP-936启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有936bp启动子片段的阳性质粒。图9为CADP-1154启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有1154bp启动子片段的阳性质粒。图10为CADP-1340启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有1340bp启动子片段的阳性质粒。图11为CADP-1565启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有1565bp启动子片段的阳性质粒。图12为CADP-2054启动子转化烟草的GUS染色及PCR鉴定结果图;其中,CK+是含有2054bp启动子片段的阳性质粒。图13为启动子不同缺失片段转化烟草的GUS酶活性测定结果图;其中,WT表示野生型;CADP-181~CADP-2054表示缺失片段表达载体。图14为转基因烟草组培苗茎的GUS组织化学染色结果图;其中,WT表示野生型;a~i分别代表转化自缺失片段载体CADP-181、CADP-296、CADP-645、CADP-758、CADP-936、CADP-1154、CADP-1340、CADP-1565和CADP-2054的烟草茎;Ph表示韧皮部;Ca表示形成层;SX表示次生木质部;PX表示初生木质部;Pi表示髓;标尺为200μm。图15为启动子对损失及激素的响应效果图;其中,WT表示野生型;CK表示空白对照(无处理);虚线框中的叶片在理论上有响应;“*”为与对照相比有明显响应的叶片。具体实施方式下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例11材料1.1植物材料:象草取自华南农业大学草业科学系引种园。2方法2.1维管组织特异性表达启动子的获得按照植物基因组DNA提取试剂盒的操作说明提取象草基因组DNA,采用hi-TAILPCR的方法,对PpCAD(华南象草肉桂醇脱氢酶)基因ATG上游2054bp启动子序列(命名为PpCADPRO的启动子区域)进行克隆,用4条上游简并引物LAD(1/2/3/4),1条上游通用引物AC1和3条靠PpCAD基因5’端的下游同向特异性引物Hi-CADR1-0、Hi-CADR1-1和Hi-CADR1-2进行三轮巢式PCR扩增。根据第1次hi-TAILPCR得到的序列,再次设计3条靠近5’端的特异性下游引物Hi-CADR2-0、Hi-CADR2-1和Hi-CADR2-2以相同方法进行3轮扩增。PCR的引物序列如表1所示,PCR反应程序如表2所示,第1次hi-TAILPCR的过程如表3所示,第2次hi-TAILPCR的过程基本同表3,区别仅在于所使用的引物为Hi-CADR2-0、Hi-CADR2-1和Hi-CADR2-2。PCR反应结束之后,经过1%琼脂糖凝胶电泳检测每一轮PCR产物,将第1次hi-TAILPCR和第2次hi-TAILPCR中得到最长的产物(即第1次hi-TAILPCR中用LAD4得到的产物(约900bp)和第2次hi-TAILPCR中用LAD2得到的产物(约1400bp))回收,连接至载体19-Tvector(宝生物工程大连有限公司)上T-克隆后送测序,并将测序结果进行拼接,共得到2300bp启动子序列,设计上游引物F1和下游引物R1再次扩增启动子序列,回收产物连接至载体19-Tvector(宝生物工程大连有限公司)上,得到T-PpCADPRO质粒,并送公司进行测序。测序后,除去5’端部分峰值不稳定的区域,最终得到2054bp的启动子片段。表1hi-TAILPCR中的引物引物名称引物序列(5’-3’)LAD1ACGATGGACTCCAGAGVNVNNNGGAALAD2ACGATGGACTCCAGAGBNBNNNGGTTLAD3ACGATGGACTCCAGAGVVNVNNNCCACLAD4ACGATGGACTCCAGAGBDNBNNNCCAAHi-CADR1-0AAAAATGACTGCGCGAGGGAATGCHi-CADR1-1ACGATGGACTCCAGTCCGATCGAGCAGGAAGGGGAAGGACGHi-CADR1-2GGTGTAGGTGTAGGGGGAGAGGTGGHi-CADR2-0AGCTGGGATTTGATAGGCACTTTGCHi-CADR2-1ACGATGGACTCCAGTCGGGTGGGGGGGCTGTTACCATCCTGHi-CADR2-2GGTTGACAGCTGGTTGAGCAAGCCCAC1ACGATGGACTCCAGAGF1GGTCGTGTCGTATTTTCTTR1CCTTCGGTGTGAGACCGGCC注:V=A/C/G,N=A/C/G/T,B=C/G/T,D=A/G/T表2hi-TAILPCR反应程序表3hi-TAILPCR反应体系2.2启动子基因序列分析利用DNAman对测序结果进行整理,采用在线分析软件NeuralNetworkPromoterPrediction(http://www.fruitfly.org/seq_tools/promoter.html)分析转录起始位点,经同源性比较后,在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)中分析顺式作用元件。2.3启动子缺失片段载体构建根据顺式作用元件分析结果,对启动子进行分段。通过设计含有XbaI和BglII两个酶切位点将分段的启动子片段替换pCAMBIA1305.1(北京天恩泽基因科技有限公司,细菌筛选标记为Kan,植物筛选标记为抗Hpt基因)的CaMV35S启动子,构建了PpCADPRO启动子的缺失表达载体。其中,PpPro-Bg-R为带有BglII酶切位点且紧接起始密码子ATG的下游引物,PpPro-Xba-F1~PpPro-Xba-F9为带有XbaI酶切位点的上游引物。以T-PpCADPRO质粒为模板,进行PCR,得到的产物经XbaI和BglII双酶切后,再与经XbaI和BglII双酶切后的pCAMBIA1305.1通过T4DNA连接酶连接,连接液涂布于含50μg/ml的卡那霉素LB平板上,长出的克隆再通过表4中的引物进行进一步鉴定,最后提取质粒通过XbaI和BglII双酶切鉴定,得到分别含有9个不同长度的启动子片段的重组载体。表4启动子缺失片段载体构建中的引物引物名称引物序列(5’-3’)PpPro-Bg-RGAAGATCTCCTTCGGTGTGAGACCGGCCPpPro-Xba-F1GCTCTAGAGCGCTCCTCCCCACTCTCCTPpPro-Xba-F2GCTCTAGAGATCCTCTGCAGTCGACTGCPpPro-Xba-F3GCTCTAGACCAGTGGTGCATGTTATCAGPpPro-Xba-F4GCTCTAGATGGCTCCGCCGCTACAGCTPpPro-Xba-F5GCTCTAGACTGGGCTTGCTCAACCAGCTPpPro-Xba-F6GCTCTAGATCCAGCAAGTACAAACCTAAPpPro-Xba-F7GCTCTAGATGAACGATTGGAGGCCATGCPpPro-Xba-F8GCTCTAGATGTGGCTATTGGAAATTTGAPpPro-Xba-F9GCTCTAGAAGCTAGTATTACGTGGGGTC2.4烟草的遗传转化将构建好的9个重组载体分别采用冻融法转入农杆菌EHA105中,以K326烟草作为植物材料,采用叶盘法,将表达载体通过农杆菌侵染法转入烟草中。2.5转基因烟草鉴定待烟草生长,并生长成为成熟植株时,通过PCR鉴定和GUS组织化学染色的方法对转基因植株进行鉴定。PCR鉴定所用引物为表4中的引物。2.6转基因烟草的GUS组织化学染色为探究不同启动子片段的表达特异性及表达差异,对9个PpCADPRO基因启动子缺失片段的烟草组培苗经行了GUS组织化学染色。2.7转基因烟草对损失及激素的响应在转基因烟草移栽1个月后,挑选含有不同缺失片段但长势一致的转基因苗进行生物与非生物处理的响应实验。设置1/10(MS液体培养基稀释10倍)MS液体培养基即空白处理、镊子刺伤叶盘、100μmol/LGA(赤霉素)、100μmol/LMeJA(茉莉酸甲酯)、100μmol/LABA(脱落酸)共5个处理,采用24孔培养板,在不同培养孔中对烟草进行培养24h,每个处理孔中的液体培养基为3mL。处理后的叶片立即进行GUS染色处理,观察不同缺失片段启动子对非生物胁迫的响应。3结果与分析3.1PpCADPRO启动子的克隆以象草基因组为模板,经过两次hi-TAILPCR,最终得到PpCAD基因ATG上游2054bp启动子序列(如SEQIDNO.1所示),命名为PpCADPRO。采用在线分析软件线NeuralNetworkPromoterPrediction预测该启动子的转录起始位点为A,位于ATG上游156bp处。包含17个TATA-box和12个CAAT-box。此外,还有AC-Ielement、CAT-box、CGTCA-motif、GARE-motif、ABRE、CCAATBOX1、ARE、W-box等多个顺式作用元件。3.2启动子缺失片段载体构建根据启动子分析结果,对PpCADPRO进行分段,根据表4中的引物进行PCR反应,可获得大小分别为181bp(如SEQIDNO.2所示)、296bp(如SEQIDNO.3所示)、645bp(如SEQIDNO.4所示)、758bp(如SEQIDNO.5所示)、936bp(如SEQIDNO.6所示)、1154bp(如SEQIDNO.7所示)、1340bp(如SEQIDNO.8所示)、1565bp(如SEQIDNO.9所示)和2054bp的9个片段(图3)。片段两端带有BglII和Xba两个酶切位点,进行双酶切,将9个启动子片段分别替换pCAMBIA1305.1的CaMV35S启动子,以驱动GUS基因的表达,这九个重组载体分别命名为CAD-181、CAD-296、CAD-645、CAD-758、CAD-936、CAD-1154、CAD-1340、CAD-1565、CAD-2054。3.3烟草的遗传转化与鉴定通过冻融法将构建好的9个载体转化农杆菌感受态EHA105,并活化阳性菌落作为种质液,扩繁后侵染烟草叶盘。待转基因苗移栽后,分别取每个转基因植株的叶片进行GUS预染色。鉴定结果显示(图4~12),CADP-936(缺失片段表达载体)的全部22株转基因植株叶片均能被GUS染色,但CADP-2054有7株植株叶片不能被染色,约占植株总数的30%。此外,CADP-181、CADP-758和CADP-1154分别有5株、4株和3株不能被染色,约占植株总数的23%、21%和8%。CAD-296、CADP-645、CADP-1340和CADP-1565都有2株不能被染色,分别占植株总数的11%、15%、8%和9%。挑选生长一致,GUS预染色结果为阳性的烟草植株,进行PCR鉴定。结果表明,在所挑选的GUS预染色为阳性的转基因植株中,都能扩增出与对照大小一致的片段),证明9个PpCADPRO启动子缺失片段载体成功转化到烟草中。选择不同3个生长时期的9个PpCADPRO缺失片段转化烟草后基部茎(第3节以下)进行GUS酶活性的检测,评价不同缺失片段启动效率。在生长时期为3个月时,转不同长度的启动子的烟草GUS酶活性都达到最高,当PpCADPRO启动子的长度为1154bp时,启动效率最高(图13)。说明PpCADPRO启动子在植物发育的前期启动效率不高,它主要能驱动基因在植株的成熟时期表达。3.4转基因烟草的GUS染色差异分析烟草组培苗的茎在经过GUS染色后也表现出不同的着色差异,且这些差异还体现在横切面的着色部位上(图14)。对照(野生型)没有着色,具有181bp启动子片段的茎着色效果也不明显,只能在初生木质部附近检测到轻微的GUS活性;除了181bp以外,所有片段的木质部都能被GUS染色,但随着片段长度的改变,着色的位置和强度也发生着变化。具有296bp启动子的片段的染色部位主要是初生木质部;随着片段长度的增加,染色部位向两端延展。由内向外,染色部位逐渐覆盖至维管形成层及韧皮部;自外向内染色效果蔓延至髓细胞中;具有1154bp启动子片段的GUS染色最深,且覆盖面积最广。3.5启动子不同缺失片段对损伤及激素的响应对叶片处理的5个外界因素分别为机械损伤、100μmol/LGA、100μmol/LMeJA和100μmol/LABA。含有长度为645bp以上的启动子缺失片段在损伤处理后表现出较高的GUS活性;含有长度为758bp以上的启动子缺失片段在GA理后表现出较高的GUS活性;含有长度为1340bp以上的启动子缺失片段在MeJA处理后表现出较高的GUS活性;只有全长启动子表现出对ABA的相应(图15)。说明PpCADPRO启动子序列中的确含有对外界响应的顺式作用元件,响应不同外界因素的启动子片段和预测结果基本一致。而且,启动子对外界的响应可能是元件本身与其它增强或抑制表达元件共同作用的结果。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1