一种鱼鳞胶原蛋白水解肽的制备方法与流程
本发明涉及一种鱼鳞胶原蛋白水解肽的制备方法。(二)
背景技术:
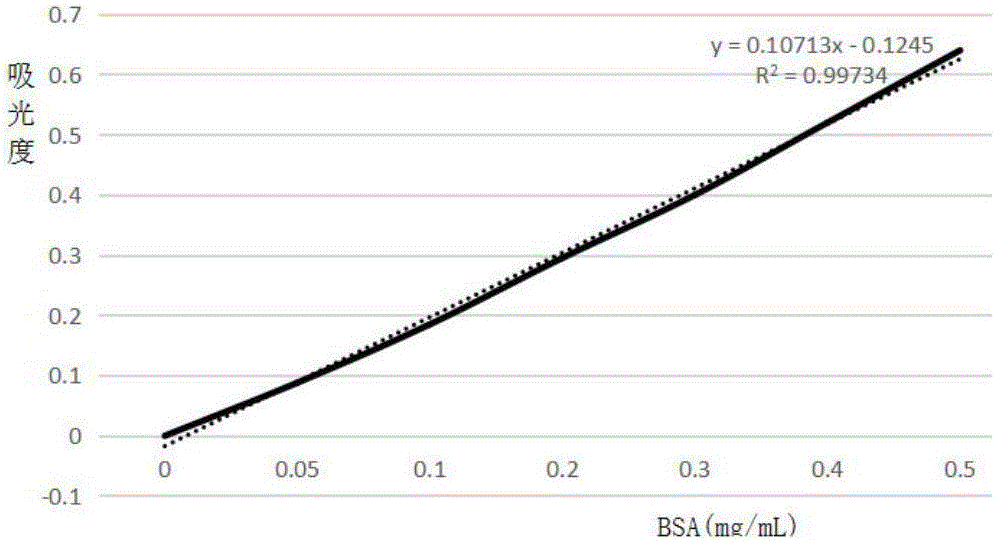
:1.鱼鳞的组织成分鱼鳞,简而言之就是鱼身上的鳞片,一般不食用。在日常生活中,通常将鱼鳞刮下当废弃物丢掉。鱼鳞既是鱼的真皮层变形物,又是鱼体与外界接触的边缘组织。鱼鳞作为一种特殊骨质衍生物是鱼类真皮层胶原质经长期进化而形成的。羟基磷灰石和蛋白质排列成有规律的空间结构,是鱼鳞的主要组成成分。鱼鳞胶原蛋白质约占鱼鳞总重量的50%~70%,其中以胶原蛋白和鱼鳞硬蛋白为主。因此,鱼鳞中丰富的胶原蛋白为其提供了开发利用的资源。2.鱼鳞的利用现状中国是世界最大的淡水鱼养殖国,而且是唯一养殖量大于捕捞量的国家。其中,养殖草鱼的产量最多,占世界养殖总产量的90%以上。鱼鳞作为鱼产品加工过程中产生的下脚料之一,虽然含有丰富的蛋白质,但受技术、观念的限制,尚未得到充分利用,其中大部分被当做废弃物扔掉,造成了环境污染和资源浪费。目前,鱼鳞作为水产品加工过程中产生的废弃物,还未得到有效利用。迄今为止,世界上对鱼鳞的研究与利用主要包括以下几个方面:提取鱼鳞胶原蛋白;制备鱼鳞胶原肽;提取卵磷脂;制备羟基磷灰石等。但上述制备工艺还不成熟,尚未形成完整的废物利用体系。3.鱼鳞胶原蛋白肽随着世界水产行业的发展,水产加工业越来越受到人们关注,加工同时产生大量下脚料,为鱼体重的30%~50%,这其中有5%约为鱼鳞。这些鱼鳞目前主要作为废弃物丢弃,其中一小部分作为提取胶原蛋白的原料加以利用。鱼鳞加工下脚料的主要成分为蛋白质,大约占鱼鳞总质量的70%,主要包括胶原蛋白和鱼鳞硬蛋白。胶原蛋白在蛋白质中比重约为25%~30%,既是动物结缔组织中的主要成分,也是哺乳动物体内含量最多、分布最广的功能性蛋白。胶原蛋白在细胞间信息的传递、组织的形成、成熟、以及伤口愈合、钙化作用关节润滑、血液凝固、和衰老等过程中也起到一定的作用。胶原蛋白作为生物科技产业最具关键性的原材料之一,在医学材料、化妆品、食品工业等领域均有着广泛应用。动物结缔组织中的胶原蛋白经适度水解后得到胶原肽。胶原肽具有良好的胶凝性、乳化性、增稠性和成膜性等功能特性,现已在食品、化妆品及医药行业中得到广泛应用。2006年世界胶原肽的产量已达20万吨,其中,猪、牛等哺乳动物的皮和骨作为主要生产原料。但随着世界各国相继出现的疯牛病、口蹄疫等疾病,从水产品中获得胶原蛋白肽被提上议程。目前,国内外对于鱼胶原肽的研究,主要有ACE抑制肽、抗氧化肽、促进学习记忆活性肽、抗冷冻肽等。我国淡水鱼资源丰富,经水产加工后每年可产生鱼鳞65万吨,其中我国每年鱼鳞废弃达30万吨左右。草鱼,是我国“四大家鱼”之一,其养殖产量、消费量和产值均居淡水鱼首位。草鱼鱼鳞约占鱼体重3%~5%左右,计算下来每年大约可生产15.8万吨鱼鳞。我国虽然鱼鳞资源丰富,但鱼鳞加工企业存在规模小、分散的问题,所以我国对鱼鳞的研究与开发利用相对滞后世界水平。糖尿病己经成为世界上继心脑血管疾病、恶性肿瘤之后第三位严重危害人类健康的慢性疾病,其中2型糖尿病(type2diabetesmellitus,T2DM)占糖尿病总发病率的90%~95%,是临床上最常见的代谢紊乱疾病,因其患病率高、患者数多,且呈逐年增长趋势,对人群健康构成严重威胁,已成为全球性的重要公共卫生问题。临床上α-葡萄糖苷酶抑制剂是治疗糖尿病的主要手段之一,其中α-葡萄糖苷酶(EC3.2.1.20,α-glucosidase)是一种存在小肠绒毛粘膜细胞刷状缘的酶类,通过水解α-1,4糖苷键,可以从淀粉和其它有关多糖的非还原端水解葡萄糖,人体对摄入的淀粉、蔗糖等碳水化合物的吸收利用,依赖于小肠内该酶的活性。α-淀粉酶属α-葡萄糖苷酶,是人体中碳水化合物转化的关键酶之一,能催化α-1,4-糖苷键水解,人体对淀粉、糊精等碳水化合物的吸收依赖于小肠刷状缘上该类酶的活性。研究发现,α-淀粉酶抑制剂对肠道内唾液及胰α-淀粉酶的活性具有抑制效果,遏制食物中淀粉及其他碳水化合物的转化利用,因此具有降低血糖的效果。而α-葡萄糖苷酶抑制剂可通过催化葡萄糖降解,来延缓葡萄糖的消化吸收,降低餐后血糖。鉴于此,以草鱼鱼鳞为研究对象,旨在研究草鱼鱼鳞中蛋白水解肽中具有抑制α-葡萄糖苷酶和α-淀粉酶的降糖肽的制备工艺,为鱼鳞进一步开发利用提供途径,变废为宝。(三)技术实现要素:本发明的目的是提供一种安全性好、易吸收,并且提取得率高,对α-葡萄糖苷酶与α-淀粉酶均有明显抑制效果的鱼鳞胶原蛋白水解肽的制备方法。为实现上述目的,本发明采用如下技术方案:一种鱼鳞胶原蛋白水解肽的制备方法,所述的制备方法按如下步骤进行:(1)原料预处理:将废弃的鱼鳞进行冲洗、浸泡、除杂,备用;(2)制备鱼鳞粉:一次浸石灰水:取经过步骤(1)预处理的鱼鳞,以料液质量比1:2~4浸于0.2wt%~0.4wt%石灰水中,在pH值为12~12.5、温度为10~20℃下浸泡7~10天,期间更换新鲜的石灰水4~5次;浸碱处理:将一次浸石灰水后的鱼鳞用清水洗涤干净,以料液质量比1:20~30投入1wt%~3wt%氢氧化钠溶液中浸泡12~24h,然后倒去碱液,取出鱼鳞,用清水冲洗、浸泡,直至碱液完全除去;浸酸处理:将浸碱处理后的鱼鳞以料液质量比1:20~30浸于1wt%~3wt%盐酸溶液中,搅拌并用pH计监测pH值,当盐酸用尽时更换新盐酸溶液,直至pH值保持在3~4之间并不再波动,然后倒去酸液,取出鱼鳞,用清水冲洗至pH值为6~7;二次浸石灰水:将浸酸处理后的鱼鳞以料液质量比1:3~5浸于0.2wt%~0.4wt%石灰水中7~10天,且每隔3~5天更换一次新鲜的石灰水,浸石灰水完毕之后,取出鱼鳞先用清水冲洗,再用pH值3~4的稀盐酸溶液浸泡4~6h将石灰水完全除去,最后用清水洗涤使pH值为6~7,干燥后粉碎,得到鱼鳞粉(40~300目,优选200目);(3)酶法提取鱼鳞胶原蛋白:将步骤(2)所得鱼鳞粉以料液质量比1:10~40(优选1:30~40)与去离子水混合,然后加入蛋白酶,在45~55℃、pH值6~10的条件下提取30min~9h(优选30min~2h),之后经离心(3000~5000r/min,15~30min),上清液用截留分子量为3000~5000Da的超滤膜进行脱盐浓缩后,冷冻干燥,得到鱼鳞胶原蛋白;所述的蛋白酶选自复合风味蛋白酶(标称活力500LAPU/g)、碱性蛋白酶(标称活力2.4AU-A/g)、复合蛋白酶(标称活力1.5AU-N/g)或中性蛋白酶(标称活力0.8AU-N/g),均可商购获得;所述蛋白酶的质量用量为鱼鳞粉质量的1%~6%(优选1.5%~3%);最优选的提取条件为:温度50℃,pH值6.5,提取时间1h,料液比1:35,所述蛋白酶为复合蛋白酶(标称活力1.5AU-N/g),其质量用量为鱼鳞粉质量的3%;(4)酶解制备鱼鳞胶原蛋白水解肽:取步骤(3)所得鱼鳞胶原蛋白,以料液质量比1:5~40(优选1:30~40)与去离子水混合,然后加入复合蛋白酶(标称活力1.5AU-N/g),在pH值5.5~7.5、40~60℃的条件下恒温酶解20min~8h(优选2~4h),之后灭酶(100℃,15min),经离心(3000~5000r/min,15~30min),上清液减压浓缩后,冷冻干燥,得到鱼鳞胶原蛋白水解肽;所述复合蛋白酶的质量用量为鱼鳞胶原蛋白质量的1%~5%(优选2%~4%);最优选的酶解制备条件为:温度50℃,pH值6.5,提取时间3h,料液比1:35,复合蛋白酶(标称活力1.5AU-N/g)的质量用量为鱼鳞胶原蛋白质量的4%。与现有工艺相比,本发明的优势体现在:(1)鱼鳞胶原蛋白作为天然的生物资源,具有合成高分子材料无法比拟的生物相容性和生物可降解性,可广泛应用在医药,如治疗真皮损伤或缺陷、美容整形、改善睡眠、增强机体免疫力等方面中的作用已获得共识。一般胶原蛋白粉是以牛皮、牛骨、猪皮、猪骨或鱼皮等为原料制成的,但由于陆生动物各种疫病较多,以牛或猪的皮骨为原料生产的胶原蛋白有受疫病污染之虞;且牛、猪或鱼的皮骨,因原料富含脂肪会影响萃取率及产品澄清度,致使后续利用受到影响。鱼鳞胶原蛋白比畜禽胶原蛋白更安全、更易吸收,因而更受市场欢迎。(2)鱼鳞加工下脚料的主要成分为蛋白质,大约占鱼鳞总质量的70%,目前国内近一半的鱼鳞废弃没有利用,已利用的主要集中在鱼胶原肽的血管紧张素转化酶抑制肽、抗氧化肽、促进学习记忆活性肽、抗冷冻肽等,关于抑制糖吸收的降糖肽鲜有研究。(3)本发明对酶法制备鱼鳞胶原蛋白水解肽的方法进行了筛选与优化,鱼鳞胶原蛋白水解肽的得率可达5.708%。分别以水解度、对α-葡萄糖苷酶的抑制率、对α-淀粉酶的抑制率为筛选指标,优化了酶法制备鱼鳞胶原蛋白水解肽的最佳水解条件,优选复合蛋白酶作为水解酶,复合蛋白酶的最佳作用条件,即pH值6.5,温度50℃的条件下,优选酶解条件为:酶解时间3h,酶与底物浓度比4%,料液比1:35,在此条件下,水解度为42.34%,对α-葡萄糖苷酶的抑制率为52.17%,对α-淀粉酶的抑制率为59.61%。该工艺条件温和,绿色环保,符合保健食品的生产要求。且保存工艺简单,易放大生产。(四)附图说明图1为实施例第3.1节中考马斯亮蓝法测蛋白质含量标准工作曲线;图2为实施例第3.4.5节中Folin-Phonel法测蛋白质含量的标准工作曲线;图3为实施例第3.4.6.1节中不同水解时间鱼鳞胶原蛋白的水解度;图4为实施例第3.4.6.1节中不同水解时间水解蛋白肽对α-葡萄糖苷酶抑制率影响;图5为实施例第3.4.6.1节中不同水解时间酶法水解蛋白肽对α-淀粉酶抑制率影响;图6为实施例第3.4.6.2节中不同料液比酶法提取蛋白质的水解效果;图7为实施例第3.4.6.2节中不同料液比水解蛋白肽对α-葡萄糖苷酶抑制率影响;图8为实施例第3.4.6.2节中不同料液比水解蛋白肽对α-淀粉酶抑制率影响;图9为实施例第3.4.6.3节中不同浓度酶法提取蛋白质的水解效果;图10为实施例第3.4.6.3节中不同浓度酶法水解蛋白肽对α-葡萄糖苷酶抑制率影响;图11为实施例第3.4.6.3节中不同浓度酶法水解蛋白肽对α-淀粉酶抑制率影响。(五)具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。实施例1.实验材料与仪器农贸市场收集的废弃草鱼鱼鳞;氢氧化钙;氢氧化钠;盐酸。数显恒温水浴锅,HH-2;筛网;高速离心机,DL-5M型,湖南星科科学仪器有限公司;水域恒温摇床,ZHWY-200B型,上海智成分析仪器制造有限公司;冷冻恒温培养摇床,ZHWY-2102C型,上海智成分析仪器制造有限公司;数控超声波清洗器:KQ2200DE型,昆山市超声仪器有限公司;数显恒温磁力搅拌器:86-2型,杭州仪表电机有限公司;电子天平:AL104型,梅特勒-托利多仪器(上海)有限公司;PH计:DELTA320型,梅特勒-托利多仪器(上海)有限公司;可见分光光度计:721型,上海元析仪器有限公司;电热恒温水槽:DK-8D型,上海森信实验仪器有限公司;洁净工作台:VS-840K-U型,苏州安泰空气技术有限公司;高压蒸汽灭菌锅:ES-315型。2.实验方法2.1原料预处理将在市场上收集的废弃新鲜草鱼鱼鳞用清水反复冲洗,浸泡,以除去粘液和污物,仔细剔除混入的其它杂质,最后将干净的鱼鳞置于阴凉处自然风干。在开始实验之前应将干鱼鳞在水中浸泡使其恢复柔软状态。实验气温在20℃左右时,清水浸泡鱼鳞为1~2天,但在浸泡过程中必须经常换水,以免发生腐败。2.2鱼鳞处理工艺取经预处理的鱼鳞,浸于浓度为0.3wt%的石灰水中。石灰水浓度可随气温变化适当调节,例如:气温较高时石灰水浓度可稍微低些,气温低时浓度要稍微高些。鱼鳞与石灰水的料液质量比为1:3,pH值区间为12~12.5,温度最好调节在15℃,浸泡时间约7~10天。浸石灰水的目的是除去鱼鳞内部的部分色素和鱼鳞表面上尚未冲洗掉的粘液污物以及光鳞物质。在浸石灰水过程中要注意及时更换新鲜的石灰水,在7~10天的浸泡期间大约更换4~5次,以免发臭。草鱼的鱼鳞有一层很厚的皮脂和色素,浸石灰水之后进行脱色处理。将浸石灰水后的鱼鳞用清水洗涤干净后,投入2wt%氢氧化钠溶液中浸泡16h,鱼鳞与氢氧化钠溶液的重量之比约为1:25,这个过程可把鱼鳞黑色皮脂层去掉,而且色素也会溶于氢氧化钠溶液中。然后倒去废液,取出鱼鳞,用清水反复冲洗,待大部分碱液除去后,再浸入清水中,不断换水,以确保碱液完全除去。浸碱结束之后,再用2wt%盐酸溶液再次浸泡鱼鳞,经常搅拌,及时用pH计检测pH值大小,以检查盐酸是否已经用尽,是否需要更换新盐酸溶液。经pH值确认待碱质完全除去后,该反应渐渐减慢,应逐步将盐酸浓度减小以免损坏鱼鳞。最后盐酸溶液的pH值将保持在3~4之间,鱼鳞片柔软透明,pH值不再波动,表示碱质已完全除去。取出鱼鳞后用清水反复冲洗使pH值到达6左右。为了能得到更纯粹的鱼鳞,除去鱼鳞内部的有机杂质,还需要再进行一次浸石灰水,石灰水的浓度仍为0.3wt%,浸泡时间7~10天,且每隔3~5天要换一次新的石灰水。经一次处理后,脱去碱质的鱼鳞已经发生膨胀,所以这次除去鱼鳞内部杂质就比没脱碱时更容易。浸石灰水完毕之后,先用清水反复冲洗,再用稀盐酸溶液(pH在3~4之间)浸泡5h将石灰水完全除去,然后用清水洗涤使pH值到6左右,干燥后粉碎,得到鱼鳞粉,作为后续试验原料。2.3鱼鳞粉颗粒大小对鱼鳞胶原蛋白得率的影响取0.2g经处理的鱼鳞粉(40目,100目,200目,300目),按料液质量比1:30各自分别加入2wt%盐酸及2wt%醋酸的混合溶液中,20℃放置12h,100℃水浴30min,8000r/min离心20min,取上清,考马斯亮蓝法测蛋白吸光度。2.4鱼鳞胶原蛋白含量测定采用考马斯亮蓝法。考马斯亮蓝G-250染色液:称取考马斯亮蓝G-25050mg溶于25ml95%wt乙醇,再量取体积分数为85%磷酸60ml加入烧杯,转入500ml容量瓶,定容,抽滤,得考马斯亮蓝G-250溶液;标准样品:0.5mg/ml牛血清蛋白。3结果3.1考马斯亮蓝标准曲线分别吸取0.01~0.08ml标准蛋白质溶液于10ml试管中,各试管补加蒸馏水至0.5ml。各管加入3ml考马斯亮蓝G-250溶液,每加完一管立即在涡旋混合器上混合,不要太剧烈,放置10~15min,于595nm处测定其吸光度。以标准蛋白浓度为横坐标,用吸光度值为纵坐标作图,即可得一条标准曲线,如图1。3.2鱼鳞颗粒大小对蛋白得率影响,如表1。表1不同目数鱼鳞胶原蛋白得率过筛目数鱼鳞胶原蛋白得率%40目2.11100目3.40200目4.16300目4.19从上述试验结果可知,过筛目数越高,鱼鳞胶原蛋白得率也越高,但200目以后鱼鳞胶原蛋白得率上升趋于平缓,且粒径越小,制备要求越高,故实验以过200目筛为最优目数。3.3鱼鳞胶原蛋白酶法提取工艺3.3.1酶种类优化准确称取1g第2.2节中所得鱼鳞粉,分别加入一定量去离子水(料液质量比1:20)和2%的复合风味蛋白酶、碱性蛋白酶、复合蛋白酶、中性蛋白酶。其中复合风味蛋白酶(无锡联合恒洲化工有限公司,pH6.0,50℃,标称活力500LAPU/g),碱性蛋白酶(无锡联合恒洲化工有限公司,pH8.0,55℃,标称活力2.4AU-A/g),复合蛋白酶(无锡联合恒洲化工有限公司,pH6.0,50℃,标称活力1.5AU-N/g),中性蛋白酶(无锡联合恒洲化工有限公司,pH6.0,45℃,标称活力0.8AU-N/g)。在各种酶最适温度与pH条件下分别提取6h后测定蛋白含量及提取得率。表2不同酶提取鱼鳞胶原蛋白效果酶种类温度℃pH蛋白浓度mg/l提取得率%碱性蛋白酶6090.0910.18中性蛋白酶5070.1530.305复合风味蛋白酶506.50.2330.466复合蛋白酶506.50.2740.55结果显示,在各酶最适宜条件下,复合蛋白酶活性最强,提取得率最高,故选取复合蛋白酶解蛋白质。3.3.2单因素试验(1)提取时间对酶法提取影响准确称取1g第2.2节中所得鱼鳞粉,分别加入一定量去离子水(料液质量比1:20)和2%的复合蛋白酶,温度50℃、pH为6.5条件下分别提取30min、1h、2h、3h、4h、5h、6h、7h、8h、9h后测定蛋白含量及提取得率。表3提取时间对酶法提取影响提取时间蛋白浓度mg/ml提取得率%30min0.2170.4341h1.3852.82h1.2092.423h0.7731.554h0.6521.35h0.3950.796h0.2740.557h0.2100.428h0.0270.0539h0.1290.026结果显示,在复合蛋白酶最适宜条件下,反应1h后提取得率最高,随着时间延长提取率反而下降。(2)酶与底物浓度比对酶法提取影响准确称取1g第2.2节中所得鱼鳞粉,分别加入一定量去离子水(料液质量比1:20)和1%、1.5%、2%、3%、4%、5%、6%的复合蛋白酶,在温度50℃、pH为6.5条件下提取1h后,测定蛋白含量及提取率。表4酶与底物浓度比对酶法提取影响酶与底物浓度比蛋白浓度mg/l提取率%1%0.3200.641.5%0.6091.222%1.1212.243%1.1352.274%1.1502.295%0.7571.516%0.2740.55结果显示,蛋白与不同浓度复合蛋白酶液,在最适宜条件下,反应1h后,2%浓度下提取率最高。(3)料液比对酶法提取的影响准确称取1g第2.2节中所得鱼鳞粉,分别加入5、10、15、20、25、30、35、40ml的去离子水和2%的复合蛋白酶,在温度50℃、pH为6.5条件下提取24h后。分别测定料液比1:10、1:15、1:20、1:25、1:30、1:35、1:40g/ml下蛋白含量及提取率。表5料液比对酶法提取的影响结果显示,料液比1:10至1:40时,蛋白提取率随之上升,但料液比为1:25之后提取率与料液比1:25时相差不大。3.3.3多因素正交试验(1)确定试验因素及水平数根据单因素试验反应的结果,设计提取时间A(30min、1h、2h)、酶与底物浓度比B(1.5%、2%、3%),料液比C(1:30、1:35、1:40)的三因素三水平进行分析。试验结果如表6。表6多因素正交试验结果分析故优选的最佳酶解条件:A2B3C2,即反应时间1h,酶与底物浓度比3%,料液比1:35,在此提取条件下,鱼鳞胶原蛋白的提取得率为5.708%。3.4鱼鳞胶原蛋白水解肽的制备工艺3.4.1制备流程取适量酶法提取蛋白后的鱼鳞胶原蛋白溶液→Folin-Phonel法测蛋白浓度→恒温酶解→100℃灭酶15min→取适量上清液测定水解度、α-葡萄糖苷酶抑制及α-淀粉酶抑制率抑制率。α-葡萄糖苷酶的活性测定方法:反应体系为1.5mL1M碳酸钠、100μL酶液、1.7mL磷酸缓冲液(pH4.3)、0.2mLpNPG(4-硝基苯基-α-D-吡喃葡萄糖苷,购自Sigma-Aldrich)。反应温度55℃、反应时间180min、底物浓度10mmol/L,以蒸馏水调零,以不加酶的反应体系为背景组(A背景),以不加多糖的反应体系为空白组(A空白),计算多糖对α-葡萄糖苷酶的抑制率为:抑制率(%)=[1-(A样-A背景)/A空白]×100%。α-淀粉酶抑制率的测定如下表7:表7α-淀粉酶抑制率测定的试剂各管于37℃水浴30min后,加入3mLDNS,经沸水浴10min,冷却后取0.5mL反应液加蒸馏水4.5mL,于A520处测吸光值。α-淀粉酶抑制率按下式计算:式中:I——α-淀粉酶抑制率;A1,A2——对照1,2号管于A520处测吸光值;A0——样品管于A520处测吸光值。3.4.2鱼鳞胶原蛋白溶液的水溶性蛋白质总量的测定取四支1.5ml离心管,并标号0、1、2、3。其中,0号管中加入蒸馏水1.0ml,1、2和3三支管中准确加入预定浓度未水解的已作处理的鱼鳞胶原蛋白溶液1.0ml,在12000rpm的速度下离心10min,分别对上清液作一定的稀释,取稀释液0.50ml加入到四支15ml试管中,分别加入4ml福林试剂D液,于室温下静置10min,然后加福林试剂E液0.5ml并混匀,于40℃下保温20min,室温冷却,在680nm下测定各管溶液的吸光度,0号为空白组。根据Folin-Phonel法测蛋白的标准曲线和稀释倍数算出蛋白含量。3.4.3鱼鳞胶原蛋白溶液中TCA可溶性短肽的含量测定取四支1.5ml离心管,并标号0、1、2、3。其中,0号管中加入蒸馏水0.5ml,1、2、3三支离心管中准确加入预定浓度已经过处的理鱼鳞胶原蛋白溶液0.5ml,所有四支管均加入0.5ml10%TCA溶液,摇匀后离心(12000rpm,10min),以下按3.4.2自“分别对上清液作一定的稀释,取稀释液0.50ml加入到四支15ml试管中……测定吸光度”进行操作。根据Folin-Phonel法测蛋白的标准曲线和稀释倍数算出TCA可溶性短肽含量。3.4.4水解度测定水解度(degreeofhydrolysis,DH)是理解和衡量蛋白水解程度和效果的重要参数,且对于建立生物大分子的功能、生物活性以及感官特性与水解作用之间的关系具有重要作用。目前有很多测定蛋白质水解度的方法,主要是根据四个原则:①测定自由α-氨基、②测定可溶性蛋白、③滴定释放的质子以及④通过渗透压测定法测定蛋白溶液的冰点。本实验根据测定可溶性蛋白质的原理来测定鱼鳞胶原蛋白的水解度。蛋白质经过水解,形成不同长度的短肽,溶解性增加,然后通过可溶性蛋白(含短肽)的含量变化来衡量蛋白质水解的程度。水解度用的是福林酚法,(水解后的多肽浓度-水解前的多肽浓度)/水解前蛋白浓度,多肽测定都经过100℃水浴15min,冷却,10%TCA沉淀的步骤。本实验运用Folin-Phonel法对可溶性蛋白质含量进行测定,鱼鳞胶原蛋白的水解度可用下式来计算:3.4.5标准曲线绘制Folin-Phonel标准曲线:y=0.10713x-0.1245,R2=0.9991,如图2。3.4.6单因素试验3.4.6.1水解时间对鱼鳞胶原蛋白水解肽的影响Folin-Phonel法检测酶法提取的鱼鳞胶原蛋白浓度。酶法提取的鱼鳞胶原蛋白(0.50g)按料液比1:40,在50℃下恒温用复合蛋白酶(3%)酶解不同时间后100℃灭酶15min,取适量上清液测定水解度(图3)、α-葡萄糖苷酶抑制率(图4)及α-淀粉酶抑制率(图5)。由图3可知,酶法提取的鱼鳞胶原蛋白在复合蛋白酶最适宜条件下,鱼鳞胶原蛋白水解度随着反应时间的延长而升高,其中反应开始后3h内升高速度最快,反应3h后速度下降,反应7h水解度虽有升高趋势但以趋于平缓。由图4可知,酶法提取的鱼鳞胶原蛋白水解肽对α-葡萄糖苷酶抑制率在0-4h内随着反应时间的延长而升高,4h后随着反应时间的延长而降低。由图5可知,酶法提取的鱼鳞胶原蛋白水解肽对α-淀粉酶抑制率在0-3h内随着反应时间的延长而升高,3h时抑制率高达60.8%,3h后随着反应时间的延长而降低,但有轻微波动。3.4.6.2料液比对鱼鳞胶原蛋白水解肽的影响Folin-Phonel法检测酶法提取的鱼鳞胶原蛋白浓度。酶法提取的鱼鳞胶原蛋白(0.50g)在50℃下恒温用复合蛋白酶(3%)酶解3h后,100℃灭酶15min,取适量上清液测定水解度(图6)、α-葡萄糖苷酶抑制率(图7)及α-淀粉酶抑制率(图8)。由图6可知,酶法提取的鱼鳞胶原蛋白水解度均随着料液比的增大而升高,其中料液比为1:5~1:25范围内上升速度最快,然后增加速度下降,1:35~1:40料液比范围内水解度虽有升高趋势但以趋于平缓。由图7可知,酶法提取的鱼鳞胶原蛋白水解肽对α-葡萄糖苷酶的抑制率随着料液比的增大而升高,其中料液比为1:5~1:30范围内上升速度最快;料液比1:35~1:40范围内水解肽对α-葡萄糖苷酶的抑制率虽有升高趋势但以趋于平缓。由图8可知,酶法提取的鱼鳞胶原蛋白水解肽对α-淀粉酶的抑制率随着料液比的增大而升高,其中料液比在1:5~1:30范围内升高速度最快,料液比1:35~1:40范围内上升趋势趋于平缓。3.4.6.3酶与底物浓度比对鱼鳞胶原蛋白水解肽的影响Folin-Phonel法检测酶法提取的鱼鳞胶原蛋白浓度。酶法提取的鱼鳞胶原蛋白(0.50g)在50℃下恒温用不同浓度复合蛋白酶酶解2h后,100℃灭酶15min,取适量上清液测定水解度(图9)、α-葡萄糖苷酶抑制率(图10)及α-淀粉酶抑制率(图11)。由图9可知,酶法提取的鱼鳞胶原蛋白水解度随着酶的浓度增大而升高,到达一定顶点后随浓度升高而下降。酶法提取的蛋白在3%浓度的酶作用下水解度最高。由图10可知,酶法提取的鱼鳞胶原蛋白水解肽对α-葡萄糖苷酶的抑制率均先随着酶与底物浓度比的增大而升高,到达最高点时,随浓度增加而下降。水解肽对α-葡萄糖苷酶的抑制率在酶与底物浓度比为3%时最高。由图11可知,酶法提取的鱼鳞胶原蛋白水解肽对α-淀粉酶的抑制率均先随着酶与底物浓度比的增大而升高,到达最高点时,随浓度增加而下降。水解肽对α-淀粉酶的抑制率在酶与底物浓度比为3%时最高。3.4.7正交试验根据单因素试验反应的结果,设计酶解时间A(2h、3h、4h)、酶与底物浓度比B(2%、3%、4%)与料液比C(1:30、1:35、1:40)的三因素三水平进行分析,以水解肽对α-葡萄糖苷酶的抑制率作为指标,结果见表8。表8多因素正交试验结果分析故优选的最佳酶解条件:A2B3C2,即酶解时间3h,酶与底物浓度比4%,料液比1:35,在此酶解条件下,鱼鳞胶原蛋白水解肽的水解度为42.34%,对α-葡萄糖苷酶的抑制率为52.17%,对α-淀粉酶的抑制率为59.61%。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1