一株高产蛋白酵母菌株C20140911及其选育、培养方法和应用与流程
本发明涉及动物饲料添加剂
技术领域:
,具体涉及一株高产蛋白酵母菌株酿酒酵母(Saccharomycescerevisiae)C20140911及其选育、培养方法和应用。
背景技术:
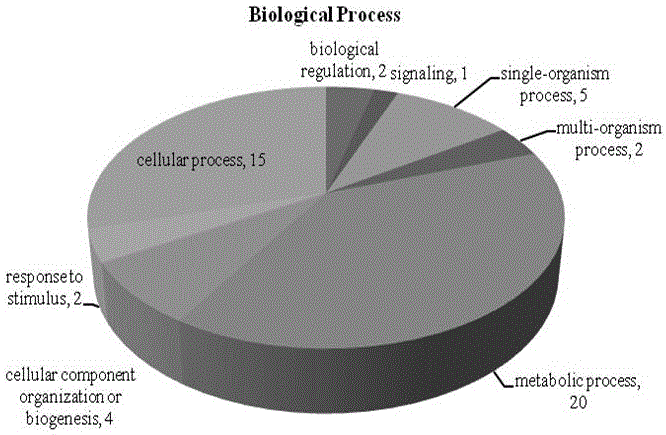
:酵母菌是一种真核单细胞微生物,具有典型的细胞结构,有细胞核、胞浆膜、细胞壁、细胞浆及其它内含物等。因酵母富含优质蛋白质、氨基酸、完整的B族维生素、以生命结合态形式存在的多种矿物质和功能膳食纤维,广泛应用于生产实际。酵母是人类应用比较早的,也是应用最为广泛的微生物,人们经常利用它的发酵作用制造各种发面食品和酿酒,如啤酒酵母应用于啤酒生产;富硒、富锌酵母作为有机微量元素的载体,使微量元素更易吸收等;在畜牧业中酵母主要作为单细胞蛋白在饲料中添加,以减少其它蛋白原料的使用。同时,也有将酵母培养物(YeastCulture,YC)作为微生态制剂的研究报道。酵母培养物是一种酵母培养的产品,是指经过严格控制条件的发酵后连同培养基一起加工制得的产品,其中的主要成分是培养基、酵母菌以及酵母菌的代谢产物。酵母代谢产物中蛋白质含量很少,但它含有其它“未知促生长因子”,用来调节动物肠道的微生态平衡,提高饲料的利用率,增加抗病力及抗应激能力,促进生长,从而提高动物的生产性能。酵母培养物在畜牧业的应用,有许多优点,因为它既不会干扰抗生素的作用,同时可以减少抗生素的使用,在呼唤食品安全,限制抗生素使用的今天,酵母产品将有更广阔的应用前景。技术实现要素:本发明的目的就是针对上述现有技术中的缺陷,为了提高菌株产蛋白水平,用以制备更好的微生态制剂及饲料添加剂,以期增强其临床使用效果,为食品安全及畜牧业生产服务,提供了一株高产蛋白酵母菌株酿酒酵母(Saccharomycescerevisiae)C20140911及其选育、培养方法和应用。为了实现上述目的,本发明提供的技术方案为:一株高产蛋白酵母菌株酿酒酵母(Saccharomycescerevisiae)C20140911,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为CGMCCNo.9675,保藏时间为2014年9月18日。上述的高生物量的富蛋白酵母菌株是在原有啤酒酵母菌Saccharomycescerevisia的基础上经过长期驯化所得。本发明的第二个目的是提供了上述一株高产蛋白酵母菌株(Saccharomycescerevisiae)C20140911的选育方法,所述选育方法是以14g麦芽汁粉状培养基、1g蛋白胨、100ml双蒸水为培养基,将培养基高压灭菌,无菌环境调初始培养液pH为5.8,接入1ml初始出发菌培养液,温度为27.3℃,转速120r/min,振摇48-72H,恒温摇床培养,反复传代;从低剂量1%的蛋白胨开始,对酵母菌株(Saccharomycescerevisiae)进行生长耐受驯化,逐步增加蛋白胨剂量至8%,经过多次复筛和传代试验,筛选出高产蛋白酵母菌株;本发明的第三个目的是提供了上述一株高产蛋白酵母菌株(Saccharomycescerevisiae)C20140911的培养方法,是将麦芽汁培养基14.0g,蛋白胨8g,双蒸水100ml,高压灭菌;无菌环境调初始培养液pH为5.8,接入种子菌1ml,在温度为27.3℃,转速120r/min,恒温摇床培养。本发明的第四个目的是提供了上述一株高产蛋白酵母菌株(Saccharomycescerevisiae)C20140911在制备动物高蛋白饲料添加剂中的应用。本发明公开的高产蛋白酵母菌株,其发酵液蛋白质含量和种类多高于原有出发菌株。本发明公开的高产蛋白酵母菌株发酵液蛋白含量为0.329mg/ml,比出发菌发酵液的0.304ml/mg提高了8.2%。本发明所述高产蛋白酵母菌株发酵液中共鉴定到肽段241个,蛋白组121个;原有出发菌株发酵液共鉴定到肽段68个,蛋白组47个,分别高出254.4%和157.4%。本发明质谱鉴定到有注释的蛋白共计109个,所述高产蛋白酵母菌株发酵液中已鉴定出特有蛋白63个,出发菌特有蛋白11个,接近出发菌的6倍;与出发菌共有蛋白35个。本发明公开的一株高产蛋白酵母菌株发酵液不仅蛋白含量高,蛋白功能和参与的代谢途径远多于出发菌。参与较多的碳水化合物代谢及能量代谢,具有唯一具有电子载体活性和转运子活性的蛋白质,可能行使着生物调控、刺激反应和定位进程等功能。本发明特有蛋白WEGO功能注释聚类分析表明,所述高产蛋白酵母菌株发酵液中63种特有蛋白,参与生物进程(biologicalprogress)的蛋白共105条注释,参与分子功能(molecularfunction)的蛋白注释77种,细胞学组分(Cellularcomponent)的蛋白注释41种。原有菌株发酵液11种中的特有蛋白,参与生物进程(biologicalprogress)的蛋白共12条注释,参与分子功能(molecularfunction)的蛋白注释7种,细胞学组分(Cellularcomponent)的蛋白注释5种。本发明特有蛋白GO功能注释表明,所述高产蛋白酵母菌株发酵液的特有蛋白中,生物进程(BiologicalProcess)分类中主要参与有细胞过程(cellularprocess)的蛋白注释有33种,参与代谢过程(metabolicprocess)蛋白注释有32种,单一生物过程(single-organismprocess)有10种蛋白注释,细胞生物合成的(cellularcomponentorganizationorbiogenesis)有8种,其余的参与有定位(localization)5种、应激反应(responsetostimulus)2种、生物调节(biogicalregulation)6种等。参与分子功能(MolecularFunction)的主要有催化活性(catalyticactivity)蛋白注释30种,结合蛋白(binding)注释27种,分子结构蛋白(structuralmolecule)注释6种,其余有转运蛋白(transporter)3种、具有转录因子活性的结合蛋白(proteinbindingtranscriptionfactoractivity)1种、具有转录活性的核酸(nucleicacidbindingtranscriptionfactoractivity)1种等注释;以及抗氧化活性(ntioxidantactivity)注释1种,电子载体活性(electroncarrieractivity)1种。参与CellularComponent分类中注释蛋白有细胞(cell)的18种,细胞器(organelle)9种,大分子化合物(macromolecularcomplex)9种,胞外区(extracellularregion)4种,细胞膜(membrane)4种,膜封闭腔(membrane-enclosedlumen)1种。出发菌株发酵液特有蛋白中,生物进程(BiologicalProcess)分类中主要参与代谢过程(metabolicprocess)的有8种蛋白注释,单一生物过程(single-organismprocess)有5种蛋白注释,细胞过程(cellularprocess)的蛋白注释有4种,其余有参与应激反应(responsetostimulus)的2种、定位(localization)的1种、细胞的生物合成(cellularcomponentorganizationorbiogenesis)的1种等。分子功能(MolecularFunction)分类中注释蛋白主要有参与催化活性(catalyticactivity)6种,结合蛋白(binding)6种,转运活性(transporteractivity)1种。细胞组成(CellularComponent)分类中注释蛋白有参与细胞(cell)组成的2种,细胞器(organelle)组成的1种,大分子化合物(macromolecularcomplex)组成的1种,胞外区(extracellularregion)组成1种,细胞膜(membrane)组成的4种。本发明KEGG通路注释表明,所述高产蛋白酵母菌株发酵液特有蛋白在KEGG数据库中进行比对分析后,得到其中一些匹配蛋白的代谢途径,剩余蛋白因研究有限,还无法找到其匹配的信息,匹配蛋白共参与24条代谢途径:分别为嘌呤代谢(Purinemetabolism)4种,糖酵解(Glycolysis/Gluconeogenesis)4种,光合固碳作用(Carbonfixationinphotosynthenicorganisms)2种,氮代谢(Nitrogenmetabolism)2种,丙氨酸,天门冬氨酸和谷氨酸代谢(Alanine,asparatateandglutamatemetabolism)2种,原核固碳作用(Carbonfixationpathwaysinprokaryotes)2种,丙酮酸代谢(Pyruvatemetabolism)1种,磷酸肌醇代谢(inositolphosphatemetabolism)1种,泛酸盐和CoA生物合成(PantothenateandCoAbiosynthesis)1种,乙醛酸盐和二羧酸途径(Glyoxylateanddicarboxylatemetabolism)1种,柠檬酸盐循环(Citratecycle(TCAcycle)1种,缬氨酸,亮氨酸和异亮氨酸的生物合成(Valine,leucineandisoleucinebiosynthesis)1种,甘氨酸,丝氨酸和苏氨酸代谢(Glycine,serineandthreoninemetabolism)1种,氨基糖和核苷酸糖代谢(Aminosugarandnucleotidesugarmetabolism)1种,半胱氨酸和蛋氨酸代谢(Cysteineandmethioninemetabolism)1种,细胞色素P450药物代谢(Drugmetabolism-cytochromeP450)1种,果糖和甘露糖代谢(Fructoseandmannosemetabolism)1种,精氨酸和脯氨酸代谢(Arginineandprolinemetabolism)1种,细胞色素P450外源性化学物质代谢(MetabolismofxenobioticsbycytochromeP450)1种,萘降解(Naphthalenedegradation)1种,氯代烷和氯烯烃的降解(Chloroalkaneandchloroalkenedegradation)1种,脂肪酸降解(Fattyaciddegradation)1种,酪氨酸代谢(Tyrosinemetabolism)1种,维生素A代谢(Retinolmetabolism)1种。原有菌株发酵液特有蛋白信息在KEGG数据库中进行比对分析,共参与8条代谢途径:其中果糖甘露糖代谢(Fructoseandmannosemetabolism)1种,嘌呤代谢(Purinemetabolism)1种,糖酵解(Glycolysis/Gluconeogenesis)1种,核黄素代谢(Riboflavinmetabolism)1种,甲烷代谢(Methanemetabolism)1种,戊糖磷酸途径(Pentosephosphatepathway)1种,氨基苯甲酸降解(Aminobenzoatedegradation)1种,光合固碳作用(Carbonfixationinphotosynthenicorganisms)1种)。本发明的有益效果为:本发明公开的酵母菌株其发酵液蛋白质含量和种类远高于出发菌。该菌株发酵液中蛋白质含量为0.329mg/ml,比出发菌发酵液的0.304ml/mg提高了8.2%。从该菌株发酵液中共鉴定到肽段241个,蛋白质组121个;出发菌发酵液共鉴定到肽段68个,蛋白质组47个,分别比出发菌提高了254.4%和157.4%。已鉴定出的蛋白中该菌发酵液特有蛋白63个,出发菌特有蛋白11个,与出发菌共有蛋白35个。该菌株发酵液不仅蛋白含量高,且参与的代谢通路也多,参与较多的碳水化合物代谢及能量代谢;具有唯一具有电子载体活性和转运子活性的蛋白质,可能行使着生物调控、刺激反应和定位进程等功能。该发明的菌株发酵液中蛋白功能和参与的代谢途径远多于出发菌。本发明的菌株可用于制备饲料添加剂及微生态制剂,提高动物生产性能,降低断奶仔猪腹泻,效果优于出发菌。附图说明图1为分子生物学鉴定中的凝胶电泳图。图2为ESI质谱鉴定的色谱图结果。其中,上图为原有出发菌株发酵液色谱图,下图为本发明菌株发酵液色谱图。图3为共有蛋白组WEGO功能注释聚类分析图。图4为共有组蛋白GO功能注释中的BiologicalProgress分类图。图5为共有组蛋白GO功能注释中的MolecularFunction分类图。图6为共有组蛋白GO功能注释中的CellComponent分类图。图7为特有蛋白组WEGO功能注释聚类分析图。图8为特有蛋白GO功能注释中的BiologicalProgress分类图。图9为特有蛋白GO功能注释中的MolecularFunction分类图。图10为特有蛋白GO功能注释中的CellComponent分类图。具体实施方式实施例1:培养选育方法1、一株富蛋白酵母菌株(Saccharomycescerevisiae)C20140911,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为CGMCCNo.9675,保藏日期为2014年9月18日。上述的高生物量的富蛋白酵母菌株是在原有啤酒酵母菌Saccharomycescerevisia的基础上经过长期驯化所得。上述高蛋白菌株的选育方法,是以14.0g麦芽汁粉状培养基、1g蛋白胨、100ml双蒸水为培养基(高压灭菌,无菌环境调初始培养液pH为5.8),接入1ml初始出发菌培养液,恒温摇床培养,温度为27.3℃,转速120r/min,振摇48-72H,反复传代。为培养驯化出产高蛋白的菌株,从低剂量1%的蛋白胨开始,对酵母菌株Saccharomycescerevisiae进行生长耐受驯化,逐步增加蛋白胨剂量至8%,经过多次复筛和传代试验,筛选出高生物量富蛋白酵母菌株。培养条件:麦芽汁培养基(14g),蛋白胨(8g),双蒸水(100ml),高压灭菌;无菌环境调初始培养液pH为5.8,恒温摇床培养:温度为27.3℃,转速120r/min。检测存活条件:恒温培养72h,用生理盐水稀释10倍后,用血细胞计数板检测活菌数目,可达到108/ml。该培养物中菌种为啤酒工业生产菌种,不是动植物病原;培养基中麦芽汁、蛋白胨都无毒无害,不会污染环境。上述一株富蛋白酵母菌株(Saccharomycescerevisiae)C20140911主要应用在制备动物高蛋白饲料添加剂中。(可否对此部分进行详细描述,如何添加,添加量为多少,能带来何种有益效果灯)实施例2:菌种的鉴定1.形态学鉴定:在麦芽汁琼脂培养基上菌落为乳白色,形态为圆形,边缘整齐,有光泽,平坦;显微镜观察时,菌株细胞多呈椭圆形或长卵形,细胞为芽殖,不形成菌丝,无掷孢子和子囊子孢子。2.生理生化鉴定:试验方法:菌悬液法:取一内盛2ml无菌水试管,用接种针从平板上挑取已纯化单个菌落至无菌水中稀释制成0.5麦氏浊度的均一细菌悬液,滴入需要试验的微量生化鉴定管中,每管1滴。(注:如内容物为半固体或斜面,则进行穿刺接种)试验结果:发酵试验,发酵葡萄糖、半乳糖、蔗糖、麦芽糖、和棉子糖;不发酵:乳糖、木糖、纤维二糖和海藻糖。碳同化试验,同化:葡萄糖、麦芽糖、蔗糖、半乳糖和甘露糖;不同化:纤维二糖、D-木糖、密二糖、海藻糖和L-阿拉伯糖。氮同化试验,同化:(NH4)2SO4;不同化:KNO3。醇类同化试验,同化:乙醇;不同化:山梨醇。上述实验结果表明,该菌株为酵母菌。3.分子生物学鉴定:3.1试验方法:菌液培养——DNA提取——PCR——电泳——测序——NCBIblast比对。①菌液培养:挑取斜面上酵母保存株,加入事先准备的液体麦芽汁培养基5ml中,摇床23℃培养48h,备用。②DNA提取:OMEGABIO-TEK试剂盒步骤进行提取。③PCR:引物制备:正向引物NL-1:5'-GCATATCAATAAGCGGAGGAAAAG-3',反向引物NL-4:5'-GGTCCGTGTTTCAAGACGG-3',由上海生工制备。反应体系25μL:2×TaqMasterMix12.50μL,NL-11.00μL,NL-41.00μL,DNA模板l.00μL,ddH209.50μL,TOTAL25.00μL。反应条件(35cycles):预变性:94℃,4min;变性:94℃,30s;复性:58℃,30s;T1:72℃,45s;T2:72℃,l0min;保存:15℃,∞。④电泳条件:1.4%的琼脂糖凝胶进行电泳,点样:6×LoadingBuffer(点样缓冲液)2.5μL,DNA5μL,电泳:点样后设定电泳条件为电压150V25min。⑤电泳条带较亮产物送至上海生工测序部进行测序。⑥将测序结果输入www.NCBI.nlm.nih.gov,利用BLAST软件,将测得的基因序列与Genbank数据库的序列进行同源性比较。3.2试验结果:①电泳图如图1所示。(长度约600bp,1,2为酵母原始菌株,3,4为驯化富蛋白酵母菌株)②BLAST对比结果:SaccharomycescerevisiaeS288c,NC_001144.5,chromosomeXII.上述实验结果表明:该发明所提供的菌株为酵母菌株。实施例3:菌株蛋白含量测定1.试验方法:样品1组:原始出发酵母菌株发酵液样品;2组:高产蛋白酵母菌株发酵液。1.1样品处理及SDS-PAGE:将酵母发酵液100ml经3000rpm离心10min,取上清,再经7830rpm,4℃离心30min后取15ml样品,3KDa过夜透析,透析液为100mM碳酸氢铵溶液。透析后样品用3KDa超滤管,7830rpm,4℃超滤至体积小于2ml。Bradford法测定浓度,取20μl进行SDS-PAGE电泳,考马斯亮蓝染色。1.2溶液内酶解:每组取50μl样品,加入DTT至终浓度为10mM。加入IAA至终浓度为50mM,避光反应30min。加入LysC37℃反应3小时。加入4倍体积25mM碳酸氢铵溶液。加入4μgTrypin37℃过夜反应,0.1%TFA酸化终止反应。C18-SDExtractionDiskCartridge脱盐处理,真空冻干。加35μl0.1%FA复溶沉淀。1.3毛细管高效液相色谱:采用纳升流速HPLC液相系统EasynLC进行分离。缓冲液:A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱以95%的A液平衡。样品由自动进样器上样到上样柱ThermoscientificEASYcolumn(2cm*100μm5μm-C18),再经分析柱ThermoscientificEASYcolumn(75μm*100mm3μm-C18)分离,流速为300nl/min。相关液相梯度如下:0分钟-50分钟,B液线性梯度从0%到50%;50分钟-54分钟,B液线性梯度从50%到100%;54分钟-60分钟,B液维持在100%。1.4ESI质谱鉴定:样品经毛细管高效液相色谱分离后用Q-Exactive质谱仪(ThermoFinnigan)进行质谱分析。分析时长:60min,检测方式:正离子,母离子扫描范围:300-1800m/z,一级质谱分辨率:70,000atm/z200,AGCtarget:3e6,一级MaximumIT:10ms,Numberofscanranges:1,Dynamicexclusion:3.0s。多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描(fullscan)后采集10个碎片图谱(MS2scan),MS2ActivationType:HCD,Isolationwindow:2m/z,二级质谱分辨率:17,500atm/z200,Microscans:1,二级MaximumIT:60ms,Normalizedcollisionenergy:27eV,Underfillratio:0.1%。1.5质谱数据分析原始文件(MGF文件)通过Mascot软件进行数据库检索。数据库为下载于uniprot的数据库uniprot_saccharomyces_112806_20141020.fasta(收录序列112806条,下载时间为2014-10-20)。搜库参数设定如下:enzyme为trypsin;missedcleavage设为2;静态修饰设定CarbamidomethyC;动态修饰设定OxidationM。Peptidestolerance设为20ppm,ms/mstolerance设为0.1Da,Ionscore>20。1.6生物信息学分析通过国际权威的数据库UniProtknowledgebase(Swiss-Prot/TrEMBL,www.expasy.org)和GeneOntology(GO)Database(http://www.geneontology.org/)进行检索,初步探究鉴定到的差异表达蛋白的亚细胞定位情况、发挥的生物学功能和参与的细胞进程。2.试验结果2.1蛋白质定量结果:经SDS-PAGE电泳,证明两组发酵液中存在丰富的蛋白,样品蛋白质定量结果如表3-1所示。表3-1样品12蛋白浓度(μg/μl)0.3040.3292.2.2ESI质谱鉴定结果:样品蛋白质鉴定结果统计如表3-2所示。表3-2样品蛋白质组单独肽段141682121241从图2的两幅色谱图中可以看出,两组样品的蛋白色谱吸收峰都较丰富,证明蛋白含量及种类较多,而通过比较分析可知,2组的蛋白吸收峰面积较1组大,吸收峰也较多,初步说明2组样品中的蛋白含量较丰富。2.3生物信息学分析——GO分析及KEGG代谢通路初步分析:利用本地化序列比对软件NCBIBLAST+(ncbi-blast-2.2.28+-win32.ext)将鉴定到的蛋白质与NCBInr数据库中的蛋白质序列进行比对。根据相似性原理,所得的同源蛋白的功能信息可以用于目标蛋白的功能注释。我们仅保留排名前10条且Evalue≤1e-3的比对序列进行后续的分析。所得的比对相似性范围为50-100%,其中大部分目标蛋白序列的比对相似性为98%或以上。原始数据中质谱鉴定到有注释的蛋白共计109个,其中1组特有蛋白11个,2组特有蛋白63个,两组共有蛋白35个。所鉴定到的蛋白质序列信息批量提取自UniProtKB数据库(http://www.uniprot.org)(版本号:Release2014_10),以FASTA格式保存。此外,通过检索数据库UniProtknowledgebase(Swiss-Prot/TrEMBL,www.expasy.org)和GeneOntology(GO)Database(http://www.geneontology.org/),对这三组蛋白质所参与的细胞功能进程和涉及的生物细胞学功能进行了初步分析。2.3.1两组发酵液共有蛋白分析:利用Blast2GO(Version2.8.0)中的Mapping功能对所有鉴定到的蛋白的比对序列所关联的GO功能条目进行提取,共提取到与其中27个蛋白序列(77.14%)相关的126条GO功能条目,本次项目中,共25条蛋白序列被78条GO功能条目注释,平均GO层次为5.41。经过补充注释,最终的注释统计结果为:共27条蛋白序列被91条GO功能条目注释。共有组蛋白WEGO功能注释聚类分析:在共有组35个蛋白质中,根据蛋白WEGO功能注释聚类分析,其中,参与生物学途径过程(biologicalprogress)的蛋白注释占51%,分子功能(molecularfunction)的蛋白注释28%,细胞学组件分析(cellcomponent)注释占20%。利用WEGO软件对鉴定到的蛋白质的主要功能类别完成GO功能富集度计算与图示化结果如图3所示。共有组蛋白GO功能注释其中,如图4所示,在BiologicalProgress图分类中,参与代谢过程(metabolicprocess)的有20种蛋白注释,占总BP数量39.2%,细胞过程(cellularprocess)有15种蛋白注释,占BP总数的29.4%,剩余的参与到生物调节(biologicalregulation)、信号通路(signaling)、多种生物进程(single-organismprocess/multi-organismprocess)、细胞原件组分生物合成途径(cellularcomponentorganizationorbiogenesis)、应激反应(responsetostimulus)等过程中;在MolecularFunction分类图(图5)中,具有催化活性(catalyticactivity)的有18种蛋白注释,占MF总数的64.3%,剩余蛋白分别参与到结合蛋白(binding)、分子结构活性(structuralmoleculeactivity)、分子转运活性(moleculartransduceractivity)等过程中;如图6所示,在CellComponent分类中,细胞组分(cell)共7种蛋白序列,占CC总量的35%,其余的蛋白分别参与到胞外活性(extracellularregion)、细胞器(organelle)、细胞膜(membrane)、大分子混合物(macromolecularcomplex)等过程中。KEGG通路注释:这些蛋白通过在KEGG数据库中查询比对,参与到的代谢有糖酵解途径Glycolysis/Gluconeogenesis(4),光合固碳作用Carbonfixationinphotosyntheticorganisms(3),淀粉蔗糖代谢Starchandsucrosemetabolism(2),甲烷代谢Methanemetabolism(1)。2.3.2两组发酵液特有蛋白分析:利用Blast2GO(Version2.8.0)中的Mapping功能对所有鉴定到的蛋白的比对序列所关联的GO功能条目进行提取,共提取到与其中56个蛋白序列(75.68%)相关的296条GO功能条目。本项目中,共54条蛋白序列被182条GO功能条目注释,平均GO层次为6.775。经过补充注释,最终的注释统计结果为:共59条蛋白序列被225条GO功能条目注释。特有蛋白WEGO功能注释聚类分析:特有蛋白WEGO功能注释聚类分析如图7所示:其中,1组特有蛋白共11种,参与生物进程(biologicalprogress)的蛋白共12条注释,占50.0%,参与分子功能(molecularfunction)的蛋白注释7种,占29.2%,细胞学组分(cellcomponent)的蛋白注释5种,占20.8%;2组特有蛋白63种,参与生物进程(biologicalprogress)的蛋白共105条注释,占46.1%,参与分子功能(molecularfunction)的蛋白注释77种,占33.8%,细胞学组分(cellcomponent)的蛋白注释41种,占17.9%。特有蛋白GO功能注释:如图8-10所示,其中,在1组特有蛋白中,BiologicalProcess分类中主要参与代谢过程(metabolicprocess)的有8种蛋白注释,占BP总量的47.1%,单一生物过程(single-organismprocess)有5种蛋白注释,占BP29.4%,细胞过程(cellularprocess)的蛋白注释有4种,占BP23.5%,其余有应激反应(responsetostimulus)(2),定位(localization)(1),细胞的生物合成(cellularcomponentorganizationorbiogenesis)(1)等;MolecularFunction分类中主要有催化活性(catalyticactivity)(6),结合蛋白(binding)(6),转运活性(transporteractivity)(1)等蛋白注释;CellularComponent分类中蛋白有细胞(cell)(2),细胞器(organelle)(1),大分子化合物(macromolecularcomplex)(1),胞外区(extracellularregion)(1),细胞膜(membrane)(4).在2组特有蛋白中,BiologicalProcess分类中主要有细胞过程(cellularprocess)的蛋白注释有33种,占BP总量的34.7%,代谢过程(metabolicprocess)蛋白注释有32种,占BP总量的33.7%,单一生物过程(single-organismprocess)有10种蛋白注释,细胞生物合成的(cellularcomponentorganizationorbiogenesis)有8种,其余的有定位(localization)(5),应激反应(responsetostimulus)(2),生物调节(biogicalregulation)(6)等;MolecularFunction分类中主要有催化活性(catalyticactivity)蛋白注释30种,占MF总量的45.5%,结合蛋白(binding)注释27种,占MF的40.9%,其余有分子结构蛋白(structuralmolecule)(6),转运蛋白(transporter)(3),具有转录因子活性的结合蛋白(proteinbindingtranscriptionfactoractivity)(1),具有转录活性的核酸(nucleicacidbindingtranscriptionfactoractivity)(1)等注释;以及抗氧化活性(antioxidantactivity)(1),电子载体活性(electroncarrieractivity)(1);CellularComponent分类中注释蛋白有细胞(cell)的18种,占CC总量的40.9%,细胞器(organelle)有9种,占CC的20.5%,大分子化合物(macromolecularcomplex)(9),胞外区(extracellularregion)(4),细胞膜(membrane)(4),膜封闭腔(membrane-enclosedlumen)(1)。KEGG通路注释:1组特有蛋白信息在KEGG数据库中进行比对分析,得到其中一些匹配蛋白的代谢途径,剩余蛋白因研究有限,还无法找到其匹配的信息,本组蛋白共参与8条代谢途径:果糖甘露糖代谢Fructoseandmannosemetabolism(1),嘌呤代谢Purinemetabolism(1),糖酵解Glycolysis/Gluconeogenesis(1),核黄素代谢Riboflavinmetabolism(1),甲烷代谢Methanemetabolism(1),戊糖磷酸途径Pentosephosphatepathway(1),氨基苯甲酸降解Aminobenzoatedegradation(1),光合固碳作用Carbonfixationinphotosynthenicorganisms(1)。2组特有蛋白KEGG数据库中进行比对分析后,匹配蛋白共参与24条代谢途径:嘌呤代谢Purinemetabolism(4),糖酵解Glycolysis/Gluconeogenesis(4),光合固碳作用Carbonfixationinphotosynthenicorganisms(2),氮代谢Nitrogenmetabolism(2),丙氨酸,天门冬氨酸和谷氨酸代谢Alanine,asparatateandglutamatemetabolism(2),原核固碳作用Carbonfixationpathwaysinprokaryotes(2),丙酮酸代谢Pyruvatemetabolism(1),磷酸肌醇代谢inositolphosphatemetabolism(1),泛酸盐和CoA生物合成PantothenateandCoAbiosynthesis(1),乙醛酸盐和二羧酸途径Glyoxylateanddicarboxylatemetabolism(1),柠檬酸盐循环Citratecycle(TCAcycle)(1),缬氨酸,亮氨酸和异亮氨酸的生物合成Valine,leucineandisoleucinebiosynthesis(1),甘氨酸,丝氨酸和苏氨酸代谢Glycine,serineandthreoninemetabolism(1),氨基糖和核苷酸糖代谢Aminosugarandnucleotidesugarmetabolism(1),半胱氨酸和蛋氨酸代谢Cysteineandmethioninemetabolism(1),细胞色素P450药物代谢Drugmetabolism-cytochromeP450(1),果糖和甘露糖代谢Fructoseandmannosemetabolism(1),精氨酸和脯氨酸代谢Arginineandprolinemetabolism(1),细胞色素P450外源性化学物质代谢MetabolismofxenobioticsbycytochromeP450(1),萘降解Naphthalenedegradation(1),氯代烷和氯烯烃的降解Chloroalkaneandchloroalkenedegradation(1),脂肪酸降解Fattyaciddegradation(1),酪氨酸代谢Tyrosinemetabolism(1),维生素A代谢Retinolmetabolism(1)。3结论:1组中共鉴定到肽段68个,蛋白组47个;2组共鉴定到肽段241个,蛋白组121个。原始数据中鉴定到有注释的蛋白共计109个,其中1组特有蛋白11个,2组特有蛋白63个,两组共有蛋白35个。说明两组发酵液中均存在丰富的蛋白质,但该发明中的高产蛋白酵母菌株发酵液中蛋白含量及种类均高于出发菌。2组发酵液较1组中不仅蛋白含量较丰富,且参加的代谢通路也较多。同时,发酵液中普遍存在较高的碳水化合物代谢和能量代谢,还参与影响了少量生物学通路等,2组有唯一具有电子载体活性和转运子活性的蛋白质,可能行使着生物调控、刺激反应和定位进程等功能。该发明的菌株发酵液中蛋白功能和参与的代谢途径远多于出发菌。实施例4:响应面法优化培养条件1.响应面分析因素水平的选择表4-1显示为响应面分析因素与水平。表4-13.2响应面试验设计与结果Box-Behnken试验设计与结果如表4-2所示。采用Design-Expert软件对表2试验数据进行多元回归分析,得到酵母菌菌落数与各因素变量的二次回归模型为:Y=2.87+0.13A-0.085B+0.015C+0.025AB+5.000E-003AC+0.000BC+2.000E-003A2-0.29B2+2.000E-003C2。表4-2试验序号ABC制剂菌落数/(108CFU/mL)10002.8920112.6130-112.7540-1-12.685-1012.7660002.8870002.86801-12.569-1-102.57100002.78111013.08121-102.8613-10-12.781410-12.9815-1102.45161102.76170002.89运用软件对模型进行方差分析,结果如表4-3所示。表4-33.3模型方程的验证实验:通过软件Design-Expert.V8.0.6求出回归模型的极值点,即最佳培养条件:初始pH为5.8,培养温度为27.26℃,装液量为100.00mL,酵母菌菌落数理论预测最大值为2.89*108CFU/mL。为检验响应面分析法的可靠性,选择最佳培养条件验证实验,考虑到实际操作方便,调整最佳培养条件为:初始pH为5.8,培养温度为27.30℃,装液量为100.00mL。在此条件下,进行3次平行试验,酵母菌菌落数为3.00*108CFU/mL。与理论预测值相近,说明该模型是可信的,响应面分析法用于酵母菌制剂培养条件的优化是可行的。最佳培养条件为:初始pH为5.8,培养温度为27.30℃,装液量为100.00mL实施例5:C20140911菌株发酵液对仔猪肠道微生物区系的影响1材料与方法1.1材料1.1.1试剂与仪器C20140911发酵液;原有酵母发酵液;麦康凯(杭州微生物试剂有限公司);SS琼脂(杭州微生物试剂有限公司);MRS(OXOID,ENGLAND);血平板(兰州荣昌生物制品公司)。1.1.2试验动物试验在榆中某猪场进行,选取健康的20d仔猪9窝,每窝6头,共54头(杜洛克×约克×长白三元杂交猪),随机分为3组,每组3窝,每窝为1重复。试验期间动物按常规进行管理,自由采食,自由饮水,试验期间腹泻不用药物治疗。1.2.试验设计试验为3处理3重复单因子试验,3处理分别为第1组(C20140911发酵液组)、第2组(原有酵母菌株发酵液组)和第3组(空白对照组),试验动物从20d开始连续观察3天,无异常则开始口服发酵液,连续5天,28d断奶,分别于23d、28d、35d、42d于各处理重复中随机选1头进行剖杀,对回肠、盲肠、结肠两端结扎,在一定部位无菌采取肠道内容物。内容物-20℃厌氧保存,用于微生物区系检测。1.3试验方法1.3.1常规方法分离计数分别取回肠内容物约0.2g,加入约1.8ml生理盐水中,摇匀;盲肠和结肠内容物约0.5g,加入4.5ml生理盐水中,摇匀.然后生理盐水10倍梯度稀释,取0.1ml加入到不同平板分类计数.每份样品平行做两遍,选取菌落数(CFU)在30~300之间的培养皿计数,算平均值,计算出每克内容物的细菌数,并以其对数值表示。其中包括乳杆菌(MRS)、双歧杆菌(培养基自制)、大肠杆菌(麦康凯)、沙门氏菌(SS)及需氧菌总数和厌氧菌总数(鲜血平板)的测定。2结果2.1发酵液对回肠微生物区系的影响2.1.1对大肠杆菌数量的影响表5-1各处理组对仔猪回肠内容物大肠杆菌的影响注:1)表中数据单位为lgCFU/g湿内容物;2)表中数据为均值±标准误;3)肩注字母表示相同肠段、相同日龄的比较;下同。试验1组和试验2组回肠内容物大肠杆菌数随日龄增加有所降低,对照组随日龄增加升高。试验1组、试验2组与对照组42日龄时差异显著(p<0.05)(p<0.01)试验1组与试验2组差异不显著。2.1.2对沙门氏菌数量的影响在试验过程中,试验1组与试验2组回肠内容物沙门氏菌数随日龄增加而降低,对照组断奶后沙门氏菌数量增加,且始终高于其它两组。两试验组与对照组相比,28d、35d差异不显著,42d差异极显著(p<0.01),但两者之间无差异显著性。表5-2各处理组对仔猪回肠内容物沙门氏菌的影响2.1.3对需氧菌数量的影响表5-3各处理组对仔猪回肠内容物总需氧菌的影响在试验过程中,试验1组和试验2组回肠需氧菌数量整体呈下降趋势,而对照组则随日龄增加而上升。试验1组与试验2组无显著差异;试验1组与对照组相比,28d、35d差异不显著,42d差异显著(p<0.05);试验2组与对照组相比,28d、35d差异不显著,42d差异显著(p<0.05)。从上述结果可以看出:各处理组在28d、35d时对回肠有害菌影响的差异不显著,42d时试验1组、试验2组有害菌数量显著低于对照组(p<0.05),而试验1组与试验2组之间差异不显著。由此说明本发明菌株发酵液与原有酵母发酵液作用相似,均可以有效降低有害菌数量2.1.4对双歧杆菌数量的影响表5-4各处理组对仔猪回肠内容物双歧杆菌的影响由表5-4可知,回肠内容物双歧杆菌数,在28日龄试验1组显著高于对照组(p<0.05),其它日龄各组之间差异不显著;但随着日龄的增加各组呈上升趋势2.1.5对乳酸杆菌数量的影响表5-5各处理组对仔猪回肠内容物乳酸杆菌的影响由表5-5可知,回肠内容物乳酸杆菌数随着日龄的增加,试验1组和试验2组呈上升趋势。在整个试验期间试验1组和试验2组显著高于对照组(p<0.05);试验1组和试验2组差异不显著。2.1.6.对厌氧菌数量的影响表5-6各处理组对仔猪回肠内容物总厌氧菌的影响由表5-6可知,在整个试验过程中,回肠内容物总厌氧菌数随着日龄的增加,试验1组和试验2组呈上升趋势,对照组保持平稳。试验1组和试验2组总厌氧菌数始终高于对照组,但各组之间差异不显著。2.2发酵液对盲肠微生物区系的影响2.2.1对大肠杆菌数量的影响表5-7各处理组对仔猪盲肠内容物大肠杆菌的影响在盲肠,随着日龄增加,试验1组和试验2组大肠杆菌数量均有所下降,对照组在28d时下降,随后开始上升,整个试验期间对照组均高于试验1组和试验2组。试验1组与试验2组之间差异不显著,与对照组35d差异显著(p<0.05),42d差异极显著(p<0.01);试验2组与对照组35d、42d差异极显著(p<0.01)。2.2.2对沙门氏菌数量的影响表5-8各处理组对盲肠内容物中沙门氏菌的影响试验中,试验1组与试验2组盲肠内容物中沙门氏菌数量呈下降趋势;对照组断奶后上升,到42d时略有下降,但仍然高于其它两组。试验1组低于试验2组,但差异不显著;低于对照组35d差异显著(p<0.05),42d差异极显著(p<0.01)。试验2组与对照组相比,35d差异显著(p<0.05),42d差异极显著(p<0.01)。2.2.3对需氧菌数量的影响试验中,试验1组与试验2组盲肠内容物需氧菌数量随日龄增加而降低,但试验1组42d较35d有所增加,高于试验2组;对照组随日龄增加而升高,35d、42d均高于其余两组。试验1组与试验2组相比,42d时高于试验2组,且差异显著(p<0.05);试验1组与对照组相比42d时差异极显著(p<0.01);试验2组与对照组相比,42d时差异极显著(p<0.01),其余不显著.表5-9各处理组对仔猪盲肠内容物总需氧菌的影响Sheet3-9Effectofdifferenttreatmentonaerobicbacterialincecumofpiglets从上述结果看出,在盲肠试验1组与试验2组酵母在35d、42d均可降低有害菌数量,二者作用相似,效果比回肠好;且试验2组控制需氧菌数量的效果优于试验1组。2.2.4对双歧杆菌数量的影响表5-10各处理组对仔猪盲肠内容物双歧杆菌的影响由表5-10可知,盲肠内容物双歧杆菌数随着日龄的增加试验1组和试验2组呈上升趋势,对照组略有下降。试验期间,试验1组与试验2组始终高于对照组;28日龄和42日龄差异显著(p<0.05);试验1组高于试验2组,但差异不显著。2.2.5对乳酸杆菌数量的影响表5-11各处理组对仔猪盲肠内容物乳酸杆菌的影响由表5-11可知,盲肠内容物乳酸杆菌数随着日龄的增加试验1组和试验2组呈上升趋势。试验期间,试验1组和试验2组始终高于对照组,28日龄差异极显著,42日龄差异显著。试验1组高于试验2组,但差异不显著。2.2.6.对厌氧菌数量的影响表5-12各处理组对仔猪盲肠内容物总厌氧菌的影响从5-12看出:试验1组和试验2组盲肠内容物总厌氧菌数随着日龄的增加呈上升趋势,对照组略有下降,基本保持平稳。试验1组和试验2组始终高于对照组,28日龄差异显著(p<0.05),35-42日龄差异极显著(p<0.01);试验1组高于试验2组,差异不显著。从上述结果看出(表5-10~5-12):C20140911发酵液和原有酵母菌株发酵液均可有效提高盲肠有益菌数量,说明二者作用相似,但C20140911发酵液效果优于原有酵母菌株发酵液。2.3断发酵液对结肠微生物区系的影响2.3.1对大肠杆菌数量的影响随着日龄的增加试验1组和试验2组结肠内容物中大肠杆菌数量呈下降趋势,对照组28d有所下降,35d上升。整个试验过程中,对照组均高于其它两组,与对试验1组相比42d差异显著(p<0.05);与试验2组相比35d、42d差异均显著(p<0.05);试验1组与试验2组差异不显著表5-13各处理组对仔猪结肠内容物大肠杆菌的影响2.3.2对沙门氏菌数量的影响表5-14各处理组对结肠内容物沙门氏菌的影响从上图可以看出,试验期间试验1组、试验2组结肠内容物沙门氏菌数整体呈下降趋势,试验1组在35d略有上升,但低于对照组,对照组在断奶后处于上升状态。试验1组与试验2组差异不显著,与对照组相比42d差异显著(p<0.05),其余时间不显著。试验2组与对照组相比35d、42d差异显著(p<0.05)。2.3.3对需氧菌数量的影响试验1组结肠需氧菌在断奶后略有上升,整个试验期间变化不大;试验2组在35d以前呈下降趋势,低于试验1组,42d上升高于试验1组;对照组随日龄增加而上升,到42d略有下降。试验1组与试验2组试验结果差异不显著;试验1组35d显著低于对照组(p<0.05);试验2组35d时极显著低于对照组(p<0.01)。表5-15各处理组对结肠内容物需氧菌的影响从上述结果看出(表5-14--5-15):在结肠试验1组与试验2组在35d、42d都可以有效控制有害菌数量,说明二者作用相似。2.3.4对双歧杆菌数量的影响表5-16各处理组对仔猪结肠内容物双歧杆菌的影响由表5-16可知,结肠内容物中双歧杆菌数随着日龄的增加各组呈上升的趋势。在28日龄和35日龄,试验1组和试验2组显著高于对照组(p<0.05);42日龄试验1组显著高于对照组(p<0.05),试验2组与对照组差异不显著。实验期间试验1组高于试验2组,但差异不显著。2.3.5对乳酸杆菌数量的影响由表5-17可知,试验1组和试验2组结肠内容物中乳酸杆菌数随着日龄的增加呈上升趋势,对照组有所下降。28日龄,试验1组和试验2组极显著高于对照组(p<0.01),35~42日龄,试验1组和试验2组显著高于对照组(p<0.05);实验期间,试验1组在35-42日龄高于试验2组,但差异不显著。表5-17各处理组对仔猪结肠内容物乳酸杆菌的影响2.3.6.对厌氧菌数量的影响表5-18各处理组对仔猪结肠内容物总厌氧菌的影响由表5-18可知,结肠内容物总厌氧菌数随着日龄的增加,试验1组和试验2组呈上升趋势,对照组35日龄以前呈下降趋势,42日龄有所恢复;试验1组始终高于试验2组和对照组。试验1组在35-42日龄显著高于对照组(p<0.05),试验2组在35日龄显著高于对照组。试验1组与试验2组之间差异不显著。综上所述(表5-16~3-18),C20140911菌株发酵液与原有酵母菌株发酵液均可不同程度增加结肠有益菌数量,C20140911菌株发酵液效果更好。实施例6:C20140911菌株发酵液对仔猪生产性能的影响1.试验方法处理分组与实施例5相同,分别于21d、28d、35d、42d称重、记录采食量。表6-1C20140911菌株发酵液对仔猪生产性能的影响注:表中数据采用平均数±标准误(X±SE)表示,同一行内比较。由表6-1可知,试验1组和试验2组较对照组均可显著提高断奶仔猪的日增重、日采食量,促进断奶仔猪生长,其中试验1组较试验2组日增重提高16.90%。试验1组仔猪体重与对照组相比,于35d差异显著(p<0.05),于42d试验末重差异极显著(p<0.01),日增重和日采食量亦极显著高于对照组(p<0.01),采食量有提高的趋势。而试验2组体重与对照组相比,在断乳后2周有明显增加的趋势,差异不显著;日增重和日采食量均极显著高于对照组(p<0.01)。料重比结果表明试验1组低于试验2组和对照组。C20140911菌株发酵液与原有酵母菌株发酵液均可提高生产性能,但是C20140911菌株发酵液组效果优于原有酵母菌株发酵液。最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1