甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制作方法
本发明属于基因工程领域,具体涉及甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用。
背景技术:
在农业生产中,高产稳产是保障粮食安全的有效途径。随着气候等全球生态的日益恶化,干旱、盐渍等极端环境常常对农作物的产量及品质造成重大损害。脱落酸(absicsic acid,ABA)是一种重要的植物激素,在植物的正常新陈代谢及生长发育过程中参与多种信号调控途径。脱落酸也被称为“逆境植物激素”,在抵御外界环境胁迫(包括干旱、低温、盐渍、渗透等非生物胁迫和病虫害等生物胁迫)过程中起到至关重要的作用。因此,认识植物响应ABA处理的分子机制,进而通过遗传改良的方法调控植物的耐逆性,已成为当前分子生物学及农业科学家们研究的重点和热点。
通过分子生物学技术,挖掘植物响应ABA处理相关功能基因,对培育耐逆稳产作物新品种具有重要的应用价值。
技术实现要素:
本发明的第一个目的是提供与甘薯耐逆相关蛋白IbFBA2。
为实现上述目的,本发明所提供的IbFBA2蛋白,来源于甘薯[Ipomoea batatas(L.)Lam],为如下(1)或(2)的蛋白质:
(1)SEQ ID NO:2所示的氨基酸序列组成的蛋白质;
(2)SEQ ID NO:2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与植物耐逆性相关的由(1)衍生的蛋白质。
序列表中SEQ ID NO:2所示的氨基酸序列由398个氨基酸残基组成。
上述蛋白质中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加是指不多于十个氨基酸残基的取代和/或缺失和/或添加。
本发明的第二个目的是提供编码所述IbFBA2蛋白的基因。
为实现上述目的,本发明所提供的IbFBA2蛋白的编码基因,是如下(1)-(4)中任何一种DNA分子:
(1)SEQ ID NO:1自5’末端起第97位至第1293位核苷酸所示的DNA分子;
(2)SEQ ID NO:1所示的DNA分子;
(3)在严格条件下与(1)或(2)限定的DNA分子杂交且编码与植物耐逆性相关蛋白的DNA分子;
(4)与(1)或(2)限定的DNA序列具有90%以上同源性且编码与植物耐逆性相关蛋白的DNA分子。
所述严格条件为用6×SSC,0.5%SDS的溶液,在65℃下杂交,然后用2×SSC,0.1%SDS和1×SSC,0.1%SDS各洗膜一次。
其中,序列SEQ ID NO:1的长度为1617bp,其开发阅读框(ORF)为来自5’末端第97位至第1293位碱基,其编码氨基酸序列是序列表中SEQ ID NO:2所示的蛋白。
本发明的第三个目的是提供含有所述IbFBA2蛋白的编码基因的重组载体。
本发明提供的重组载体为将SEQ ID NO:1自5’端第28位至第1584位核苷酸所示的DNA分子插入到pGWB12的两个attR位点之间得到的重组载体。
本发明的第四个目的是提供所述IbFBA2蛋白、编码基因和含有所述编码基因的重组载体在调控植物耐逆性中的应用。
上述应用中,所述耐逆性为ABA胁迫的耐性;所述植物为双子叶植物,所述双子叶植物可为拟南芥(Arabidopsis thaliana);所述调控植物耐逆性为调控植物响应ABA胁迫,所述调控植物响应ABA胁迫为控制植物在含20mmol ABA的1/2MS培养基上根的长势;所述根的长势为统计植物根的长度及根的数量体现。
本发明的第五个目的是提供所述IbFBA2蛋白、编码基因和含有所述编码基因的重组载体在培育转基因植物中的应用。具体的,所述转基因植物具有如下性状:根的长度较对照更长、根的数量较对照更多;所述植物为拟南芥。
本发明的第六个目的是提供一种培育响应ABA处理的转基因植物的方法。
本发明所提供的培育转基因植物的方法,为将编码上述IbFBA2蛋白的DNA分子导入目的植物,获得转基因植物,所述转基因植物比目的植物更加耐受逆境胁迫。
上述方法中,所述编码上述IbFBA2蛋白的DNA分子是通过上述的重组载体导入目的植物中。
上述方法中,所述目的植物为野生型拟南芥(Col_0)。
本发明提供了一种IbFBA2蛋白及其编码基因,将该基因导入野生型拟南芥中,得到了转IbFBA2拟南芥植株,结果证明IbFBA2能够促使目的植物响应ABA处理,增加耐逆性,根的长度显著长于对照,根的数量显著多于对照。说明IbFBA2蛋白及其编码基因在植物响应ABA处理过程中起着重要的作用。本发明提供的IbFBA2蛋白及其编码基因在提高植物耐逆性方面具有重要的理论意义与应用价值。
附图说明
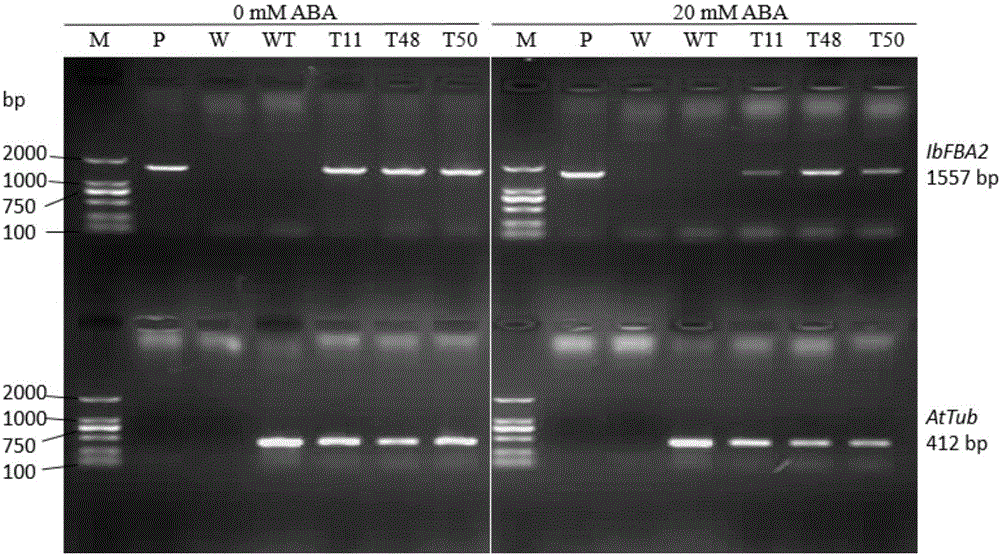
图1为转IbFBA2拟南芥植株的PCR检测结果图;
图2为转IbFBA2拟南芥响应ABA处理的表型结果图;
图3为转IbFBA2基因拟南芥在不同ABA浓度下根长对比图;
图4为转IbFBA2基因拟南芥在不同ABA浓度下根数量对比图。
具体实施方式
下面结合附图和具体实例对本发明作进一步详细描述。
下述实例中所用的实验方法如无特殊说明,均为常规方法。
下述实例中所用的材料、试剂等,如无特殊说明,均可从商业途径获得。
实施例1与甘薯响应ABA处理相关蛋白IbFBA2及其编码基因的获得
实验材料:将甘薯品种徐781薯块(由江苏徐州甘薯研究中心提供)在苗床催芽,待生长约30天后取1-2片新鲜叶片,液氮速冻,-80℃保存。
1、叶片总RNA提取与纯化
RNA提取所用溶液、器皿等均经过DEPC水的特殊处理,其操作严格按照《分子克隆实验指南(第二版)》(2005-3-1,J.萨姆布鲁克等,科学出版社)有关RNA操作的要求进行,严防RNase污染。
采用上海捷瑞公司生产的总RNA提取试剂盒(动物总RNA快速提取试剂盒(离心柱型),产品目录为GK3016)进行RNA的提取,具体步骤如下:
1)在液氮中将样品研磨成粉末,转移50.0mg至1.5ml RNase-Free的离心管中,并加1.0ml RnaEX(Trizol);
2)涡旋振荡30sec,室温静置5min,以充分裂解样品;
3)于通风厨中加入200.0μl氯仿,涡旋振荡30sec,室温静置5min;
4)台式离心机上,12000rpm,4℃离心10min,使溶液充分分层;
5)直接吸取约500.0μl的上清至离心柱中,加入200.0μl的无水乙醇,并充分混匀,室温静置2min(可能会有絮状沉淀产生);
6)常温条件下,8000rpm离心1min;
7)小心取出柱子,倒掉滤液,并将柱子放回收集柱中,加入600.0μl buffer RWA,8000rpm,室温离心30sec,倒掉滤液;
8)重复7的步骤;
9)倒掉滤液,将柱子放回收集管,12000rpm离心1min;
10)小心取出柱子,放入新的RNase-Free的1.5ml离心管中,在柱膜中央加入50.0μl的DEPC-H2O,60℃下放置2min;
11)12000rpm离心1min,收集管内的溶液即为RNA样品,可立即使用或-80℃保存。
取6μl RNA用于电泳检测,取2μl RNA用于浓度测定,剩余的RNA于-80℃保存备用。用紫外分光光度计检测RNA的质量(OD260)和纯度(OD260/OD280);并用1.2%变性琼脂糖凝胶电泳检测RNA完整性。
2、cDNA第一链的合成
将提取的总RNA,通过M-MLV逆转录酶(Promega,产品目录号为M1701)反转录成First-strand cDNA,具体步骤如下:
1)取总RNA 2.0μg于PCR管中,加入2.9μl的Oligo(dT)18(0.3μg/μl),用RNase-Free H2O补足至15.0μl,混匀离心管,并短暂离心;
2)利用PCR仪控温,加热离心管70℃,5min,迅速置于冰上冷却2min;
3)然后加入以下试剂:5.0μl M-MLV 5×Reaction Buffer,1.2μl dNTP mix(10mM),0.6μl RNase Inhibitor(40U/μl),1.1μl M-MLV反转录酶(200.0U/μl),加RNase-Free H2O定容至总体积为25.0μl;
4)混匀后轻微离心,在PCR仪中42℃孵育60min,即可得First-strand cDNA;
5)取4.0μl至0.2ml离心管中,并稀释10倍用于后续实验或放置-20℃保存。
3、IbFBA2蛋白的cDNA编码序列克隆
根据甘薯转录组测序的结果,通过同源序列比对找到IbFBA2蛋白的cDNA序列,并设计正向引物1和反向引物2进行IbFBA2蛋白cDNA编码序列克隆。引物序列如下:
引物1:5’–GAGGAGATAAGATCGAATAGTAAAA-3’(SEQ ID NO:3)
引物2:5’–GGAATACAAGATAAACCATAACTGA-3’(SEQ ID NO:4)
以步骤2中准备好的cDNA为模板,用正向引物1和反向引物2进行PCR反应。
PCR反应体系如下:10.0μl 5×PrimeSTAR GXLbuffer,4.0μl dNTPs(2.5mM),1.0μl PrimeSTAR GXL DNA聚合酶(1.25U/μl)(购自大连TAKARA公司,产品目录为R050Q),100ng cDNA,1.0μl正、反向引物(10.0mM),ddH2O补充至终体积50.0μl。热循环参数为:94℃3min;94℃30sec,57℃30sec,72℃1min30sec,35个循环;72℃10min,1个循环;4℃保存,反应是在Eppendorf(Mastercycler Nexus)PCR仪上完成。扩增产物在水平电泳槽上1.2%琼脂糖凝胶电泳检测,获得1557bp长度的扩增片段。
经过测序,该PCR产物具有SEQ ID NO:1所示的核苷酸,该序列所示的基因的编码区为序列表中SEQ ID NO:1自5’端第97–1293位核苷酸;序列表中SEQ ID NO:1由1617个碱基组成;该基因编码的蛋白命名为IbFBA2,该蛋白的氨基酸序列为序列表中的SEQ ID NO:2;序列表中SEQ ID NO:2由398个氨基酸残基组成。
实施例2IbFBA2蛋白在提高植物ABA胁迫耐性中的应用
1、植物表达载体的构建
根据甘薯IbFBA2蛋白cDNA的编码序列和构建载体用的Gateway pCR8/GW/TOPO TA Cloning kit(Invitrogen,产品目录号为45-0642)技术,将实施例1得到的PCR产物进行纯化,并与pCR8/GW/TOPO载体混合,转入大肠杆菌感受态细胞Trans-T1(购自北京全式金生物技术有限公司,产品目录号为CD501)中,涂到含有大观霉素(Spe)抗性的固体LB平板培养基上,37℃条件下培养过夜待菌落长出,挑选单克隆作菌落用正向引物1和反向引物2进行PCR反应。PCR反应体系如下:10.0μl康为2×Taq mix(购自北京康为世纪公司,产品目录号为CW0716A),1.0μl单克隆菌落稀释液,1.0μl正向引物(序列表中SEQ ID NO:3)、反向引物(序列表中SEQ ID NO:4)(10.0mM),ddH2O补充至终体积20.0μl。热循环参数为:94℃3min;94℃30sec,55℃30sec,72℃1min,35个循环;72℃10min,1个循环;4℃保存,反应是在Eppendorf(Mastercycler Nexus)PCR仪上完成。扩增产物在水平电泳槽上1.2%琼脂糖凝胶电泳检测。挑选PCR检测有条带且条带很亮对应的单克隆送上海生工测序,确定片段插入的方向以及片段的序列无变异。
将测序无误的载体命名为pCR8/GW/TOPO::IbFBA2,将载体pCR8/GW/TOPO::IbFBA2与植物表达载体pGWB12(由中国农业科学院甘薯研究所提供)进行LR反应,得到重组载体pGWB12:IbFBA2,即为植物表达载体。
将上述重组载体pGWB12:IbFBA2转化大肠杆菌感受态Trans-T1(购自北京全式金生物技术有限公司,产品目录号为CD501),涂到含有卡那霉素(Kan)抗性的固体LB平板培养基上,37℃培养16h,对重组载体pGWB12:IbFBA2进行PCR扩增鉴定并进行测序验证。测序结果表明,重组载体pGWB12:IbFBA2为将序列表中SEQ ID NO:1自5’端第28位至第1584位所示核苷酸插入pGWB12的两个attR位点之间得到的载体。
2、植物表达载体转化农杆菌
1)从-80℃低温冰箱中取出100μl的GV3101感受态细胞(购自上海迈其生物科技有限公司,产品目录号为CH5002A),置于冰上融化,加入1.0μg上述步骤1得到的植物表达载体pGWB12:IbFBA2,混匀;
2)液氮冷冻5min,37℃温育5min;
3)加入250.0μl的LB液体培养基,28℃培养2h;
4)取200.0μl菌液于含有抗生素(100.0μg/ml利福平(Rif)、50.0μg/ml卡那霉素(Kan))的LB固体培养基上涂布均匀,于28℃培养1-2天;
5)挑取单菌落并进行PCR鉴定(鉴定引物为引物1(序列表中SEQ ID NO:3)和引物2(序列表中SEQ ID NO:4)),得到1557bp片段的菌落为阳性菌落;
6)将阳性单菌落接种含有100.0μg/ml Rif和50μg/ml Kan的LB液体培养基中,28℃、150rpm的摇床培养至OD值达到0.8,即得到了可用于后续转化工作的农杆菌液。
3、转IbFBA2拟南芥的获得
转化用农杆菌介导的方法将IbFBA2cDNA的编码序列导入到野生型拟南植株中,具体方法如下:
1)将步骤2中准备好的农杆菌液离心后,倒掉上清,加入相同体积含有5.0%蔗糖、0.02%silwet L-77表面活性剂的悬浮溶液;
2)用移液枪吸取上述农杆菌悬浮液,滴到拟南芥的花蕾以及腋芽上(去除已开放的花朵);
3)将处理好的植株置于透光的塑料盆中,内壁喷洒一定量的水,并覆盖保鲜膜以维持较高湿度,正常光照培养24h;
4)次日去掉保鲜膜,正常培养1个月后,单株收获得到T1代转IbFBA2拟南芥种子;
5)对T1代种子进行消毒,用Top agar(0.1%agar)将其播种到含40mg/L潮霉素(Hyg)的1/2MS培养基上进行筛选;
6)根据根的萌发情况,挑选长根的单株移栽到基质中,正常培养1个月后,PCR检查挑出转基因阳性植株并单株收获,得到T2代转IbFBA2拟南芥种子;
4、转IbFBA2拟南芥的ABA耐受性鉴定
将编号为T11、T48、T50转基因拟南芥种子以及野生型拟南芥(WT)种子消毒后播种到1/2MS培养基上,于4℃条件下暗培养48-72小时,取出后置于光照培养箱中培养,待两片子叶完全张开后,挑选长势均匀的幼苗种植到含有0mM(对照)和20mM ABA的1/2MS方形培养基(100mm×100mm)上,于光照培养箱中竖直培养,观察拟南芥生长情况。每个株系种植3苗,两个处理各三个生物学重复,统计结果取平均值。
用Edwards Solution分别提取野生型拟南芥和T2代3株转IbFBA2拟南芥的基因组DNA作为模板,进行PCR检测,所用的IbFBA2基因引物为:引物1(SEQ ID NO:3)和引物2(SEQ ID NO:4),所用的AtTub基因引物为:引物3:5’-AGCAAATGTGGGACTCCAAG-3’(SEQ ID NO:5)和引物4:5’-CACCTTCTTCATCCGCAGTT-3’(SEQ ID NO:6)。PCR反应体系如下:10.0μl2×Taq mix(购自北京康为世纪公司,产品目录号为CW0716A),1.0μl DNA(50ng/μl),1.0μl正向引物(序列表中SEQ ID NO:3)、反向引物(序列表中SEQ ID NO:4)(10.0mM),ddH2O补充至终体积20.0μl。热循环参数为:94℃3min;94℃30sec,55℃30sec,72℃1min,35个循环;72℃10min,1个循环;4℃保存。
从电泳检测扩增结果见图1(泳道M为Marker;泳道P为阳性对照(重组质粒pGWB12::IbFBA2);W为空白对照;WT为阴性对照(Col_0拟南芥);泳道T11、T48和T50为转IbFBA2基因拟南芥)可以看出,得到1557bp的为阳性T2代转IbFBA2拟南芥,表明IbFBA2基因已经整合到拟南芥基因组中,并证明这些再生植株为阳性转基因植株。
结果如图2和图3所示,可以看出在20mM ABA的培养基上编号为T11、T48、T50的转基因拟南芥根的长度比对照植株的根长显著伸长,表明其耐逆性明显增强。从图4可以看出在20mM ABA的培养基上,编号为T11、T48、T50的转基因拟南芥根的数目较对照更多。
上述实验结果表明,IbFBA2蛋白及其编码基因可以增强植物响应ABA胁迫的耐性,增强植物耐逆性。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于日本血吸虫尾蚴期基因的环介导等温扩增法的制造方法与工艺
- MicroRNA‑34a的检测体系和方法与制造工艺
- OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- Nemesia strumosa KLM花青素生物合成基因及编码蛋白和应用的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 诱导植物雄性不育相关调控的microRNA167a及其应用的制造方法与工艺
- 乳酸乳球菌乳亚种YF11的非编码小RNAs144的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- Purα蛋白在抑制淀粉样前体蛋白编码基因表达中的应用的制作方法
- Unc5cl及其编码蛋白的应用的制作方法
- 具有抑制癌细胞生长功能的新的人蛋白及其编码序列的制作方法
- 具有抑制癌细胞生长功能的新的人蛋白及其编码序列的制作方法
- 蝶蛹金小蜂抗菌蛋白Pp-AP2及其编码的核酸序列的制作方法
- 蝶蛹金小蜂抗菌蛋白Pp-AP3及其编码的核酸序列的制作方法
- 一种植物耐逆性相关蛋白及其编码基因与应用的制作方法
- 一种新的多肽——核编码的线粒体起始因子11.00和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——线粒体分拣蛋白1-39.71和编码这种多肽的多核苷酸的制作方法
- 通过过表达编码tfl-1 样蛋白的多核苷酸而具有增强的产量相关性状的植物及其制备方法
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺