检测植原体的LAMP引物组及其试剂盒和应用的制作方法
本发明涉及用于检测16SrI组植原体的LAMP引物组,尤其涉及利用LAMP引物组检测泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的检测方法,还涉及LAMP引物组在泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的早期诊断和病原菌的监测与鉴定中的应用,属于植物病害检测、鉴定及防治技术领域。
背景技术:
植原体(Phytoplasma,原称Mycoplasma-like organism简称MLO),是一类类似植物病原细菌但无细胞壁的原核生物。能引起许多重要的粮食作物、蔬菜、观赏植物和果树等经济林木的严重病害。根据植原体16S rDNA基因序列,可将植原体分为28个组,其中引起泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变的植原体均属于16Sr I组。此类病害的分布范围广,传播速度快,致病力强,一旦感病,传统的病害防治技术难以治愈。泡桐原产自中国,在中国的栽培面积广泛,是重要的速生丰产用材林,也是重要的行道树和环境美化树种。泡桐丛枝病在中国大面积发生,严重影响树木的生长与发育。桑树萎缩病是一种十分危险的病害,分布在中国江苏、浙江、安徽等省。此病近年来日渐增多,尤其中国江浙江界的太湖地区,每年发病率一般为5-15%,重病区达30%以上,很多病株数年后即枯死。莴苣黄化近来被报道在中国福建发生,发病后严重降低莴笋的产量和品质,给农民们带来严重损失。为了从根本上解决此类病害的防治问题,最有效的措施就是建立严格的植物检疫,从源头上杜绝病原。
植原体病害的检测,前期主要依靠生物学、电镜观察、抗生素试验相结合的传统方法进行检测,到后期随着生物技术的发展,基于酶联免疫反应、核酸杂交以及PCR技术的检测方法也相继建立,检测的灵敏度和准确性不断提高。但是目前的这些方法往往需要昂贵的仪器设备,且操作程序复杂,检测时间长,对检测人员的技术要求较高,这些都大大限制了此类诊断方法的使用和推广。
环介导等温扩增是Notomi等在2000年开发的一种恒温核酸扩增方法,是一种新型的分子诊断方法。该方法针对靶基因6个特异区域设计特异性引物,并利用一种具有链置换活性的DNA聚合酶,在恒温下对核酸实现扩增。由于该方法具有特异性强、操作简单、不需要复杂的仪器、检测周期短和结果可视化的特点,使得其非常适合作为基层和现场的病害诊断方法进行推广使用。
环介导等温扩增作为一种新型的分子诊断方法。已有部分报道将该技术应用于植原体的检测上,如16Sr I组的翠菊黄化和草莓绿瓣植原体、16Sr II组的银胶菊丛枝植原体、16Sr V组的枣疯病和葡萄金黄化植原体、16Sr XII组的番木瓜丛枝植原体等均已开发出相应的LAMP检测方法。但这些方法的靶标基因主要是16S rDNA基因。16S rDNA基因在植原体中为双拷贝,存在一定的变异性,而蛋白延伸因子编码基因tuf在植原体中为单拷贝,被认为是一种新的进化标签。它和16S rDNA基因相比保守性略低,可在16S rDNA基因分组的基础上进一步区分亚组。
因此以tuf基因作为靶标基因,针对泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变等植原体,设计有更好特异性的LAMP引物,对泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的早期诊断和病原菌的监测与鉴定具有十分重要的意义。
技术实现要素:
本发明目的之一是提供泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的LAMP引物组;
本发明目的之二是提供泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的LAMP检测方法;
本发明目的之三是提供泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的LAMP检测试剂盒;
本发明目的之四是提供LAMP引物组及其检测方法在泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的早期诊断和病原菌的监测与鉴定中的应用。
为达到上述目的,本发明是通过以下技术方案来实现的:
本发明首先公开了检测泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的LAMP引物组,包括一对内引物对和一对外引物对,所述外引物对(PaWB3-F3/PaWB3-B3):由SEQ ID No.2和SEQ ID No.3所示的核苷酸序列组成;所述内引物对(PaWB3-FIP/PaWB3-BIP):由SEQ ID No.4和SEQ ID No.5所示的核苷酸序列组成。
本发明还公开了一种检测泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的LAMP试剂盒,包括:LAMP引物、LAMP反应液RM、Bst DNA聚合酶、荧光染料10×SYBR GreenⅠ、待测样品DNA、阳性和阴性对照、超纯水和密封液,所述LAMP引物为上述LAMP引物组。
本发明进一步公开了上述LAMP引物组在泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的检测方法,包括以下步骤:
(1)提取待测样品DNA;(2)以待检测样品的DNA为模板,以上述LAMP引物组为扩增引物建立LAMP反应体系进行等温基因扩增;(3)对扩增产物结果进行判定。
其中,所述LAMP反应体系中包含:由SEQ ID No.2和SEQ ID No.3所示的核苷酸序列组成外引物对以及由SEQ ID No.4和SEQ ID No.5所示的核苷酸序列组成内引物对组成的引物组,LAMP反应液RM,Bst DNA聚合酶,荧光染料10×SYBR Green Ⅰ,待测样品DNA,超纯水和密封液;
优选的,所述LAMP反应体系为45μL,包含:10μM PaWB3-F3 0.5μL,10μM PaWB3-B3 0.5μL,40μM PaWB3-FIP 1μL,40μM PaWB3-BIP 1μL,LAMP反应液RM(2×)12.5μL,8U/μL Bst DNA聚合酶1μL,荧光染料10×SYBR GreenⅠ0.5μL,待测样品DNA 0.5μL,超纯水7.5μL和20μL密封液。
所述等温基因扩增为63℃恒温反应40~60min,80℃灭活5~10min;优选的63℃恒温反应60min,80℃灭活5min。
所述对扩增产物结果进行判定:将扩增产物置于恒温荧光检测仪或者荧光PCR仪中,实时读取荧光信号,若出现“S”型扩增曲线则判定为阳性反应,即样品中感染有植原体,若无“S”型扩增曲线则判定为阴性;或,在扩增产物中加入1μL显色液,所述显色液为1.25mM钙黄绿素和12.5mM氯化锰混合液,在日光下,肉眼观察反应管中颜色的变化,若扩增产物变为翠绿色则判定为阳性反应,即样品中感染有植原体,若扩增产物仍为棕黄色则判定为阴性。
本发明在GeneBank中搜集不同组植原体16S基因和tuf基因的核酸序列,利用DNAMAN软件对上述序列进行比较及相似性比对,找出泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变(16Sr I组)植原体与其他组植原体的基因差异位点和高度保守区域,利用LAMP引物在线设计软件Primer Explorer V4针对16SrI组植原体16S基因和tuf基因(SEQ ID No.1所示的核苷酸序列组成)保守序列的6个区域设计出特异性引物。针对植原体16S基因设计了6套引物组(I-VI),针对tuf基因设计了两套引物组(⑦和⑧),利用上述引物组进行等温基因扩增,从扩增结果中看出I组和⑧组不能实现扩增,III组阴性对照同样出现扩增。因此弃用I组、III组和⑧组引物。对IV组、V组、VI组和⑦组引物进行特异性分析,同时对16SⅠ组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病与健康组织样品;16SⅡ组的花生丛枝、甘薯丛枝和臭矢菜丛枝的发病与健康组织样品;16SⅤ组的枣疯病、槐树丛枝、樱桃致死黄化和重阳木丛枝的发病与健康组织样品;16SXIV组的板栗黄化的发病与健康组织样品;以及以灭菌ddH2O作为阴性对照,进行泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化植原体环介导等温扩增的特异性试验,结果表明IV组、V组、VI组引物扩增反应极其灵敏,所有样品均出现扩增,包括病样品和健康对照。另外,从针对植原体16S基因设计引物的多次重复实验显示:其结果极其不稳定,极易出现健康对照的污染,因此弃用针对16S基因所设计的引物。而针对⑦组引物只有16Sr I组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病组织样品表现为阳性反应,在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色,而不同属的花生丛枝、甘薯丛枝、臭矢菜丛枝、枣疯病、槐树丛枝、樱桃致死黄化、重阳木丛枝、板栗黄化和所有的健康对照均为阴性。由此可见,本发明由⑦组引物(由SEQ ID No.2和SEQ ID No.3所示的核苷酸序列组成外引物对和由SEQ ID No.4和SEQ ID No.5所示的核苷酸序列组成内引物对)建立的环介导等温扩增检测方法对16Sr I组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化有较强的特异性,能较好的区分不同组间的植原体,可用于16Sr I组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化植原体的检测。
本发明对LAMP引物组(由SEQ ID No.2和SEQ ID No.3所示的核苷酸序列组成外引物对和由SEQ ID No.4和SEQ ID No.5所示的核苷酸序列组成内引物对)所建立的泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植环介导等温扩增检测方法的稳定性和灵敏度进行了检测检验。
稳定性检测表明:来自不同地方泡桐丛枝病样品均能表现为阳性反应,在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色,由此说明,本发明建立的环介导等温扩增检测方法具有较好的稳定性。
灵敏度检验表明:常规PCR经1%琼脂糖凝胶电泳检测样品在稀释到2-10的时候达到检测限度;本发明环介导等温扩增检测方法在稀释到2-13时检测结果仍为阳性(在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色)。由此说明,本发明建立的环介导等温扩增检测方法的灵敏度比常规PCR高8倍。
本发明还公开了LAMP引物组在泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体的早期诊断和病原菌的监测与鉴定中的应用。
本发明技术方案与现有技术相比具有以下有益效果:
(1)快速高效:整个扩增只需40~60min即可完成。
(2)操作简便:不需要复杂的仪器,不需要特殊的试剂,不需要预先进行双链DNA变性等步骤,只需一部恒定温度仪就能完成检测。
(3)高特异性:所用的特异性引物针对植原体tuf基因中6个不同区域设计,特异性强,对16Sr V组的枣疯病、16Sr II组的花生丛枝病以及16Sr XIV组的板栗黄化等均不能发生扩增。
(4)灵敏度高:相比于普通PCR,其检测灵敏度提高了8倍以上。
总之,本发明将LAMP等温扩增技术应用于泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变植原体检测上,对此类病害的早期预警、疫区的病原监测等方面具有重要意义,同时可以免除高昂的仪器投入,适合于基层推广使用。
本发明所涉及的术语定义
除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。
术语“引物”意指一小段单链DNA,作为DNA复制的起始点,在核酸合成反应时,作为每个多核苷酸链进行延伸的出发点而起作用的多核苷酸链。
术语“聚合酶链式反应”,简称PCR,意指一种分子生物学技术,用于放大扩增特定的DNA片段,PCR是利用DNA在体外95℃高温时变性会变成单链,低温(经常是60℃左右)时引物与单链按碱基互补配对的原则结合,再调温度至DNA聚合酶最适反应温度(72℃左右),DNA聚合酶沿着磷酸到五碳糖(5'→3')的方向合成互补链。
术语“环介导等温扩增法”,简称LAMP,是2000年开发的一种新颖的恒温核酸扩增方法,其特点是针对靶基因的6个区域设计4种特异引物,利用一种链置换DNA聚合酶在等温条件(63℃左右)保温30-60分钟,即可完成核酸扩增反应。
附图说明
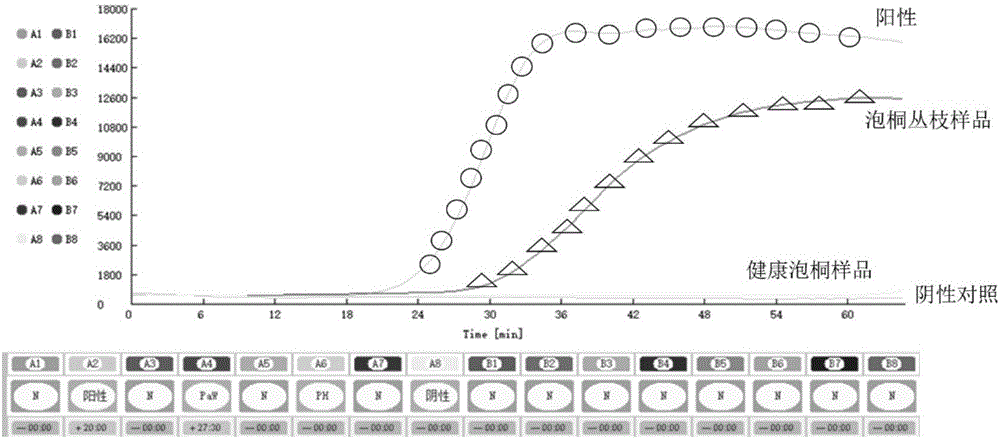
图1为泡桐丛枝病植原体环介导等温扩增产物的实时荧光检测结果:其中,阳性为LAMP扩增试剂盒自带阳性对照,阴性为LAMP扩增试剂盒自带阴性对照,PaWB为泡桐丛枝病样品,PH为健康泡桐样品;
图2为泡桐丛枝病植原体环介导等温扩增产物的颜色反应检测结果:其中,阳性为LAMP扩增试剂盒自带阳性对照,阴性为LAMP扩增试剂盒自带阴性对照,PaWB为泡桐丛枝病样品,PH为健康泡桐样品;
图3为引物组(I-VI)和引物组(⑦和⑧)的LAMP扩增产物的实时荧光检测结果;
图4为II组引物的序列比对结果;其中A为引物PaWBⅡ-F3的序列比对结果;B为引物PaWBⅡ-B3的序列比对结果;
图5为IV组引物的序列比对结果;其中A为引物PaWBⅣ-F3的序列比对结果;B为引物PaWBⅣ-B3的序列比对结果;
图6引物组IV的LAMP扩增特异性验证的实时荧光检测结果;
图7为V组引物的序列比对结果;其中A为引物PaWBV-F3的序列比对结果;B为引物PaWBV-B3的序列比对结果;
图8引物组V组的LAMP扩增特异性验证的实时荧光检测结果;
图9为VI组引物的序列比对结果;其中A为引物PaWBVI-F3的序列比对结果;B为引物PaWBVI-B3的序列比对结果;
图10为引物组VI组的LAMP扩增特异性验证的实时荧光检测结果;
图11为⑦组引物的序列比对结果;其中A为引物PaWBVI-F3的序列比对结果;B为引物PaWBVI-B3的序列比对结果;
图12引物组⑦组的LAMP扩增特异性验证的实时荧光检测结果;
图13为引物组⑦组的LAMP扩增特异性验证的颜色反应检测结果:其中,1:泡桐丛枝,2:苦楝丛枝,3:桑树萎缩,4:长春花绿变,5:莴苣黄化,6:花生丛枝,7:甘薯丛枝,8:臭矢菜丛枝,9:枣疯病,10:重阳木丛枝,11:樱桃致死黄化,12:红花槐丛枝,13:板栗黄化,14:健康泡桐,15:健康苦楝,16:健康桑树,17:健康长春花,18:健康莴苣,19:健康花生,20:健康甘薯,21:健康臭矢菜,22:健康枣树,23:健康重阳木,24:健康樱桃,25:健康槐树,26:健康板栗,CK:空白对照;
图14为LAMP扩增稳定性验证的实时荧光检测结果:其中,阳性为LAMP扩增试剂盒自带阳性对照,阴性为LAMP扩增试剂盒自带阴性对照,28:北京泡桐丛枝病样品,84:福建福州泡桐丛枝病病样品,95:辽宁大连泡桐丛枝病样品,96:河北保定泡桐丛枝病样品,97:贵州贵阳泡桐丛枝病样品,98:河南开封泡桐丛枝病样品,PH:为健康泡桐样品;
图15为LAMP扩增稳定性验证的颜色反应检测结果:其中,阳性为LAMP扩增试剂盒自带阳性对照,阴性为LAMP扩增试剂盒自带阴性对照,28:北京泡桐丛枝病样品,84:福建福州泡桐丛枝病病样品,95:辽宁大连泡桐丛枝病样品,96:河北保定泡桐丛枝病样品,97:贵州贵阳泡桐丛枝病样品,98:河南开封泡桐丛枝病样品,PH:为健康泡桐样品;
图16为常规PCR1%琼脂糖凝胶电泳检测灵敏度:其中,泳道M为4500bp的DNA Maker,其余泳道为采用二倍梯度稀释DNA作为模板的扩增情况;
图17为LAMP扩增灵敏度试验的实时荧光检测结果:其中,-10~-18为采用二倍梯度稀释DNA作为模板的扩增情况,CK为灭菌ddH2O对照;
图18为LAMP扩增灵敏度试验的颜色反应检测结果:其中,2-10~2-18为采用二倍梯度稀释DNA作为模板的扩增情况,CK为灭菌ddH2O对照。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
1、试剂来源
植物基因组提取试剂盒(Plant Genomic DNA Kit)购自艾德莱生物科技有限公司;
核酸扩增试剂盒购自广州迪澳生物科技有限公司;
2×PCR预混液购自博迈德生物科技有限公司。
实施例1泡桐丛枝病植原体环介导等温扩增快速检测方法的建立
1.植物总DNA的提取
采用植物基因组提取试剂盒(Plant Genomic DNA Kit,艾德莱生物科技有限公司)提取待测植物总DNA,置于-20℃冰箱保存备用。
2.LAMP扩增
反应体系:总体积45μL,包含有:10μM PaWB3-F3 0.5μL,10μM PaWB3-B3 0.5μL,40μM PaWB3-FIP 1μL,40μM PaWB3-BIP 1μL,LAMP反应液RM(2×)12.5μL,8U/μLBst DNA聚合酶1μL,荧光染料10×SYBR GreenⅠ0.5μL,待测样品DNA 0.5μL,用超纯水补齐到25μL,同时加入20μL密封液。
反应条件:将配置好的反应管混匀后离心,置于63℃恒温反应60min,80℃灭活5min。
3.扩增结果判定
每次检测,设置阴阳性对照,在阴性对照和阳性对照均成立时,整个实验有效,可判定结果。
LAMP反应结果的判定:如图1所示,将反应管置于恒温荧光检测仪或者荧光PCR仪中,实时读取荧光信号,若出现“S”型扩增曲线则判定为阳性反应,即样品中感染有植原体,若无“S”型扩增曲线则判定为阴性。或者通过肉眼观察反应管中颜色的变化(图2),反应结束后,在反应混合液中加入1μL显色液,若扩增产物变为翠绿色则判定为阳性反应,即样品中感染有植原体,若扩增产物仍为棕黄色则判定为阴性。该结果与普通PCR检测结果吻合,证明此方法数据可靠。
实验例2引物的制备与初步筛选
1、实验方法
1.1引物设计与合成
在GeneBank中搜集不同组植原体16S基因和tuf基因的核酸序列,利用DNAMAN软件对上述序列进行比较及相似性比对,找出泡桐丛枝、苦楝丛枝、桑萎缩、莴苣黄化和长春花绿变(16Sr I组)植原体与其他组植原体的基因差异位点和高度保守区域,利用LAMP引物在线设计软件Primer Explorer V4针对16SrI组植原体16S基因和tuf基因保守序列的6个区域设计出特异性引物。其中,针对植原体16S基因设计了6套引物组(I-VI),针对tuf基因设计了两套引物组(⑦和⑧),结果见表1,引物由上海生工生物工程公司按照HPLC纯度级别合成。
表1 PCR引物序列
1.2引物的初步筛选
1.2.1植物总DNA的提取
参照实施例1。
1.2.2LAMP扩增
参照实施例1。
1.2.3扩增结果判定
参照实施例1。
2、实验结果
扩增结果见图3,从图中可以看出:I组和⑧组不能实现扩增,III组阴性对照同样出现扩增。因此弃用I组、III组和⑧组引物。而II组、IV组、V组、VI组和⑦组引物均出现了阳性扩增,同时阴性对照未出现扩增。
实施例3特异性检验
1、试验方法
按照上述实施例1所建立的环介导等温扩增反应体系,同时对16SⅠ组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病与健康组织样品;16SⅡ组的花生丛枝、甘薯丛枝和臭矢菜丛枝的发病与健康组织样品;16SⅤ组的枣疯病、槐树丛枝、樱桃致死黄化和重阳木丛枝的发病与健康组织样品;16SXIV组的板栗黄化的发病与健康组织样品;以及以灭菌ddH2O作为阴性对照,进行泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化植原体环介导等温扩增的特异性试验。
分别提取16SⅠ组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病与健康组织样品;16SⅡ组的花生丛枝、甘薯丛枝和臭矢菜丛枝的发病与健康组织样品;16SⅤ组的枣疯病、槐树丛枝、樱桃致死黄化和重阳木丛枝的发病与健康组织样品;16SXIV组的板栗黄化的发病与健康组织样品植物总DNA以及灭菌ddH2O作为模板。
按照上述实施例1中所提供的反应体系和反应条件进行环介导等温扩增反应。所用引物分别为:IV组、V组、VI组和⑦组引物。
按照上述实施例1中所提供的LAMP扩增结果判定方法进行结果判定。
2、试验结果
针对IV组(引物序列的比对见图5)、V组(引物序列的比对见图7)、VI组引物(引物序列的比对见图9),结果如图6、8、10所示,从图中可以看出:扩增反应极其灵敏,所有样品均出现扩增,包括病样品和健康对照。
另外,从针对植原体16S基因设计引物的多次重复实验显示:其结果极其不稳定,极易出现健康对照的污染,因此弃用针对16S基因所设计的引物。
针对⑦组引物(引物序列的比对见图11),结果如图12和13所述,从图中可以看出:只有16Sr I组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病组织样品表现为阳性反应,在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色,而不同属的花生丛枝、甘薯丛枝、臭矢菜丛枝、枣疯病、槐树丛枝、樱桃致死黄化、重阳木丛枝、板栗黄化和所有的健康对照均为阴性,由此可见,本发明⑦组引物建立的环介导等温扩增检测方法对16Sr I亚组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化有较强的特异性,能较好的区分不同组间的植原体,可用于16Sr I组的泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化植原体的检测。
实施例4稳定性检验
1、试验方法
按照上述实施例1所建立的环介导等温扩增反应体系,同时对来自不同地区泡桐丛枝病发病样品,以及以健康泡桐作为阴性对照,进行泡桐丛枝植原体环介导等温扩增的稳定性试验。
分别提取来自不同地区泡桐丛枝病发病样品和健康泡桐的植物组织总DNA作为模板。
按照上述实施例1中所提供的反应体系和反应条件进行环介导等温扩增反应。
按照上述实施例1中所提供的LAMP扩增结果判定方法进行结果判定。
2、试验结果
判断结果如图14、图15所示,来自不同地方泡桐丛枝病样品均能表现为阳性反应,在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色,由此说明,本发明建立的环介导等温扩增检测方法具有较好的稳定性。
实施例5灵敏度检验
1、试验方法
采用植物基因组提取试剂盒(Plant Genomic DNA Kit,艾德莱生物科技有限公司)提取泡桐丛枝病发病植株的叶片总DNA,以此做为模板,用灭菌ddH2O进行二倍梯度稀释,按照上述实施例2中的反应体系和反应条件进行环介导等温扩增,同时进行常规PCR进行灵敏度比较。
常规PCR检测:以二倍梯度稀释的DNA为模板,用植原体通用引物R16mF2/R16mR1进行PCR扩增。常规PCR扩增体系为25μL,扩增反应体系中含有制备的DNA模板1μL,正反向引物各0.5μL(10μM),2×PCR预混液(0.05U/μLTaq DNA聚合酶,4mM MgCl2和0.4mM dNTPs)12.5μL,ddH2O补至25μL。反应程序:94℃5min;94℃45s,52℃45s,72℃1min,共35个循环;72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳检测。
2、试验结果
常规PCR经1%琼脂糖凝胶电泳检测结果如图16所示,样品在稀释到2-10的时候达到检测限度。而如图17、图18所示环介导等温扩增检测方法在稀释到2-13时检测结果仍为阳性(在荧光检测仪器中出现“S”型扩增曲线,同时肉眼观察可见颜色变为翠绿色)。由此说明,本发明建立的环介导等温扩增检测方法的灵敏度比常规PCR高8倍。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用