一种长链非编码RNAlnc‑HR1用途及克隆方法与流程
技术领域:
本发明涉及医药
技术领域:
,尤其涉及一种长链非编码RNAlnc-HR1、用途及其克隆方法。
背景技术:
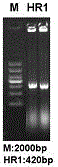
:临床慢性肝炎、脂肪肝等肝病,主要是由于病毒感染、不合理的饮食、致病细菌感染、药物损伤等引发的脂类在肝脏的代谢异常,从而引发相关的症状。针对大量中性脂类在肝脏内的大量累积,可能应发肝纤维化甚至造成肝硬化肝细胞肝癌等严重的肝病,目前的治疗方法首先是给予患者降脂酶,降低肝脏内脂类的积累,最终恢复肝脏和血液中脂类的含量达到正常值。但是对于常用的降脂药物,只能降低肝脏和血液中脂类的含量,并不能直接抑制脂类的合成,需要长期用药。技术实现要素:本发明的目的是提供一种lnc-HR1、用途及其克隆方法,实现从源头抑制肝脏内脂类的合成。为了解决上述技术问题,本发明提供的一种lnc-HR1、用途及其克隆方法是这样实现的:一种长链非编码RNAlnc-HR1,具有如下序列:GGTGATAAGGGTCATCTCTATGAATAGCTTTCTTCCTGGAACTGACTGGACTTCACAACCAATTTTGGGCTAGTGTGGAGAGATCAGCTGTGAGAAACATCCATTGATTTGCTCAGGCTGCCCTTTGTATCTTAATGCTTCAGGTTTTGTTATCCTGCGCCTTTCTTCTGTCTTCTTTCCTCATAAGTTTTTTAGATACAATTTTATTGCCAATAATTAAAGAGTGAGAATGAGCGGCAATGGGCTGGTATGGTTGCATTCAAACTCCAAAGTTCACATTTTGGAATATTGATTTTTGCTTGAGAACAACTTACCTAAAAACCATGGGAATTTGGCAGGGAGGGATGTGATGGGGCATATGTTGAGTTCTTTCAAGGAATTTAACTTTCATTTCTGAAGAAGTAAAAACTGTGGCATGGT。所述lnc-HR1的克隆方法,包括:提取细胞的总RNA,在所述总RAN中加入逆转录酶,所述总RAN逆转录成cDNA,以所述cDNA为PCR反应模板克隆得到所述lnc-HR1。可选的,所述PCR反应的引物为:上游序列:5’-GGAGAATAGCTTTCTTCCTGGAACT-3’下游序列:5’-CCGCATGCCACAGTTTTTACTTCTTC-3’。所述lnc-HR1抑制肝脏中脂类合成的用途。可选的,所述lnc-HR1抑制肝脏中甘油三酯合成的用途。可选的,所述的lnc-HR1抑制SREBP-1c合成的用途,所述固醇调节元件结合蛋白1c促进所述甘油三酯的合成。可选的,所述的lnc-HR1抑制所述SREBP-1cmRNA转录的用途。所述的lnc-HR1在抑制肝脏中脂类合成的药物中的用途。可选的,lnc-HR1在抑制肝脏中甘油三酯合成的药物中的用途。可选的,lnc-HR1在抑制肝脏中SREBP-1c合成的药物中的用途。本发明从Huh7细胞中提取总RNA、克隆lnc-HR1,构建lnc-HR1的真核表达载体(pMIR-lncHR1),然后将lnc-HR1的真核表达载体转染到Huh7细胞中,经过一段时间的培养,实时荧光定量PCR检测细胞中lnc-HR1、固醇调节元件结合蛋白(SREBP-1c)的mRNA;使用2-△△Ct法分析mRNA转录水平的变化,结果如下:lncHR1的表达量随着pMIR-lncHR1剂量的增加而梯度升高,SREBP-1c的mRNA表达水平受到lncHR1的抑制,并且呈剂量依赖性,最终受抑制率达到50%左右。将转染了pMIR-lncHR1的Huh7细胞裂解,进一步验证在蛋白质水平上lncHR1对SREBP-1c的抑制作用,westernblot结果显示:随着lncHR1剂量的增加,SREBP-1c的蛋白表达受到抑制。本发明提供的lnc-HR1能够抑制SREBP-1c的合成,而SREBP-1c是甘油三酯合成的关键因子,从而抑制甘油三酯的合成,实现从源头抑制肝脏内脂类的合成,有效的降低脂类的含量和保护肝脏。附图说明图1是本发明提供的lnc-HR1复制电泳图;图2是本发明构建的真核表达载体pMIR-DFT图谱;图3是本发明提供的pMIR-lncHR1剂量与lncHR1表达关系图;图4是本发明提供的lncHR1剂量与SREBP-1c的mRNA表达关系图;图5是本发明提供的lncHR1剂量与SREBP-1c的关系图;图6是本发明提供的经油酸处理的细胞试验结果对比图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本发明从细胞中提取总RNA并克隆lncHR1,然后构建质粒表达载体pMIR-lncHR1,然后将pMIR-lncHR1转染到细胞中培养,实时荧光定量PCR确定SREBP-1c的mRNA表达水平受到lncHR1的抑制,SREBP-1c的蛋白表达受到抑制;然后油酸处理细胞,设置正常细胞组、转染了pMIR-lncHR1和转染pMIR-DFT空载体质粒细胞组对比试验,得出转染了pMIR-lncHR1的细胞,甘油三酯的积累形式(脂滴)累积受到抑制。1、提取总RNA并克隆lncHR1。按照Trizol方法,Thermo公司生产的TRIzol试剂提取Huh7细胞的总RNA,在总RAN中加入逆转录酶,逆转录成cDNA,在同一反应体系中以cDNA为模板,使用TAKARA公司生产的一步法RT-PCR试剂盒,,按照说明书操作方法克隆lncHR1基因,克隆引物如表1所示;PCR的反应体系和循环条件如表2所示。使用ThermoPCR仪进行的PCR反应。引物序列上游5’-GGAGAATAGCTTTCTTCCTGGAACT-3’下游5’-CCGCATGCCACAGTTTTTACTTCTTC-3’注:斜体(GGA,CCG)为单酶切位点的保护碱基表1表2获得的PCR产物,采用常规的1%琼脂糖核酸电泳上样量5μl,使用bio-Rad核酸电泳仪,结果如图1所示:lncHR1RNA大小为420bp,通过测序得到lncHR1RNA序列为:GGTGATAAGGGTCATCTCTATGAATAGCTTTCTTCCTGGAACTGACTGGACTTCACAACCAATTTTGGGCTAGTGTGGAGAGATCAGCTGTGAGAAACATCCATTGATTTGCTCAGGCTGCCCTTTGTATCTTAATGCTTCAGGTTTTGTTATCCTGCGCCTTTCTTCTGTCTTCTTTCCTCATAAGTTTTTTAGATACAATTTTATTGCCAATAATTAAAGAGTGAGAATGAGCGGCAATGGGCTGGTATGGTTGCATTCAAACTCCAAAGTTCACATTTTGGAATATTGATTTTTGCTTGAGAACAACTTACCTAAAAACCATGGGAATTTGGCAGGGAGGGATGTGATGGGGCATATGTTGAGTTCTTTCAAGGAATTTAACTTTCATTTCTGAAGAAGTAAAAACTGTGGCATGGT。2、构建真核表达载体pMIR-lncHR1首先:克隆基因lncHR1的消化和真核表达载体pMIR-DFT的线性化真核表达载体pMIR-DFT图谱如图2所示,lncHR1在表达载体上的单克隆位点为BglⅡ(A^GATCT)和XhoⅠ(C^TCGAG)。将lncHR1克隆产物消化、获得两个酶切位点的黏性末端,对表达载体进行线性化;线性化双切酶体系如表3所示。表3然后2%琼脂糖核酸电泳,切割下lncHR1消化产物片段和质粒线性化片段,用QUIGENDNA胶回收试剂盒,按照KIT的操作步骤获得lncHR1线性化片段和线性化质粒DNA。然后,将线性化质粒和消化回收的lncHR1片段连接使用NEB公司生产的T4DNAligase,将线性化质粒和消化回收的lncHR1片段连接,T4连接酶反应体系如表4所示:表4取5μlT4连接产物,用DH5α感受态细胞做常规的转化实验,培养12h挑取单菌落测序,测序引物为MSCV序列:GGGGTACAGTGCAGGGGAAAGAAT,以确定lncHR1已经连接到过表达质粒的克隆位点;阳性克隆扩大培养、提取质粒,做后续实验。此时,提取的质粒中已经含有lncHR1基因。3、细胞转染在24wellplate的Huh7细胞中转染过表达质粒pMIR-lncHR1,以空载体质粒pMIR-DFT为对照。转染具体操作如下:转染试剂使用SignaGen生产的LipoD293;Gibco生产的FBS、DMEM培养基和双抗抗生素。1)转染前24h,用含10%FBS的DMEM培养基在24孔板内接种培养细胞,37℃,恒温、5%CO2培养箱培养过夜。2)待细胞长到80%汇合度,转染前1h更换新鲜的完全培基。3)用空DMEM培养基稀释1μgDNA质粒,混匀。4)用空DMEM培养基稀释2μl转染试剂D293,混匀。5)将转染试剂逐滴加入到稀释的质粒中,轻柔混匀,室温静置温育15min。6)将步聚5)中质粒和转染试剂的混悬液均匀滴加入待转染的细胞中;轻轻晃动,以使其分布均匀。7)5~8h换成新的含10%FBS的培养基,继续培养48h,得到转染过表达质粒pMIR-lncHR1的细胞。4、在mRNA水平验证lncHR1对SREBP-1c的抑制作用收集过表达质粒pMIR-lncHR1的细胞于Trizol试剂中,提取RNA,以总RNA为模版,对lncHR1以及SREBP-1c和β-actin的mRNA水平进行相对定量测定,进行qRT-PCR实验;使用TAKARA的OneStepSYBRPrimescriptRT-PCRKIT。.定量引物如下:结果如表5下:表5PCR反应体系及循环条件如表6所示:表6相对定量中以管家基因β-actin为内参,用2-△△Ct法分析mRNA转录水平的变化。结果如图3和图4所示:lncHR1的表达量随着pMIR-lncHR1剂量的增加而梯度升高,SREBP-1c的mRNA表达水平受到lncHR1的抑制,并且呈剂量依赖性,最终受抑制率达到50%左右。结果表明,SREBP-1c在转录水平上受到过表达lncHR1的抑制作用。5、在蛋白质水平上验证lncHR1对SREBP-1c的抑制作用收集过表达质粒pMIR-lncHR1的细胞,用2×loadingbuffer裂解液裂解,用于蛋白质检测实验SREBP-1c抗体(SCRUZ);Sigma的抗鼠β-actin。,如图5所示,westernblot结果显示:随着lncHR1剂量的增加,SREBP-1c的蛋白表达受到抑制,呈现出剂量的梯度依赖性。6、pMIR-HR1抑制肝细胞中甘油三酯合成脂滴(LDs,LipidDroplets)是肝病发生时,肝细胞中重要的脂类累积形式,主要有中性脂类甘油三酯(Triglyceride,TG)组成。首先用0.5μM的油酸(OA,OleicAcid)处理Huh7细胞,诱导细胞形成脂肪变性细胞;采用油红染色的方法,观察细胞内LDs的累积。在脂肪变性细胞中,采用3中转染方式转染pMIR-HR1,48h后用油红染色,如图6所示,蓝色的(黑白图中显示为大块黑色)为细胞核,红色的(黑白图中显示为小黑点)为LDs;图6中A为未经油酸处理的细胞,含有少量的LDs;B为经油酸处理脂肪变性的细胞,转染pMIR-DFT空载体质粒,含有大量的LDs;C为油酸处理脂肪变性的细胞,转染了pMIR-HR1,LDs量明显减少。结果表示,过表达lncHR1后,LDs的累积受到抑制。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。SEQUENCELISTING<110>新乡医学院<120>一种长链非编码RNAlnc-HR1用途及克隆方法<130>2016<160>1<170>PatentInversion3.3<210>1<211>420<212>RNA<213>人种(Humansp.)<400>1ggtgataagggtcatctctatgaatagctttcttcctggaactgactggacttcacaacc60aattttgggctagtgtggagagatcagctgtgagaaacatccattgatttgctcaggctg120ccctttgtatcttaatgcttcaggttttgttatcctgcgcctttcttctgtcttctttcc180tcataagttttttagatacaattttattgccaataattaaagagtgagaatgagcggcaa240tgggctggtatggttgcattcaaactccaaagttcacattttggaatattgatttttgct300tgagaacaacttacctaaaaaccatgggaatttggcagggagggatgtgatggggcatat360gttgagttctttcaaggaatttaactttcatttctgaagaagtaaaaactgtggcatggt420当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1