药物活性物质的固体形式的制作方法
技术领域
本发明涉及化合物的多种形式及制剂,例如,在药学应用中具有用途的化合物。
背景技术:
由式1表示化合物丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物1):
已经在WO 2007002433和WO 2007002325中描述了式1的化合物。在国际申请号PCT/US10/29489中公开了化合物1的结晶形式1和2(也表示为I和II),无定形形式,以及甲苯磺酸盐和甲磺酸盐。
可以以多种不同的形式如例如盐、溶剂化物、水合物、共结晶来制备活性药物成分(API’s)。API’s也可为它们的无定形状态或一种或几种结晶形式(多晶型物)。取决于形式,可改变API的物理化学性质,例如,导致不同的溶解度、热力学稳定性、不同形式的密度或熔点。因此,这样的物理化学性质可对已知的API的功效或生物利用率具有重要的影响。
技术实现要素:
本发明提供式1的化合物的固体形式,其选自:
a)化合物1的基本无定形形式,选自形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV、XXVI或其组合,其中化合物1被分子地分散。
b)形式III、IV、V、VI、VII、IX、X、XI、XII、XIII、XIV、或XV的溶剂化物;
c)形式VIII或XVI的多晶型物;和
d)化合物1的磺酸盐、氢溴酸盐、或盐酸盐。
在一个具体的实施方式中,所述固体形式选自形式III、IV、V、VI、VII、IX、X、XI、XII、XIII、XIV或XV的溶剂化物。
在另一个具体地优选的实施方式中,所述固体形式选自形式VIII或XVI的多晶型物。
在还有的另一个优选的实施方式中,所述固体形式选自化合物1的硫酸盐、氢溴酸盐或盐酸盐。
在还有的另一个优选的实施方式中,所述固体形式是化合物1的基本无定形形式,选自形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV、或XXVI或其组合,其中化合物1被分子地分散。
在另一个实施方式中,本发明提供用于治疗需要其的哺乳动物的疾病或病症的方法。方法包含给予哺乳动物有效量的组合物,该组合物包括此处描述的固体形式化合物。在某些实施方式中,由具有V600E、V600M、V600R、V600K或V600G突变的b-Raf突变体调节疾病或病症。在其他实施方式中,疾病或病症包括但不限于黑素瘤、甲状腺癌和结肠直肠癌。
此处公开的固体形式可进一步被加工成为本领域的技术人员所熟知的任何类型的固体药物配制剂或剂量形式。特别优选的是口服剂量形式如药片、胶囊、药丸、散剂、混悬剂、贴剂等等。例如,可在Raymond C.Rowe et al,Handbook of Pharmaceutical Excipients,6th edition,2009,Pharmaceutical Press(PubL);ISBN-10:0853697922中发现适当的赋形剂以及用于制造这样的药物配制剂的方法的详述。
因此,这样获得的药物配制剂进一步形成此处提供的实施方式。
附图说明
图1示出如可通过实施例1中公开的方法获得的化合物1的无定形形式的XRPD图形。
图2示出如通过实施例3中公开的方法获得的化合物1的形式III的XRPD图形。
图3示出如通过实施例4中公开的方法获得的化合物1的形式IV的XRPD图形。
图4示出如通过实施例5中公开的方法获得的化合物1的形式V的XRPD图形。
图5示出如通过实施例6中公开的方法获得的化合物1的形式VI的XRPD图形。
图6示出如通过实施例7中公开的方法获得的化合物1的形式VII的XRPD图形。
图7示出如通过实施例8中公开的方法获得的化合物1的形式VIII的XRPD图形。
图8示出如通过实施例9中公开的方法获得的化合物1的形式IX的XRPD图形。
图9示出如通过实施例10中公开的方法获得的化合物1的形式X的XRPD图形。
图10示出如通过实施例11中公开的方法获得的化合物1的形式XI的XRPD图形。
图11示出如通过实施例12中公开的方法获得的化合物1的形式XII的XRPD图形。
图12示出如通过实施例13中公开的方法获得的化合物1的形式XIII的XRPD图形。
图13示出如通过实施例14中公开的方法获得的化合物1的形式XIV的XRPD图形。
图14示出如通过实施例15中公开的方法获得的化合物1的形式XV的XRPD图形。
图15示出如通过实施例16中公开的方法获得的化合物1的形式XVI的XRPD图形。
图16示出如通过实施例17中公开的方法获得的化合物1的图形(pattern)6的XRPD图形。
图17示出如通过实施例18中公开的方法获得的化合物1的硫酸盐的XRPD图形。
图18示出如通过实施例19中公开的方法获得的化合物1的氢溴酸盐的XRPD图形。
图19示出如通过实施例20中公开的方法获得的化合物1的盐酸盐的XRPD图形。
图20示出如通过实施例21和22中公开的方法获得的化合物1的形式XVII的XRPD图形。
图21示出如通过实施例21和22中公开的方法获得的化合物1的形式XVIII的XRPD图形。
图22示出如通过实施例21和22中公开的方法获得的化合物1的形式XIX的XRPD图形。
图23示出如通过实施例21和22中公开的方法获得的化合物1的形式XX的XRPD图形。
图24示出如通过实施例21和22中公开的方法获得的化合物1的形式XXI的XRPD图形。
图25示出如通过实施例21和22中公开的方法获得的化合物1的形式XXII的XRPD图形。
图26示出如通过实施例21和22中公开的方法获得的化合物1的形式XXIII的XRPD图形。
图27示出如通过实施例21和22中公开的方法获得的化合物1的形式XXIV的XRPD图形。
图28示出如通过实施例21和22中公开的方法获得的化合物1的形式XXV的XRPD图形。
图29示出如通过实施例21和22中公开的方法获得的化合物1的形式XXVI的XRPD图形。
具体实施方式
定义
此处应用的术语“化合物1”意指丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺,有时也将该化合物指定为PLX-4032。
如此处应用的,常用术语“无定形形式”指示缺少长程有序且因此不显示尖锐的X-射线峰的材料。无定形材料的X-射线粉末衍射(XRPD)图形的特点是一个或更多无定形晕。更具体地,假如所述无定形形式不形成单相系统,如,例如,固体分散体或微沉淀体相粉末(MBP)和任何类型的支撑材料如聚合物等等,因此,如此处应用的术语“无定形形式”指丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物1)的无定形形式。
术语“无定形晕”意指无定形物质——即,化合物1的无定形形式——的X射线粉末衍射图形中的宽衍射峰(maximum)。无定形晕的FWHM(半峰全宽)通常大于2-θ中的两度。
此处提及的化合物1的“形式II”意指丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺的热力学稳定形式。
如此处使用的术语“分子地分散”指化合物1在聚合物内的随机分布。更具体地,可在由固体状态的聚合物形成的基质内分散化合物(例如,化合物1),以使得化合物1和基质形成单相系统(固体分散体)和以它的无定形形式固定化合物1。这样的固体分散体的实例是微沉淀体相粉末(MBP)。可利用多种方法,例如,通过所获得的具有单一的玻璃化转变温度的固体分子络合物,证实化合物是否在聚合物中分子地分散。
如此处应用的术语“瞬时冷却”意指利用液体氮冷却。
与此处公开的XRPD图形结合的术语“大约”意指,存在±0.2度的2θ度(用度2θ表示)的测量值的不确定性。
如此处应用的术语“多晶型物”意指其中可使化合物结晶的不同的结晶结构中的一个。最好通过它们的空间群和晶胞参数表征多晶型物。为具有相同的元素分析的材料保留该术语。
如此处应用的术语“溶剂化物”意指包括溶剂的化学计量或非化学计量的量的晶体形式。
术语“基本无定形的”材料包含具有至多大约10%的结晶度的材料;和“无定形的”材料包含具有至多大约2%的结晶度的材料。在一些实施方式中,“无定形的”材料意指具有至多1%、0.5%或0.1%的结晶度的材料。
“环境温度”意指18至28℃、优选地20至24℃的范围内的任何温度。
术语“组合物”指适于给予预期的动物受试者以用于治疗目的的药物配制剂,所述配制剂含有至少一种药学活性化合物,包含其任何固体形式。组合物可包含至少一种另外的药学上可接受的成分,以便提供化合物的改进的制剂,如适当的载体、添加剂或赋形剂。
术语“药学上可接受的”指,考虑到要治疗的疾病或病症和各自的给予途径,指定的材料不具有使有理性地谨慎的医师避免将材料给予病人的性能。例如,通常要求的是,例如,对于可注射的,这样的材料本质上是无菌的。
术语“治疗上有效的”或“有效的量”指,材料或材料的量对预防、减轻、或改善疾病或身体状况的一个或更多症状,和/或对延长正在治疗的受试者的存活是有效的。在某些实施方式中,化合物1的“治疗上有效的量”指用于抑制含有V600E突变的人类b-Raf所需要的这样一段时间的这样的剂量和/或给药。在一些实施方式中,人类b-Raf包含V600A、V600M、V600R、V600K或V600G突变。此外,治疗上有效的量可能是其中总的治疗上有益效果超过有毒的或不期望的副作用的量。可根据正在被治疗的受试者的疾病状态、年龄和体重改变化合物1的治疗上有效的量。因而,通常调整给药方案以便适应每一个具体情况中的个体需要,且所述给药方案在本领域的技术内。在某些实施方式中,关于化合物1给予至成人的适当的日剂量可以是从大约100mg至大约3200mg;或从大约250mg至大约2000mg,尽管上限可能超过指定时的量。可作为一次剂量、分开的剂量、或用于肠胃外给药给予化合物1的日剂量,可作为皮下注射给予所述日剂量。
在喷雾干燥分散工艺中,化合物1和聚合物可溶解在具有低沸点的普通溶剂中,例如,乙醇、甲醇、丙酮,等等。依靠喷雾干燥或冷冻干燥,在接近于沸点的温度或在高真空(低蒸汽压)下通过闪蒸蒸发溶剂,留下化合物1沉淀在由聚合物形成的基质中。在某些实施方式中,化合物1处于甲磺酸盐形式或甲苯磺酸盐形式,且因而优选地具有改进的溶解度。
如在喷雾干燥分散工艺中此处使用的术语“甲基丙烯酸共聚物”包括但不限于,甲基丙烯酸共聚物、甲基丙烯酸-甲基丙烯酸酯共聚物、甲基丙烯酸-丙烯酸乙酯共聚物、季胺基甲基丙烯酸酯共聚物、甲基丙烯酸氨基烷基酯共聚物等等。在某些实施方式中,“甲基丙烯酸共聚物”可以是L 100和L 12,5(也称为,或符合:“甲基丙烯酸共聚物,类型A”;“甲基丙烯酸-甲基丙烯酸甲酯共聚物(1∶1)”;“甲基丙烯酸共聚物L”;“DMF 1242”或“PR-MF 6918”);S 100和S 12,5(也称为,或符合:“甲基丙烯酸共聚物,类型B”;“甲基丙烯酸-甲基丙烯酸甲酯共聚物(1∶2)”;“甲基丙烯酸共聚物S”;“DMF 1242”或“PR-MF 6918”);L 100-55(也称为,或符合:“甲基丙烯酸共聚物,类型C”;“甲基丙烯酸-丙烯酸乙酯共聚物(1∶1)类型A”;“干燥的甲基丙烯酸共聚物LD”;或“DMF 2584”);L 30D-55(也称为,或符合:“甲基丙烯酸共聚物分散体”;“甲基丙烯酸-丙烯酸乙酯共聚物(1∶1)分散体30%”;“甲基丙烯酸共聚物LD”;JPE DMF 2584”;“PR-MF 8216”);FS 30D(也称为DMF 13941或DMF 2006-176);RL 100(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“甲基丙烯酸氨基烷基酯共聚物RS”;“DMF 1242”或“PR-MF 6918”);RL PO(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“甲基丙烯酸氨基烷基酯共聚物RS”;“DMF 1242”);RL 12,5(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“DMF 1242”或“PR-MF 6918”);L 100-55(也称为,或符合:“甲基丙烯酸共聚物,类型C”;“甲基丙烯酸-丙烯酸乙酯共聚物(1∶1)类型A”;“干燥的甲基丙烯酸共聚物LD”;“DMF 2584”);L 30D-55(也称为,或符合:“甲基丙烯酸共聚物分散体”NF“甲基丙烯酸-丙烯酸乙酯共聚物(1∶1)分散体30%”;“甲基丙烯酸共聚物LD”;“DMF 2584”或“PR-MF 8216”);FS 30D(也称为,或符合:“DMF 13941”或“DMF 2006-176”);RL 100(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“甲基丙烯酸氨基烷基酯共聚物RS”;“DMF 1242”或“PR-MF 6918”);RL PO(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“甲基丙烯酸氨基烷基酯共聚物RS”;或“DMF 1242”);RL 12.5(也称为,或符合:符合“季胺基甲基丙烯酸酯共聚物,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;“DMF 1242”或“PR-MF 6918”的聚合物);RL 30D(也称为,或符合:“季胺基甲基丙烯酸酯共聚物分散体,类型A”;“季胺基甲基丙烯酸酯共聚物(类型A)”;或“DMF 1242”);RS 100(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型B”;NF“季胺基甲基丙烯酸酯共聚物(类型B)”;“甲基丙烯酸氨基烷基酯共聚物RS”;“DMF 1242”或“PR-MF 6918”);RS PO(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型B”;“季胺基甲基丙烯酸酯共聚物(类型B)”;“甲基丙烯酸氨基烷基酯共聚物RS”;或“DMF 1242”);RS 12.5(也称为,或符合:“季胺基甲基丙烯酸酯共聚物,类型B”;符合“季胺基甲基丙烯酸酯共聚物(类型B)”的NF聚合物;“DMF 1242”或“PR-MF 6918”);RS 30D(也称为,或符合:“季胺基甲基丙烯酸酯共聚物分散体,类型B”;符合“季胺基甲基丙烯酸酯共聚物(类型B)”的NF聚合物;或“DMF 1242”);E 100(也称为,或符合:“甲基丙烯酸氨基酯共聚物”;NF“碱性丁基化甲基丙烯酸酯共聚物”;“甲基丙烯酸氨基烷基酯共聚物E”;“DMF 1242”或“PR-MF 6918”);E PO(也称为,或符合:“碱性丁基化甲基丙烯酸酯共聚物”;“甲基丙烯酸氨基烷基酯共聚物E”;“甲基丙烯酸氨基酯共聚物)”;“DMF 1242”);E 12.5(也称为,或符合:“甲基丙烯酸氨基酯共聚物”;“碱性丁基化甲基丙烯酸酯共聚物”;“DMF 1242”或“PR-MF 6918”);NE 30D(也称为,或符合:“丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散体”;“聚丙烯酸酯分散体30%”(“聚(丙烯酸乙酯-甲基丙烯酸甲酯)-分散体30%”);“丙烯酸乙酯甲基丙烯酸甲酯共聚物分散体”;“DMF2822”或“PR-MF 6918”);NE 40D(也称为,或符合:DMF 2822);NM 30D(也称为“聚丙烯酸酯分散体30%”;“聚(丙烯酸乙酯-甲基丙烯酸甲酯)-分散体30%”);或“DMF 2822”);B(也称为,或符合“DMF 12102”),等等。
如此处使用的术语“API”意指活性药物成分。
如此处应用的术语“DSC”意指差示扫描量热法。
如此处应用的术语“DVS”意指动态蒸汽吸附。
如此处应用的术语“IR”意指红外光谱学。
如此处应用的术语“Raman”意指拉曼光谱学。
如此处应用的术语“XRPD”意指X-射线粉末衍射。
如此处应用的术语“TGA”意指热重分析。
表征方法
利用具有FRS05传感器的Mettler-ToledoTM差示扫描量热计DSC820、DSC821或DSC 1记录DSC曲线。利用铟作为参照物进行系统适应性检验,和利用铟、苯甲酸、联苯和锌作为参考物执行校准。
对于测量,将大约2-6mg的样品放置在精确地称重和利用穿孔盖密封地封闭的铝盘中。在测量之前,自动地穿通盖,造成大约1.5mm的针孔。然后,使用通常10K/min的加热速度,在大约100mL/min的氮流量下加热样品。
在Mettler-ToledoTM热重分析器上(TGA850或TGA851)进行TGA分析。利用库仑法阳极液(Hydranal)作为参照物进行系统适应性检验,和利用铝和铟作为参照物进行校准。
对于热重量分析,将大约5-10mg的样品放置在精确地称重和利用穿孔盖密封地封闭的铝盘中。在测量之前,自动地穿通盖,造成大约1.5mm的针孔。然后,利用5K/min的加热速度,在大约50mL/min的氮流量下加热样品。
在DVS-1(SMS表面测量系统)水分平衡系统上收集DVS等温线。在25℃,0%RH至90%RH的范围内逐步地测量吸附/解吸等温线。选择小于0.002mg/min的重量改变作为标准,以便转变成相对湿度的下一个水平(具有六小时的最大平衡时间,如果不满足重量标准)。校正数据用于样品的最初含水量;即,将在0%相对湿度干燥样品之后的重量认为是零点。
利用FTIR分光计的透过率,根据大约5mg的样品的努乔尔(Nujol)悬浮液的薄膜和两个氯化钠盘之间的少量的努乔尔记录IR光谱。分光计是NicoletTM20SXB或等同物(分辨率2cm-1,32或更多的共同附加的扫描,MCT检测器)。
利用装备有Peltier冷却CCD探测器和1200l/mm光栅的ARAMIS(HoribaJobinYvon)拉曼显微镜,在785nm的激发下,在150-1800cm-1的范围内记录拉曼光谱。
在环境条件下,在具有STOE STADIP衍射计的传动几何体中记录X-射线粉末衍射图形(Cu Ka辐射,基本的单色仪,位置灵敏探测器、角度范围3°至42°2θ,大约60分钟的总的测量时间)。在没有进一步加工(例如研磨或筛选)物质的情况下,制备和分析大约25mg的样品。可选地,在装备有密封的铜Kal辐射源的Scintag XI粉末X-射线衍射仪上测量X-射线衍射图形。以2和4mm的入射电子束狭缝宽度以及0.3和0.2mm的衍射电子束狭缝宽度,以1°每分钟的速度,从2°至36°2θ扫描样品。
优先地,根据本发明的化合物1的无定形形式基本上是纯的,意指,无定形形式包含少于大约15%、优选地少于大约10%、优选地少于大约5%、优选地少于大约1%、甚至更优选地少于0.1%按重量计的杂质,所述杂质包含其他多晶型物形式的化合物1。在一些实施方式中,按重量计至少大约30-99%的总的化合物1作为无定形形式存在于组合物中。在进一步的实施方式中,按重量计至少大约70%、至少大约80%、至少大约90%、至少大约99%或至少大约99.9%的总的化合物1作为无定形形式存在于组合物中。由本发明提供的组合物也是基本上由化合物1组成的组合物,其中按重量计至少大约97-99%的化合物1作为如此处描述的无定形形式、多晶型物形式、溶剂化物形式或其组合存在于组合物中。
根据本发明的化合物1的多晶型物形式、溶剂化物形式或无定形形式也可存在于混合物中。在一些实施方式中,无定形形式XVII可与一种或多种其他无定形形式存在于混合物中,其中所述一种或多种其他无定形形式选自XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV或XXVI。溶剂化物形式III可与一种或多种选自下述的溶剂化物形式存在于混合物中:IV、V、VI、VII、IX、X、XI、XII、XIII、XIV或XV。多晶型物形式VIII可与多晶型物形式XVI存在于混合物中。
用于制备化合物1的喷雾干燥分散无定形形式的适当的溶剂包括但不限于,丙酮、水、醇类、其混合物,等等。醇类包括但不限于,乙醇、甲醇、异丙醇和其混合物。
此处公开的化合物1的固体形式可用于广泛的多种给药的制备,具体地用于口服剂量形式。示例性的剂量形式包括可干燥口服或通过添加水以便形成糊状物、浆体、悬浮液或溶液重组口服的粉末或颗粒;药片、胶囊、或药丸。多种添加剂可与此处描述的固体分散体混合、研磨或颗粒化,以便形成适于上述的剂量形式的材料。通常,可将潜在地有益的添加剂分成下列类别:其他基质材料或稀释剂、表面活性剂、药物络合剂或增溶剂、填充剂、崩解剂、粘结剂和润滑剂。关于此处公开的溶剂化物和多晶型物,还可添加pH调节剂(例如,酸、碱、或缓冲剂)。其他基质材料、填充剂、或稀释剂的实例包括乳糖、甘露糖醇、木糖醇、微晶纤维素、焦磷酸钙、和淀粉。表面活性剂的实例包含十二烷基硫酸钠和多乙氧基醚。药物络合剂或增溶剂的实例包含聚乙二醇、咖啡因、呫吨、2,5-二羟基苯甲酸和环糊精。崩解剂的实例包含羟甲基淀粉钠(sodium starch glycolate)、藻酸钠、羟甲基纤维素钠、甲基纤维素、和交联羧甲基纤维素钠。粘结剂的实例包含甲基纤维素、微晶纤维素、淀粉、和树胶如瓜尔胶、和黄蓍胶。润滑剂的实例包含硬脂酸镁和硬脂酸钙。pH调节剂的实例包含酸如柠檬酸、乙酸、抗坏血酸、乳酸、天冬氨酸、琥珀酸、磷酸,等等;碱如乙酸钠、乙酸钾、氧化钙、氧化镁、磷酸三钠、氢氧化钠、氢氧化钙、氢氧化铝,等等,和缓冲剂通常包括酸和所述酸的盐的混合物。这样的pH调节剂的内含物的至少一个功能是控制药物、基体聚合物、或两者的溶解速率,因此控制溶解期间的局部的药物浓度。
除了上述的添加剂或赋形剂之外,利用本领域的技术人员已知的此处公开的组合物配制和制备口服剂量形式的任何常见的材料和方法的应用是潜在有用的。例如,技术人员可以以适当的方式和根据接受的实践,如在Remington′s Pharmaceutical Sciences(Gennaro,Ed.,Mack Publishing Co.,Pa.1990)中描述的那些来配制组合物。
因此,进一步的实施方式包含含有如通过此处描述的方法获得的固体分散体的药物配制剂。
在某些实施方式中,本发明提供用于制备化合物(1)的基本无定形形式的方法,无定形形式选自形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV或XXVI或其组合。方法包括在足够获得无定形形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV或XXVI或其组合的条件下,制备化合物(1)的喷雾干燥分散溶液且干燥化合物(1)的分散溶液。在一个实施方式中,在真空下干燥喷雾干燥分散溶液。在一个实施方式中,通过在足够获得喷雾干燥分散溶液的条件下将化合物(1)的溶液分散到聚合物溶液中来制备喷雾干燥分散溶液。可使用任何适于溶解化合物(1)的溶剂或溶剂的混合物。用于溶解化合物(1)的示例性的溶剂包括但不限于,四氢呋喃(THF)、丙酮、乙腈、苯、乙醇、甲苯、醚、乙酸乙酯、二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)或其任何两种或更多种的混合物。在某些情况中,以足够帮助化合物(1)的溶解的比率,将酸如盐酸、硫酸或硝酸加入到有机溶剂系统中。可通过以适当的比率将聚合物溶解在有机溶剂中或溶剂的混合物中制备聚合物溶液。在某些情况中,在范围是从20-100℃、30-50℃或40-100℃的温度下,将聚合物溶解在溶剂或溶剂的混合物中。此处描述的任何聚合物可用于制备聚合物溶液。用于制备聚合物溶液的示例性的溶剂包括但不限于THF、丙酮、乙腈、苯、乙醇、甲苯、醚、乙酸乙酯、DMF、DMSO、H2O或其混合物。
在某些实施方式中,本发明提供用于治疗需要其的哺乳动物的疾病或病症的方法,所述方法包括给予所述哺乳动物有效量的包括化合物1的至少一种固体形式的组合物,其中所述固体形式选自:
a)化合物1的基本无定形形式,选自形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV、XXVI或其组合,其中分子地分散化合物1。
b)形式III、IV、V、VI、VII、IX、X、XI、XII、XIII、XIV、或XV的溶剂化物;
c)形式VIII或XVI的多晶型物;和
d)化合物1的硫酸盐、氢溴酸盐、或盐酸盐。
在某些实施方式中,使用上述描述的方法的疾病或病症是黑素瘤、甲状腺癌或结肠癌。
在某些实施方式中,本发明提供用于治疗需要其的哺乳动物的疾病或病症的方法,所述方法包括给予所述哺乳动物有效量的组合物,该组合物包括如此处描述的化合物1的至少一种固体形式。
在某些实施方式中,使用上述描述的方法的疾病或病症是黑素瘤、甲状腺癌或结肠癌。
实施例
实施例1(参考实施例)
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}(化合物1)的无定形形式的制备
通常可通过熔化物的瞬时冷却和喷雾干燥获得无定形物质。还可使用其他工艺如例如冷冻干燥。
a)通过喷雾干燥制备无定形材料
在环境温度下,将5.0g的化合物1溶解在150g的四氢呋喃(THF)中。通过5μm过滤器过滤溶液。利用Buechi喷雾干燥器(型号B290),应用下列参数喷雾干燥上清液:
入口气流[m3/h] 40
进气口温度[℃] 100
溶剂流量[%] 20
喷雾干燥流量[%] 100
冷凝器[℃] -10
产量:2.8g(56%)无定形化合物1。
b)通过熔化物的瞬时冷却制备无定形材料
在加热板上的不锈钢盘中,将2g的丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺加热至300℃。另外,利用热风枪加热材料。在获得完全的熔化之后,将盘浸入液体氮中。在10min之后,去除盘且将盘放入干燥器中48h。为了较好的处理,利用研钵粉碎玻璃态材料。
c)无定形形式的表征
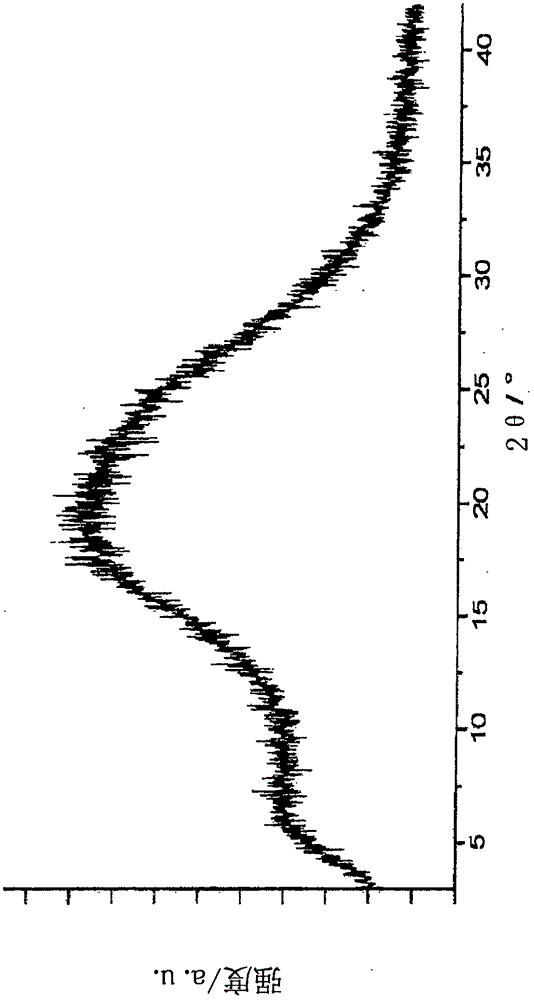
无定形形式可通过在它的XRPD图形中缺少尖锐的X-射线衍射峰、以及在大约100℃至110℃的范围中的如通过DSC测量获得的玻璃化转变温度来表征。精确的玻璃化转变温度主要地取决于水/溶剂含量。图1示出如可通过该实施例中公开的方法获得的化合物1的无定形形式的XRPD图形。
实施例2(参考实施例)
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式I的制备
通常,可通过在大于70℃干燥半丙酮溶剂化物(形式IX)获得多晶型物形式I。
实施例3
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式III的制备
a)通过乙腈中的平衡化制备形式III
在环境温度下,在500μL的乙腈中将221.3mg的无定形材料水解(digest)2天。然后,通过过滤分离材料,且在22℃/5mbar下干燥48h。
b)形式III的表征
形式III的特征可通过利用Cu Ka辐射获得的XRPD图形来表征,所述XRPD图形在大约9.5、10.0、13.0、16.7、18.7、20.1、21.0、25.6上具有以度2θ表达的特征峰。在图2中示出丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的典型的许多形式III的XRPD(X-射线粉末衍射)图形。
实施例4
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式IV的制备
形式IV是THF 0.75-溶剂化物,且通常可通过包括化合物1和作为溶剂的THF的工艺获得。
a)从THF通过蒸发结晶化制备形式IV
在65℃,将254.3mg的化合物1(形式II)溶解在6mL的THF中。在12h之后,将上清液冷却至5℃。通过过滤分离晶体,且在环境条件下干燥晶体。
b)形式IV的表征
形式IV可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约5.5、7.4、11.0、13.4、14.8、16.0、16.7、17.1、17.9、19.1、19.5、20.1、20.5、20.9、21.2、22.2、23.0、23.6、24.2、24.5、25.1上具有以度2θ表达的特征峰。图3显示化合物1的典型的许多形式IV的XRPD图形。
实施例5
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式V的制备
形式IV是二烷单-溶剂化物,且可通过包括化合物1和作为溶剂的二烷的工艺获得。
a)通过在二烷中平衡化制备形式V
在500μL的二烷中悬浮110.3mg的化合物1的无定形材料。在环境温度下,将湿料水解2天。然后,通过过滤分离材料,且在22℃/5mbar下干燥48h。
b)形式V的表征
形式V可通过利用Cu Ka辐射获得的其XRPD图形来表征,所述XRPD图形在大约12.7、13.1、14.3、16.3、19.0、20.1、22.4、25.1、27.1、28.9上具有以度2θ表达的特征峰。图4显示化合物1的典型的许多形式V的XRPD图形。
实施例6
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式VI的制备
形式IV是DMF单-溶剂化物,且可通过包括化合物1和作为溶剂的DMF的工艺获得。
a)通过在DMF中平衡化制备形式VI
在环境温度下,在500μL的DMF中将120.3mg的无定形材料悬浮(slurry)2天。通过过滤分离出褐色的材料,且在30℃/5mbar下干燥48h。
b)形式VI的表征
形式VI可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约7.8、10.3、11.4、11.8、15.1、15.6、16.1、16.6、18.6、18.9、19.2、20.4、21.0、21.6、22.8、24.6、25.1、25.8、26.1、27.4、28.8上具有以度2θ表达的特征峰。图5显示化合物1的典型的许多形式VI的XRPD图形。
实施例7
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式VII的制备
形式VII是THF半-溶剂化物,且可通过包括化合物1和作为溶剂的THF的工艺获得。
a)通过在THF中平衡化制备形式VII
在环境温度下,在500μL的THF中将196.3mg的无定形材料水解3天。然后,通过过滤分离出褐色的材料,且在22℃/5mbar下干燥24h。
b)形式VII的表征
形式VII可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约7.6、9.4、9.9、13.1、15.9、16.2、17.0、18.1、18.8、19.9、20.5、20.7、21.4、21.8、24.3、24.9、25.3上具有以度2θ表达的特征峰。图6显示化合物1的典型的许多形式VII的XRPD图形。
实施例8
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式VIII的制备
a)通过无定形材料的保温(incubation)进行形式VIII的制备
利用滚珠管式炉,在130℃下将210mg的化合物1的无定形材料回火24h。然后,将褐色的材料冷却至环境温度。
b)形式VIII的表征
形式VIII可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约5.0、11.3、11.6、12.0、13.8、16.2、16.7、19.0、20.1、20.8、22.5、27.1上具有以度2θ表达的特征峰。图7显示化合物1的典型的许多形式VIII的XRPD图形。
实施例9
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式IX的制备
形式IX是丙酮半-溶剂化物,且可通过包括化合物1和作为溶剂的丙酮的工艺获得。
a)通过在丙酮中平衡化制备形式IX
在环境温度下,在500μL的丙酮中将180.5mg的化合物1的无定形材料水解3天。然后,通过过滤分离出褐色的材料,且在环境温度下干燥24h。
b)形式IX的表征
形式IX可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约9.5、9.9、13.0、15.9、16.4、17.0、17.9、18.7、19.9、20.7、21.7、24.8、25.1上具有以度2θ表达的特征峰。图8显示化合物1的典型的许多形式IX的XRPD图形。
实施例10
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式X的制备
形式X是吡啶单-溶剂化物,且通常可通过包括化合物1和作为溶剂的吡啶的工艺获得。
a)通过在吡啶中平衡化制备形式X
在环境温度下,在200μL吡啶中将150.0mg的化合物(形式II)水解10天。然后,通过过滤分离出褐色的材料,且在22℃/5mbar下干燥48h。
b)形式X的表征
形式X可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约7.4、9.2、10.8、13.6、14.9、19.0、20.2、21.4、22.4、23.7、25.5、27.0、29上具有以度2θ表达的特征峰。图9显示化合物1的典型的许多形式X的XRPD图形。
实施例11
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式XI的制备
形式XI是2-甲基吡啶单-溶剂化物,且通常可通过包括化合物1和作为溶剂的2-甲基吡啶的工艺获得。
a)从2-甲基吡啶通过蒸发结晶化进行形式XI的制备
将150.0mg的化合物1(例如,它的无定形形式或形式II)溶解在4mL的2-甲基吡啶中。允许在环境温度下被动地蒸发溶液。在10d之后,进一步在22℃/5mbar将材料干燥48h。
b)形式XI的表征
形式XI可通过利用Cu Ka辐射获得的它的XRPD图形来表征,所述XRPD图形在大约8.0、12.1、12.6、13.4、13.9、14.8、16.2、17.6、18.5、19.2、20.1、21.0、21.4、21.7、23.5、25.3、25.5、26.6、27.0、30.8上具有以度2θ表达的特征峰。图10显示化合物1的典型的许多形式XI的XRPD图形。
实施例12
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式XII的制备
形式XII是二异丙胺单-溶剂化物,且通常可通过包括化合物1和作为溶剂的二异丙胺的工艺获得。
a)从2-甲基吡啶通过蒸发结晶化进行形式XII的制备
在60℃下,在500μL二异丙胺中将243.0mg的化合物(形式II)悬浮9天。然后,通过过滤分离出褐色的材料,且在22℃/5mbar下干燥48h。
b)形式XII的表征
形式XII可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述XRPD图形在大约7.5、9.9、12.1、13.6、16.2、16.7、17.1、17.5、18.3、18.5、20.1、21.7、22.4、23.4、24.3、25.6、26.9、31.6上具有以度2θ表达的特征峰。图11显示化合物1的典型的许多形式XII的XRPD图形。
实施例13
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式XIII的制备
形式XIII是吗啉单-溶剂化物,且通常可通过包括化合物1和作为溶剂的吗啉的工艺获得。
a)利用吗啉蒸汽通过保温进行形式XIII的制备
在环境温度下,利用吗啉蒸汽将250.3mg的无定形材料保温44d。
b)形式XIII的表征
形式XIII可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约5.1、5.8、6.9、15.3、16.2、17.4、18.4、18.9、19.5、20.4、21.1、21.5、22.2、22.6、25.2、25.7上具有以度2θ表达的特征峰。图12显示化合物1的典型的许多形式XIII的XRPD图形。
实施例14
丙烷-1-磺酸{3-[5-(4-氯-苯基、)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式XIV的制备
形式XIV是DMSO单-溶剂化物,且通常可通过包括化合物1和作为溶剂的DMSO的工艺获得。
a)从DMSO通过蒸发结晶化进行形式XIV的制备
在环境温度下,将1.2g化合物1(形式II)溶解在5mL的DMSO中。在40℃/20mbar下,在真空盘式干燥器中将上清液浓缩2天。通过过滤分离晶体,且在环境条件下将晶体干燥4天。
b)形式XIV的表征
形式XIV可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约5.2、10.2、12.9、13.9、17.1、17.6、18.7、19.8、20.1、20.5、21.0、21.7、22.8、24.1、25.1、25.5、27.1、27.4上具有以度2θ表达的特征峰。图13显示化合物1的典型的许多形式XIV的XRPD图形。
实施例15
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺的形式XV的制备
形式XV是DMSO单-溶剂化物,且通常可通过包括化合物1在作为溶剂的DMSO中的工艺获得。
a)利用DMSO蒸汽,通过保温进行形式XV的制备
将500μL的DMSO中的100mg化合物1的溶液的滴剂放置在载玻片上。在溶剂蒸发之后,观察到小的晶形。在9个滴剂的3个中,观察到形式XV。其他结晶试验产生形式XIV。
b)形式XV的表征
形式XV可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约12.6、13.8、14.6、16.2、16.6、17.8、18.3、20.4、20.7、21.4、22.4、23.2、24.2、24.5、25.5、26.9、27.8、28.7上具有以度2θ表达的特征峰。图14显示化合物1的形式XV的XRPD图形。
实施例16
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}的形式XVI的制备
可通过在载玻片上加热无定形熔化薄膜获得多晶型物形式XVI。形式XVI可能不是纯的结晶,而是具有形式VIII。
a)形式XVI的制备
在显微载玻片和盖薄片之间将少量的化合物1(形式II)加热至大约280℃。然后,通过将盖玻片直接地转移至冷的金属块上,将熔化物冷却至低温(例如,冷却至-18或-196℃)。应该尽可能快地转移。然后,将获得的无定形熔化薄膜放置在显微镜的加热台上,且在正交偏振的光下观察。在利用1和10℃/min的加热速度的加热后,可在从140-150℃的范围内观察到结晶化。在该过程期间,形式VIII和形式XVI一起结晶。
b)形式XVI的表征
形式XVI可通过如图15中显示的拉曼光谱来表征。
实施例17
“图形6”的制备
在1mm直径的玻璃毛细管中制备少量的无定形材料,且在连接至STOEStadi P衍射计的发热台中将所述材料加热至150℃。随后,在150℃分析样品。
b)图形6的表征
图形6可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约7.0、8.4、8.9、13.0、13.8、17.7、18.8、20.7、25.8、29.7上具有以度2θ表达的特征峰。图16显示化合物1的图形6的XRPD图形。
实施例18
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}硫酸盐的制备
可通过包括化合物1和硫酸的工艺获得硫酸盐。
a)在四氢呋喃中进行硫酸盐的制备
在168.7g的四氢呋喃中悬浮6.15g的化合物1。将悬浮液加热至55℃。获得上清液。在30℃下,添加1.4g硫酸的5g2-异丙醇溶液。在40℃和20mbar下,通过蒸馏去除80mL的溶剂。随后,添加22.3g的叔丁基甲基醚。在20℃将溶液搅拌12小时,且开始结晶。通过过滤分离固体,且通过17.8g的四氢呋喃漂洗所述固体。
在40℃/2mbar下将产物干燥12h。产量:4.2g(57.5%)。
b)硫酸盐的表征
硫酸盐可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约4.7、6.7、10.6、13.3、14.5、15.7、16.4、18.3、18.6、18.9、19.5、20.1、20.9、21.2、23.2、23.7、24.0、26.9、30.0上具有以度2θ表达的特征峰。图17显示化合物1的典型的许多硫酸盐的XRPD图形。化合物1的硫酸盐的可进一步表征为具有大约221℃至228℃的起始温度(DSC)的熔点。
实施例19
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}氢溴酸盐(溴化物盐)的制备
可通过包括化合物1和溴化氢的工艺获得氢溴酸盐。
a)在四氢呋喃中进行氢溴酸盐的制备
在168.7g的四氢呋喃中悬浮6.15g的化合物1。将悬浮液加热至55℃。获得上清液。在30℃,添加3.4g氢溴酸溶液(33%HBr的乙酸溶液)的溶液,且沉淀出白色固体。在20℃,将悬浮液搅拌2小时。通过过滤分离固体,且通过17.8g的四氢呋喃漂洗所述固体。
在40℃/2mbar下将产物干燥12h。产量:4.6g(61.7%)。
b)溴化物盐的表征
溴化物盐可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约5.7、6.8、11.4、13.6、18.1、19.8、20.2、21.4、21.8、24.6、26.1、27.3、29.2上具有以度2θ表达的特征峰。图18显示化合物1的典型的许多溴化物盐的XRPD图形。这种盐可进一步表征为具有范围在大约240℃至246℃的起始温度(DSC)的熔点。在分解下发生熔化,且可充分地改变所述熔化。
实施例20
丙烷-1-磺酸{3-[5-(4-氯-苯基)-1H-吡咯[2,3-b]吡啶-3-羰基-2,4-二氟-苯基]-酰胺}盐酸盐的制备
可通过包括化合物1和盐酸的工艺获得盐酸盐。
a)在四氢呋喃中进行盐酸盐的制备
在176g的四氢呋喃中悬浮10.0g的化合物1。在20℃下搅拌悬浮液。在30分钟内添加4.8g盐酸溶液(二烷中4M)。沉淀出白色固体。在40℃下,将悬浮液搅拌另外的3小时,且随后冷却至20℃。通过过滤分离固体,且通过17.8g的四氢呋喃漂洗所述固体。
在40℃/2mbar下将产物干燥12h。产量:8.9g(83.7%)。
b)氯化物盐的表征
氯化物盐可通过利用Cu Ka辐射获得的X-射线粉末衍射图形来表征,所述图形在大约6.6、7.8、11.2、12.6、14.1、14.7、16.3、17.8、19.3、19.6、20.7、21.5、22.7、24.1、25.4、25.8上具有以度2θ表达的特征峰。图19显示化合物1的典型的许多盐酸盐的XRPD图形。
实施例21
喷雾干燥分散溶液配制
将化合物(1)分散在丙酮或THF/丙酮的混合物中,将1mol过量的等同的2M盐酸分散到容器中,且搅拌直到被溶解。将异丙醇分散到容器中,且允许搅拌。过量的盐酸足够维持溶液稳定性,以便用于喷雾干燥。
通过将聚合物溶解到乙醇中、将适当量的丙酮加入到溶解的聚合物溶液中、将化合物(1)分散到聚合物溶液中,和将溶液加热至大约45℃,直到完全溶解所有的成分,分别制备醋酸羟丙基甲基纤维素琥珀酸酯(HPMCAS)、甲基丙烯酸和丙烯酸乙酯(L100-55)的共聚物或乙烯吡咯烷酮-醋酸乙烯酯(PVPVA)的共聚物的聚合物溶液。在喷雾干燥之前,将溶液冷却回到室温。
实施例22
喷雾干燥分散溶液配制和制造
利用100-105℃的目标进气温度、55℃的出口温度、和0.5bar的雾化气压喷雾干燥每一个配方。利用0.5mm双流体Schlick喷嘴雾化进料,以便全部移动。在旋风下进行产品的收集。装备有#14Tygon化学泵管的变速蠕动泵Master Flex用于运送进料。
在Hg中,-25至-30之间的减少的压力下,在37℃,将喷雾干燥的分散体真空炉过夜干燥65小时(阶段1)。进一步在Hg中,-25至-30之间的减少的压力下,在45℃,将这些样品真空炉干燥另外的65小时(阶段2)。在Hg中,-25至-30之间的减少的压力下,在45℃,将喷雾干燥的分散体真空炉干燥65小时。残留溶剂低于5000PPM。
根据实施例21中阐明的方法制备无定形形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV或XXVI的喷雾干燥分散溶液。根据实施例22中阐明的方法制备无定形形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV或XXVI的喷雾干燥分散配方。
表1说明无定形形式XVII、XVIII、XIX、XX、XXI、XXII、XXIII、XXIV、XXV和XXVI的制剂的喷雾干燥分散体。
表1
实施例23
化合物的表征
a)固体形式XVII的表征
固体形式XVII可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由宽的晕峰和较小的以度2θ表示的尖锐的峰组成。在下面的表格中显示较小的尖锐峰的位置。图20显示典型的许多基本无定形固体状态形式XVII的XRPD图形。
b)固体形式XVIII的表征
固体形式XVIII可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形具有如图21显示的以度2θ表达的两个宽的晕峰。
c)固体形式XIX的表征
固体形式XIX可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由宽的晕峰和较小的以度2θ表达的尖锐的峰组成。图22显示典型的许多基本无定形固体状态形式XIX的XRPD图形。
d)固体形式XX的表征
固体形式XX可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由宽的晕峰和较小的以度2θ表达的尖锐的峰组成。图23显示典型的许多基本无定形固体状态形式XX的XRPD图形。
e)固体形式XXI的表征
固体形式XXI可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由宽的晕峰和较小的以度2θ表达的尖锐的峰组成。图24显示典型的许多基本无定形固体状态形式XXI的XRPD图形。
f)固体形式XXII的表征
固体形式XXII可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由以度2θ表达的宽的晕峰组成。图25显示典型的许多基本无定形固体状态形式XXII的XRPD图形。
g)固体形式XXIII的表征
固体形式XXIII可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由以度2θ表达的宽的晕峰组成。图26显示典型的许多基本无定形固体状态形式XXIII的XRPD图形。
h)固体形式XXIV的表征
固体形式XXIV可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由宽的晕峰和较小的以度2θ表达的尖锐的峰组成。图27显示典型的许多基本无定形固体状态形式XXIV的XRPD图形。
i)固体形式XXV的表征
固体形式XXV可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由以度2θ表达的宽的晕峰组成。图28显示典型的许多基本无定形固体状态形式XXV的XRPD图形。
j)固体形式XXVI的表征
固体形式XXVI可通过利用Cu Ka辐射获得的X-射线粉末衍射分析来表征。X-射线粉末衍射图形由以度2θ表达的宽的晕峰组成。图29显示典型的许多基本无定形固体状态形式XXVI的XRPD图形。
- 还没有人留言评论。精彩留言会获得点赞!