用于稠合氨基二氢噻嗪衍生物的合成的方法和化合物与流程
相关申请
本申请要求在35U.S.C.§119(e)下的2011年1月21日提交的美国临时专利申请第61/434,849号的权益。
技术领域
本发明涉及用于制备用作β-位点淀粉状前体蛋白(APP)-裂解酶抑制剂的化合物的化合物和方法。
背景技术:
阿尔兹海默氏病是特征为神经元变性和丧失以及形成老年斑和神经纤维变性的疾病。目前,阿尔兹海默氏病仅用使用以乙酰胆碱酯酶抑制剂为代表的症状改善剂的症状疗法来治疗,和用于抑制疾病的进展的基本治疗还未开发。需要开发用于控制病理学发作的原因的方法以创建对阿尔兹海默氏病的基础治疗。
据认为Aβ-蛋白,作为淀粉状前体蛋白(APP)的分解产物,涉及神经元的变性和丧失和痴呆症状的发作(参见,例如,Klein等人,Alzheimer's disease-affected brain:Presence of oligomeric Aβ ligands(ADDLs)suggests a molecular basis for reversible memory loss,PNAS USA 2003,Sep 2;100(18),p.10417-10422;Nitsch等人,Antibodies against β-amyloid slow cognitive decline in Alzheimer's disease,Neuron,2003,May22;38,p.547-554)。
Aβ-蛋白具有作为主要组分的由40个氨基酸组成的Aβ40和在C端添加了两个氨基酸的Aβ42。已知Aβ40和Aβ42具有高聚集性并且是老年斑的主要组分(参见,例如,Jarrett等人,The carboxy terminus of the β amyloid protein is critical for the seeding of amyloid formation:Implications for the pathogenesis of Alzheimers'disease,Bi℃hemistry,1993,32(18),p.4693-4697;Glenner等人,Alzheimer's disease:initial report of the purification and characterization of a novel cerebrovascular amyloid protein,Biochemical and biophysical research communications,1984,May 16,120(3),p.885-890;Masters等人,Amyloid plaque core protein inAlzheimer disease and Down syndrome,PNAS USA,1985,Jun,82(12),p.4245-4249)。此外,已知Aβ40和Aβ42通过APP和早老素(presenilin)基因中的突变增加,其在家族性阿尔兹海默氏病中观察到(参见,例如,Gouras等人,IntraneuronalAβ42accumulation in human brain,American Journal of Pathology,2000,Jan,156(1),p.15-20;Scheuner等人,Secreted amyloidβ-protein similar to that in the senile plaques of Alzheimer's disease is increased in vivo by the presenilin 1and 2and APP mutations linked to familial Alzheimer's disease,Nature Medicine,1996,Aug,2(8),p.864-870;Forman等人,Differential effects of the swedish mutant amyloid precursor protein onβ-amyloid accumulation and secretion in neurons and nonneuronal cells,The Journal of Biological Chemistry,1997,Dec 19,272(51),p.32247-32253)。因此,期望减少Aβ40和Aβ42的产生的化合物是阿尔兹海默氏病的进展抑制剂或预防剂。
Aβ通过β-分泌酶(BACE1)和随后通过γ-分泌酶裂解APP来产生。因为这一原因,已经尝试产生γ-分泌酶和β-分泌酶抑制剂以抑制Aβ产生。
技术实现要素:
本发明涉及用于制备β-位点淀粉状前体蛋白(APP)-裂解酶(也称为β-分泌酶或BACE1)的抑制剂的化合物和方法。BACE1抑制剂化合物和制备其的方法已经例如在WO2009/091016中描述,其内容通过参考以其全部并入本文。
本文提供式I化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6烷基)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式I遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
还提供了如上面所定义的式I化合物的制备方法。在一些实施方案中,所述方法包括加热包含以下的混合物的步骤:
(i)式A的肟:
其中R1、R2和R3如上面为式I所示出;
(ii)氢醌;和
(iii)烃溶剂(例如,苯、甲苯、二甲苯等),
所述加热达到90℃、95℃、100℃、105℃或110℃至115℃、120℃、125℃、130℃、135℃、140℃、145℃、150℃、155℃或160℃的温度(例如,90℃至160℃,或110℃至140℃,或100℃至120℃,或120℃至140℃),
以制备所述式I的化合物或其盐。
在一些实施方案中,所述方法包括加热包含以下的混合物的步骤:
(i)式B化合物:
其中R1、R2和R3如上面所示出;
(ii)乙酸盐;
(iii)羟基胺或其盐;和
(iv)烃溶剂(例如,苯、甲苯、二甲苯等),
所述加热达到90℃、95℃、100℃、105℃或110℃至115℃、120℃、125℃、130℃、135℃、140℃、145℃、150℃、155℃或160℃的温度(例如,90℃至160℃,或110℃至140℃,或100℃至120℃,或120℃至140℃),
以制备所述式I的化合物或其盐。
还提供了式II化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟);
在一些实施方案中,式II遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
还提供了制备式II化合物或其盐的方法:
其中:
R1是C1-4烷基;和
R2和R3各自独立地是氢或卤素,
所述方法包括以下步骤:
(a)加热包含以下的混合物:
(i)式B的酮:
其中R1、R2和R3如上面为式II所示出;
(ii)羟基胺或其盐;
(iii)碱(例如,乙酸盐、丙酸盐、叔胺碱例如三乙胺或二乙基异丙基胺、吡啶或其盐);和
(iv)选自以下的溶剂:水和醇(例如,C3-8醇),
所述加热达到至少90或100摄氏度(例如,如通过回流达到沸腾)产生加热的混合物,
(b)将加热的混合物冷却至60、50或45摄氏度或低于60、50或45摄氏度,并且然后
(c)向所述混合物加入有机溶剂(例如,四氢呋喃或醚溶剂如二乙基醚或甲基叔丁基醚),酸(例如,羧酸如乙酸或无机酸例如盐酸或硫酸),和锌(例如,锌粉末或锌粉),其中在所述加入过程中将所述混合物维持在60、50或45摄氏度或低于60、50或45摄氏度(例如,25、30或35至45、50或60摄氏度),
以制备所述式II化合物。
在一些实施方案中,将加热进行至少30小时。
还提供制备式IIa的立体化学纯的化合物或其盐的方法:
其中R1、R2和R3如上面为式II所示出,
所述方法包括以下步骤:
(a)向溶剂(例如,醇如乙醇或异丙醇,或混合物如甲苯-乙腈混合物、甲苯-丙酮混合物、甲苯-四氢呋喃混合物或醇-水混合物)加入式II化合物的立体异构体混合物:
其中R1、R2和R3如上面所示出,
该溶剂包括手性羧酸化合物(例如,D-二苯甲酰基酒石酸、L-二苯甲酰基酒石酸、D-二甲苯甲酰基(ditoluyl)酒石酸和L-二甲苯甲酰基酒石酸等)以形成式II化合物的非对映体盐的混合物;并且然后(b)使由式II化合物形成的单个非对映体盐结晶以制备式IIa的立体化学纯的化合物或其盐。
在一些实施方案中,立体化学纯的化合物具有大于约80wt%的化合物的一种立体异构体和少于约20wt%的化合物的其它立体异构体,更优选大于约90wt%的化合物的一种立体异构体和小于约10wt%的化合物的其它立体异构体,甚至更优选大于约95wt%的化合物的一种立体异构体和少于约5wt%的化合物的其它立体异构体,和最优选大于约97wt%的化合物的一种立体异构体和小于约3wt%的化合物的其它立体异构体,大于约90wt%的化合物的一种立体异构体和小于约10wt%的化合物的其它立体异构体。
在一些实施方案中,结晶步骤通过将式II化合物的非对映异构体盐的混合物冷却(例如,达到40、45、50、55或60℃至80、90、100或110℃的温度,达到-10、-5、0、5或10℃至15、20、29或35℃的温度)来执行。
进一步提供式III化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式III遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
还提供式IV化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式IV遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
进一步提供式V化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式V遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
还提供用于制备式V化合物或其盐的方法:
其中:
R1是C3-4烷基、卤-C1-4烷基、羟基-C1-4烷基或–C1-4烷基-OR',
其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素;
所述方法包括以下步骤:
(a)提供以下的混合物
(i)式III化合物,
其中R1、R2和R3如上面为式V所示出;
(ii)胺碱(例如,吡啶,或取代吡啶如三甲基吡啶);和
(iii)有机溶剂(例如,芳族烃溶剂,甲苯、二甲苯、苯、二氯甲烷等),
其中所述混合物在0摄氏度或低于0摄氏度的温度下,
(b)使所述混合物与三氟甲基磺酸酐、4-甲苯磺酰氯、甲基磺酰氯或甲基磺酰酐反应,并且然后,
(c)加入:
(i)醇(例如,丙醇,如2-丙醇);和
(ii)碱,如选自以下的强碱:氢氧化物、醇盐和氨,
以制备所述式V化合物。
在一些实施方案中,在-15、-10或-5至0摄氏度的温度下进行反应步骤。
还提供式VI化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式VI遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
进一步提供了式VII化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,R1是甲基、三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
还提供了制备式VII化合物或其盐的方法,其包括以下步骤:
还原式VI化合物以形成式VII化合物,如下面所示:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
在一些实施方案中,还原式VI化合物以形成式VII化合物可包括以下步骤中的一个或更多个:(a)将粉末状铁加到甲醇溶剂以形成其混合物;(b)将盐酸(HCl)(例如,浓HCl)加到步骤(a)的混合物;(c)将步骤(b)的混合物加热至31℃、40℃或50℃至65℃、70℃、75℃、80℃、85℃的温度,或至步骤(b)的混合物的沸点(例如,持续0–4小时)以形成加热的混合物;和(d)将式VI化合物或其盐加到步骤(c)的加热的混合物中。
在一些实施方案中,该方法还包括以下步骤:(e)将步骤(d)的混合物冷却至10至30℃的温度以形成冷却的混合物;和(f)任选地,搅拌所述冷却的混合物(例如,持续0-4小时)。
在一些实施方案中,以选自以下的量提供HCl:关于式VI化合物的量,化学计量的HCl量;和关于式VI化合物的量,摩尔过量的HCl量。
进一步提供制备式IX化合物或其盐的方法:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素;和
R4选自:烷基、卤烷基、烷氧基和用烷氧基取代的烷基;
其包括以下步骤:
使式VII化合物与式VIII的吡嗪羧酸反应:
其中R1、R2、R3和R4如上面所示出,以形成所述式IX化合物或其盐。
在一些实施方案中,反应可包括以下步骤中的一个或更多个:(a)将亚硫酰氯加到包含在溶剂中的式VIII化合物的溶液以制备形成的混合物;和(b)将式VII化合物加到步骤(a)的形成的混合物,以形成所述式IX化合物或其盐。
在一些实施方案中,在加入步骤(a)之前或过程中将包含在溶剂中的式VIII化合物的溶液冷却(例如,到0至25℃的温度)。
在一些实施方案中,溶剂可包括:N,N'-二甲基咪唑啉-2-酮、甲苯、二氯甲烷、二甲基甲酰胺、N-甲基吡咯烷或二甲基乙酰胺。
在一些实施方案中,反应可包括以下步骤中的一种或更多种:(a)将乙酸乙酯(EtOAc)加到式VIII化合物和式VII化合物以制备形成的混合物;和(b)将烷基膦酸酐(例如,2-丙基膦酸酐)加到步骤(a)的形成的混合物以形成所述式IX化合物或其盐。
在一些实施方案中,可以在所述加入步骤(a)过程中将形成的混合物维持在0℃至35℃的温度。
附图说明
图1A-1B表示根据实施例4,部分C的式II的四氢呋喃的非对映体拆分后来自手性HPLC的典型色谱。
图2表示((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-((三苄基氧基)甲基)四氢呋喃-3-基)甲醇(2R,3R)-2,3-双(苯甲酰基氧基)琥珀酸酯的x-射线晶体结构:
具体实施方式
A.定义
本发明的化合物包括上面一般性描述的那些,并且通过实施方案、亚实施方案和本文公开的形式进一步说明。如本文所使用,除非另外说明否则下述定义将适用。
如本文所描述,本发明的化合物可任选地用一种或更多种取代基(如上面一般说明的或如通过本发明的特别的类、亚类和形式例示的)取代。一般而言,术语“取代的指用特定的取代基取代给定结构中的氢。除非另外说明,否则被取代的基团可以具有在概基团的每个可取代位置的取代基,并且当任何给定结构中多于一个位置可以用选自特定基团的多于一个的取代基取代时,在每一位置取代基可以是相同的或不同的。本发明预期的取代基的组合优选是致使形成稳定的或化学上可行的化合物的那些。
“异构体“指具有相同数目和种类的原子并因此具有相同分子量,但关于原子的排列或构型不同的化合物。
“立体异构体”指仅在空间中原子的排列不同的异构体。
“非对映异构体”指相互不是镜像的立体异构体。
“对映体”指相互不可重叠的镜像的立体异构体。
对映体包括“对映体纯”异构体,其包括基本上单一对映体,例如,大于或等于90%、92%、95%、98%或99%,或等于100%的单一对映体。
“对映体纯”如本文所用指包括基本上单一对映体,例如大于或等于90%、92%、95%、98%或99%,或等于100%的单一对映体的化合物或化合物的组合物。
“立体异构体纯”如本文所用指包括化合物的一种立体异构体并且基本上不含那种化合物的其它立体异构体的其化合物或其组合物。例如,具有一个手性中心的化合物的立体异构体纯的组合物基本上不含该化合物的相对的对映体。具有两个手性中心的化合物的立体异构体纯的组合物基本上不含该化合物的非对映体,并且基本上不含该化合物的对映体。典型的立体异构体纯的化合物包含大于约80wt%的该化合物的一种立体异构体和少于约20wt%的该化合物的其它立体异构体,更优选大于约90wt%的该化合物的一种立体异构体和少于约10wt%的该化合物的其它立体异构体,甚至更优选大于约95wt%的该化合物的一种立体异构体和少于5wt%的该化合物的其它立体异构体,和最优选大于约97wt%的该化合物的一种立体异构体和少于约3wt%的该化合物的其它立体异构体。参见,例如,美国专利第7,189,715号。
“R”和“S”作为描述异构体的术语是不对称取代的碳原子上立体化学构型的描述符号。将不对称取代的碳原子指定为"R"或"S"通过应用Cahn-Ingold-Prelog优选规则进行,这是本领域技术人员所熟知,并且描述在国际理论和应用化学联合会(International Union of Pure and Applied Chemistry)(IUPAC)关于有机化学命名规则,第E节,立体化学中。
对映体的“对映体过量”(ee)是[(主要对映体的摩尔分数)减(次要对映体的摩尔分数)]x 100。
"稳定的"如本文所用,指当经受考虑它们的生产、检测和优选它们的回收、纯化和用于本文公开的一种或更多种目的的条件时基本上不改变的化合物。在一些实施方案中,稳定的化合物或化学上可行的化合物是当保持在40℃或更低温度下,不存在湿气或其它化学反应性条件时持续至少一周基本上不改变的化合物。
"回流"如本文所用指其中来自沸腾液体的蒸气冷凝并返回到其所来自的混合物的技术,该技术典型地通过在连接冷凝器的容器中使液体沸腾。
"粉状铁"或"铁粉末"是具有小于0.1、0.5、1、5、10、20、50、250、500或1000μm的平均粒径的铁。可使用本领域已知方法测定粒径,例如筛分(mesh sizing)、激光衍射等。
"锌粉"是具有小于0.001、0.05、0.1、0.5、1、5、10、15或20μm的平均粒径的锌。"锌粉末"是具有小于200、175、150、125或100μm的平均粒径的锌。可使用本领域已知方法测定粒径,例如筛分、激光衍射等。
“有机”化合物如本文所用是含碳化合物。类似地,“有机溶剂”是用作溶剂的含碳化合物。“无机”化合物是不含碳的化合物。
"无机酸"如本文所用是无机化合物的酸。实例包括但不限于盐酸(HCl)、硝酸(HNO3)、磷酸(H3PO4)、硫酸(H2SO4)、硼酸(B(OH)3)、氢氟酸(HF)、氢溴酸(HBr)、高氯酸(HClO4)等。
"烃"是由碳和氢原子组成的有机化合物。用作“烃溶剂”的烃的实例包括但不限于“芳族烃溶剂”如苯、甲苯、二甲苯等,和“脂族烃溶剂”如戊烷、己烷、庚烷等。
“胺”或“胺碱”如本文所用指具有碱性氮原子的有机化合物(R-NR'R"),并且可以是伯(R-NH2)、仲(R-NHR')或叔(R-NR'R")胺。
“强碱”如本文所用是能够使非常弱的酸去质子化的化合物。强碱的实例包括但不限于氢氧化物、醇盐和氨。
“氢氧化物”是通常已知的二原子阴离子OH-或其盐(典型地其碱金属或碱土金属盐)。氢氧化物的实例包括但不限于:氢氧化钠(NaCl)、氢氧化钾(KOH)、氢氧化锂(LiOH)和氢氧化钙(CaOH)。
“醇盐”是RO-,醇的共轭碱。实例包括但不限于甲醇盐、乙醇盐和丙醇盐。
"芳(Ar)"或"芳基(aryl)"指具有一个或更多个闭合的环的芳族碳环部分。实例包括但不限于:苯基、萘基、蒽基、菲基、双苯基和芘基。
"杂芳基"指具有一个或更多个闭合环的环部分,在至少一个环中具有一个或更多个杂原子(例如,氧、氮或硫),其中至少一个环是芳族的,并且其中所述环独立地是稠合的,和/或桥连的。实例非限制性地包括:喹啉基、异喹啉基、吲哚基、呋喃基、噻吩基、吡唑基、喹喔啉基、吡咯基、吲唑基、噻吩并[2,3-c]吡唑基、苯并呋喃基、吡唑并[1,5-a]吡啶基、苯硫基吡唑基、苯并噻吩基、苯并噻唑基、噻唑基、2-苯基噻唑基和异噁唑基。
"烷基"或"烷基基团"如本文所用,指完全饱和的直链(即,非支链的)、支链的或环状烃链。在一些实施方案中,烷基包含1、2或3至4、5或6个碳原子(例如,C1-4、C2-4、C3-4、C1-5、C2-5、C3-5、C1-6、C2-6、C3-6)。在一些实施方案中,烷基包含3-4个碳原子。在某些实施方案中,烷基包含1-3个碳原子。在其它实施方案中,烷基包含2-3个碳原子,并且在其它实施方案中烷基包含1-2个碳原子。在某些实施方案中,术语“烷基”或“烷基基团”指环烷基,也称为碳环。示例性烷基的非限制性实例包括甲基、乙基、丙基、异丙基、丁基、环丙基和环己基。
"烯基"或"烯基基团"如本文所用指具有一个或更多个双键的直链(即非支链)、支链或环状烃链。在某些实施方案中,烯基包含2-6个碳原子。在某些实施方案中,烯基包含2-4个碳原子。在其它实施方案中,烯基包含3-4个碳原子,和在其它实施方案中烯基包含2-3碳原子。根据另一个方面,术语烯基指具有两个双键的直链烃,也称为“二烯”。在其它实施方案中,术语“烯基”或“烯基基团”指环烯基基团。示例性烯基基团的非限制性实例包括:-CH=CH2、-CH2CH=CH2(也称为烯丙基)、-CH=CHCH3、-CH2CH2CH=CH2、-CH2CH=CHCH3、-CH=CH2CH2CH3、-CH=CH2CH=CH2和环丁烯基。
如之前所定义,"烷氧基"或"烷基硫代"如本文所用指通过氧("烷氧基")或硫("烷基硫代")原子连接到主要碳链的烷基。
“亚甲基”、“亚乙基”、“亚丙基”如本文所用分别指二价部分-CH2-、-CH2CH2-和-CH2CH2CH2-。
“亚乙烯基”、“亚丙烯基”和“亚丁烯基”如本文所用指二价部分-CH=CH-、-CH=CHCH2-、-CH2CH=CH-、-CH=CHCH2CH2-、-CH2CH=CH2CH2-和-CH2CH2CH=CH-,其中每个亚乙烯基、亚丙烯基和亚丁烯基可以是顺式或反式构型。在某些实施方案中,亚乙烯基、亚丙烯基或亚丁烯基可以是反式构型。
“烷叉”指由甲叉的单或二烷基取代形成的二价烃基团。在某些实施方案中,烷叉基团具有1-6个碳原子。在其它实施方案中,烷叉基团具有2-6、1-5、2-4或1-3个碳原子。这些基团包括丙叉(CH3CH2CH=)、乙叉(CH3CH=),和异丙叉(CH3(CH3)CH=)以及类似物。
“烯叉”指由甲叉的单或二烯基取代形成的具有一个或更多个双键的二价烃基团。在某些实施方案中,烯叉基团具有2-6个碳原子。在其它实施方案中,烯叉基团具有2-6、2-5、2-4或2-3个碳原子。根据一方面,烯叉具有两个双键。示例性烯叉基团包括CH3CH=C=、CH2=CHCH=、CH2=CHCH2CH=和CH2=CHCH2CH=CHCH=。
“C1-6烷基酯或酰胺”指C1-6烷基酯或C1-6烷基酰胺,其中每个C1-6烷基如上面所定义。这些C1-6烷基酯基团是式(C1-6烷基)OC(=O)-或(C1-6烷基)C(=O)O-。这些C1-6烷基酰胺基团是式(C1-6烷基)NHC(=O)-或(C1-6烷基)C(=O)NH-。
“C2-6烯基酯或酰胺”指C2-6烯基酯或C2-6烯基酰胺,其中每个C2-6烯基如上面所定义。这些C2-6烯基酯基团是式(C2-6烯基)OC(=O)-或(C2-6烯基)C(=O)O-。这些C2-6烯基酰胺基团是式(C2-6烯基)NHC(=O)-或(C2-6烯基)C(=O)NH-。
“卤”指氟、氯、溴或碘。
“卤烷基”指用一个或更多个卤原子取代的烷基。例如,“氟甲基”指用一个或更多个氟原子取代的甲基(例如,单氟甲基、二氟甲基、三氟甲基)。
“羟基烷基”指用羟基(-OH)取代的烷基。
“氟甲氧基”如本文所用,指通过氧原子连接主要碳链的氟甲基,氟甲基如之前所定义。
“保护基”如本文所用,指使特别的官能部分例如O、S或N被暂时阻塞使得在多官能化合物的其它反应部位选择性地进行反应。例如,在某些实施方案中,如本文所详述,使用某些示例性氧保护基。氧保护基包括但不限于连接到氧以形成醚的基团,如甲基、取代甲基(例如,Trt(三苯基甲基)、MOM(甲氧基甲基)、MTM(甲基硫代甲基)、BOM(苄氧基甲基)、PMBM或MPM(对甲氧基苄氧基甲基)),取代乙基(例如,2-(三甲基甲硅烷基)乙基)、苄基、取代苄基(例如,对甲氧基苄基)、甲硅烷基(例如,TMS(三甲基甲硅烷基)、TES(三乙基甲硅烷基)、TIPS(三异丙基甲硅烷基)、TBDMS(叔丁基二甲基甲硅烷基)、三苄基甲硅烷基、TBDPS(叔丁基二苯基甲硅烷基)、2-三甲基甲硅烷基丙-2-烯基、叔丁基、四氢吡喃基、烯丙基等。
在一些实施方案中,可作为盐如药学上可接受的盐的形式提供化合物。药学上可接受的盐是保留母体化合物的期望的生物学活性并不赋予不期望的毒理学效果的盐。药学上可接受的盐的特定实例包括无机酸盐(如硫酸盐、硝酸盐、高氯酸盐、磷酸盐、碳酸盐、碳酸氢盐、氢氟酸盐、氢氯酸盐、氢溴酸盐和氢碘酸盐),有机羧酸盐(如乙酸盐、草酸盐、马来酸盐、酒石酸盐、延胡索酸盐和柠檬酸盐),有机磺酸盐(如甲磺酸盐、三氟甲基磺酸盐、乙基磺酸盐、苯磺酸盐、甲苯磺酸盐和樟脑磺酸盐),氨基酸盐(如天冬氨酸盐和谷氨酸盐),季胺盐,碱金属盐(如钠盐和钾盐)以及碱土金属盐(如镁盐和钙盐)。
除非另外说明,否则用于描述如本文使用的化学基团或部分的术语遵循惯例,其中从左向右读名字,连接到分子剩余部分的点在名字的右手侧。例如,基团“(C1-3烷氧基)C1-3烷基”在烷基末端连接到分子的剩余部分。进一步的实例包括甲氧基乙基,其中连接点在乙基末端,和甲基氨基,其中连接点在氨基末端。
除非另外说明,否则其中通过其化学式描述单价或二价基团,包括由“-”表示的一种或两种终端结合部分,应当理解连接从左向右读。
除非另外说明,否则本文描述的结构也指包括结构的所有对映体、非对映体和几何(或构象)形式;例如,对于每个不对称中心的R和S构型,(Z)和(E)双键异构体,以及(Z)和(E)构象异构体。因此,本发明化合物的单一立体化学异构体以及对映体、非对映体和几何(或构象)混合物属于本发明的范围。除非另外说明,否则本发明化合物的所有互变异构形式属于本发明的范围。
此外,除非另外说明,否则本文描述的结构也指包括仅在存在一个或更多个同位素富集的原子时不同的化合物。例如,除通过氘或氚置换氢或通过13C-或14C富集的碳置换碳之外,具有本发明结构的化合物属于本发明的范围。这些化合物例如用作分析工具或生物学测试中的探针。
B.化合物和化学合成
本文提供了式I化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6烷基)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式I遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式I化合物的实例包括:
还提供了制备如上面定义的式I化合物的方法。在一些实施方案中,该方法包括加热包含以下的混合物的步骤:
(i)式A的肟:
其中R1、R2和R3如上面为式I所示出;
(ii)氢醌;和
(iii)烃溶剂(例如,苯、甲苯、二甲苯等),
所述加热达到90℃、95℃、100℃、105℃或110℃至115℃、120℃、125℃、130℃、135℃、140℃、145℃、150℃、155℃或160℃的温度(例如,90℃至160℃,或110℃至140℃,或100℃至120℃,或120℃至140℃),
以制备所述式I的化合物或其盐。
在一些实施方案中,所述方法包括加热包含以下的混合物的步骤:
(i)式B化合物:
其中R1、R2和R3如上面所示出;
(ii)乙酸盐;
(iii)羟基胺或其盐;和
(iv)烃溶剂(例如,苯、甲苯、二甲苯等),
所述加热达到90℃、95℃、100℃、105℃或110℃至115℃、120℃、125℃、130℃、135℃、140℃、145℃、150℃、155℃或160℃的温度(例如,90℃至160℃,或110℃至140℃,或100℃至120℃,或120℃至140℃),
以制备所述式I的化合物或其盐。
还提供了式II化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟);
在一些实施方案中,式II遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式II化合物的实例包括:
还提供了制备式II化合物或其盐的方法:
其中:
R1是C1-4烷基;和
R2和R3各自独立地是氢或卤素,
所述方法包括以下步骤:
(a)加热包含以下的混合物:
(i)式B的酮:
其中R1、R2和R3如上面为式II所示出;
(ii)羟基胺或其盐;
(iii)碱(例如,乙酸盐、丙酸盐、叔胺碱如三乙胺或二乙基异丙基胺、吡啶或其盐);和
(iv)选自以下的溶剂:水和醇(例如,C3-8醇),
所述加热达到至少90或100摄氏度(例如,如通过回流达到沸腾)产生加热的混合物,
(b)将加热的混合物冷却至60、50或45摄氏度或低于60、50或45摄氏度,并且然后
(c)向所述混合物加入有机溶剂(例如,四氢呋喃或醚溶剂如二乙基醚或甲基叔丁基醚),酸(例如,羧酸如乙酸或无机酸例如盐酸或硫酸),和锌(例如,锌粉末或锌粉),其中在所述加入过程中将所述混合物维持在60、50或45摄氏度或低于60、50或45摄氏度(例如,25、30或35至45、50或60摄氏度),
以制备所述式II化合物。
在一些实施方案中,将加热进行至少30小时。
还提供制备式IIa的立体化学纯的化合物或其盐的方法:
其中R1、R2和R3如上面为式II所示出,
其包括以下步骤:
(a)向溶剂(例如,醇如乙醇或异丙醇,或混合物如甲苯-乙腈混合物、甲苯-丙酮混合物、甲苯-四氢呋喃混合物或醇-水混合物)加入式II化合物的立体异构体的混合物:
其中R1、R2和R3如上面所示出,
该溶剂包括手性羧酸化合物(例如,D-二苯甲酰基酒石酸、L-二苯甲酰基酒石酸、D-二甲苯甲酰基酒石酸和L-二甲苯甲酰基酒石酸等)以形成式II化合物的非对映体盐的混合物;并且然后
(b)使由式II化合物形成的单个非对映体盐结晶以制备式IIa的立体化学纯的化合物或其盐。
在一些实施方案中,立体化学纯的化合物具有大于约80wt%的化合物的一种立体异构体和少于约20wt%的化合物的其它立体异构体,更优选大于约90wt%的化合物的一种立体异构体和小于约10wt%的化合物的其它立体异构体,甚至更优选大于约95wt%的化合物的一种立体异构体和少于约5wt%的化合物的其它立体异构体,和最优选大于约97wt%的化合物的一种立体异构体和小于约3wt%的化合物的其它立体异构体,大于约90wt%的化合物的一种立体异构体和小于约10wt%的化合物的其它立体异构体。
在一些实施方案中,结晶步骤通过将式II化合物的非对映异构体盐的混合物冷却(例如,达到40、45、50、55或60℃至80、90、100或110℃的温度,达到-10、-5、0、5或10℃至15、20、29或35℃的温度)来执行。
进一步提供式III化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式III遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式III化合物的实例包括:
还提供式IV化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式IV遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式IV化合物的实例包括:
进一步提供式V化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式V遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式V化合物的实例包括:
还提供用于制备式V化合物或其盐的方法:
其中:
R1是C3-4烷基、卤-C1-4烷基、羟基-C1-4烷基或–C1-4烷基-OR',
其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素;
所述方法包括以下步骤:
(a)提供以下的混合物
(i)式III化合物,
其中R1、R2和R3如上面为式V所示出;
(ii)胺碱(例如,吡啶,或取代吡啶如三甲基吡啶);和
(iii)有机溶剂(例如,芳族烃溶剂,甲苯、二甲苯、苯、二氯甲烷等),
其中所述混合物在0摄氏度或低于0摄氏度的温度下,
(b)使所述混合物与三氟甲基磺酸酐、4-甲苯磺酰氯、甲基磺酰氯或甲基磺酰酐反应,并且然后,
(c)加入:
(i)醇(例如,丙醇,如2-丙醇);和
(ii)碱,如选自以下的强碱:氢氧化物、醇盐和氨,
以制备所述式V化合物。
在一些实施方案中,在-15、-10或-5至0摄氏度的温度下进行所述反应步骤。
还提供式VI化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,式VI遵守这样的条件:当R2或R3中的一个是邻-氟,并且另一个是氢时,R1不是–CH2F。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式VI化合物的实例包括:
进一步提供了式VII化合物或其盐:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素(例如,氟)。
在一些实施方案中,R1是甲基、三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
式VII化合物的实例包括:
还提供了制备式VII化合物或其盐的方法,其包括以下步骤:
还原式VI化合物以形成式VII化合物,如下面所示:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素。
在一些实施方案中,R1是三氟甲基、羟甲基、单氟甲基或三苯基甲氧基甲基。
在一些实施方案中,R2是氟,和/或R3是氢或氟。
在一些实施方案中,还原式VI化合物以形成式VII化合物可包括以下步骤中的一个或更多个:
(a)将粉末状铁加到甲醇溶剂以形成其混合物;
(b)将盐酸(HCl)(例如,浓HCl)加到步骤(a)的混合物中;
(c)将步骤(b)的混合物加热至31℃、40℃或50℃至65℃、70℃、75℃、80℃、85℃的温度,或至步骤(b)的混合物的沸点(例如,持续0–4小时)以形成加热的混合物;和
(d)将式VI化合物或其盐加到步骤(c)的加热的混合物中。
在一些实施方案中,该方法还包括以下步骤:
(e)将步骤(d)的混合物冷却至10至30℃的温度以形成冷却的混合物;和
(f)任选地,搅拌所述冷却的混合物(例如,持续0-4小时)。
在一些实施方案中,以选自以下的量提供HCl:关于式VI化合物的量,化学计量的HCl量;和关于式VI化合物的量,摩尔过量的HCl量。
进一步提供制备式IX化合物或其盐的方法:
其中:
R1是烷基、卤烷基、羟基烷基或–(C1-6)-OR',其中R'是氧保护基;和
R2和R3各自独立地是氢或卤素;和
R4选自:烷基、卤烷基、烷氧基和用烷氧基取代的烷基;
其包括以下步骤:
使式VII化合物与式VIII的吡嗪羧酸反应:
其中R1、R2、R3和R4如上面所示出,以形成所述式IX化合物或其盐。
在一些实施方案中,反应可包括以下步骤中的一个或更多个:
(a)将亚硫酰氯加到包含在溶剂中的式VIII化合物的溶液以制备形成的混合物;和
(b)将式VII化合物加到步骤(a)的形成的混合物,以形成所述式IX化合物或其盐。
在一些实施方案中,在加入步骤(a)之前或过程中将包含在溶剂中的式VIII化合物的溶液冷却(例如,到0至25℃的温度)。
在一些实施方案中,溶剂可包括:N,N'-二甲基咪唑啉-2-酮、甲苯、二氯甲烷、二甲基甲酰胺、N-甲基吡咯烷或二甲基乙酰胺。
在一些实施方案中,反应可包括以下步骤中的一种或更多种:
(a)将乙酸乙酯(EtOAc)加到式VIII化合物和式VII化合物以制备形成的混合物;和
(b)将丙烷膦酸酐(例如,Archimica,Germany)加到步骤(a)的形成的混合物以形成所述式IX化合物或其盐。
在一些实施方案中,可以在所述加入步骤(a)过程中将形成的混合物维持在0℃至35℃的温度。
这些化合物或其盐以及制备方法用于稠合氨基二氢噻嗪衍生物的合成方法,例如下面方案1中提出的方法。
为了可以更充分地理解本文描述的发明,阐述以下实施例。应当理解这些实施例仅用于说明性目的并且不应被解释为以任何方式限制本发明。
实施例
一般:
使用Biotage SP4进行柱色谱法。使用Büchii旋转蒸发仪或Genevac离心蒸发仪进行溶剂除去。使用Water自动纯化器和19x 100mm XTerra 5微米MS C18柱在酸性流动相条件下进行制备型LC/MS。使用Varian 400MHz分光计记录NMR谱。
当术语“惰性的”用于描述反应器(例如,反应容器、烧瓶、玻璃反应器和类似物)时,指反应器中的空气已经用基本上无水的或干燥的惰性气体(如氮气、氩气和类似气体)置换。术语“当量”(缩写:当量)如本文所用描述了通过与预定的起始物质相比试剂或反应化合物的化学计量(摩尔比率)。术语“重量”(缩写:wt)如本文所用相当通过与下面在实施例中具体引用的反应或纯化的特别化学组分的质量相比物质或物质组的质量比。该比率计算为:g/g或Kg/Kg。术语“体积”(缩写:vol)如本文所用相当给定物质或物质组与反应或纯化的预定化学组分的质量或体积的体积比。方程中使用的单位涉及匹配数量级。例如,比率计算为:mL/mL、mL/g、L/L或L/Kg。
制备本发明的化合物的一般方法和实验在下面阐述。在某些情况下,特别的化合物通过实施例描述。然而,应当理解在每种情况下一系列本发明的化合物根据下面描述的方案和实验制备。
本文使用以下缩写:
A.式I的六氢呋喃并异噁唑化合物的制备
实施例1:6a-(2-氟苯基)-4-(三氟甲基)六氢呋喃并-[3,4-c]异噁唑的制备
2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酸叔丁酯在rt在氮气下向反应容器装入甲苯(3.2L)、THF(0.60L)和丙烯醛(0.40L,5.985mol)。在17℃下加入(三氟甲基)三甲基硅烷(1.003kg,7.059mol)。将反应混合物冷却至2.5℃并经2小时加入TBAF(0.01M在THF中,0.400L,0.004mol)。在加入TBAF过程中,将反应混合物的温度升高至65℃。将反应混合物冷却至0℃,并且2h之后,加入四正丁基铵硫酸氢盐(0.171kg,0.503mol),随后加入溴乙酸叔丁基酯(0.987kg,5.064mol)。经2h加入氢氧化钠(50%wt在水中,4.2kg,52.6mol)同时维持温度在10℃之下。在0-5℃2h之后,向反应混合物加入水(2.9L)和甲基叔丁基醚(6.0L)。将水相用甲基叔丁基醚(6.0L)再萃取一次。合并有机相并用14%NaCl水溶液洗涤(3x1.6L)。在真空下浓缩有机物以得到油状标题化合物1(1.150kg,94.5%),其不经另外的纯化用于随后的阶段。
2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酸叔丁酯:
1H NMR(500MHz,CDCl3)δ5.86-5.74(m,1H),5.59(d,J=17.5Hz,1H),5.56(d,J=10.9Hz,1H),4.37-4.30(m,1H),4.11(d,J=16.5Hz,1H),4.06(d,J=16.4Hz,1H),1.40(s,9H);13C NMR(125MHz,CDCl3)δ168.51,128.49(d,J=1.7Hz),123.86,123.71(q,J=281.8Hz),82.22,78.67(q,J=31.5Hz),66.60,28.02.
N-甲氧基-N-甲基-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酰胺.在rt向包含2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酸叔丁酯1(1.150kg,4.788mol)的反应器加入甲酸(6.2kg)。将反应混合物加入55-60℃持续4-5小时。在真空下蒸发甲酸(T=40-45℃)并用甲苯(2x 3.0L)逐出(chased)。向残余物加入CH2Cl2(2.0L)并在真空中进一步浓缩。向所得残余物加入CH2Cl2(4.6L)并将溶液冷却至0℃,随后以五部分加入N,N-羰基二咪唑(1.05kg,6.49mol)。将混合物搅拌30分钟并分几部分加入N,O-二甲基羟基胺盐酸盐(0.67kg,6.72mol)同时维持温度低于10℃。将反应混合物升温至rt并经14小时搅拌。将反应混合物冷却至3.2℃并以两部分装入咪唑(100.7g,1.48mol)。将反应混合物升温至rt并加入水(1.4kg),随后加入甲基叔丁基醚(14.0L)。将有机相用2.0N HCl水溶液(1.0L和0.7L)洗涤,随后用NaHCO3饱和水溶液(1.2L)和NaCl饱和水溶液(1.20L)洗涤。将有机物浓缩以得到油状标题化合物2(0.95kg,87.2%)。
N-甲氧基-N-甲基-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酰胺:
1H NMR(500MHz,CDCl3)δ5.85-5.76(m,1H),5.62(d,J=17.2Hz,1H),5.56(d,J=10.4Hz,1H),4.49-4.34(m,3H),3.68(s,3H),3.67(s,1H),3.18(s,3H),3.08(s,1H);13C NMR(126MHz,cdcl3)δ169.9*,163.4*,128.61,123.87(d,J=282.0Hz),123.82,78.54(q,J=31.3Hz),66.12,61.52,60.56,36.20,32.24.
HRMS计算C8H12F3NO3[M+H]+228.0848;实测228.0836。
1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮.在-75℃向1-溴-2-氟苯(0.967kg,5.527mol)在THF(6.2L)中的溶液加入正丁基锂(己烷中2.50M,2.09L,5.22mol)同时维持温度低于-65℃(ca.100min.)。15分钟之后,加入N-甲氧基-N-甲基-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酰胺2(0.949kg,4.178mol)在THF(1.6L)中的溶液同时维持温度低于-65℃(ca.70min.)。在-78℃2.5h之后,将反应通过加入NH4Cl饱和水溶液(3.0L)和甲基叔丁基醚(9.0L)猝灭。将反应混合物升温至rt,将水相再次用甲基叔丁基醚(2.5L)萃取。将有机相合并,用NaCl饱和水溶液洗涤(2x 0.3L)并在真空下浓缩得到油状标题化合物3(1.007kg,80.0%)。
1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮:
1H NMR(500MHz,CDCl3)δ7.96(td,J=7.6,1.8Hz,1H),7.62-7.54(m,1H),7.33-7.25(m,1H),7.20-7.12(m,1H),5.86(ddd,J=17.5,10.4,7.3Hz,1H),5.60(dd,J=20.5,13.8Hz,2H),4.91-4.76(m,2H),4.39(dq,J=12.8,6.4Hz,1H);13C NMR(125MHz,CDCl3)δ193.55,162.14(d,JCF=254.1Hz),135.36(d,JCF=9.2Hz),130.62(d,JCF=3.2Hz),128.49,124.85(d,JCF=3.3Hz),123.89,122.93,122.72(d,JCF=24.5Hz),116.50(d,JCF=23.7Hz),78.97(q,JCF=31.4Hz),74.56(d,JCF=12.4Hz).
HRMS计算C12H10F4O2[M+H]+263.0695;实测263.0709。
1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮肟.向反应器加入羟基胺盐酸盐(0.34kg,4.95mol)、乙酸钠(0.47kg,5.70mol)和MeOH(2.68L)。向这种悬浮液中加入1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮3(0.998kg,3.806mol)在MeOH(1.8L)中的溶液并将反应混合物加热至40-50℃。完成(ca.2h)之后,将反应混合物冷却至rt,并滤过硅藻土(0.5wt)并用EtOAc(3.0L)冲洗。在真空下浓缩滤液并向所得残余物加入甲基叔丁基醚(6.3L)、水(0.94L)和NaHCO3饱和水溶液(2.5L)。将有机相用水(1.6L)和NaCl饱和水溶液(0.1L)洗涤一次。在真空下浓缩有机相以提供油状标题化合物4(1.03kg,95.0%)。
1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮肟:
1H NMR(500MHz,CDCl3)δ7.49-7.35(m,2H),7.24-7.06(m,2H),5.78-5.65(m,1H),5.54-5.40(m,2H),4.89-4.81(m,1H),4.53(d,J=12.6Hz,1H),4.47(d,J=12.6Hz,0.5H),4.27-4.18(m,1H),4.13-4.05(m,0.5H)
HRMS计算C12H11F4NO2[M+H]+278.0804;实测278.0780。
注意:肟4作为结构异构体的平衡存在,其解释了低于总数的积分值。
6a-(2-氟苯基)-4-(三氟甲基)六氢呋喃并[3,4-c]异噁唑.在rt向1-(2-氟苯基)-2-(1,1,1-三氟丁-3-烯-2-基氧基)乙酮肟4(1.085kg,3.328mol)在二甲苯(6.9L)中的溶液加入氢醌(86.2g,0.8mol)。将溶液加热至128℃(内温)持续18h。将溶液冷却至rt,加入己烷(7.0L),随后加入4.0M HCl水溶液(2.4L)。将反应混合物搅拌1h并过滤。向固体加入水(2.0L)、甲基叔丁基醚(7.0L)和25wt.%NaOH水溶液(0.4L)。将水层用甲基叔丁基醚(7.0L)萃取一次,将有机物合并,用27%NaCl水溶液(2.0L)洗涤并在真空下浓缩至黑色油状物5(512.0g,56%)。
6a-(2-氟苯基)-4-(三氟甲基)六氢呋喃并[3,4-c]异噁唑:
1H NMR(500MHz,CDCl3)δ7.64-7.52(m,1H),7.39-7.31(m,1H),7.19(td,J=7.7,1,2Hz,1H),7.11(ddd,J=11.9,8.2,1.0Hz,1H),4.54(d,J=10.1Hz,1H),4.34-4.23(m,1H),4.26-4.17(m,1II),4.16(d,J=10.2Hz,1H),4.10(d,J=8.5Hz,1H),3.71(d,J=20.2Hz,1H);13C NMR(125MHz,CDCl3)δ160.59(d,JCF=247.0Hz),130.50(d,JCF=8.7Hz),128.72,124.69(d,JCF=3.3Hz),124.45(q,JCF=281.8Hz),124.43(d,JCF=11.9Hz),116.66(d,JCF=22.7Hz),83.70(q,JCF=32.1Hz),78.17(d,JCF=3.1Hz),77.63.54.53.
HRMS计算C12H11F4NO2[M+H]+278.0804;实测278.0802。
实施例2:6a-(2-氟苯基)-4-甲基六氢呋喃并[3,4-c]异噁唑的制备
2-(丁-3-烯-2-基氧基)乙酸叔丁酯:向反应器装入四丁基铵硫酸氢盐(0.17Wt,0.10当量)和甲苯(2.6Wt,3.0V)。将混合物搅拌并冷却至0-5℃。同时维持内部温度低于10℃,加入50wt%氢氧化钠水溶液(4.5wt,3.0V,10.5当量;由2.25wt的氢氧化钠和2.25wt的水制备的50%wt氢氧化钠),随后加入3-丁烯-2-醇(0.45Wt,0.53V,1.20当量)。将混合物在0-10℃搅拌15分钟。加入溴乙酸叔丁酯(1.0Wt,1.00当量)同时维持内部温度在0-10℃。加入之后,将混合物在0-5℃搅拌1h并监测溴乙酸叔丁基酯的完全消耗(目标>98%转化)。向反应器装入水(3.0Wt,3.0V)和MTBE(4.4Wt,6.00V)并升温至20-25℃。将双相混合物剧烈搅拌15分钟并然后允许分开。将有机层用水(1.5Wt,1.5V)洗涤。在减压下浓缩有机层(T<40℃并不低于15torr或20mbar)。加入庚烷(1.0wts,1.5V)和MTBE(1.1wts,1.5V)。如为使产物澄清所需,将溶液过滤以除去颗粒,并用另外的庚烷:MTBE冲洗。将溶液返回到反应器中并在减压下浓缩以得到油状6(0.91Wt,95.0%)其带有少于1体积的溶剂。
2-(丁-3-烯-2-基氧基)乙酸叔丁酯:
1H NMR(500MHz,CDCl3)δ5.78-5.66(m,1H),5.23-5.12(m,2H),4.00-3.85(m,3H),1.47(s,11H),1.31(d,J=6.4Hz,3H);13C NMR(125MHz,CDCl3)δ169.87,139.30,116.72,81.20,77.53,65.83,28.04,27.92,21.08.
2-(丁-3-烯-2-基氧基)-N-甲氧基-N-甲基乙酰胺:向反应器装入6的甲苯溶液(1.0Wt,1.0V)并冷却至0-5℃。加入甲酸(4.84Wt,4.0V,19.2当量)同时维持内温低于10℃。加入甲酸后,将混合物加热至35-40℃持续三小时。关于6的消耗监测反应(>90%转化)。完成后在45℃在真空下除去甲酸。将残余的甲酸通过在真空下在45℃下与甲苯(2.0-2.50Wt,2.3-3.0V)两次共沸蒸馏除去以得到粗制酸(0.67Wt,95%)。
将粗制酸溶解在二氯甲烷(5.3Wt,4.0V)中并在0℃冷却。向溶液以5-7部分加入N,N-羰基二咪唑(1.15Wt,1.28当量)并维持反应温度在0-10℃。注意:在反应过程中存在气体放出。完成加入N,N-羰基二咪唑后,将混合物升温至15-20℃并搅拌30分钟。然后将反应混合物冷却回到0-5℃。以几部分加入N,O-二甲基羟基胺盐酸盐(0.71Wt,1.33当量),维持反应在0-10℃。完成加入之后,将反应混合物升温至15-20℃。关于中间体酸的完全消耗监测反应(>98%转化)。在0-10℃向反应器装入水(1.2Wt,1.2V)并且然后装入MTBE(9.1Wt,12.3V)。将双相混合物剧烈搅拌15分钟并然后允许分开。将水层分离,然后将合并的有机层用2N HCl(1.8Wt,1.8V)洗涤(检查pH以保证其在1-3之间或通过TLC检查有机层以保证除去产物以下的极性物质。若需要装入更多的2N HCl)。分离水层,将有机物用饱和碳酸氢钠T(NaHCO3,0.1Wt和水1.1Wt,1.2V)和然后在水(1.2Wt,1.2V)中的20%NaCl洗涤。在减压下浓缩有机相。加入无水THF(1.33Wt,1.50V),然后将溶液过滤以除去沉淀,若需要用另外的无水THF冲洗以使产物澄清。将THF溶液返回到反应器并在减压下浓缩以得到油状物7(0.73Wt,75.0%)。
2-(丁-3-烯-2-基氧基)-N-甲氧基-N-甲基乙酰胺:
1H NMR(500MHz,CDCl3)δ5.80-5.70(m,1H),5.21(d,J=17.3Hz,1H),5.17(d,J=10.3Hz,1H),4.28(d,J=15.6Hz,1H),4.18(d,J=15.6Hz,1H),4.03-3.96(m,1H),3.68(s,3H),3.18(s,3H),1.32(d,J=6.4Hz,3H);13C NMR(125MHz,CDCl3)δ139.62,116.73,77.49,65.34,61.44,32.36,21.25.
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮.向反应器装入1-溴-2-氟苯(1.31Wt,1.30当量)和无水THF(7.60Wt,8.6V)。将反应混合物冷却至低于-70℃.加入己烷中的2.5M正丁基锂(1.94Wt,2.89V,1.25当量)同时维持内温低于-60℃。完成加入之后,将混合物在低于-60℃的温度下搅拌15分钟并且然后加入酰胺7(1.0Wt,1.0当量)在THF(1.9Wt,2.2V)中的溶液同时维持内温低于-60℃。搅拌反应60分钟之后就,关于酰胺7的完全消耗监测反应(>90%转化)。向反应器装入20wt%氯化铵水溶液(1.0Wt,1.0V)并升温至20-25℃。将混合物转移到含有另外的20wt%氯化铵水溶液(3.0Wt,3.0V)的后处理容器中。将混合物搅拌15分钟,然后停止搅拌并相分离。将下面的水层返回到反应器中。加入MTBE(4.45Wt,6.0V)。将双相混合物剧烈搅拌15分钟,并且然后允许分开。将有机层合并并用25wt%氯化钠水溶液(4.75Wt,4.75V)洗涤。在减压下浓缩有机相(T<40℃)。加入无水THF(1.78Wt,2.0V),然后将混合物过滤以除去颗粒,若需要用另外的无水THF冲洗以使产物澄清。将THF溶液返回到反应器并在减压下浓缩以得到油状物酮8(0.8Wt,73.0%)。
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮:
1H NMR(500MHz,CDCl3)δ7.93(td,J=7.6,1.8Hz,1H),7.57-7.49(m,1H),7.24(dt,J=14.6,3.8Hz,1H),7.12(ddd,J=11.0,8.3,0.8Hz,1H),5.21(dd,J=17.3,1.3Hz,1H),5.17(dd,J=10.3,0.8Hz,1H),4.69(dd,J=18.1,3.2Hz,1H),4.60(dd,J=18.1,3,4IIz,1II);4.00(dq,J=12.9,6.4Hz,1H),1.36(d,J=6.4Hz,3H);13C NMR(125MHz,CDCl3)δ195.24(d,JCF=5.3Hz),162.03(d,JCF=253.9Hz),139.42,134.86(d,JCF=8.9Hz),130.64(d,JCF=3.4Hz),124.67(d,JCF=3.2Hz),123.57(d,JCF=15.3Hz),116.89,116.45(d,JCF=23.7Hz),77.93,74.11(d,JCF=11.2Hz),21.19.
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮肟.向反应器装入粗制酮8(1.0Wt,1.0当量)、羟基胺盐酸盐(0.43Wt,1.30当量)、乙酸钠(0.59Wt,1.50当量)和甲醇(4.6Wt,5.8V)。将混合物升温至50-55℃,并且然后继续搅拌1-2hr。关于酮8的消耗(>95%转化)监测反应。将混合物冷却至15-20℃,然后将反应混合物过滤以除去固体。将固体用乙酸乙酯冲洗直到产物澄清(3.6Wt,4.0V)。将滤液返回到反应器并在减压下浓缩(T<40℃)。加入MTBE(5.9Wt,8.0V)和水(1.0Wt,1.0V)。将双相混合物剧烈搅拌15分钟并然后分开。将有机相用10wt%碳酸氢钠水溶液(3.2Wt,3.2V)、水(2.0Wt,2.0V)和最后25wt%氯化钠水溶液(1.0Wt,1.0V)顺序洗涤。在减压下浓缩有机相(T<40℃)。加入无水THF(1.78Wt,2.0V),然后将混合物过滤以除去颗粒,若需要用另外的无水THF冲洗以使产物澄清。将THF溶液返回到反应器并在减压下浓缩以得到油状物肟9(0.8-1.2Wt,90.0%)。
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮肟:
1H NMR(500MHz,cdcl3)δ7.45(ddd,J=9.2,6.2,2.5Hz,1H),7.38-7.30(m,1H),7.20-7.03(m,2H),5.73-5.58(m,1H),5.21-5.05(m,2H),4.67(s,2H),4.38(d,J=13.0Hz,1H),4.26(d,J=13.0Hz,1H),3.97-3.88(m,1H),3.79-3.72(m,1H),1.18(d,J=6.4Hz,1H),1.05(d,J=6.4Hz,2H);13C NMR(126MHz,cdcl3)δ160.68(d,JCF=249.9Hz),159.13(d,JCF=249.1Hz),156.42,151.80,139.39,130.78(d,JCF=8.2Hz),130.67(d,JCF=8.4Hz),130.27(d,JCF=3.7Hz),129.77(d,JCF=4.2Hz),123.96(d,JCF=3.5Hz),123.86(d,JCF=3.4Hz),122.51(d,JCF=14.1Hz),120.08(d,JCF=17.1Hz),116.59,116.29,115.72(d,JCF=7.4Hz),115.55(d,JCF=7.7Hz),77.45,76.53,68.48(d,JCF=1.7Hz),77.45,76.53,68.48(d,JCF=1.7Hz),62.01(d,JCF=2.4Hz),20.99,20.81.
注意:存在许多1H和13C信号,因为这一化合物是四种可能的异构体的混合物。
6a-(2-氟苯基)-4-甲基六氢呋喃并[3,4-c]异噁唑.向反应器装入肟9(1.0Wt,1.0当量)、二甲苯(6.8Wt,7.9V)和然后氢醌(0.10Wt,0.2当量.)。将混合物加热至125-130℃并关于肟9的消耗(>90%转化)监测反应。将混合物冷却至20-25℃。加入2N盐酸水溶液(4.0Wt,4.0V)。将双相混合物剧烈搅拌15分钟并然后分离相。将有机相用2N盐酸水溶液(3.0Wt,3.0V)萃取。注意;产物存在于水层。将水相返回到反应器中。加入叔丁基甲基醚(5.8Wt,7.9V)并且然后加入氢氧化钠(0.55Wt)以将pH调节至9-10。将双相混合物剧烈搅拌15分钟并然后分离相。将水相用MTBE(5.8Wt,8.0vol)萃取第二次。将合并的有机相用25wt%氯化钠水溶液(1.0Wt,1.0V)洗涤。在减压下浓缩有机相(T<40℃)。加入无水THF(1.0Wt,1.1V),并过滤以除去颗粒,若需要用另外的无水THF浸洗以使产物澄清。将THF溶液返回到反应器并在减压下浓缩以得到油状物四氢异噁唑10(0.6-0.8Wt,65.0%)。
6a-(2-氟苯基)-4-甲基六氢呋喃并[3,4-c]异噁唑:
1H NMR(400MHz,CDCl3)δ7.61(t,J=8.0Hz,1H),7.30(ddd,J=15.0,5.2,1.8Hz,1H),7.19-7.03(m,2H),4.36(d,J=10.2Hz,1H),4.23-4.16(m,1H),4.05(dt,J=12.2,6.2Hz,1H),3.98-3.87(m,2H),3.19-3.09(m,1H),1.40(d,J=6.4Hz,3H).
注意:对于这一化合物未获得13C-NMR数据。
用于制备酮8的可选过程#1:
2-(丁-3-烯-2-基氧基)-3-(2-氟苯基)-3-氧代丙酸叔丁酯.在氮气气氛下向反应器加入酯6的甲苯溶液(1.00Wt,1.0当量)、2-氟苯甲酸甲酯(0.91Wt,0.75Vol 1.10当量)和THF(0.53Wt,1.8Vol)。将溶液冷却至低于-70℃。以这样的速率加入六甲基二硅基氨基锂(LiHMDS,1.0M在THF中,7.6Wt,8.6Vol,1.6当量)使得内部温度不超过-60℃。在完成LiHMDS加入之后,将混合物升温(10-20℃/h的速率)并在-40℃搅拌1h。通过GC监测反应(转化目标≥95%)。如果4h之后转化仍然在目标量以下,加入另外的THF中LiHMDS 1M(基于未反应的原料1.1当量)。达到目标转化之后,使内部温度升高(20-30℃/h的速率)至-15至-20℃。将25%氯化铵水溶液(1.7Wt,1.6Vol)加入反应器,并维持内部温度低于0℃。加入完成后,将混合物升温至>0℃并转移含有25wt%氯化铵水溶液(4.4Wt,4.1Vol)和水(1.1Wt,1.1Vol)的容器中。在20-25℃将混合物搅拌至少30分钟。除去下面的水层并且有机层用20wt%氯化钠水溶液(3.0Wt,1.4Vol)洗涤。将混合物搅拌至少15分钟,然后使其沉淀。除去下面的水层。在减压下浓缩有机相(夹套<25℃)直到蒸馏停止。加入甲苯(6.6Wt,6.7Vol)并且所得的混合物用水洗涤(3.0Wt,3.0Vol),搅拌15分钟,然后使其沉淀。有机物用水洗涤(3.0Wt,3.0Vol)直到pH恒定在pH=7-8。有机相20wt%氯化钠水溶液(3.0Wt,1.4Vol)洗涤。在减压下浓缩有机相(夹套<25℃)以提供橙色油状物的酮酯11(2.1Wt)。
2-(丁-3-烯-2-基氧基)-3-(2-氟苯基)-3-氧代丙酸叔丁酯:
1H NMR(500MHz,CDCl3)δ7.88-7.78(m,1H),7.57-7.48(m,1H),7.29-7.19(m,1H),7.17-7.07(m,1H),5.85-5.64(m,1H),5.28-5.13(m,2H),5.09(s,1H),5.05(s,1H),4.18-4.10(m,1H),4.02-3.94(m,1H),1.39(s,9H),1.37(s,9H),1.35(d,J=6.3Hz,3H),1.28(d,J=6.4Hz,3H);13C NMR(125MHz,CDCl3)δ193.17,193.14,192.33,192.30,166.57,166.16,162.44,162.36,160.42,160.33,138.93,138.80,134.76,134.68,134.61,131.17,131.15,131.05,131.02,124.50,124.47,124.40,124.37,117.86,117.60,116.37,116.34,116.19,116.16,82.95,82.91,82.76,82.73,82.38,82.34,78.75,78.48,27.82,27.76,21.21,21.13.
注意:该化合物是非对映体的混合物。
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮.在氮气气氛下向反应器加入酮酯11(1.00Wt,1.0当量)和甲酸(10.0Wt,8.0Vol)。将所得混合物在25-30℃搅拌12h,然后取样测定转化(目标>97%)。达到目标转化之后,在减压下浓缩混合物并维持内部温度低于30℃。加入甲苯(1.4Wt,1.6Vol)并在减压下将混合物浓缩,维持内部温度低于30℃以使残余的甲酸共沸。加入甲苯(1.4Wt,1.6Vol)并在减压下将混合物浓缩,维持内部温度低于30℃。粗制酮8(0.6Wt,77%)直接用于下一阶段。
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮:
1H NMR(500MHz,CDCl3)δ7.93(td,J=7.6,1.8Hz,1H),7.57-7.49(m,1H),7.24(dt,J=14.6,3.8Hz,1H),7.12(ddd,J=11.0,8.3,0.8Hz,1H),5.21(dd,J=17.3,1.3Hz,1H),5.17(dd,J=10.3,0.8Hz,1H),4.69(dd,J=18.1,3.2IIz,1II),4.60(dd,J=18.1,3.4Hz,1H);4.00(dq,J=12.9,6.4Hz,1H),1.36(d,J=6.4Hz,3H);13C NMR(125MHz,CDCl3)δ195.24(d,JCF=5.3Hz),162.03(d,JCF=253.9Hz),139.42,134.86(d,JCF=8.9Hz),130.64(d,JCF=3.4Hz),124.67(d,JCF=3.2Hz),123.57(d,JCF=15.3Hz),116.89,116.45(d,JCF=23.7Hz),77.93,74.11(d,JCF=11.2Hz),21.19.
用于制备酮8的可选过程#2:
2-(丁-3-烯-2-基氧基)-1-吗啉代乙酮.向反应器装入四丁基铵硫酸氢盐(0.10当量)和甲苯(4.0V)。将混合物冷却至10-20℃。当维持内部温度低于20℃时,加入50wt%氢氧化钠水溶液(2.2V,9.7当量)并且然后加入3-丁烯-2-醇(0.66V,1.25当量)。将混合物在10-20℃搅拌15分钟。加入4-(氯乙酰基)吗啉(1.0Wt,1.00当量)同时维持内部温度在10-20℃。加入之后,将混合物在10-20℃搅拌1h并关于4-(氯乙酰基)吗啉的完全消耗(目标>98%转化)监测反应。向反应器装入水(3.0V)和MTBE(6.00V)同时维持内部温度在10-20℃。将双相混合物剧烈搅拌15分钟并然后允许分开。将水层用MTBE(3.0V)萃取。将合并的有机层用水洗涤两次(每次1.5V)。将水洗物用MTBE萃取两次(每次1.6V)。将有机层合并并在减压下浓缩(T<40℃)。加入庚烷(1.0V)和MTBE(1.0V)。如为使产物澄清所需,将溶液过滤以除去颗粒,用另外的庚烷:MTBE冲洗。将溶液返回到反应器并在减压下浓缩以得到油状酰胺12(77%)。
2-(丁-3-烯-2-基氧基)-1-(2-氟苯基)乙酮.向反应器装入THF中1.3M的异丙基氯化镁-氯化锂(5.15V,1.33当量)并冷却至0-5℃。加入1-溴-2-氟苯(0.726V,1.33当量)同时维持内部温度在0-10℃。完成加入之后,将混合物搅拌0-10℃持续1h。加入酰胺12(1.0Wt,1.0当量.)在THF(1.0V)中的溶液同时维持内部温度在0-10℃。搅拌反应3h之后,关于酰胺12的完全消耗(>97%转化)监测反应。将反应混合物转移到1M HCl(11V,.2.2当量)中同时维持内部温度低于20℃。将混合物搅拌15分钟并然后分离相。将下面的水层用MTBE(5.0V)萃取。将所有有机层合并并用25wt%氯化钠水溶液(6.0V)洗涤。将有机相在减压下浓缩(T<40℃)以得到油状酮8(93%)。
实施例3:6a-(2,3-二氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑的制备
1-吗啉代-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮。向具有1-(三苯甲基氧基)丁-3-烯-2-醇13(41.6g,0.111mol,1.0当量)的反应器加入甲苯(146mL)。将所得溶液冷却至0-5℃并加入四正丁基铵硫酸氢盐(7.52g,0.0222mol,0.20当量)。在0-5℃下加入4-(氯乙酰基)吗啉(18.1g,0.111mol,1.00当量)。将氢氧化钠(50%wt.在水中;88.6g,1.10mol,10当量)冷却至15℃并加入反应混合物,同时T<10℃。在T<15℃将反应混合物搅拌1hr并监测1-(三苯甲基氧基)丁-3-烯-2-醇的消耗(目标>99%)。向反应混合物加入2-甲氧基-2-甲基丙烷(146mL)和水(146mL),同时T<20℃。将有机物用18%NaCl水溶液(73mL)和NH4Cl饱和水溶液(21mL)洗涤。将有机物滤过硅藻土(10.4g)以除去颗粒并用2-甲氧基-2-甲基丙烷(83mL)冲洗。在真空下在T<30℃蒸发溶剂以经静置得到白色固体14(55.0g,98.7%收率,是残余溶剂的缘故)。
1-吗啉代-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮:
1H NMR(500MHz,CDCl3)δ7.46-7.41(m,6H),7.32-7.25(m,6H),7.25-7.18(m,3H),5.79-5.68(m,1H),5.28(d,J=17.0Hz,1H),5.26(d,J=10.1Hz,1H),4.20(d,J=12.7Hz,1H),4.10(d,J=12.7Hz,1H),3.97-3.88(m,1H),3.69-3.47(m,8H),3.25(dd,J=9.9,6.5Hz,1H),3.17(dd,J=9.9,4.3Hz,1H);13C NMR(125MHz,CDCl3)δ167.84,143.84,134.84,128.67,127.78,127.04,119.06,86.73,81.07,68.78,66.78,66.34,45.94,42.16.
1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮.在氮气下将异丙基氯化镁-LiCl复合物(1.30M于THF中,155.0mL,0.0715mol)冷却至0-5℃并加入2,3-二氟溴苯(13.8g,0.0715mol,1.50当量)同时T<10℃。在0-5℃1h后,加入1-吗啉代-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮14(21.8g,0.048mol,1.0当量)在THF(2.0vols)中的溶液,同时T<10℃。将反应混合物搅拌2.5小时并监测1-吗啉代-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮的消耗(目标>97%)。将反应混合物通过加入冷的NH4Cl饱和水溶液(110mL)和水(33mL)猝灭同时T<20℃。加入2-甲氧基-2-甲基丙烷(218mL)并分层。将有机物用NH4Cl饱和水溶液(65mL)和18%NaCl水溶液(44mL.)洗涤。将有机物在T<25℃真空下浓缩至浅黄色油状酮15(21.6g)。
1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮:
1H NMR(500MHz,CDCl3)δ7.70-7.64(m,1H),7.47-7.42(m,6H),7.37-7.30(m,1H),7.30-7.25(m,6H),7.24-7.19(m,3H),7.19-7.13(m,1H),5.84-5.71(m,1H),5.30(d,J=17.3Hz,1H),5.25(d,J=10.4Hz,1H),4.78(dd,J=17.7,3.1Hz,1H),4.70(dd,J=17.7,3.1Hz,lH),4.03(dd,J=11.8,6.5Hz,1H),3.35(dd,J=9.8,6.4Hz,1H),3.18(dd,J=9.8,4.6Hz,1H);13C NMR(125MHz,CDCl3)δ194.15(dd,JCF=4.9,2.4Hz),150.77(dd,JCF=250.3,14.1Hz),150.29(dd,JCF=256.4,13.9Hz),143.98,135.34,128.75,127.76,126.95,125.70(d,JCF=12.0Hz),125.16(d,JCF=3.5Hz),124.55(dd,JCF=6.4,4.2Hz),121.62(d,JCF=17.6Hz),118.83,86.78,81.35,74.98(d,JCF=9.5Hz),66.71.
1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮肟.在环境温度下向1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮15(21.1g,0.0435mol,1.0当量)在MeOH(106mL)中的溶液加入NaOAc(5.36g,0.0653mol,1.50当量)。5min.之后,以几部分加入NH2OH HCl(3.33g,0.048mol,1.10当量)。将悬浮液升温至35℃并搅拌1小时。将反应混合物冷却至17.8℃并搅拌15分钟,然后过滤并用乙酸乙酯(84mL)冲洗。在真空(T<30℃)下浓缩滤液。向所得残余物加入2-甲氧基-2-甲基丙烷(169mL)和水(21.1mL)。将有机物用NaHCO3饱和水溶液(53mL)和18%NaCl水溶液(21mL)洗涤。在真空下浓缩有机物以得到油状标题化合物16(21.0g)。
1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮肟:
1H NMR(500MHz,CDCl3)δ7.42-7.32(m,6H),7.30-7.15(m,10H),7.16-7.06(m,1H),7.03-6.95(m,1H),5.72-5.58(m,1H),5.24-5.13(m,2H),4.80(d,J=14.6Hz,1H),4.73(d,J=14.6Hz,1H),4.45(d,J=12.4Hz,0.3H),4.35(d,J=12,4Hz,0.3H),3.99-3.91(m,0.3H),3.91-3.83(m,1H),3.20(dd,J=9.9,6.8Hz,0.3II),3.09(dd,J=9.8,6.6Hz,1H),3.02(dd,J-9.9,4.2Hz,0.3H),2.95(dd,J=9.8,4.0Hz,1H);13C NMR(125MHz,CDCl3)δ155.40,150.59(dd,JCF=248.1,13.0Hz),148.86(dd,JCF=252.6,13.5Hz),143.96,135.10,128.73,128.69,127.72,127.68,126.92,126.85,124.96,124.56(d,JCF=10.6Hz),124.03-123.86(m),118.64(d,JCF=15.1Hz),117.92(d,JCF=17.2Hz),86.66,86.50,81.30,80.32,69.20,66.54,66.48,62.57.
6a-(2,3-二氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑.向1-(2,3-二氟苯基)-2-(1-(三苯甲基氧基)丁-3-烯-2-基氧基)乙酮肟16(20.0g,0.0400mol,1.0当量)在甲苯(140mL)中的溶液加入氢醌(0.0882g,0.008mol,0.2当量)。将反应混合物加热至回流(110-115℃)并保持13小时。将反应混合物冷却至20-25℃并然后在真空(T<45℃)下浓缩。将溶剂用2-丙醇(100mL)逐出。向粗的残余物加入异丙醇(140mL)并将混合物加热至65-70℃直到形成澄清溶液。以10℃/hr将溶液冷却至0℃并且然后保持1小时。将所得悬浮液过滤并将固体用冷的2-丙醇(40.0)冲洗。干燥后获得粉末状标题化合物17(13.2g)。
6a-(2,3-二氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑:
1H NMR(500MHz,DMSO)δ7.42-7.33(m,8H),7.31(t,J=7.6Hz,6H),7.28-7.21(m,3H),7.20-7.12(m,1H),6.39(s,1H),4.13(d,J=.8.2Hz,1H),4.03(s,1H),3.97(s,1H),3.89(d,J=9.2IIz,1H),3.81-3.70(m,1H),3.36-3.29(m,1H),3.26(dd,J=10.1,6.0Hz,1H),3.15(dd,J=10.0,3.5Hz,1H);13C NMR(125MHz,DMSO)δ150.74(dd,JCF=246.4,14.4Hz),148.66(dd,JCF=248.3,13.5Hz),144.09,130.58,128.67,128.32,127.48,124.75,124.45,117.18(d,JCF=17.0Hz),86.57,84.91,78.16,76.81,64.82,56.46.
实施例4:6a-(2-氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑的制备
6a-(2-氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑.向反应器装入1-(2-氟苯基)-2-((1-(三苯甲基氧基)丁-3-烯-2-基)氧基)乙酮(61.2g,1.0当量)、甲苯(428mL)和乙酸钠(16.1g,1.5当量)。完成加入之后,将反应混合物在环境温度下搅拌5分钟。加入羟基胺盐酸盐(10.0g,1.1当量)并将悬浮液加热至111℃。在111℃搅拌>20小时后,允许反应混合物冷却至环境温度,并将悬浮液过滤并将固体用甲苯(245mL)冲洗并然后用THF(10体积)冲洗。在减压下将滤液浓缩(浴温≤40℃)并用2-丙醇(275mL)逐出。将2-丙醇(428mL)加到固体中并将悬浮液加热至83℃。在83℃搅拌1小时后,允许混合物冷却到环境温度。将浆液经1小时期间冷却至0℃并在0℃下搅拌1小时。将悬浮液过滤并将固体分两部分用冷的2-丙醇(490mL)冲洗以得到固体状6a-(2-氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑(42.3g)。
1H NMR(400MHz,CDCl3)δ7.62(t,1H),7.41(d,J=7.2Hz,6H),7.31-7.21(m,10H),7.12(m,1H),7.03(dd,J=12.0,8.0Hz,1H),4.29-4.04(m,3H),3.91(dd,J=8.8,1.2Hz,1H),3.88(m,1H),3.42(dd,J=9.2,6.8Hz,1H),3.29(m,1H),3.22(dd,J=10.0,4.8Hz,1H).
B.式II的四氢呋喃的制备
4-氨基-4-(2-氟苯基)-2-(三氟甲基)四氢呋喃-3-基)甲醇.将锌(389.2g,5.95mol)放入反应容器中,并加入水(893mL)。加入乙酸同时维持温度低于10℃。15分钟后,作为在THF(665mL)中的溶液加入6a-(2-氟苯基)-4-((三氟甲基)六氢呋喃并[3,4-c]异噁唑5(550.0g,1.98mol)。反应混合物在rt下搅拌16小时。加入二氯甲烷(1.89L),随后加入28%NH4OH水溶液(552mL),同时使温度维持在低于30℃。将混合物搅拌30分钟,然后滤过硅藻土(80g),用二氯甲烷(378mL)冲洗。水层用二氯甲烷(1.89L)萃取。合并有机物,用饱和NaCl水溶液(1.0L)洗涤并且在真空下浓缩以提供氨基醇18(502g,90.6%)。粗制的残留物不经附加的纯化在下一步骤中使用。
HRMS计算C12H13F4NO2[M+H]+280.0961;实测280.0972.
4-氨基-4-(2-氟苯基)-2-甲基四氢呋喃-3-基)甲醇.向反应器装入四氢异噁唑10(1.0Wt,1.0当量)和冰乙酸(4.1Wt,6.0V)。将混合物在20℃搅拌并且以3部分逐渐地加入锌粉(1.17Wt,4.0当量),保持反应温度低于60℃。一旦放热减退,将混合物在40℃搅拌2h并且然后监测四氢异噁唑10的完全消耗(>99%转化)。将混合物过滤以除去残余的锌。将反应器和固体用乙酸乙酯(4.5Wt,5V)冲洗。将滤液返回到反应器并在减压(T<40℃)下浓缩。加入甲苯(1.73wt,2.0V)并在减压下将混合物浓缩。加入甲苯(1.73wt,2.0V)并在减压下将混合物浓缩。加入二氯甲烷(6.81wt,5V)和水(5.0wt,5.0vol)。加入28%氢氧化铵直到pH到达8-9。将混合物搅拌15分钟,然后允许相分离并将较低的有机层除去。加入二氯甲烷(5.4wt,4.0V)。将混合物搅拌15分钟然后分相。将有机相合并然后用25%氯化钠水溶液(2.0Wt,2.0V)洗涤。在减压下浓缩有机相(T<40℃)。如为使产物澄清所需,加入无水THF(2.0Wt),并将溶液过滤以除去颗粒,用另外的无水THF冲洗。将THF溶液返回到反应器并在减压下浓缩以得到油状氨基醇19(0.93Wt,94.0%)。
4-氨基-4-(2-氟苯基)-2-甲基四氢呋喃-3-基)甲醇:
1H NMR(500MHz,DMSO)δ7.63(td,J=8.6,1.7Hz,1H),7.32-7.24(m,1H),7.20-7.08(m,2H),4.43(s,1H),4.07(dd,J=8.7,1.3Hz,1H),4.02(dq,J=8.5,6.1Hz,1H),3.68-3.57(m,2H),3.55-3.46(m,1H),2.23(dd,J=14.4,6.7Hz,1H),1.24(d,J=6.1Hz,3II);13C NMR(125MHz,DMSO)δ160.69(d,JCF=244.7Hz),133.57(d,JCF=11.3Hz),128.95(d,JCF=8.8Hz),128.81(d,JCF=4.8Hz),124.33(d,JCF=3.2Hz),116.32(d,JCF=23.5Hz),79.58(d,JCF=4.9Hz),78.52,63.99(d,JCF=3.5Hz),59.39,56.91(d,JCF=2.2Hz),21.37.
4-氨基-4-(2,3-二氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇.向6a-(2,3-二氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑17(87.5g,0.175mol,1.0当量)中加入乙酸(385mL)。将悬浮液冷却至15℃,并经2-3min以小部分加入锌(88.4g,1.35mol,7.71当量)。允许反应经3-4小时升温至18℃并搅拌9h。将反应滤过硅藻土(40g)并用甲苯(210mL)冲洗。将收集的滤液在减压下浓缩,其中浴温低于35℃并用三部分的甲苯(3x 130mL)逐出。将所得油状物溶解在CH2Cl2(320mL)中。加入水(195mL),随后加入28%NH4OH(43.4mL)。将有机层分离并将剩余的水相用CH2Cl2(130mL)萃取。将合并的有机相用27%NaCl水溶液(87.5mL)洗涤。将溶液在减压下浓缩,溶解在THF(270mL)中并滤过硅藻土。将固体用THF(130mL)冲洗并将合并的滤液在真空下浓缩以产生泡沫状标题化合物20(69.1g)。
4-氨基-4-(2,3-二氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇:
1H NMR(500MHz,DMSO)δ7.47(t,J=7.5Hz,1H),7.41(d,J=7.5Hz,6H),7.34-7.27(m,7H),7.28-7.21(m,3H),7.19-7.10(m,1H),4.14(d,J=8.7Hz,1H),4.15-4.09(m,1H),3.77(dd,J=8.6,2.6Hz,1H),3.59(dd,J=11.1,6.4Hz,1H),3.46(dd,J=11.1,6.6Hz,1H),3.18(dd,J=9.9,3.0Hz,1H),3.07(dd,J=9.9,5.8Hz,1H),2.62(dd,J=14.6,6.6Hz,1H);13C NMR(125MHz,DMSO)δ150.68(dd,JCF=244.4,13.9Hz),148.46(dd,JCF=246.7,13.0Hz),144.36,135.44(d,JCF=8.1Hz),128.76,128.23,127.37,124.31,124.23,116.12(d,JCF=17.1Hz),86.29,81.48,78.92(d,JCF=4.3Hz),66.03,63.93,59.49,51.27
HRMS计算C31H29F2NO3[M+Na]+524.2013;实测524.2039。
制备式II化合物的可选过程
4-氨基-4-(2-氟苯基)-2-甲基四氢呋喃-3-基)甲醇(19)
向反应器装入酮8(1.0Wt,1.0当量)和水(10Wt,10V),加入羟基胺盐酸盐(0.350Wt,1.05当量)和乙酸钠(0.433Wt,1.10当量)。将所得混合物搅拌并升温至101-102℃持续至少40h并监测向四氢噁唑10的完全转化(>95%)。将混合物冷却到25℃以下并且然后装入THF(1.8wt,2.0V)和乙酸(0.86Wt,0.82V,3.0当量)。加入锌粉(0.942Wt,3.00当量)同时维持内部温度低于45℃。将所得混合物在35-45℃搅拌1h并关于向氨基醇19的完全转化(>99%)监测反应。将混合物冷却到20℃以下并加入二氯甲烷(2.6Wt,2.0V)。加入氢氧化铵水溶液(28%;1.3wt,1.5V,2.2当量)直到pH达到10-12。将所得混合物搅拌15分钟并入然后将固体过滤,用二氯甲烷(4.6Wt,3.5V)冲洗。允许滤液层分开之后,留出较低的有机层。将上面水层用二氯甲烷萃取两次(2.6wt,2.0V每次)。将合并的有机层在减压下浓缩(夹套T<45℃)以得到氨基醇19(0.88wt,81%)。
C.式II四氢呋喃的非对映体拆分
((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-(三氟甲基)四氢呋喃-3-基)甲醇(2S,3S)-2,3-双(苯甲酰基氧基)琥珀酸酯.向4-氨基-4-(2-氟苯基)-2-(三氟甲基)四氢呋喃-3-基)甲醇18(0.502kg,1.798mol)在乙醇(4.865L)中的溶液加入二苯甲酰基-D-酒石酸(0.642kg,1.798mol)。将所得悬浮液加热至67℃。经15min加入水(94.0mL,5.2mol)同时维持温度>66℃。将所得溶液冷却至45℃同时发生沉淀。将浆液再加热至60℃,并且然后以5℃/小时冷却至环境温度。将浆液过滤,并将固体用乙醇(950mL)和水(20mL)的预混合并冷却的溶液冲洗。将固体氨基醇二苯甲酰基酒石酸盐21在真空下干燥至恒重(370g,97.6%ee)。
((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-(三氟甲基)四氢呋喃-3-基)甲醇(2S,3S)-2,3-双(苯甲酰基氧基)琥珀酸酯:
1H NMR(500MHz,CD3OD)δ8.13(d,J=7.2Hz,4H),7.66-7.58(m,3H),7.54-7.45(m,5H),7.36-7.20(m,2H),5.92(s,2H),4.79-4.66(m,1H),4,40-4.28(m,1H),4.04(dd,J=12.1,3.4Hz,1H),3.92(dd,J=12.1,5.4Hz,1H),3.30-3.24(m,1H);13C NMR(125MHz,DMSO)δ169.61,165.81,160.23(d,J=246.1Hz),133.00,131.34(d,J=9.1Hz),129.65,129.55,128.08,127.97(d,J=3.5Hz),124.95(d,J=3.3Hz),116.56(d,J=23.5Hz),77.48(q,JCF=31.0Hz),76.33,73.20,65.61(d,J=3.1Hz),57.11.
HRMS计算C12H13F4NO2[M+H]+280.0961;实测280.0967(对于氨基醇)。
通过与从对映体富集的(S)-2-(三氟甲基)环氧乙烷开始制备的样品比较,指定氨基醇21的绝对立体化学。
手性HPLC参数:
装置、试剂和流动相:
装置:
试剂:
流动相:
向适合的烧瓶加入70mL 2-丙醇和930mL庚烷(分别用100mL和1000-mL有刻度的量筒测定)和1.0mL三乙胺(用测体积用玻璃移液管测定)并混合。在使用过程中线内脱气。
稀释溶液:2-丙醇
HPLC参数:
分析物和杂质的保留时间:
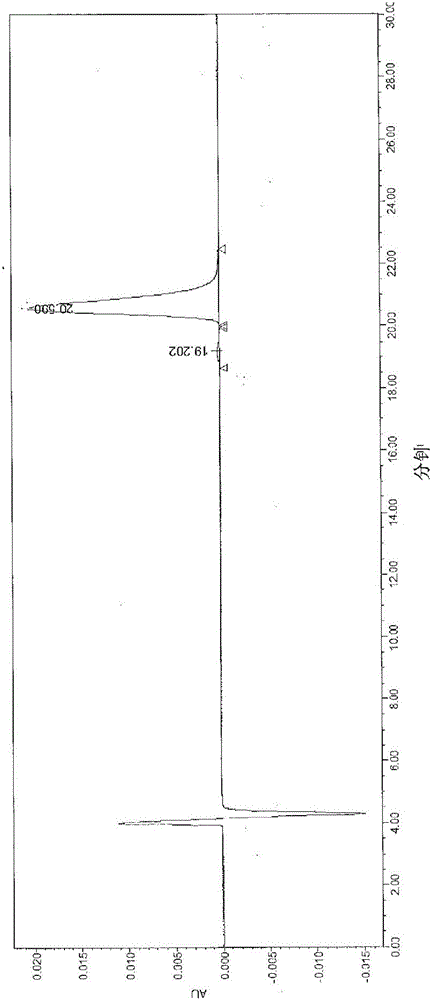
典型色谱图呈现在图1A中。
((2R,3R,4S)-4-氨基-4-(2-氟苯基)-2-甲基四氢呋喃-3-基)甲醇(2S,3S)-2,3-双(苯甲酰基氧基)琥珀酸酯.向反应器装入氨基醇19(1.0Wt,1.0当量)和乙醇(5.5Wt,7.0V)。将混合物加热至内部温度65-70℃。经30-60分钟向混合物加入二苯甲酰基-D-酒石酸(1.0当量,1.59wt)在乙醇(1.97Wt,2.50V)和水(0.25Wt,0.25V)中的溶液,同时维持内部温度高于60℃。将含有二苯甲酰基酒石酸的容器用最小量乙醇冲洗。然后将混合物以3℃/小时的速率冷却至40℃。结晶之后将混合物冷却至10℃(以10℃/小时)并在10℃搅拌至少2小时。然后将晶体过滤并用预冷却的乙醇(1.4Wt,1.8V)冲洗并在真空下干燥以得到固体状氨基醇二苯甲酰基酒石酸盐22(0.86Wt,33.0%)。
((2R,3R,4S)-4-氨基-4-(2-氟苯基)-2-甲基四氢呋喃-3-基)甲醇(2S,3S)-2,3-双(苯甲酰基氧基)琥珀酸酯:
1H NMR(500MHz,CD3OD)δ8.14-8.10(m,4H),7.60(t,J=7.4Hz,2H),7.55(td,J=8.1,1.3Hz,1H),7.47(t,J=7.8Hz,4H),7.46-7.42(m,1H),7.30-7.19(m,2H),5.90(s,2H),4.39-4.26(m,2H),4.15(dd,J=10.4,2.4Hz,1H),3.90(ddd,J=28.3,11.9,5.0Hz,2H),2.52(dt,J=8.4,5.0Hz,1H),1.31(d,J=6.1Hz,3H);13C NMR(126MHz,CD3OD)δ169.96,165.90,160.35(d,J=245.9Hz),132.95,131.05(d,JCF=9.1Hz),129.75,129.57,128.06,127.57(d,JCF=3.5Hz),124.82(d,JCF=3.2Hz),124.24(d,JCF=11.5Hz),116.45(d,JCF=23.1Hz),76.34,74.32(d,JCF=5.4Hz),73.50,65.60(d,JCF=2.8Hz),57.43,54.88,19.00.
(2S,3R,4S)-4-氨基-4-(2,3-二氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇(-)二苯甲酰基-L-酒石酸.将消旋的混合物6a-(2,3-二氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑20(69.1g,0.138mol,1.0当量)和(-)-二苯甲酰基-L-酒石酸(49.4g,0.138mol,1.0当量)溶解在丙酮(346mL)中。然后经15min将混合物加热至61.9℃。加入甲苯(415mL)。然后允许溶液冷却至室温。然后将反应混合物冷却至-5℃并在这一温度下搅拌另外的一小时。将悬浮液过滤并用甲苯/丙酮(V/V 6/5,138mL,冷却至0℃)溶液洗涤。在减压下将固体干燥,并分离标题化合物23(44.5g)。
(2S,3R,4S)-4-氨基-4-(2,3-二氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇(-)二苯甲酰基-L-酒石酸:
1H NMR(500MHz,DMSO)δ8.00-7.95(m,4H),7.66(t,J=7.4Hz,2H),7.53(t,J=7.8Hz,4H),7.47-7.39(m,2H),7.40-7.35(m,6H),7.35-7.28(m,6H),7.28-7.23(m,3H),7.23-7.15(m,1H),5.75(s,1H),4.19(d,J=9.5Hz,2H),4.02(dd,J=9.5,2.1Hz,1H),3.61(dd,J=11.4,6.4Hz,1H),3.52(dd,J=11.4,6.2Hz,1H),3.21-3.14(m,1H),3.12-3.05(m,1H),2.77(dd,J=14.3,6.4Hz,1H);13C NMR(125MHz,DMSO)δ168.07,165.23,150.68(dd,JCF=245.2,13.4Hz),148.27(dd,JCF=248.0,13.6Hz),144.18,134.09,129.75,129.60,129.24,128.70,128.28,127.45,124.88,124.20,117.40(d,JCF=16.8Hz),86.40,80.73,76.73,72.22,65.42,64.58,58.63,50.51.
HRMS计算C31H29F2NO3[M+Na]+524.2013;实测524.2047.
手性HPLC参数:
装置、试剂和流动相:
装置:
试剂:
流动相:
向适合的烧瓶加入100mL 2-丙醇和900mL庚烷(分别用100mL和1000-mL有刻度的量筒测定)以及0.5mL三乙胺(用测体积用玻璃移液管测定)并混合。在使用过程中线内脱气。
稀释溶液:2-丙醇
HPLC参数:
分析物和杂质的保留时间:
典型色谱法呈现在图1B中。
D.式III的氨基硫代甲酰基(Carbamothioyl)苯甲酰胺的合成
N-((3S,4R,5S)-3-(2-氟苯基)-4-(羟甲基)-5-(三氟甲基)-四氢呋喃-3-基氨基硫代甲酰基)苯甲酰胺.向手性盐21(0.361kg,0.556mol)加入乙酸乙酯(1.08L)并将悬浮液冷却至-3℃。经20分钟加入1.0N NaOH水溶液(1.30L)同时维持T<5℃。5分钟之后,经8分钟加入苯甲酰基异硫代氰酸酯(80.0mL,594mmol)同时维持T<5℃。1hr之后,加入乙酸乙酯(722mL)。除去水层,并将有机物用饱和NaHCO3水溶液(361mL)和饱和NaCl水溶液(361mL)洗涤。将有机物滤过硅藻土(90g)并用乙酸乙酯(360mL)冲洗。在真空下浓缩有机物以得到残余物,将残余物再溶解到CH2Cl2(1.1L)中并浓缩以得到黄色泡沫状标题化合物24(261g,99%收率,由于存在残余溶剂的缘故),其用于下一步骤。
N-((3S,4R,5S)-3-(2-氟苯基)-4-(羟甲基)-5-(三氟甲基)-四氢呋喃-3-基氨基硫代甲酰基)苯甲酰胺:
1H NMR(500MHz,DMSO)δ12.04(s,2H),11.20(s,2H),7.95(d,J=7.4Hz,2H),7.69-7.60(m,1H),7.56-7.42(m,2H),7.37-7.28(m,1H),7.24-7.12(m,2H).5.59(t,J=4.5Hz,1H),5.03(d,J=9.7Hz,1H),4.92(d,J=9.7Hz,1H),4.75-4.63(m,1H).3.92-3.74(m,2H),2.77-2.66(m,1H);13C NMR(125MHz,DMSO)δ179.98,167.85,159.75(d,JCF=245.0Hz).133.44,132.58,129.88,129.81,129.04,128.85,126.31(d,JCF=9.8Hz),124.36,116.83(d,JCF=23.4Hz),76.11(q,JCF=31.0Hz).74.37(d,JCF=6.1Hz),68.77(d,JCF=3.4Hz),57.03,52.23.
HRMS计算C20H18F4N2O3S[M+H]+441.0896;实测441.0818.
N-((3S,4R,5R)-3-(2-氟苯基)-4-(羟甲基)-5-甲基四氢呋喃-3-基氨基硫代甲酰基)苯甲酰胺.向反应器装入22(1Wt,1当量)和乙酸乙酯(2.7Wt,3.0V)。将混合物冷却至0至10℃。加入1.00M NaOH水溶液(4.2Wt,4.0V,2.3当量)。加入苯甲酰基异硫氰酸酯(0.314Wt,0.259V,1.10当量),伴随剧烈搅拌,同时维持T在0至10℃。完成加入之后,在0-5℃继续搅拌2h并监测22的完全消耗(目标>98%转化)。将反应混合物过滤并将滤饼用:1)水(2.0Wt,2.0V);2)庚烷(0.91Wt,1.3V)和乙酸乙酯(1.2Wt,1.3V)的混合物冲洗。在减压下干燥固体(T<40℃)以得到25(0.57Wt,85.4%收率)。
N-((3S,4R,5R)-3-(2-氟苯基)-4-(羟甲基)-5-甲基四氢呋喃-3-基氨基硫代甲酰基)苯甲酰胺:
1H NMR(500MHz,CDCl3)δ11.78(s,1H),8.88(s,1H),7.88-7.82(m,2H),7.67(td,J=8.1,1.6Hz,1H),7.65-7.59(m,1H),7.50(dd,J=10.8,4.8Hz,2H),7.30-7.23(m,1H),7.15(td,J=7.8,1.2Hz,1H),7,01(ddd,J=12.3,8.2,1.1Hz,1H),4.73(d,J=10.1Hz,1H),4.42(dd,J=10.1,1.7Hz,1H),4.10-4.03(m,1H),4.03-3.91(m,2H),2.80(t,J=5.3Hz,1H),2.63-2.52(m,1H),1.35(d,J=6.1Hz,3H);13C NMR(125MHz,CDC13)δ179.42,166.60,160.35(d,JCF=247.4Hz),133.60,131.81,129.27(d,JCF=8.9Hz),129.20(d,JCF=3.7Hz),129.15,127.55,127.39(d,JCF=10.0Hz),123.96(d,JCF=3.3Hz),116.18(d,JCF=23.0Hz),76.90(d,JCF=2.8Hz),76.27,69.26,59.49,58.03,20.04.
N-(((3S,4R,5S)-3-(2,3-二氟苯基)-4-(羟甲基)-5-((三苯甲基氧基)甲基)四氢呋喃-3-基)氨基硫代甲酰基)苯甲酰胺.将手性盐23(44.21g,0.051mol,1.0当量)在乙酸乙酯(133mL)中的悬浮液冷却至1.7℃。加入NaOH水溶液(1.0M,121mL,0.12mol,2.4当量)同时维持温度低于5℃。将反应搅拌5min然后经5min加入异硫氰酸苯甲基酯(9.43g,0.058mol,1.12当量)。1.5h之后,加入乙酸乙酯(133mL)。将有机相分离并连续用饱和的NaHCO3水溶液(130mL)和18%NaCl水溶液(44mL)洗涤。将合并的水相用EtOAc(66mL)和CH2Cl2(30mL)萃取。合并所有有机相,过滤并在减压下浓缩。在用CH2Cl2(88mL)逐出残余溶剂后作为泡沫分离标题化合物26(34.2g)。
N-(((3S,4R,5S)-3-(2,3-二氟苯基)-4-(羟甲基)-5-((三苯甲基氧基)甲基)四氢呋喃-3-基)氨基硫代甲酰基)苯甲酰胺:
1H NMR(500MHz,DMSO)δ11.97(br s,1H),11.20(br s,1H),7.94(d,J=7.4Hz,2H),7.63(t,J=7.4Hz,1H),7.51(t,J=7.8Hz,2H),7.38-7.21(m,17H),7.13(dd,J=13.4,7.9Hz,1H),5.13(t,J=4.4Hz,1H),5.07(d,J=9.7Hz,1H),4.47(d,J=9.8Hz,1H),4.24-4.16(m,1H),3.68(t,J=4.6Hz,2H),3.19(dd,J=10.1,2.9Hz,1H),3.01(dd,J=10.1,4.8Hz,1H),2.63-2.52(m,1H);13C NMR(125MHz,DMSO)5180.06,168.14,150.75(dd,JCF=244.6,13.2Hz),147.93(dd,JCF=247.5,13.5Hz),144.15,133.46,132.55.131.90(d,JCF=6.4Hz),129.04,128.86,128.67,128.28,127.43,124.41,124.25,116.12(d,JCF=17.0Hz),86.27,79.75,75.03,68.04,64.63,58.16,53.35.
HRMS计算C39H34F2N2O4S[M+H]+663.2129;实测663.2200.
((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇(2R,3R)-2,3-双(苯甲酰基氧基)琥珀酸酯.向反应器装入锌粉(<10微米,3.39g 5.0当量)、6a-(2-氟苯基)-4-((三苯甲基氧基)甲基)六氢呋喃并[3,4-c]异噁唑(5.0g,1.0当量)和THF(30.0mL)。向搅拌的悬浮液加入乙酸(2.97mL,5.0当量)。加入之后,将反应温度维持在20-30℃持续1小时。然后将反应混合物升温至35-40℃并维持该温度同时监测原料的消耗。完成后,将反应混合物冷却至20-25℃并加入28%NH4OH水溶液(12.5mL)同时维持温度<40℃。将悬浮液冷却至20-25℃并滤过硅藻土(0.5Wts)。将固体用MTBE(35.0mL)冲洗。将滤液转移至分液漏斗中。除去水层,将有机层用水(10.0mL)洗涤。在真空下浓缩有机物(浴温<40℃)以得到泡沫状消旋的氨基醇(95-105%粗制收率)。向消旋的氨基醇加入(-)-二苯甲酰基-L-酒石酸(3.74g,1.0当量)。向该混合物加入水(0.76mL,4.0当量),然后丙酮(25.3mL)。将混合物加热至56-60℃并且然后加入甲苯(30.3mL)同时维持温度高于50℃。完全加入之后,将温度保持在56-60℃持续至少30分钟并且然后以10℃/小时冷却至17-22℃。将悬浮液在17-22℃搅拌至少二小时。将固体过滤并以两部分用甲苯/丙酮溶液洗涤(6/5V/V,4.0体积)。在减压下干燥固体得到白色粉末状((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇(2R,3R)-2,3-双(苯甲酰基氧基)琥珀酸酯(3.4g38%收率)。典型ee%96-97%.
1H NMR(400MHz,d6-DMSO)δ7.92(d,J=7.6Hz,4H),7.61-7.54(m,2H),7.46(t,J=7.6Hz,4H),7.33-7.09(m,19H),5.66(s,2H),4.20(s,1H),4.12(d,J=9.6Hz,1H),4.07(d,J=9.6Hz,1H),3.57(dd,J=11.2,6.0,1H),3.48(dd,J=10.8,6.4,1H),3.12(d,J=8.0Hz,1H),3.03(dd,J=10.0,5.2Hz,1H),2.77(app q,J=7.2Hz,1H).
对映体过量评估的分析方法:
HPLC参数:
流动相:将120mL 2-丙醇和880mL庚烷(分别用100mL和1000-mL有刻度的量筒测量)和0.5mL三乙胺(用测体积用玻璃移液管测定)加到适合的烧瓶并混合。在使用中线内脱气。
分析物和杂质的保留时间:
获得((2S,3R,4S)-4-氨基-4-(2-氟苯基)-2-((三苯甲基氧基)甲基)四氢呋喃-3-基)甲醇(2R,3R)-2,3-双(苯甲酰基氧基)琥珀酸酯的X射线晶体结构并显示在图2中。
E.式IV噻唑基苯甲酰胺的合成
N-((4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺.将N-((3S,4R,5S)-3-(2-氟苯基)-4-(羟甲基)-5-(三氟甲基)-四氢呋喃-3-基氨基硫代甲酰基)苯甲酰胺24(258.3g,583.8mmol)在CH2Cl2(1.55L)中的溶液冷却至-19.4℃。加入吡啶(118mL,1.46mol)同时维持温度在-20℃,并且然后将反应混合物冷却至-24℃。在另一氮气吹扫的容器中,加入CH2Cl2(258mL)随后加入三氟甲磺酸酐(108.0mL,642.2mmol)。经30min将所得溶液加到反应混合物,同时维持温度低于-19.7℃。完成加入之后,在-20℃至-15℃将反应混合物搅拌30min,并且然后经20min升温至-11℃。加入NH4Cl饱和水溶液(646mL)和水(390mL)。将混合物升温至环境温度并将水层除去。将有机物用预混合的NH4Cl饱和水溶液(646mL)和水(390mL)洗涤。合并水层,并用CH2Cl2(520mL)萃取一次。将有机物合并,并在真空下浓缩以得到浅橙色泡沫状27(250g,100%)。将残余物不经纯化用于下一阶段。
N-((4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺:
1H NMR(500MHz,CDCl3)δ8.03(d,J=6.7Hz,2H),7.52(t,J=7.0Hz,1H),7.48-7.31(m,4H),7.20(t,J=7.4Hz,1H),7.12(dd,J=12.0,8.4Hz,1H),4.82-4.73(m,1H),4.60(d,J=8.9Hz,1H),4.03(d,J=8.3Hz,1H),3.57(d,J=2.7Hz,1H),3.20(d,J=13.6Hz,1H),2.81(dd,J-13.8,2.5Hz,1H);13C NMR(125MHz,CDCl3)δ171.50,159.57(d,JCF=247.2Hz),134.62,132.49,130.65(d,JCFJ=8.8Hz),129.77,128.51,128.45,125.14(q,JCF=281.8Hz),124.97(d,JCF=3.0Hz),124.66(d,JCF=10.3Hz),117.05(d,JCF=23.5Hz),66.81(d,JCF=5.2Hz),38.90,23.20.
HRMS计算C20H16F4N2O2S[M+H]+425.0947;实测425.0945.
N-((4aS,5R,7aS)-7a-(2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺.在18-22℃下向反应器装入25(1Wt,1当量)、二氯甲烷(8.0Wt,6.0V)和吡啶(0.509Wt,0.520V,2.50当量)。将混合物冷却至-20至-15℃。加入三氟甲基磺酸酐(0.807Wt,0.481V,1.10当量)在二氯甲烷(1.32Wt,1.00V)中的溶液同时维持T在-15至-5℃。完成加入之后,在-5至0℃继续搅拌0.5h并监测25的完全消耗(目标>97%转化)。加入氯化铵饱和水溶(2.67Wt,2.50V)和水(1.50Wt,1.50V)。将双相混合物在18-22℃剧烈搅拌并允许分开。保留有机层并将水层用二氯甲烷(4.7Wt,3.5V)萃取。将合并的有机层在减压下浓缩(T<40℃)以得到28(0.95Wt,假定100%理论)。
N-((4aS,5R,7aS)-7a-(2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺:
1H NMR(500MHz,CDCl3)δ8.11-8.07(m,2H),7.56-7.49(m,1H),7.49-7.33(m,4H),7.26-7.19(m,1H),7.18-7,11(m,1H),4.55(d,J=9.6H2,1H),4.55-4.46(m,1H),4.16(s,2H),4.06(dd,J=9.5,2.8Hz,1H),3.26(dd,J=13.7,3.7Hz,1H),2.93-2.87(m,1H),2.84(dd,J=13.7,3.8Hz,1H),1.42(d,J=6.1Hz,3H);13C NMR(126MHz,cdcl3)δ174.13,160.15(d,JCF=247.1Hz),148.20,135.46,132.50,130.58(d,JCF=8.9Hz),128.97,128.47,128.43(d,JCF=3.5Hz),126.94(d,JCF=10.7Hz),125.00(d,JCF=3.4Hz),117.17(d,JCF=23.1Hz),77.56(d,JCF=5.7Hz),76.60,66.88(d,JCF=4.4Hz),46.16(d,JCF=2.9Hz),23.36,19.67.
N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-((三苯甲基氧基)甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺.在-20℃向N-(((3S,4R,5S)-3-(2,3-二氟苯基)-4-(羟甲基)-5-((三苯甲基氧基)甲基)四氢呋喃-3-基)氨基硫代甲酰基)苯甲酰胺26(34.0g,0.0511mol,1.0当量)在CH2Cl2(204mL)中的溶液加入吡啶(10.3ml,0.128mol,2.50当量)。然后经12min加入三氟甲基磺酸酐(9.46mL,0.0563mol,1.10当量)在CH2Cl2(34mL)中的溶液同时维持温度低于-17℃。在-20℃将反应搅拌30min然后允许缓慢升温至5℃。加入NH4Cl饱和水溶液(85mL)和水(32mL)。然后将水层用CH2Cl2(68mL)萃取。将有机相在减压下浓缩得到橙色泡沫状标题化合物29(33.6g)。
HRMS计算C39H32F2N2O3S[M+H]+647.2180;实测647.2123.
N-(3-((4aS,5S,7aS)-2-氨基-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(二氟甲基)吡嗪-2-甲酰胺.将5-(二氟甲基)吡嗪-2-羧酸(30.0g,1.05当量)和(4aS,5S,7aS)-7a-(5-氨基-2-氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺(49.2g,1.00当量)加入反应器中并将EtOAc(443mL)加到混合物以得到悬浮液。在环境温度下加入(105g,1.10当量,50wt%在EtOAc中)(Archimica,Germany)溶液同时控制内部温度低于30℃。将反应混合物在40-45℃搅拌>3小时并通过HPLC监测。将反应混合物冷却至环境温度并加入水(98mL)。10-15分钟之后加入28%氢氧化铵(137mL)同时控制温度低于30℃。加入另外的EtOAc(172mL)并将反应混合物在环境温度下搅拌30分钟。分离水相并用EtOAc(246mL)萃回。将有机相合并并用15%NaCl水溶液(98mL)和水(98mL)洗涤。将有机层滤过硅藻土(0.5Wt)并在真空下浓缩以获得浅褐色固体(定量的粗制收率),其从1-丙醇结晶得到褐色固体状N-(3-((4aS,5S,7aS)-2-氨基-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(二氟甲基)吡嗪-2-甲酰胺(54.2g)。
1H NMR(500MHz,DMSO)δ=10.94(s,1H),9.38(d,J=0.9,1H),9.08(s,1H),7.93(dd,J=7.3,2.7,1H),7.90-7.85(m,1H),7.25(t,J=54.0,2H),7.18(dd,J=11.8,8.8,1H),6.04(s,2H),4.68-4.44(m,2H),4.40-4.30(m,1H),4.26(d,J=8.2,1H),3.79(dd,J=8.1,3.1,1H),3.30(s,1H),3.12(dd,J=13.5,3.6,1H),3.00(dd,J=13.5,3.8,1H),2.76(dt,J=7.9,3.7,1H).
13C NMR(126MHz,DMSO)δ160.90(s),156.22(d,J=244.2Hz),149.16(t,J=24.7Hz),148.46(s),146.91(s),143.69(s),140.35(t,J=4.4Hz),134.02(s),130.27(d,J=12.3Hz),122.46(d,J=4.2Hz),121.18(d,J=8.7Hz),116.26(d,J=25.0Hz),112.49(t,J=239.1Hz),83.53(d,J=169.8Hz),78.52(d,J=18.2Hz),77.55(s),65.61(s),35.59(s),22.93(s).
E.式V的氨基噻嗪的合成
(4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.向N-((4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺27(250.2g,589.5mmol)在甲醇(1.25L)中的溶液加入K2CO3(81.5g,590.0mmol)。将悬浮液加热至65℃持续6小时。冷却至环境温度之后,在真空下蒸发溶剂。向所得残余物加入1.0N NaOH水溶液(1.18L)和THF(502mL)。将多相的混合物加热至45℃持续1小时。将混合物冷却至环境温度,加入EtOAc(1.38L)。将水层用EtOAc(0.75L)萃取。将有机物合并,用NaHCO3饱和水溶液(500mL)和NaCl饱和水溶液(500mL)洗涤。将有机物在真空下浓缩以得到棕色油状标题化合物30(184.1g,91.6%收率,包含残余溶剂)。
(4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ7.49-7.42(m,1H),7.40-7.33(m,1H),7.26-7.15(m,2H),6.26(s,2H),4.77-4.54(m,1H),4.40(d,J=8.0Hz,1H).3.80(dd,J=7.9,2.3Hz,1H),3.24-3.17(m,1H),3.00(dd,J=13.9,3.2Hz,1H),2.85(dd,J=13.9,3.9Hz,1H);13C NMR(125MHz,DMSO)δ159.75(d,JCF=245.1Hz),149.51,131.31(d,JCF=3.9Hz),130.13(d,JCF=8.8Hz),128.08(d,JCF=10.4Hz),128.28(q,JCF=282.1Hz).124.87(d,JCF=3.0Hz),116.80(d,J=23.8Hz).78.77,76.80(q,JCF=30.8Hz),66.31,36.37,23.27.
HRMS计算C13H12F4N2O3S[M+H]+321.0685;实测321.0677.
(4aS,5R,7aS)-7a-(2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.向反应器装入28(1.0Wt,1.0当量)、碳酸钾(0.19Wt,0.50当量)和MeOH(4.0Wt,5.0V)。将反应混合物加热至60-65℃。在60-65℃下继续搅拌6h并关于28的完全消耗(目标>97%转化)监测反应。在减压下将反应混合物浓缩(T<40℃)以除去大部分的甲醇。加入水(1.5Wt,1.5V),随后加入庚烷(1.1Wt,1.6V)和乙酸乙酯(0.36Wt,0.40V)的混合物。将混合物冷却至0-5℃并剧烈搅拌1-2h。将混合物过滤并将反应器和滤饼用水(1.0Wt,1.0V)和预冷却的(0-5℃)的庚烷(0.89Wt,1.3V)和乙酸乙酯(0.29Wt,0.32V)的混合物冲洗。将固体在真空中干燥(T<40℃)以得到31(0.61Wt,85%,浅棕色固体)。
(4aS,5R,7aS)-7a-(2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,CDCl3)δ7.41(td,J=8.2,1.6Hz,1H),7.28-7.20(m,1H),7.15-7.09(m,1H),7.03(ddd,J=12.4,8.1,0.7Hz,1H),4.81-4.42(s,2H),4.61(dd,J=8.7,0.5Hz,1H),4.40-4.27(m,1H),3.80(dd,J=8.7,2.2Hz,1H),3.07(dd,J=13.3,3.9Hz,1H),2.70(dd,J=13.3,3.9Hz,1H),2.56-2.47(m,1H),1.34(d,J=6.1Hz,3II);13C NMR(125MHz,CDCl3)δ160.03(d,JCF=247.0Hz),149.41,130.73(d,JCF=10.0Hz),129.80(d,JCF=4.1Hz),128.83(d,JCF=8.7Hz),124.02(d,JCF=3.4Hz),116.38(d,JCF=23.5Hz),78.54(d,JCF=4.8Hz),76.43,66.97(d,JCF=4.6Hz),44.50(d,JCF=3.7Hz),23.70,19.83.
(4aS,5R,7aS)-7a-(2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺(31)的可选的合成
向反应器装入硫脲25(1Wt,1当量)、吡啶(2.9Wt,3.0V)和甲苯(2.6Wt,3.0V)。将所得混合物冷却到-15℃以下。加入三氟甲基磺酸酐(0.800Wt,0.476V,1.10当量)同时维持温度低于0℃。完成加入之后,在-5–0℃继续搅拌1.5h并关于完全转化(≥97.0%)监测反应。加入甲苯(5.2Wt,6.0V)和20wt%氯化铵水溶液(4.2Wt,4.0V)。将所得两相混合物升温至15–25℃,搅拌至少15min并且然后允许分开。将较低水层分离,并将上面的有机相除去并保存。将水层用甲苯(2.6Wt,3.0V)萃取。将合并的有机层用水(2.0Wt,2.0V)洗涤并在减压下浓缩以得到稠的棕色油状的粗制的28。加入2-丙醇(2.4Wt,3.0V)和3.0M氢氧化钠水溶液(3.5Wt,3.0V),并将所得反应混合物加热至80℃持续6h并关于完全转化(>99.0%)进行监测。然后加入庚烷(1.4Wt,2.0V)和水(10Wt,10V),同时保持内部温度高于60℃。将所得混合物冷却至0–5℃并在这一温度下维持至少2h,然后过滤。将反应器和滤饼用水(1.8Wt,1.8V)和2-丙醇(0.16Wt,0.20V)的混合物冲洗并且然后用庚烷(1.2Wt,1.8V)和乙酸乙酯(0.18Wt,0.20V)的混合物冲洗。将固体干燥以得到异硫脲31(0.57Wt,83%收率)。
N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(羟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺.将甲酸(116mL)加到N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-((三苯甲基氧基)甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺29(33.30g,0.051mol,1.0当量)中,将混合物在rt下搅拌25min。滴加水(17mL)然后将反应搅拌另外30min。将所得悬浮液过滤,将滤液在真空下通过与甲苯(360mL)共沸蒸馏来干燥。加入甲醇(110mL),随后加入三乙胺(22mL,0.15mol,3.0当量)并将溶液搅拌2小时。将溶剂在真空下除去并用甲苯(66mL)逐出。将残余的油溶解在CH2Cl2(250ml)中并连续用HCl水溶液(1M,100mL)、NaHCO3饱和水溶液(67mL)和18%NaCl水溶液(67mL)洗涤。将有机相在减压下浓缩。将甲苯(66mL)和THF(67mL)加到残余物然后将溶液滤过硅藻土并在减压下浓缩以得到标题化合物32(21g)。
1H NMR(500MHz,DMSO)δ8.11(dd,J=16.4,4.2Hz,2H),7.70-7.58(m,1H),7.57-7.44(m,3H),7.43-7.34(m,1H),7.34-7.26(m,1H),4.43(d,J=9.5Hz,1H),4.25-4.16(m,1H),4.10(d,J=9.2Hz,1H),3.59(d,J=4.5Hz,2H),3.30-3.21(m,1H),3.20-3.08(m,2H);13C NMR(125MHz,DMSO)δ169.08,150.95(dd,JCF=245.8,13.1Hz),148.22,148.09(dd,JCF=248.7,13.2Hz),133.46,129.11,128.99,128.62,125.43,124.70,118.16(d,JCF=16.9Hz),81.36,75.29,66.76,62.39,40.77,24.25.
HRMS计算C20H18F2N2O3S[M+H]+405.1084;实测405.1081.
N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺.在氮气气氛下将N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(羟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺32(21.0g,0.519mol,1.0当量)溶解在干燥的THF(105mL)中并将溶液在0℃冷却。加入N,N-二异丙基乙基胺(40.7mL,0.234mol,4.50当量)、三乙胺三氢氟化物(14.0mL,0.0857mol,1.65当量)和全氟丁烷磺酰基氟化物(22.4mL,0.125mol,2.40当量)同时维持温度低于5℃。在0℃将反应搅拌3小时然后缓慢升温至室温并搅拌11小时。向反应混合物加入饱和NH4Cl(100mL),随后加入2-甲氧基-2-甲基丙烷(100mL)。将有机相分离并用HCl水溶液(1.0M,100ml)洗涤,浓缩并再溶解在2-甲氧基-2-甲基丙烷(301ml)中。然后将有机相用HCl水溶液(1M,63mL)、饱和NaHCO3水溶液(100mL)洗涤。将最后的水层用2-甲氧基-2-甲基丙烷萃取。将合并的有机相用18%水溶液NaCl(63mL)洗涤并在减压下浓缩以得到泡沫状标题化合物33(19.40g)。
N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺:
1H NMR(500MHz,DMSO)δ8.02(s,2H),7.61-7.51(m,1H),7.51-7.38(m,3H),7.39-7.18(m,2H),4.72-4.49(m,2H),4.48-4.37(m,1H),4.41(d,J=9.1Hz,21H),3.04(s,2H);13C NMR(125MHz,DMSO)δ150.92(dd,JCF=245.5,13.3Hz),148.11(dd,JCF=248.2,13.4Hz),132.40,128.99,128.63,125.16,124.94,117.61,83.64(d,JCF=170.2Hz),79.51(d,JCF=18.4Hz),76.17,66.27,23.67.
HRMS计算C20H17F3N2O2S[M+H]+407.1041;实测407.1024.
(4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.在氮气下,将N-((4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-基)苯甲酰胺33(19.40g,0.048mol,1.0当量)溶解在甲醇(97mL)中。加入1,8-二氮杂双环[5.4.0]十一-7-烯(8.92mL,0.060mol,1.25当量),并且将溶液加热至55-60℃。在8h之后,在减压下浓缩反应混合物,并将残余物通过硅胶快速柱色谱法纯化(5%至100%EtOAc在庚烷中)以得到标题化合物34(9.01g)。
(4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ7.38-7.28(m,1H),7.26-7.14(m,2H),6.12(s,2H),4.66-4.41(m,2H),4.37-4.27(m,2H),4.29(d,J=8.2Hz,1H),3.74(dd,J=8.2,2.6Hz,1H),3.30(s,1H),3.06-2.90(m,2H),2.79-2.71(m,1H);13C NMR(125MHz,DMSO)δ150.84(dd,J=244.8,14.0Hz),149.71,148.07(dd,JCF=247.8,13.4Hz),133.08(d,JCF=7.7Hz),125.24,124.55(dd,JCF=7.2,4.3Hz),116.58(d,JCF=17.2Hz),83.91·(d,JCF=170.0Hz),79.12(d,JCF=18.2Hz),77.96(d,JCF=4.9Hz),66.22,36.41(d,JCF=3.3Hz),23.40.
HRMS计算C13H13F3N2OS[M+H]+303.0779;实测303.0767.
G.式VI的硝基苯基噻嗪的合成
(4aS,5S,7aS)-7a-(2-氟-5-硝基苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺盐酸盐.向包含(4aS,5S,7aS)-7a-(2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺30(184.1g,574.8mmol)的冷却的容器中分几部分加入三氟乙酸(0.954kg)同时将温度维持在低于20℃。将混合物冷却至3.5℃并经20min加入硫酸(146mL,2.73mol)同时维持温度低于5℃。经30min加入发烟硝酸(39.8mL,0.948mol),同时将温度维持在低于10℃。在0-10℃1.5h后,将反应混合物通过转移到冷却至5℃的NaOH(575g,14.4mol)在水(4.6L)中的水溶液来缓慢地猝灭。在21℃将所得悬浮液搅拌1h。然后将悬浮液过滤并将固体用冷水(920mL)冲洗。将固体在真空下干燥直到恒重,然后溶解到乙醇(1.05L)中。将溶液加热至35℃,并加入浓HCl(55.6mL,0.690mol)同时维持温度低于40℃。然后将悬浮液冷却至-5℃,保持1hr并过滤。将固体用冷乙醇(420mL)冲洗并干燥至恒重以获得标题化合物35(185.0g,87.3%)。
(4aS,5S,7aS)-7a-(2-氟-5-硝基苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺盐酸盐:
1H NMR(500MHz,DMSO)δ11.80(s,2H),8.45-8.36(m,1H),8.31(dd,J=6.6,2.5Hz,1H),7.66(dd,J=11.1,9.3Hz,1H),4.96-4.72(m,1H),4.58(d,J=10.0Hz,1H),4.27(d,J=9.9Hz,1H),3.76-3.66(m,1H),3.39(dd,J=14.9,3.6Hz,1H),3.24(dd,J=14.3,4.6Hz,1H);13C NMR(125MHz,DMSO)δ168.34,163.33(d,JCF=257.8Hz),144.58,127.61(d,JCF=11.6Hz),125.84,124.10,119.28(d,JCF=26.5Hz),77.38(q,JCF=31.5Hz),75.99,65.88(d,JCF=4.8Hz),40.36,23.98.
HRMS计算C13H11F4N3O3S[M+H]+366.0536;实测366.0523.
(4aS,5R,7aS)-7a-(2-氟-5-硝基苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.向反应器(反应器1)装入三氟乙酸(3.7Wt,2.5V)并冷却至0-5℃。伴随搅拌分几部分加入31(1Wt,1当量),同时维持T低于20℃。将储存罐(the holding vessel)和反应器用三氟乙酸(1.5Wt,1.0V)冲洗。将混合物冷却到5℃以下,并且然后加入硫酸(1.3Wt,0.72V)同时维持T低于15℃。将所得溶液冷却至0-5℃并且然后加入发烟硝酸(纯度>90%,0.315Wt,0.210V,1.20当量)同时维持T低于25℃。在完全加入之后,继续搅拌混合物0.5h同时冷却(浴温T.0-5℃)并监测反应关于31的完全消耗(目标>98%转化)。将另一反应器(反应器2)装入3.0MNaOH(26Wt,23V)并将混合物冷却至3-7℃。将反应混合物转移到第二反应器中同时维持T低于30℃。在加入过程中,形成白色沉淀。完成加入之后,在23-27℃下继续搅拌。将第一反应器用水(2.0Wt,2.0V)冲洗,并将水洗物转移到反应器2中。若需要,加入另外的3MNaOH使得pH>12。在23-27℃搅拌0.5-1h之后,将混合物过滤并将反应器和滤饼用水(4.0Wt,4.0V)冲洗。将滤饼在减压下干燥(T<30℃)过夜以得到36(1.12Wt,96.1%收率)。
(4aS,5R,7aS)-7a-(2-氟-5-硝基苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,CDCl3)δ8.39(dd,J=6.9,2.9Hz,1H),8.20-8.14(m,1H),7.21(dd,J=10.8,9.0Hz,1H),4.55(dd,J=9.1,0.9Hz,1H),4.41-4.31(m,1H),3.80(dd,J=9.1,1.8Hz,1H),3.05(dd,J=13.5,3.8Hz,1H),2.74(dd,J=13.5,4.1Hz,1H),2.52-2.42(m,1H),1.37(d,J=6.1Hz,3H);13C NMR(1256MHz,CDCl3)δ163.56(d,JCF=258.9Hz),150.91,144.23,133.73(d,JCF=12.3Hz),126.05(d,JCF=6.2Hz),124.76(d,JCF=10.8Hz),117.53(d,JCF=26.3Hz),78.83(d,JCF=4.0Hz),76.96,66.91(d,JCF=4.8Hz),45.26(d,JCF=3.1Hz),23.88,19.63.
(4aS,5S,7aS)-7a-(2,3-二氟-5-硝基苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.将(4aS,5S,7aS)-7a-(2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺34(9.10g,0.03mol,1.0当量)溶解在三氟乙酸(36.4mL)中,并将溶液冷却至0℃。加入硫酸(浓硫酸,12.0mL),随后滴加发烟硝酸(6.9mL)同时维持温度低于5℃。在0-5℃搅拌4h之后,将反应混合物缓慢加入到剧烈搅拌的NaOH水溶液(43.3g在273mL水中)同时维持温度低于20℃。将混合物用CH2Cl2(1x 94ml,and 2x 64mL)萃取,并将合并的有机相用NaCl饱和水溶液(46mL)洗涤。将硅藻土(15.0g)加到有机物中,并将混合物过滤,用CH2Cl2(40mL)冲洗。将溶剂蒸发以得到标题化合物37(8.3g),其不经纯化直接用于后面的步骤。
(4aS,5S,7aS)-7a-(2,3-二氟-5-硝基苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ8.41-8.30(m,1H),8.22-8.13(m,1H),6.36(s,2H),4.70-4.46(m,2H),4.43-4.31(m,1H),4.35(d,J=8.7H2,1H),3.69(dd,J=8.5,1.6Hz,1H),3.04-2.91(m,2H),2.86-2.76(m,1H);13C NMR(125MHz,DMSO)δ152.36(dd,JCF=246.8,12.3Hz),151.13,150.32(dd,JCF=238.2,12.2Hz),143.25(dd,JCF=7.9,2.5Hz),134.70(d,JCF=9.5Hz),121.28,113.02(d,JCF=22.3Hz),83.74(d,JCF=170.1Hz),79.44(d,JCF=18.3Hz),78.02(d,J=3.9Hz),36.96,23.28.
HRMS计算C13H12F3N3O3S[M+H]+348.0630;实测348.0614.
H.式VII的二氨基噻嗪的合成
(4aS,5S,7aS)-7a-(5-氨基-2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.在氮气气氛下将乙醇(0.975L)加到铁粉(62.5g,1.12mol)中。在环境温度下加入浓HCl(9.03mL)并将悬浮液加热至65℃持续1.5h。然后将悬浮液冷却至50℃,并加入NH4Cl饱和水溶液(299g)。允许反应混合物的温度到达50℃,并分几部分加入(4aS,5S,7aS)-7a-(2-氟-5-硝基苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺盐酸盐35(75.0g,187.0mol)同时维持温度低于68℃。30min之后,加入乙醇(0.45L),然后将反应混合物经1h冷却至20-25℃。将悬浮液搅拌2h并滤过硅藻土(75g),用乙醇(0.972L)冲洗。将溶液在真空下浓缩至棕色固体。加入水(0.9L)随后加入3.0N NaOH(0.187L,560mmol)同时维持温度低于35℃。将所得悬浮液在20-25℃搅拌1h。将悬浮液过滤,并将固体用冷水(0.38L)冲洗。在40-45℃将固体在真空下干燥经24h以获得标题化合物38(57.7g,95.5%)。
(4aS,5S,7aS)-7a-(5-氨基-2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ6.81(dd,J=12.5,8.6Hz,1H),6.62(dd,J=7.0,2.9Hz,1H),6.50-6.42(m,1H),6.16(s,2H).4.96(s,2H),4.72-4.54(m,1H),4.35(d,J=7.8Hz,1H),3.74(dd,J=7.8,2.5Hz,1H),3.18-3.08(m,1H),3.01(dd,J=13.9,3.0Hz,1H).2.84(dd,J=13.8,3.8Hz,1H);13C NMR(125MHz,DMSO)δ156.20(d,JCF=243.0Hz),148.73,145.49.127.86(d,JCF=11.0Hz),116.79(d,.JCF=24.8Hz),116.10(d,JCF=3.3Hz),114.10(d,JCF=8.0Hz),78.89,76.57(q,JCF=31.0Hz),66.35,36.35,23.11.
HRMS计算C13H13F4N3OS[M+H]+336.0794;实测336.0789.
(4aS,5R,7aS)-7a-(5-氨基-2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.在18-22℃向粉末铁(6当量)在乙醇(8.0V)中的悬浮液中加入浓HCl(37Wt%,0.60当量)。将所得混合物升温至65-70℃并搅拌2h。冷却至50-55℃并加入饱和NH4Cl溶液(4.0wt)。在另一反应器中,将36(1.0Wt,1.0当量)溶解在乙醇(5.0V)和浓HCl(1.0当量)的混合物中。将所得溶液加到铁浆液反应器中同时将T维持在低于65℃,用乙醇(1.0V)冲洗。将反应混合物在55-65℃搅拌直到36的完全消耗。将反应混合物用6.0V乙醇稀释并冷却至15-20℃。搅拌1-2h后,将混合物滤过硅藻土垫(1.0Wt),用15V乙醇冲洗。在真空中浓缩得到橙色固体残余物,将其溶解在水(8V)中。产生了一些橙色颗粒并通过抛光过滤(polishfiltration)除去。将2V的水用于冲洗。在18-25℃经45min加入3MNaOH(3V)。产物作为白色固体沉淀下来。在18-22℃搅拌1-2h后,将混合物过滤并将滤饼用水冲洗三次(2V每次)。在45℃在真空烘箱中干燥过夜得到灰白色固体状39,分离收率92%。
(4aS,5R,7aS)-7a-(5-氨基-2-氟苯基)-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ6.76(dd,J=12.3,8.6Hz,1H),6.59(dd,J=7.1,2.8Hz,1H),6.45-6.36(m,1H),5.91(s,2H),4.87(s,2H),4.29(d,J=8.2Hz,1H),4.20-4.11(m,1H),3.61(dd,J=8.0,2.7Hz,1H),2.93(dd,J=13.3,3.7Hz,1H),2.82(dd,J=13.3,3.7Hz,1H),2.37-2.28(m,1H),1.23(d,J=6.1Hz,3H);13C NMR(126MHz,DMSO)δ151.95(d,JCF=232.6Hz),148.19,145.02,131.37(d,JCF=11.3Hz),116.56(d,JCF=24.6Hz),115.42(d,JCF=3.4Hz),113.38(d,JCF=7.9Hz),78.56(d,JCF=5.4Hz),76.00,66.55(d,JCF=4.9Hz),43.73(d,JCF=3.6Hz),22.96,20.32.
(4aS,5S,7aS)-7a-(5-氨基-2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺.向铁(8.03g,0.144mol,6.0当量)加入乙醇(66.56mL),随后加入浓HCl(62%,1.2mL,0.014mol,0.60当量)。将混合物加热至65℃持续2h,并且然后加入饱和NH4Cl(33%,33.3mL)并将反应温度维持在55℃。将(4aS,5S,7aS)-7a-(2,3-二氟-5-硝基苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺37(8.32g,0.024mol,1.0当量)和浓HCl(1.93mL,0.024mol,1.0当量)在乙醇(41.6mL)中的溶液加到铁悬浮液。在55℃将反应搅拌30min,然后加入乙醇(50mL)并允许悬浮液冷却至20℃,滤过硅藻土(8.3g)并用乙醇(125mL)冲洗。将滤液在减压下浓缩并加入水(66mL),随后加入3.0M NaOH水溶液(24mL,0.0179mol,3.0当量)。将所得混合物用CH2Cl2(2x 83mL)萃取。将有机相合并并滤过硅藻土并在减压下浓缩以得到标题化合物40(7.60g)。
(4aS,5S,7aS)-7a-(5-氨基-2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺:
1H NMR(500MHz,DMSO)δ6.42-6.35(m,2H),6.02(brs,2H),4.66-4.41(m,2H),4.37-4.25(m,1H),4.21(d,J=8.0Hz,1H),3.69(dd,J=7.8,2.2Hz,1H),2.97(qd,J=13.5,3.4Hz,3H),2.74-2.64(m,1H);13C NMR(125MHz,DMSO)δ151.08(dd,JCF=240.1,14.8Hz),148.88,145.40(d,JCF=10.7Hz),139,33(dd,JCF=233.5,13.8Hz),132.53(d,JCF=8.1Hz),109.90,100.70(d,JCF=20.0Hz),83.99(d,JCF=169.9Hz),78.79(d,JCF=18.3Hz),77.99(d,JCF=5.5Hz),66.22,36.24,23.14.
HRMS计算C13H14F3N3OS[M+H]+318.0888;实测318.0874.
I.式IX的化合物的合成
N-(3-((4aS,5S,7aS)-2-氨基-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-甲氧基吡嗪-2-甲酰胺.将5-甲氧基吡嗪-2-羧酸(26.29g,0.17mol)在N,N’-二甲基咪唑啉-2-酮(160mL)中的悬浮液在环境温度下搅拌15min,然后冷却至2.2℃。加入亚硫酰氯(14.7mL,0.202mol)同时维持温度低于5℃。将所得悬浮液在0-10℃搅拌2小时同时其转变成澄清的溶液。在另一容器中,将(4aS,5S,7aS)-7a-(5-氨基-2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺38(52.0g,0.155mol)溶解到N,N’-二甲基咪唑啉-2-酮(160mL)中。将所得溶液加到酰氯溶液中同时维持温度低于10℃。将反应混合物搅拌30min。加入水(780mL)同时维持温度低于30℃。将所得混合物搅拌30min.,并且然后加入EtOAc(780mL)。向这一混合物加入50%NaOH水溶液(84.8g)直到水层pH达到11。将水层用EtOAc(260mL)萃取。将有机层合并,用饱和NaCl水溶液(260mL)和水(260mL)洗涤。将有机物滤过硅藻土垫(26g)并用EtOAc(260mL)冲洗。将有机物在真空下浓缩以得到固体。向该固体加入1-丙醇(728mL),并将悬浮液加热至75℃直到形成澄清溶液。将该溶液冷却至-10℃并保持1小时。将固体过滤,用冷的1-丙醇(104mL)冲洗并在真空下干燥(35℃)直到恒重,得到标题化合物41(62.1g,84.9%)。
N-(3-((4aS,5S,7aS)-2-氨基-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-甲氧基吡嗪-2-甲酰胺:
1H NMR(500MHz,DMSO)δ10.56(s,2H),8.88(d,J=1.2Hz,1H),8.39(d,J=1.2Hz,1H),7.95-7.83(m,2H),7.18(dd,J=12.0,8.8Hz,1H),6.25(s,2H),4.76-4.60(m,1H),4.36(d,J=8.1Hz,1H),4.01(s,3H),3.88(dd,J=7.9,2.3Hz,1H),3.23-3.11(m,2H),2.91(dd,J=13.8,3.6Hz,1H);13C NMR(125MHz,DMSO)δ162.11,161.93,156.13(d,JCF=242.9Hz),149.38,142.01,138.35,135.09,133.98,128.53(d,JCF=11.6Hz),126,06(q,JCF=282.0Hz),123.32,121.93(d,JCF=8.6Hz),116.76(d,JCF=25.1Hz),78.86(d,JCF=6.9Hz),76.94(q,JCF=30.5Hz),66.37,54.75,36.44,23.53.
HRMS计算C19H17F4N5O3S[M+H]+472.1066;实测472.1052.
特定的旋光性[α]D+110.5(c 0.584,MeOH)
特定的旋光性参数:
装置:
试剂:
甲醇:HPLC等级,Baker(目录号9093-03)或等同物
仪器参数:
N-(3-((4aS,5R,7aS)-2-氨基-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(二氟甲基)吡嗪-2-甲酰胺.将5-(二氟甲基)吡嗪-2-羧酸42(0.68wt,1.1当量)加入反应器中并且若需要,通过与甲苯共沸蒸馏干燥。加入DMI(2.0V)并将混合物冷却至0-5℃。加入亚硫酰氯(0.337V,1.30当量)同时保持内部温度低于10℃。将所得溶液在4-10℃搅拌直到通过HPLC检测转化>95.0%。将混合物冷却到0℃并加入39(1.0Wt,1.0当量)在DMI(2.5V)中的溶液同时保持内部温度低于5℃。将容器用DMI(0.50V)冲洗并搅拌反应混合物直到转化>99%。加入水(12V)并将所得混合物在15-20℃搅拌0.5h。加入EtOAc(15V)和然后50%NaOH水溶液(1.5Wt,5.3当量)同时维持T低于30℃。监测pH以保证其高于10。将水相分离并用EtOAc(5.0V)萃取。将有机层合并并用盐水(5.0V)洗涤并用水洗涤两次(5.0V每次)。将混合物滤过硅藻土垫(0.50Wt),用EtOAc(3.0V)冲洗。在40-50℃在减压下将滤液浓缩。加入1-丙醇(15V)并将混合物升温至90-100℃同时搅拌直到获得澄清溶液。将混合物经2h冷却至0-5℃并搅拌1h。将混合物过滤,用冷的1-丙醇冲洗两次(2.5V每次)。在45℃在真空烘箱中干燥过夜,得到灰白色固体状标题化合物43,分离收率81%。
5-(二氟甲基)吡嗪-2-羧酸:
1H NMR(500MHz,DMSO)δ4.72(s,1H),4.57(s,1H),4.32(s,1H),2.06(t,J=54.2Hz,1H);13C NMR(125MHz,DMSO)δ164.34,151.67(t,JCF=26.8Hz),145.45,143.29,141.04(t,JCF=3.4Hz),112.59(t,JCF=242.1Hz).
N-(3-((4aS,5R,7aS)-2-氨基-5-甲基-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(二氟甲基)吡嗪-2-甲酰胺:
1H NMR(500MHz,CD3OD)δ9.38(s,1H),9.00(s,1H),7.89-7.77(m,2H),7.14(dd,J=11.9,8.8Hz,1H),6.94(t,J=54.3Hz,1H),4.80(s,2H),4.58(d,J=8.9Hz,1H),4.37-4.28(m,1H),3.81(dd,J=8.8,2.4Hz,1H),3.14(dd,J=13.5,4.0Hz,1H),2.88(dd,J=13.5,4.1Hz,1H),2.61-2.54(m,1H),1.33(d,J=6.1Hz,3H);13C NMR(125MHz,CD3OD)δ161.11,156.94(d,JCF-244.9Hz),154.91,150.21(t,JCF=25.8Hz),146.53,143.30,140.02(t,JCF=4.0Hz),133.73(d,JCF=2.6Hz),130.70(d,JCF=11.6Hz),122.05(d,JCF=3.9Hz),121.48(d,JCF=8.8Hz),116.39(d,JCF=25.3Hz),112.96(t,JcF=239.8Hz),77.56(d,JCF=5.3Hz),76.79,66.49(d,JCF=4.8Hz),45.16,45.13,22.60,18.58.
N-(3-((4aS,5S,7aS)-2-氨基-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4,5-二氟苯基)-5-甲氧基吡嗪-2-甲酰胺.将5-甲氧基吡嗪-2-羧酸(4.01g,0.026mol,1.10当量)在N,N’-二甲基咪唑啉-2-酮(22.5mL)中的悬浮液在环境温度下搅拌15min,然后冷却至0℃。加入亚硫酰氯(2.24mL,0.031mol,1.3当量)同时维持温度低于10℃。将所得悬浮液在0-10℃搅拌2小时同时其转变成澄清溶液。在另一容器中,将(4aS,5S,7aS)-7a-(5-氨基-2,3-二氟苯基)-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺40(7.60g,0.024mol,1.0当量)溶解到N,N’-二甲基咪唑啉-2-酮(22.5mL)中。将所得溶液加到酰氯溶液同时维持温度低于10℃。将反应混合物搅拌30min。加入水(112mL)同时维持温度低于30℃。将所得混合物搅拌30min.,并且然后加入EtOAc(112mL)。向这一混合物加入50%NaOH水溶液(10.0g)直到水层pH达到11。将水层用EtOAc(75mL)萃取。将有机物合并,用NaCl饱和水溶液(38mL)和水(38mL)洗涤。将有机物滤过硅胶垫(15g)并用EtOAc(37.5mL)冲洗。将有机物在真空下浓缩以得到固体。向该固体加入1-丙醇(112mL),并将悬浮液加热至100℃。将混合物冷却至-10℃并保持1小时。将固体过滤,用冷的1-丙醇(15mL)冲洗并在真空下干燥(35℃)直到恒重以得到标题化合物44(8.18g)。
N-(3-((4aS,5S,7aS)-2-氨基-5-(氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4,5-二氟苯基)-5-甲氧基吡嗪-2-甲酰胺:
1H NMR(500MHz,DMSO)δ10.73(s,1H),8.88(d,J=0.8Hz,1H),8.39(d,J=0.9Hz,1H),8.11-7.87(m,1H),7.73(d,J=5.0Hz,1H),6.07(s,2H),4.68-4.44(m,2H),4.41-4.28(m,1H),4.23(d,J=8.3Hz,1H),4.01(s,3H),3.82(dd,J=8.1,2.4Hz,1H),3.18(dd,J=13.5,3.5Hz,1H),3.01(dd,J-13.5,3.8Hz,1H),2.77-2.69(m,1II);13C NMR(125MHz,DMSO)δ162.24,162.20,150.05(dd,JCF=242.1,14.4Hz),149.37,144.42(dd,JCF=245.5,13.7Hz),142.18,138.09,134.73(dd,JCF=10.3,2.7Hz),134.03,133.22(d,JCF=9.1Hz),116.6,108.42(d,JCF=22.4Hz),83.98(d,JCF=169.9Hz),79.21(d,JCF=18.2Hz),77.96(d,JCF=5.2Hz),66.26,54.78,36.23,23.64..
HRMS计算C19H18F3N5O3S[M+H]+454.1161;实测454.1149.
特定的旋光性[α]D+115.3(c 0.584,MeOH)
特有的旋光性参数:
装置:
试剂:
甲醇:HPLC等级,Baker(目录号9093-03)或等同物
仪器参数:
N-(3-((4aS,5S,7aS)-2-氨基-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(氟甲基)吡嗪-2-甲酰胺.将5-(氟甲基)吡嗪-2-羧酸(32.6g,1.05当量)和(4aS,5S,7aS)-7a-(5-氨基-2-氟苯基)-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-2-胺(70.0g,1.0当量)加入到反应器并将EtOAc(630mL)加到混合物以得到悬浮液。在环境温度下加入(146g,1.10当量,50wt%于EtOAc中)(Archimica,Germany)的溶液同时控制内部温度低于30℃。将反应混合物在40-45℃搅拌>3小时并通过HPLC监测。将反应混合物冷却至15-20℃并加入水(140mL)。10-15分钟之后充入28%氢氧化铵(175mL)同时控制温度低于30℃。加入EtOAc(245mL)并将反应混合物在环境温度下搅拌30分钟。分离水层并用EtOAc(490mL)萃回。将有机相合并并用15%NaCl水溶液(140mL)和水(140mL)洗涤。将有机层滤过硅藻土(1.0Wt)并用EtOAc(140mL)冲洗。将溶液在真空下浓缩得到浅褐色固体(定量的粗制收率),其从1-丙醇再结晶得到N-(3-((4aS,5S,7aS)-2-氨基-5-(三氟甲基)-4a,5,7,7a-四氢-4H-呋喃并[3,4-d][1,3]噻嗪-7a-基)-4-氟苯基)-5-(氟甲基)吡嗪-2-甲酰胺,白色固体状(70.0g)。
1H NMR(500MHz,DMSO)δ10.89(s,1H),9.30(s,1H),8.89(s,1H),7.95(dd,J=7.3,2.7Hz,1H),7.94-7.89(m,1H),7.21(dd,J=12.0,8.8Hz,1H),6.22(s,2H),5.71(d,J=46.3Hz,2H),4.77-4.61(m,1H),4.37(d,J=8.1Hz,1H),3.87(dd,J=8.0,2.7Hz,1H),3.20(dt,J=7.0,3.5Hz,1H),3.15(dd,J=13.9,3.1Hz,1H),2.91(dd,J=13.8,3.8Hz,1H).
13C NMR(126MHz,DMSO)δ161.32(s),155.82(d,J=243.4Hz),153.71(d,J=18.7Hz),148.77(s),144.71(d,J=1.9Hz),143.30(s),141.01(d,J=5.6Hz),134.36(d,J=2.0Hz),128.20(d,J=12.1Hz),125.57(q,J=283.0Hz),123.12(d,J=3.6Hz),121.64(d,J=8.6Hz),116.35(d,J=25.2Hz),82.55(d,J=165.8Hz),78.37(s),76.44(q,J=30.6Hz),65.89(d,J=5.3Hz),35.89(s),23.01(s).
- 还没有人留言评论。精彩留言会获得点赞!
- N-烯基苯并三唑类氮氧衍生物及其制备方法和应用
- 含有噻二唑衍生物、纳米铜和石墨烯的添加剂,添加剂制备方法,含该有该添加剂的润滑油的制作方法
- 一种具有抗菌活性的手性螺1,2,3-噻二唑衍生物及其合成方法和应用
- 含有噻二唑衍生物和纳米铜的润滑油添加剂,添加剂的制备方法,及含有该添加剂的润滑油的制作方法
- 作为免疫调节剂的1,3,4-*二唑和1,3,4-噻二唑衍生物的制作方法
- 含有噻二唑衍生物和石墨烯的润滑油添加剂,添加剂的制备方法,及含有该添加剂的润滑油的制作方法
- 一类1,3,4-噻二唑衍生物、制备方法及应用
- 一类1,3,4-噻二唑衍生物、合成方法及其应用
- 一种双磷酸酯唑类衍生物的制备方法
- 一种用于rv减速器的锂基润滑脂及其制备方法