人源白细胞介素6的siRNA、重组表达CAR‑T载体及其构建方法和应用与流程
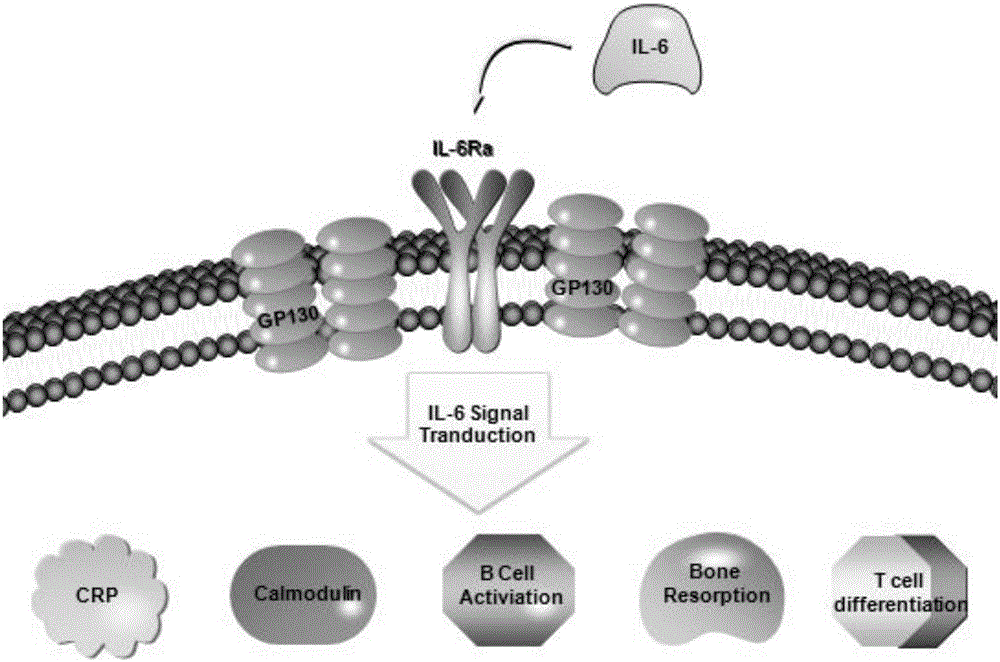
本发明属于肿瘤免疫治疗
技术领域:
,具体涉及一种人源白细胞介素6(IL-6)的siRNA、重组表达CAR-T载体(尤其是一种通过敲减IL-6的用于缓解CRS的CAR-T转基因载体)及其构建方法和应用。
背景技术:
:肿瘤免疫治疗的理论基础是免疫系统具有识别肿瘤相关抗原、调控机体攻击肿瘤细胞(高度特异性的细胞溶解)的能力。1950年代,Burnet和Thomas提出了“免疫监视”理论,认为机体中经常会出现的突变的肿瘤细胞可被免疫系统所识别而清除,为肿瘤免疫治疗奠定了理论基础[BurnetFM.Immunologicalaspectsofmalignantdisease.Lancet,1967;1:1171-4]。随后,各种肿瘤免疫疗法包括细胞因子疗法、单克隆抗体疗法、过继免疫疗法、疫苗疗法等相继应用于临床。2013年一种更先进的肿瘤免疫疗法---CAR-T疗法成功用于临床,并表现了前所未有的临床疗效。CAR-T,全称是ChimericAntigenReceptorT-CellImmunotherapy,嵌合抗原受体T细胞免疫疗法。CAR-T疗法在临床上最领先的有诺华的CLT019,采用CLT019治疗复发难治急性淋巴细胞白血病患者,六个月的肿瘤无进展生存率达到67%,其中最长的应答时间达到两年多。总部位于中国上海的上海优卡迪生物医药科技有限公司与医院合作,共治疗复发难治急性淋巴细胞白血病患者36例,其中完全24例,缓解比例达到66.6%。这是抗癌研究的颠覆性突破。CAR-T细胞疗法可能是最有可能治愈癌症的手段之一,并被《Science》杂志评为2013年度十大科技突破之首。CAR-T疗法虽然效果显著,但是在治疗过程中会出现一类特殊的临床综合症,临床常表现为发热,低血压,寒颤,以及出现与血清中一系列细胞因子水平显着升高有关的神经系统症状,被称为细胞因子释放综合症(CytokineReleaseSyndrome,CRS)。其发生机制是由于抗原与T细胞受体结合后,激活了T细胞,T细胞被激活后释放了包括IL-6在内的一系列细胞因子,造成了一种系统性的炎症反应,IL-6信号通路如图1所示。如果治疗不及时,很可能引起肺水肿而导致患者死亡。目前临床上可通过静脉注射抗组胺类药物(如扑尔敏)或皮质类固醇(如氢化可的松)来抑制炎症反应,但是相应的,CAR-T细胞对肿瘤的杀伤作用也被抑制,使得这类患者,有较高的复发率,影响CAR-T治疗的疗效。还有一个比较可行的方案是使用商品化的托珠单抗来控制CRS的发生程度。托珠单抗是一种人源化的IL-6受体单克隆抗体(Tocilizumab),托珠单抗与IL-6受体发生特异性结合,阻断IL-6信号转导,从而减少急性时相反应物、降低铁调素产物、减少B细胞活化、减少骨吸收和软骨转化,以及抑制T淋巴细胞向Th17细胞的分化,从而有效控制炎症反应。但是托珠单抗也有一些很明显的缺点,首先是费用很高。一支10kg体重剂量的托珠单抗价格约为2000元RMB,成年患者一般一次要用5支,普通家庭难以承受。其次是使用托珠单抗后,由于封闭了IL-6受体,导致患者后期很容易遭受感染。自从20世纪90年代以来,研究人员发现双链RNA(“dsRNA”)可以用来抑制蛋白表达。这种沉默基因的能力在治疗人类疾病方面具有具有广泛的潜力,和许多研究人员和商业实体目前投入相当大的资源在发展中基于这种技术的治疗方法。从机制的角度来看,当dsRNA进入植物和无脊椎动物细胞后,被III型核酸内切酶Dicer分解成siRNA。【Sharp,RNAinterference-2001,GenesDev.2001,15:485】。III型核糖核酸酶Dicer,将dsRNA分解成带有2碱基凸出3’粘性末端的19-23bp的siRNA。【Bernstein,Caudy,Hammond,&Hannon,RoleforabidentateribonucleaseintheinitiationstepofRNAinterference,Nature2001,409:363】。siRNA与RNA诱导的沉默复合体(RISC)整合,复合体中一个或多个解旋酶解开双链siRNA,使互补反义链引导靶点识别。【Nykanen,Haley,&Zamore,ATPrequirementsandsmallinterferingRNAstructureintheRNAinterferencepathway,Cell2001,107:309】。在结合相应的目标mRNA后,RISC复合物中的一个或多个核酸内切酶切割目标mRNA引起mRNA沉默。【Elbashir,Elbashir,Lendeckel,&Tuschl,RNAinterferenceismediatedby21-and22-nucleotideRNAs,GenesDev2001,15:188】。这种干扰效应可以持续很久,而且在细胞分裂后仍然有效。并且,RNAi具有非常好的序列特异性【Kisielow,M.etal.(2002)Isoform-specificknockdownandexpressionofadaptorproteinShcAusingsmallinterferingRNA,J.ofBiochemistry363:1-5】。因此,RNAi系统可以特异性敲减一种类型的转录本,而不影响序列相近的其它mRNA。这些特性使siRNA系统在抑制基因表达、基因功能研究和药物靶点验证方面表现出潜力和价值。此外,siRNA系统可以用来治疗相关疾病,包括(1)基因过表达或错误表达引起的疾病;(2)的基因突变引起的疾病。技术实现要素:本发明的目的在于克服现有技术的不足,提供了一种人源白细胞介素6的siRNA、重组表达载体及其构建方法和应用。本发明的目的通过以下技术方案来实现:本发明的第一目的在于提供一种人源白细胞介素6的siRNA,所述siRNA选自下述中的a-h中的任一对:a.SEQIDNO.43和SEQIDNO.44所示的核苷酸序列;b.SEQIDNO.45和SEQIDNO.46所示的核苷酸序列;c.SEQIDNO.47和SEQIDNO.48所示的核苷酸序列;d.SEQIDNO.49和SEQIDNO.50所示的核苷酸序列;e.SEQIDNO.51和SEQIDNO.52所示的核苷酸序列;f.SEQIDNO.53和SEQIDNO.54所示的核苷酸序列;g.SEQIDNO.55和SEQIDNO.56所示的核苷酸序列;h.SEQIDNO.57和SEQIDNO.58所示的核苷酸序列。进一步的,优选b.SEQIDNO.45和SEQIDNO.46所示的核苷酸序列。本发明的第二目的在于提供上述siRNA在制备治疗缓解细胞因子释放综合症药物中的应用。本发明的第三目的在于提供一种包含上述siRNA的重组表达载体。进一步的,所述表达载体为慢病毒表达载体、逆转录病毒表达载体、腺病毒表达载体、腺相关病毒表达载体或质粒;优选的,包含上述siRNA的慢病毒表达载体。进一步的,所述的慢病毒表达载体包括:用于质粒复制的原核复制子pUCOri序列,如SEQIDNO.2所示;用于目的菌株大量扩增的含氨苄青霉素抗性基因AmpR序列,如SEQIDNO.1所示;用于增强真核细胞内的复制的病毒复制子SV40Ori序列,如SEQIDNO.3所示;用于慢病毒包装的慢病毒包装顺式元件;用于真核细胞表达绿色荧光的ZsGreen1绿色荧光蛋白,如SEQIDNO.11所示;用于共同转录表达蛋白质的IRES核糖体结合序列,如SEQIDNO.12所示;用于嵌合抗原受体基因的真核转录的人EF1α启动子,如SEQIDNO.14所示;用于组成集识别、传递、启动于一体的二代CAR或三代CAR的抗CD19嵌合抗原受体的编码基因,如SEQIDNO.52或SEQIDNO.53所示;用于增强转基因的表达效率的eWPRE增强型土拨鼠乙肝病毒转录后调控元件,如SEQIDNO.13所示;用于胞内转录siRNA的人RNA聚合酶III启动子hU6,如SEQIDNO.14所示。进一步的,所述慢病毒包装顺式元件采用第二代慢病毒载体包括:如SEQIDNO.5所示的慢病毒5terminalLTR、如SEQIDNO.6所示的慢病毒3terminalSelf-InactivatingLTR、如SEQIDNO.7所示的Gag顺式元件、如SEQIDNO.8所示的RRE顺式元件、如SEQIDNO.9所示的env顺式元件、如SEQIDNO.10所示的cPPT顺式元件。进一步的,所述慢病毒包装顺式元件采用第三代慢病毒载体包括:如SEQIDNO.5所示的慢病毒5terminalLTR、如SEQIDNO.6所示的慢病毒3terminalSelf-InactivatingLTR、如SEQIDNO.7所示的Gag顺式元件、如SEQIDNO.8所示的RRE顺式元件、如SEQIDNO.9所示的env顺式元件、如SEQIDNO.10所示的cPPT顺式元件所述慢病毒包装顺式元件,以及如SEQIDNO.4所示的RSV启动子。进一步的,所述eWPRE增强型土拨鼠乙肝病毒转录后调控元件有6个核苷酸的增强突变,具体为:g.396G>A、g.397C>T、g.398T>C、g.399G>A、g.400A>T、g.411A>T。进一步的,所述抗CD19嵌合抗原受体(二代CAR),包括依次串联的如SEQIDNO.16所示的CD8leader嵌合受体信号肽、如SEQIDNO.17所示的CD19单链抗体轻链VL、如SEQIDNO.18所示的OptimalLinkerC、如SEQIDNO.19所示的CD19单链抗体重链VH、如SEQIDNO.20所示的CD8Hinge嵌合受体铰链、如SEQIDNO.21所示的CD8Transmembrane嵌合受体跨膜区、如SEQIDNO.22所示的CD137嵌合受体共刺激因子,以及如SEQIDNO.23所示的TCR嵌合受体T细胞激活域。进一步的,所述抗CD19嵌合抗原受体(三代CAR),包括依次串联的如SEQIDNO.16所示的CD8leader嵌合受体信号肽、、如SEQIDNO.17所示的CD19单链抗体轻链VL、如SEQIDNO.18所示的OptimalLinkerC、如SEQIDNO.19所示的CD19单链抗体重链VH、如SEQIDNO.20所示的CD8Hinge嵌合受体铰链、如SEQIDNO.21所示的CD8Transmembrane嵌合受体跨膜区、如SEQIDNO.24所示的CD28嵌合受体共刺激因子、如SEQIDNO.22所示的CD137嵌合受体共刺激因子以及如SEQIDNO.23所示的TCR嵌合受体T细胞激活域。本发明的第四目的在于提供一种包含上述siRNA的慢病毒表达载体的构建方法,包括以下步骤:(1)将含氨苄青霉素抗性基因AmpR序列(如SEQIDNO.1所示)、原核复制子pUCOri序列(如SEQIDNO.2所示)、病毒复制子SV40Ori序列(如SEQIDNO.3所示)、用于慢病毒包装的慢病毒包装顺式元件、ZsGreen1绿色荧光蛋白(如SEQIDNO.11所示)、IRES核糖体结合序列(如SEQIDNO.12所示)、eWPRE增强型土拨鼠乙肝病毒转录后调控元件(如SEQIDNO.13所示)、人RNA聚合酶III启动子hU6(如SEQIDNO.14所示)存储于慢病毒骨架质粒(pLenti-3Gsilencer)上;(2)将人EF1α启动子(如SEQIDNO.15所示)、用于组成集识别、传递、启动于一体的二代CAR或三代CAR的抗CD19嵌合抗原受体组合成二代CAR或三代CAR设计方案,经过酶切、连接、重组反应克隆至慢病毒骨架质粒中,得到二代CAR或三代CAR设计的重组慢病毒质粒pCAR19-silencer;(3)将上述siRNA以及如SEQIDNO.41和SEQIDNO.42所示的negativecontrol序列,分别克隆至步骤(2)所得的重组慢病毒质粒中,得到IL-6敲减重组慢病毒质粒(pCAR19-1762~pCAR19-1769和negativecontrol的pCAR19-1761);(4)将步骤(3)得到的重组慢病毒质粒(pCAR19-1761~pCAR19-1769)分别与慢病毒包装质粒pPac-GP、pPac-R以及膜蛋白质粒pEnv-G共同转染HEK293T/17细胞,在HEK293T/17细胞中进行基因转录表达后,包装成功重组慢病毒载体会释放到细胞培养上清中,收集包含的重组慢病毒载体的上清液;(5)将得到的重组慢病毒上清采用抽滤、吸附、洗脱的离子交换方式进行纯化,分别得到重组慢病毒载体。进一步的,步骤(1)中,所述慢病毒包装顺式元件采用第二代慢病毒载体包括:如SEQIDNO.5所示的慢病毒5terminalLTR、如SEQIDNO.6所示的慢病毒3terminalSelf-InactivatingLTR、如SEQIDNO.7所示的Gag顺式元件、如SEQIDNO.8所示的RRE顺式元件、如SEQIDNO.9所示的env顺式元件、如SEQIDNO.10所示的cPPT顺式元件;所述慢病毒包装顺式元件采用第三代慢病毒载体包括:如SEQIDNO.5所示的慢病毒5terminalLTR、如SEQIDNO.6所示的慢病毒3terminalSelf-InactivatingLTR、如SEQIDNO.7所示的Gag顺式元件、如SEQIDNO.8所示的RRE顺式元件、如SEQIDNO.9所示的env顺式元件、如SEQIDNO.10所示的cPPT顺式元件所述慢病毒包装顺式元件,以及如SEQIDNO.4所示的RSV启动子。进一步的,步骤(2)中,所述用于组成集识别、传递、启动于一体的二代CAR的抗CD19嵌合抗原受体,包括依次串联的如SEQIDNO.16所示的CD8leader嵌合受体信号肽、如SEQIDNO.17所示的CD19单链抗体轻链VL、如SEQIDNO.18所示的OptimalLinkerC、如SEQIDNO.19所示的CD19单链抗体重链VH、如SEQIDNO.20所示的CD8Hinge嵌合受体铰链、如SEQIDNO.21所示的CD8Transmembrane嵌合受体跨膜区、如SEQIDNO.22所示的CD137嵌合受体共刺激因子,以及如SEQIDNO.23所示的TCR嵌合受体T细胞激活域;所述用于组成集识别、传递、启动于一体的三代CAR的抗CD19嵌合抗原受体,包括依次串联的如SEQIDNO.16所示的CD8leader嵌合受体信号肽、、如SEQIDNO.17所示的CD19单链抗体轻链VL、如SEQIDNO.18所示的OptimalLinkerC、如SEQIDNO.19所示的CD19单链抗体重链VH、如SEQIDNO.20所示的CD8Hinge嵌合受体铰链、如SEQIDNO.21所示的CD8Transmembrane嵌合受体跨膜区、如SEQIDNO.24所示的CD28嵌合受体共刺激因子、如SEQIDNO.22所示的CD137嵌合受体共刺激因子以及如SEQIDNO.23所示的TCR嵌合受体T细胞激活域。进一步的,步骤(1)中,所述eWPRE增强型土拨鼠乙肝病毒转录后调控元件有6个核苷酸的增强突变,具体为:g.396G>A、g.397C>T、g.398T>C、g.399G>A、g.400A>T、g.411A>T。进一步的,步骤(2)中,由人EF1α启动子启动整个CAR基因表达;CD8leader嵌合受体信号肽位于CAR编码序列的N端,用于引导CAR蛋白定位于细胞膜;CD19单链抗体轻链VL、OptimalLinkerC、CD19单链抗体重链VH组合成scfv区域,用于识别CD19抗原;CD8Hinge嵌合受体铰链用于将scfv锚定于细胞膜外侧;CD8Transmembrane嵌合受体跨膜区用于将整个嵌合受体固定于细胞膜上;CD137嵌合受体共刺激因子用于刺激T细胞增殖和细胞因子分泌;TCR嵌合受体T细胞激活域用于激活下游信号通路的表达;当scfv区域与CD20抗原结合时,信号通过嵌合受体传递至细胞内,从而产生包括T细胞增殖、细胞因子分泌增加、抗细胞凋亡蛋白分泌增加、细胞死亡延迟、裂解靶细胞的一系列生物学效应。进一步的,步骤(4)中,所述慢病毒载体有带荧光标签zsGreen1的版本和不带荧光标签zsGreen1版本,带荧光标签的版本用于体外实验,不带荧光标签的版本用于临床实验。进一步的,步骤(4)中,所述抽滤步骤控制上清体积在200ml~2000ml,真空度控制在-0.5MPA~-0.9MPA,防止由于堵孔带来的载体损失;所述吸附步骤控制溶液的PH值在6~8,防止PH的变化导致载体失活;所述洗脱步骤控制洗脱液的离子强度在0.5M~1.0M,防止离子强度的变化导致洗脱不完全或者载体失活。本发明的第五目的在于提供包含上述siRNA的重组表达载体在制备CAR-T治疗过程中由IL6释放引起的炎症细胞因子综合症药物中的应用。本发明的第六目的在于提供一种CART细胞,所述的CAR-T细胞是由上述siRNA修饰的T淋巴细胞。本发明的再一目的在于提供上述CAR-T细胞在制备B淋巴瘤、胰腺癌、脑胶质瘤、骨髓瘤治疗药物中的应用。本发明是将人RNA聚合酶III启动子hU6、人EF1α启动子、CD8leader嵌合受体信号肽、CD19单链抗体轻链VL、OptimalLinkerC、CD19单链抗体重链VH、CD8Hinge嵌合受体铰链、CD8Transmembrane嵌合受体跨膜区、CD137嵌合受体共刺激因子、TCR嵌合受体T细胞激活域构建进入重组慢病毒载体,由人EF1α启动子启动整个CAR基因表达。CAR蛋白定位于细胞膜表面,识别CD19抗原,刺激T细胞增殖和细胞因子分泌,激活下游信号通路的表达。当scfv区域与CD19抗原结合时,信号通过嵌合受体传递至细胞内,从而产生T细胞增殖、细胞因子分泌增加、抗细胞凋亡蛋白分泌增加、细胞死亡延迟、裂解靶细胞等一系列生物学效应。由人RNA聚合酶III启动子hU6启动siRNA的表达,通过RISCcomplex的作用,降解IL-6mRNA,抑制IL-6的合成与分泌,达到抑制CRS的效果。本发明所采用的表达载体包括原核复制子(pUCori)用于质粒复制;原核筛选标记(AmpR)用于目的菌株大量扩增;病毒复制子(SV40Ori)用于增强真核细胞内的复制;慢病毒包装顺式元件(RSV、5terminalLTR、3terminalSelf-InactivatingLTR、Gag、RRE、env、cPPT)用于慢病毒包装;人RNA聚合酶III启动子(hU6)用于胞内转录siRNA;真核荧光标签蛋白(ZsGreen1)用于真核细胞表达绿色荧光;共表达元件(IRES)用于共同转录表达蛋白质;真核启动子(EF1α)用于嵌合抗原受体基因的真核转录;嵌合抗原受体(CD8leader、CD19VL、OptimalLinkerC(SEQIDNO.19)、CD19VH、CD8Hinge、CD8Transmembrane、CD137、TCR)用于组成集识别、传递、启动于一体的二代和三代CAR;转录后调控元件(eWPRE)用于增强转基因的表达效率。本发明涉及含肽的医药配置品,具体涉及:一、人RNA聚合酶III启动子hU6、含氨苄青霉素抗性基因AmpR序列、原核复制子pUCOri序列,、病毒复制子SV40Ori序列、RSV启动子、人EF1α启动子、慢病毒5terminalLTR、慢病毒3terminalSelf-InactivatingLTR、Gag顺式元件、RRE顺式元件、env顺式元件、cPPT顺式元件、IRES核糖体结合序列、ZsGreen1绿色荧光蛋白、WPRE土拨鼠乙肝病毒转录后调控元件的重组慢病毒载体骨架,这种重组慢病毒载体骨架可以搭载不同的治疗性基因并广泛的用于过继性细胞治疗领域,搭载不同的siRNA并广泛的用于基因过表达、错误表达和基因突变引起的疾病。二、重组慢病毒载体骨架、IL6-siRNA、CD8leader嵌合受体信号肽、CD19单链抗体轻链VL、单链抗体铰链LinkerA、单链抗体铰链LinkerB、单链抗体铰链LinkerC、CD19单链抗体重链VH、CD8Hinge嵌合受体铰链、CD8Transmembrane嵌合受体跨膜区、CD28嵌合受体共刺激因子、CD137嵌合受体共刺激因子、TCR嵌合受体T细胞激活域构建形成重组慢病毒载体,该方法得到的重组慢病毒载体可以实现在人T淋巴细胞上表达CD19嵌合抗原受体,引导并激活T淋巴细胞对CD19阳性细胞的杀伤作用,在临床上用于治疗B淋巴细胞白血病、B淋巴瘤和多发性骨髓瘤。在人T淋巴细胞内表达白介素-6(IL-6)的siRNA,有效降低白介素-6的表达水平,临床上可用于缓解细胞因子释放综合症(CytokineReleaseSyndrome,CRS)。本发明设计的siRNA序列含有21个bp的核苷酸,采用N2[CG]N8[AU]N8[AU]N2的寡核苷酸排列模式,互补序列之间采用stem-loop的发卡结构,通过siRNApattern、GCpercentage、TorAorGinarow、consecutiverGC、3’endntpattern、thermodynamicvalue、siRNAtarget、identity、alignment等条件的筛选,大大提高siRNA设计的干扰成功率。本发明所采用的人RNA聚合酶III启动子hU6转录siRNA,抑制IL-6表达的系统,在T细胞杀伤实验中,经过QPCR检测,能有效抑制mRNA的转录水平,经过CBA检测,能有效减少细胞培养上清中的IL-6表达水平,将来可以在体内抑制IL-6表达水平,减轻CRS的症状。本发明采用慢病毒载体方式递送siRNA(如图2所示)。首先,节约了成本,避免siRNA体外合成的昂贵费用。其次,避免了siRNA的在体递送效率低的问题。第三,使用人RNA聚合酶III启动子hU6表达siRNA,能够有效利用细胞内的RNA转录体系,大量表达出相应的siRNA,经过一系列的酶促作用,达到良好的基因沉默效果。本发明所采用的载体骨架为第三代慢病毒载体(如图3A所示),3’SINLTR去除了U3区域,消除了慢病毒载体自我复制的可能性,大大提高了安全性;增加了cPPT和WPRE元件,提高了转导效率和转基因的表达效率;采用RSV启动子保证了慢病毒载体包装时核心RNA的持续高效转录;采用人自身的EF1α启动子,使CAR基因能够在人体内长时间持续表达。本发明所采用的siRNA敲减方案,同样可以应用于第三代CAR设计方案。第三代CAR设计与第二代设计相比,增加了CD28嵌合受体共刺激因子(SEQIDNO.24)。本发明所采用的慢病毒载体柱纯化系统(如图8所示),系本公司开发出的慢病毒规模化生产工艺。常用的超速离心法或者高速离心法,是利用离心沉降原理分离慢病毒颗粒,不可避免的会残留很多沉降系数相近的杂质,对后续实验带来不利影响。并且,装管过程复杂、操作繁琐、多次转换容器带来更多的污染机会。而本发明的慢病毒载体柱纯化工艺为半自动化操作,全部过程在百级实验区域完成,避免人工操作的繁琐和污染几率,所回收的慢病毒载体在内毒素、支原体等指标上完全达到临床标准。后续可跟进开发全自动纯化仪。本发明所采用CAR设计方案也可以应用于第二代慢病毒载体结构上。第二代和第三代慢病毒载体在结构上的区别(如图3B所示),主要是第三代慢病毒载体把第二代载体5’LTR的U3区域替换为RSV启动子,这样就消除了U3转录时对Tat蛋白的依赖,既可以在慢病毒的结构基因里去除Tat序列,也提高了慢病毒基因组转录水平和转录持续性。第二代和第三代慢病毒载体主要是基因组转录方式的区别,因此本发明所采用CAR设计方案可以应用于这两代慢病毒载体。本发明的第三代慢病毒骨架质粒,采用enhancedWPRE元件,与宾州大学CarlH.June等人(PorterDL,LevineBL,KalosM,BaggA,JuneCH.ChimericantigenreceptormodifiedTcellsinchroniclymphoidleukemia.NEnglJMed2011;365:725-33.)所采用的WPRE元件相比,有6个核苷酸的增强突变(g.396G>A、g.397C>T、g.398T>C、g.399G>A、g.400A>T、g.411A>T),能够增强初级转录产物的多聚腺苷化,增加细胞内mRNA的含量,增强转基因的表达效率。本发明的Lentival包装系统是无辅助病毒的四质粒包装系统,通过四种质粒共同转染至HEK293T/17细胞中,产生重组慢病毒载体。重组后的慢病毒载体是复制缺陷型载体,能将外源片段整合入宿主基因,一次性使用,无法复制和增殖,安全性有很大提高。本发明采用的慢病毒载体有带荧光标签zsGreen1的版本和不带荧光标签zsGreen1版本,带荧光标签的版本用于体外实验,不带荧光标签的版本用于临床实验。本发明采用的scfv段的Linker设计,能够显著提高细胞因子的分泌、CAR-T细胞的体外杀伤作用以及临床治疗效果。可见,本发明所述的重组慢病毒载体在给急性B淋巴细胞白血病(ALL)的CAR-T治疗提供可靠转基因保障的同时,可以极大的降低发生CRS的风险,减轻患者的痛苦。本发明所述的IL-6敲减siRNA表达框及其siRNA表达产物,不仅可以应用于CAR19-T治疗急性B淋巴细胞白血病(ALL)中用于消除或减轻CRS的症状,还可应用于缓解CAR-T治疗诸如B淋巴瘤、胰腺癌、脑胶质瘤、骨髓瘤等等所有类型肿瘤时引起的CRS症状,甚至还可以应用于缓解其他类型的治疗引起的CRS。附图说明图1是本发明所述的IL-6信号通路示意图;图2是本发明所述的慢病毒递送siRNA方式示意图;图3是本发明所述的慢病毒载体结构示意图;其中,图3(A)是本发明采用的第三代慢病毒载体结构示意图,图3(B)是第二代和第三代慢病毒载体结构比较;图4是本发明所述的重组慢病毒载体的构建流程图;其中,(A)图是慢病毒骨架质粒pLenti-3Gsilencer的结构示意图;(B)图是pCAR19-silencer质粒的结构示意图;(C)图是pCAR19-1761~pCAR19-1769质粒的示意图;(D)图是慢病毒包装质粒pPac-GP的结构示意图;(E)图是慢病毒包装质粒pPac-R的结构示意图;(F)图是膜蛋白pEnv-G的结构示意图;图5是慢病毒骨架质粒pLenti-3Gsilencer的酶切预测及酶切琼脂糖凝胶电泳图;其中,图5A是慢病毒骨架质粒pLenti-3Gsilencer的酶切预测示意图,其中,lane1是1kbDNAladderMarker:条带从上到下依次为:10kb、8kb、6kb、5kb、4kb、3.5kb、3kb、2.5kb、2kb、1.5kb、1kb、750bp、500bp、250bp;lane2是pLenti-3Gsilencer的ClaI+BamHI酶切预测:条带从上到下依次为:7381bp,23bp;图5B是慢病毒骨架质粒pLenti-3Gsilencer的酶切琼脂糖凝胶电泳图,其中,lane1是pLenti-3Gsilencer的ClaI+BamHI酶切电泳结果;lane2是1kbDNAladderMarker的电泳结果;图6是重组慢病毒质粒pCAR19-silencer的酶切预测及酶切琼脂糖凝胶电泳图;其中,图6A是重组慢病毒质粒pCAR19-silencer的酶切预测示意图,其中,lane1是1kbDNAladderMarker:条带从上到下依次为:10kb、8kb、6kb、5kb、4kb、3.5kb、3kb、2.5kb、2kb、1.5kb、1kb、750bp、500bp、250bp;lane2是pCAR19-silencer的KpnI酶切预测:条带从上到下依次为:8335bp、1708bp;图6B是重组慢病毒质粒pCAR19-silencer的酶切琼脂糖凝胶电泳图,其中,lane1是1kbDNAladderMarker的电泳结果;lane2是pCAR19-silencer的KpnI酶切电泳结果;图7是IL-6敲减重组慢病毒质粒pCAR19-1761~pCAR19-1769的测序比对结果;其中,A是pCAR19-1761的测序比对结果;B是pCAR19-1762的测序比对结果;C是pCAR19-1763的测序比对结果;D是pCAR19-1764的测序比对结果;E是pCAR19-1765的测序比对结果;F是pCAR19-1766的测序比对结果;G是pCAR19-1767的测序比对结果;H是pCAR19-1768的测序比对结果;I是pCAR19-1769的测序比对结果;图8是离子交换色谱法纯化重组慢病毒载体的流程图;图9是重组慢病毒载体的滴度检测结果;图10是重组慢病毒载体的不同纯化方式的支原体检测结果,lane1为DL2000marker,从上到下条带条带从上到下依次为:2kb、1kb、750bp、500bp、250bp、100bp;lane2为阳性对照;lane3为阴性对照;lane4为PBS;lane5为水;lane6为lvCAR19-1761;lane7为lvCAR19-1762;lane8为lvCAR19-1763;lane9为lvCAR19-1764;lane10为lvCAR19-1765;lane11为lvCAR19-1766;lane12为lvCAR19-1767;lane13为lvCAR19-1768;lane14为lvCAR19-1769;图11为mRNA相对表达量的柱状图;图12为CAR蛋白表达量的WB检测图;其中,图12A,lane1为PBMC空细胞,lane2为对照病毒MOCK,lane3为lvCAR19-1761,lane4为lvCAR19-1762,lane5为lvCAR19-1763,lane6为lvCAR19-1764,lane7为lvCAR19-1765,lane8为lvCAR19-1766,lane9为lvCAR19-1767,lane10为lvCAR19-1768,lane11为lvCAR19-1769;图12B,是beta-actin内参条带;图13为IL-6敲减重组慢病毒lvCAR19-1761~lvCAR19-1769与靶细胞孵育后,4h和24h上清中CBA的检测结果;图13A是4h的CBA检测结果;图13B是24h的CBA检测结果;图14为不同效应细胞分别与靶细胞共培养条件下,4h和24h上清中IL-6含量的变化情况;图15为不同效应细胞分别与靶细胞共培养条件下,24hmRNA转录水平的变化情况;图16为不同效应细胞分别与靶细胞以10:1的比例共培养条件下,24h后检测对靶细胞的杀伤情况,E为效应细胞,T为靶细胞。具体实施方式以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例1构建重组慢病毒载体一、材料1、慢病毒骨架质粒pLenti-3Gsilencer,慢病毒包装质粒pPac-GP、pPac-R以及膜蛋白质粒pEnv-G,HEK293T/17细胞、同源重组酶、OligoAnnealingBuffer由世翱(上海)生物医药科技有限公司提供;2、引物:根据引物设计原则设计扩增DNA片段和靶位点所需的引物,具体为:EF1α-F:5’-ATTCAAAATTTTATCGATGCTCCGGTGCCCGTCAGT-3’(SEQIDNO.25)EF1α-R:5’-TCACGACACCTGAAATGGAAGA-3’(SEQIDNO.26)CD8leader-F:5’-GGTGTCGTGAGGATCCGCCACCATGGCCTTACCAGTGACCGC-3’(SEQIDNO.27)CD8leader-R:5’-GTGTCATCTGGATGTCCGGCCTGGCGGCGTG-3’(SEQIDNO.28)VL-F:5’-CACGCCGCCAGGCCGGACATCCAGATGACACAGACTACATC-3’(SEQIDNO.29)VL-R:5’-TGTGATCTCCAGCTTGGTCC-3’(SEQIDNO.30)OLC-VH-F:5’-CAAGCTGGAGATCACAGGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCTGAGGTGAAACTGCAGGAGTCA-3’(SEQIDNO.31)VH-R:5’-TGAGGAGACGGTGACTGAGGT-3’(SEQIDNO.32)CD8Hinge-F:5’-AGTCACCGTCTCCTCAACCACGACGCCAGCGCC-3’(SEQIDNO.33)CD8Hinge-R:5’-GTAGATATCACAGGCGAAGTCCA-3’(SEQIDNO.34)CD8Transmembrane-F:5’-CGCCTGTGATATCTACATCTGGGCGCCCTTGGC-3’(SEQIDNO.35)CD8Transmembrane-R:5’-TCTTTCTGCCCCGTTTGCAGTAAAGGGTGATAACCAGTG-3’(SEQIDNO.36)CD137-F:5’-AAACGGGGCAGAAAGAAACTC-3’(SEQIDNO.37)CD137-R:5’-TGCTGAACTTCACTCTCAGTTCACATCCTCCTTCTTCTTC-3’(SEQIDNO.38)TCR-F:5’-AGAGTGAAGTTCAGCAGGAGCG-3’(SEQIDNO.39)TCR-R:5’-GGAGAGGGGCGTCGACTTAGCGAGGGGGCAGGGC-3’(SEQIDNO.40)siRNA1761-F(negativecontrol):5’-CCGGTTCTCCGAACGTGTCACGTCTCGAGACGTGACACGTTCGGAGAATTTTTG-3’(SEQIDNO.41)siRNA1761-R(negativecontrol):5’-AATTCAAAAATTCTCCGAACGTGTCACGTCTCGAGACGTGACACGTTCGGAGAA-3’(SEQIDNO.42)siRNA1762-F:5’-CCGGGTGAAGCTGAGTTAATTTATGCTCGAGTAAATTAACTCAGCTTCACATTTTTTTG-3’(SEQIDNO.43)siRNA1762-R:5’-AATTCAAAAAAATGTGAAGCTGAGTTAATTTACTCGAGCATAAATTAACTCAGCTTCAC-3’(SEQIDNO.44)siRNA1763-F:5’-CCGGGCACAGAACTTATGTTGTTCTCTCGAGAACAACATAAGTTCTGTGCCCTTTTTTG-3’(SEQIDNO.45)siRNA1763-R:5’-AATTCAAAAAAGGGCACAGAACTTATGTTGTTCTCGAGAGAACAACATAAGTTCTGTGC-3’(SEQIDNO.46)siRNA1764-F:5’-CCGGCTCAGATTGTTGTTGTTAATGCTCGAGTTAACAACAACAATCTGAGGTTTTTTTG-3’(SEQIDNO.47)siRNA1764-R:5’-AATTCAAAAAAACCTCAGATTGTTGTTGTTAACTCGAGCATTAACAACAACAATCTGAG-3’(SEQIDNO.48)siRNA1765-F:5’-CCGGGCAGCTTTAAGGAGTTCCTGCCTCGAGAGGAACTCCTTAAAGCTGCGCTTTTTTG-3’(SEQIDNO.49)siRNA1765-R:5’-AATTCAAAAAAGCGCAGCTTTAAGGAGTTCCTCTCGAGGCAGGAACTCCTTAAAGCTGC-3’(SEQIDNO.50)siRNA1766-F:5’-CCGGGTGTAGGCTTACCTCAAATAACTCGAGATTTGAGGTAAGCCTACACTTTTTTTTG-3’(SEQIDNO.51)siRNA1766-R:5’-AATTCAAAAAAAAGTGTAGGCTTACCTCAAATCTCGAGTTATTTGAGGTAAGCCTACAC-3’(SEQIDNO.52)siRNA1767-F:5’-CCGGCTCAAATAAATGGCTAACTTACTCGAGAGTTAGCCATTTATTTGAGGTTTTTTTG-3’(SEQIDNO.53)siRNA1767-R:5’-AATTCAAAAAAACCTCAAATAAATGGCTAACTCTCGAGTAAGTTAGCCATTTATTTGAG-3’(SEQIDNO.54)siRNA1768-F:5’-CCGGGATGCTTCCAATCTGGATTCACTCGAGAATCCAGATTGGAAGCATCCATTTTTTG-3’(SEQIDNO.55)siRNA1768-R:5’-AATTCAAAAAATGGATGCTTCCAATCTGGATTCTCGAGTGAATCCAGATTGGAAGCATC-3’(SEQIDNO.56)siRNA1769-F:5’-CCGGCTTCCAATCTGGATTCAATGACTCGAGATTGAATCCAGATTGGAAGCATTTTTTG-3’(SEQIDNO.57)siRNA1769-R:5’-AATTCAAAAAATGCTTCCAATCTGGATTCAATCTCGAGTCATTGAATCCAGATTGGAAG-3’(SEQIDNO.58)WPRE-QPCR-F:5’-CCTTTCCGGGACTTTCGCTTT-3’(SEQIDNO.59)WPRE-QPCR-R:5’-GCAGAATCCAGGTGGCAACA-3’(SEQIDNO.60)Actin-QPCR-F:5’-CATGTACGTTGCTATCCAGGC-3’(SEQIDNO.61)Actin-QPCR-R:5’-CTCCTTAATGTCACGCACGAT-3’(SEQIDNO.62)CAR-QPCR-F:5’-GACTTGTGGGGTCCTTCTCCT-3’(SEQIDNO.63)CAR-QPCR-R:5’-GCAGCTACAGCCATCTTCCTC-3’(SEQIDNO.64)IL6-QPCR-F:5’-GGATTCAATGAGGAGACTT-3’(SEQIDNO.65)IL6-QPCR-R:5’-ATCTGTTCTGGAGGTACT-3’(SEQIDNO.66)3、SEQIDNO.15~SEQIDNO.66所示的DNA序列由上海捷瑞生物工程有限公司合成,并以寡核苷酸干粉或者质粒形式保存;4、工具酶BspEI、EcoRI、BamHI、KpnI、ClaI、T4DNA连接酶均购自NEB公司;5、高保真酶PrimeSTAR、RN购自Takara公司;6、0.22μm-0.8μmPES滤器购自millipore公司;7、质粒抽提试剂盒、琼脂糖凝胶回收试剂盒均购自MN公司;8、感受态细胞TOP10购自tiangen公司;9、NaCl、KCl、Na2HPO4.12H2O、KH2PO4、Trypsin、EDTA、CaCl2、NaOH、PEG6000均购自上海生工;10、Opti-MEM、FBS、DMEM、1640、Pen-Srep、Hepes、购自invitrogen公司;11、BiotinylatedproteinL购自GeneScript公司;13、辣根过氧化物酶标记的二抗、DAB工作液均购自北京中杉金桥;13、ECL+plusTMWesternblottingsystem购自Amersham公司;14、DNeasy试剂盒购自上海捷瑞公司;15、淋巴细胞分离液购自深圳达科为公司;16、phycoerythrin(PE)-conjugatedstreptavidin、CBAkit购自BDBioscience公司;17、SA-HRP购自上海翊圣公司;18、支原体检测试剂盒、内毒素检测试剂盒、CD19+K562细胞购自世翱(上海)公司;19、LDH检测试剂盒购自promega公司;二、重组慢病毒载体lvCAR19-1761~lvCAR19-1769的构建方法。参见图4,本发明所述重组慢病毒载体的构建方法如下:1、将人EF1α启动子、CD8leader嵌合受体信号肽、CD19单链抗体轻链VL、OptimalLinkerC、CD19单链抗体重链VH、CD8Hinge嵌合受体铰链、CD8Transmembrane嵌合受体跨膜区、CD137嵌合受体共刺激因子、TCR嵌合受体T细胞激活域片段克隆至慢病毒骨架质粒pLenti-3Gsilencer,得到重组慢病毒质粒pCAR19-silencer,再将siRNA片段分别连接到pCAR19-silencer中,得到IL-6敲减重组慢病毒质粒pCAR19-1761~pCAR19-1769。(1)将慢病毒骨架质粒pLenti-3Gsilencer使用ClaI和BamHI限制性内切酶进行双酶切,产物经过1.5%的琼脂糖凝胶电泳,确认7381bp的片段V1(图5所示),并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;1、溶胶按200μlNTI/100mggel比例加入溶胶液,50℃水浴放置5-10分钟。2、结合DNA11000g离心30秒,弃去滤液。3、洗膜加入700μlNT3,11000g离心30秒,弃去滤液。4、洗膜重复第三步一次5、晾干11000g离心1分钟,换新的收集管,室温放置1分钟。6、洗脱DNA加入15-30μlNE,室温放置1分钟,11000g离心1分钟,收集滤液。表1琼脂糖凝胶回收步骤(2)用引物EF1α-F和EF1α-R以合成的SEQIDNO.15为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃2min)*35cycle,72℃10min。产物经过1.5%的琼脂糖凝胶电泳,确认1208bp的片段a,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;表250μlPCR反应体系(3)用引物CD8leader-F和CD8leader-R以合成的SEQIDNO.16为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认101bp的片段b,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(4)用引物VL-F和VL-R以合成的SEQIDNO.17为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认336bp的片段c,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(5)用引物OLC-VH-F和VH-R以合成的SEQIDNO.19为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认421bp的片段d,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(6)用引物CD8Hinge-F和CD8Hinge-R以合成的SEQIDNO.20为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认147bp的片段e,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(7)用引物CD8Transmembrane-F和CD8Transmembrane-R以合成的SEQIDNO.21为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认100bp的片段f,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(8)用引物CD137-F和CD137-R以合成的SEQIDNO.22为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认142bp的片段g,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(9)用引物TCR-F和TCR-R以合成的SEQIDNO.23为模板,使用表2中的体系,PCR循环条件为:98℃3min,(98℃10sec,55℃15sec,72℃30sec)*35cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认355bp的片段h,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(10)将DNA片段b、c、d各1μl作为模板,使用表3中的体系,除引物外加入Eppendorf管内,PCR循环条件为:98℃3min,(98℃10sec,60℃10sec,72℃30sec)*6cycle,加入引物CD8leader-F/VH-R,(98℃10sec,60℃10sec,72℃40sec)*24cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认814bp的片段i,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;试剂体积(μl)H2O33.5-1*模板数5×Buffer(withMg2+)10dNTP(各2.5mM)4Primer1(+)(10μM)1Primer2(-)(10μM)1Template1*模板数PrimeSTAR0.5表350μl重叠PCR反应体系(11)将DNA片段e、f、g、h各1μl作为模板,使用表3中的体系,除引物外加入Eppendorf管内,PCR循环条件为:98℃3min,(98℃10sec,60℃10sec,72℃30sec)*6cycle,加入引物CD8Hinge-F/TCR-R,(98℃10sec,60℃10sec,72℃30sec)*24cycle,72℃5min。产物经过1.5%的琼脂糖凝胶电泳,确认704bp的片段j,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(12)将DNA片段V1、a、i、j以5μl总体积且摩尔比1:1:1:1的比例加入Eppendorf管内,加入同源重组酶反应液15μl,混匀后在42℃孵育30分钟,转移至冰上放置2-3分钟,将反应液加入50μlTOP10中,轻轻旋转以混匀内容物,在冰中放置30分钟,将管放到预加温到42℃的恒温水浴锅中热激90秒,快速将管转移到冰浴中,使细胞冷却2-3分钟,每管加900μlLB培养液,然后将管转移到37℃摇床上,温育1小时使细菌复苏,取100μl的转化菌液涂布于AmpLB琼脂平板上,倒置平皿,于恒温培养箱中37℃培养,16小时。挑取克隆进行菌落PCR鉴定,鉴定正确的克隆即为重组慢病毒质粒pCAR19-silencer,对正确的克隆进行酶切鉴定(见图6);(13)将重组慢病毒质粒pCAR19-silencer使用BspEI和EcoRI限制性内切酶进行双酶切,产物经过1.5%的琼脂糖凝胶电泳,确认10029bp的片段V2,并割胶回收置于Eppendorf管内,用MN公司的琼脂糖凝胶回收试剂盒回收相应的片段(见表1),并测定产物的纯度和浓度;(14)将合成好的siRNA1761-F/R~siRNA1769-F/R分别用oligoannealingbuffer溶解成20μM,对应的F和R各取30μl混合。然后将siRNA1761-F&R~siRNA1769-F&R混合物在水浴锅中95℃加热5分钟,然后水浴锅开盖置室温中自然冷却至室温,形成双链寡核苷酸片段。取1μl用于的连接反应(见表4),4℃连接16h,转移至冰上放置2-3分钟,将反应液加入50μlTOP10中,轻轻旋转以混匀内容物,在冰中放置30分钟,将管放到预加温到42℃的恒温水浴锅中热激90秒,快速将管转移到冰浴中,使细胞冷却2-3分钟,每管加900μlLB培养液,然后将管转移到37℃摇床上,温育1小时使细菌复苏,取100μl的转化菌液涂布于AmpLB琼脂平板上,倒置平皿,于恒温培养箱中37℃培养,16小时。挑取克隆进行菌落PCR鉴定,鉴定正确的克隆即为IL-6敲减重组慢病毒质粒pCAR19-1761~pCAR19-1769,对正确的克隆进行测序鉴定(见图7)。试剂体积(μl)H2O13V2310×T4DNAligaseBuffer2T4DNAligase1退火的双链寡核苷酸1表420μl连接反应体系2、重组慢病毒载体lvCAR19-1761~lvCAR19-1769的包装。(1)完全培养基:取出预热好的新鲜培养基,加入10%FBS+5mlPen-Srep,上下颠倒混匀即可;(2)1XPBS溶液:称量NaCl8g,KCl0.2,Na2HPO4.12H2O3.58g,KH2PO40.24g置于1000ml烧杯中,加入900mlMilli-Qgrade超纯水溶解,溶解完成后,使用1000ml量筒定容至1000ml,121℃高温湿热灭菌20min;(3)0.25%Trypsin溶液:称量Trypsin2.5g,EDTA0.19729g置于1000ml烧杯中,加入900ml1XPBS溶解,溶解完成后,使用1000ml量筒定容至1000ml,0.22μM过滤除菌,长期使用可保存至-20℃冰箱;(4)0.5MCaCl2溶液:称量36.75gCaCl2用400mlMilli-Qgrade超纯水溶解;用Milli-Qgrade超纯水将总体积定容至500ml,混匀;0.22μm过滤除菌,分装保存到50ml离心管中,每管45ml左右,4℃保存。(5)2XHBS溶液:称量4.09gNaCl,0.269gNa2HPO4,5.96gHepes,用400mlMilli-Qgrade超纯水溶解;校准pH仪后,用2MNaOH溶液将HBS溶液的pH调到7.05。调整每瓶HBS的PH消耗2MNaOH为3ml左右;(6)从液氮罐中取出冻存的HEK293T/17细胞,迅速转移到37℃水浴中,1~2min后转移到超净台中,无菌操作将冻存管中的液体全部转移至10cm2培养皿中,补足含10%FBS的DMEM至8mL/10cm2dish,24h后显微镜观察细胞,细胞汇合的程度大于80%进行传代;(7)选择细胞状态良好、无污染的HEK293T/17细胞,每2-6个培养皿为一组,将细胞胰酶消化后,用电动移液器吸取4-12ml完全培养基,向每个消化后的培养皿中加2ml,避免培养皿变干;使用1ml移液器将所有细胞吹打成单细胞悬液,转移到培养基瓶中;(8)将上述2-6个培养皿中的剩余细胞转移到培养基瓶中,并用培养基再冲洗一便培养皿;(9)盖紧培养基瓶盖,上下颠倒10次左右充分混匀细胞悬液,将细胞传到8-24个10cm2培养皿中,每皿的细胞密度应当约4×106个/10ml完全培养基左右。如果细胞密度和预期的相差较大,则需要对细胞进行计数,然后按照4×106个/皿的量接种;(10)每6个培养皿整理为一摞,注意保持上下皿之间的配合。将培养皿左右,前后晃动数次,使细胞充分铺开,然后放入5%CO2培养箱。剩余细胞做同样处理;(11)检查所传代细胞,细胞汇合度应当为70-80%,轮廓饱满,贴壁良好,在细胞培养皿中均匀分布;(12)为细胞换液,将培养基替换为新鲜完全培养基,每皿9ml,并将培养箱的CO2浓度设定值提高到8%;(13)按照N+0.5配DNA/CaCl2溶液。每皿HEK293T/17细胞转染质粒量按照下列比例使用:重组慢病毒质粒(20μg),pPac-GP(15μg),pPac-R(10μg),pEnv-G(7.5μg)。取一个新的5ml离心管,加入0.5MCaCl2:0.25ml,重组慢病毒质粒20μg:pPac-GP15μg:pPac-R10μg:pEnv-G7.5μg,补充超纯水至0.5ml盖上盖子,充分混匀;(14)另取一支5ml离心管,加入0.5mlDNA/CaCl2溶液。打开涡旋振荡器,一只手拿住5ml离心管的上端,使管底接触振荡头,使液体在管壁上散开流动,另一只手拿一把1mL移液枪,吸取0.5mL2×HBS溶液,缓慢滴加进入离心管,控制流速,以半分钟滴完为宜。2×HBS加入后,继续振荡5秒钟,停止振荡,可直接加入需要转染的细胞中;(15)取一皿细胞,将离心管中的1mL钙转液滴加进去,尽可能使钙转试剂分布到整个培养皿中;(16)钙转液加入后,在皿盖上做好标记,将培养皿放还到另一个5%CO2培养箱中。确保培养皿水平放置,每摞培养皿不要超过6个。在5%CO2培养箱中放置(6–8h);(17)将第一个培养箱的CO2浓度设定值调回到5%;(18)24小时后,检查细胞状态。细胞汇合度应当为80–85%左右,状态良好。将培养基吸走,更换10ml新鲜的DMEM完全培养基;(19)48小时后,观察转染效率。绝大多数细胞仍然是贴壁的。可以看到超过95%细胞都会带有绿色荧光。将同一个病毒包装上清液收集到一起,并向培养皿中继续添加10mL新鲜培养基;(20)72小时后,再次将同一个病毒上清液收集到一起,两次收集的病毒可以放在一起,丢弃培养皿;此时收集的上清里包含了重组慢病毒载体lvCAR19-1761~lvCAR19-1769。实施例2重组慢病毒载体的浓缩及检测一、离子交换色谱法纯化重组慢病毒载体(如图8所示);(1)将收集的上清液使用Thermo真空泵,经0.22μm-0.8μm的PES滤器抽滤,除去杂质;(2)按1:1~1:10的比例往上清中加入1.5MNaCl250mMTris-HCl(pH6-8);(3)将2个离子交换柱串联放置,用4ml1MNaOH、4ml1MNaCl、5ml0.15MNaCl25mMTris-HCl(pH6-8)溶液依次过柱;(4)将步骤2中获得的溶液通过蠕动泵以1-10ml/min的速度给离子交换柱上样;(5)全部上清液过柱后,使用10ml0.15MNaCl25mMTris-HCl(pH6-8)溶液清洗一遍;(6)根据上样量使用1-5ml1.5MNaCl25mMTris-HCl(pH6-8)进行洗脱,收集洗脱液;(7)将洗脱液分成25到50μl一管,冻存到-80℃冰箱,进行长期保存;二、滴度测定;(1)取24孔板接种293T细胞。每孔细胞为5×104个,所加培养基体积为500ul,不同种类的细胞生长速度有所差异,进行病毒感染时的细胞融合率为40%-60%;(2)准备3个无菌EP管,在每个管中加入90ul的新鲜完全培养基(高糖DMEM+10%FBS)接种细胞24小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N;(3)取待测定的病毒原液10ul加入到第一个管中,轻轻混匀后,取10ul加入到第二个管中,然后依次操作直到最后一管;在每管中加入410ul完全培养基(高糖DMEM+10%FBS),终体积为500ul;(4)感染开始后20小时,除去培养上清,更换为500μl完全培养基(高糖DMEM+10%FBS),5%CO2继续培养48小时;(5)72小时后,观察荧光表达情况,正常情况下,荧光细胞数随稀释倍数增加而相应减少,并拍照;(6)用0.2ml0.25%胰酶-EDTA溶液消化细胞,在37℃放置1分钟。用培养基吹洗整个细胞面,离心收集细胞。按照DNeasy试剂盒的说明抽提基因组DNA。每个样品管中加入200μl洗脱液洗下DNA并定量;(7)准备目的DNA检测qPCRmix总管Ⅰ(QPCR引物序列为SEQIDNO.59---SEQIDNO.60):n=numberofreactions.例如:总反应数为40,将1ml2×TaqManUniversalPCRMasterMix,4μlforwardprimer,4μlreverseprimer,4μlprobe和788μlH2O混和。震荡后放在冰上;(8)准备内参DNA检测qPCRmix管Ⅱ(QPCR引物序列为SEQIDNO.61---SEQIDNO.62):n=numberofreactions.例如:总反应数为40,将1ml2×TaqManUniversalPCRMasterMix,100μl10×RNasePprimer/probemix和700μlH2O混和。震荡后放在冰上;(9)在预冷的96孔PCR板上完成PCR体系建立。从总管Ⅰ中各取45μl加入到A-D各行的孔中,从总管Ⅱ中各取45μl加入到E-G各行的孔中。(10)分别取5μl质粒标准品和待测样品基因组DNA加入到A-D行中,每个样品重复1次。另留1个孔加入5μl的水做为无模板对照(no-templatecontrol)。(11)分别取5μl基因组标准品和待测样品基因组DNA加入到E-G行中,每个样品重复1次。另留1个孔加入5μl的水做为无模板对照(no-templatecontrol)。(12)所使用定量PCR仪为ABIPRISM7500定量系统。循环条件设定为:50℃2分钟,95℃10分钟,然后是95℃15秒,60℃1分钟的40个循环。数据分析:测得的DNA样品中整合的慢病毒载体拷贝数用基因组数加以标定,得到每基因组整合的病毒拷贝数。滴度(integrationunitsperml,IUml-1)的计算公式如下:IUml-1=(C×N×D×1000)/V其中:C=平均每基因组整合的病毒拷贝数N=感染时细胞的数目(约为1×105)D=病毒载体的稀释倍数v=加入的稀释病毒的体积数(13)重组慢病毒载体lvCAR19-1761~lvCAR19-1769的滴度结果(如图9所示);三、内毒素测定;(1)、内毒素工作标准品为15EU/支;(2)、鲎试剂灵敏度λ=0.25EU/ml,0.5ml/管(3)、内毒素标准品稀释:取内毒素标准品一支,分别用BET水按比例稀释成4λ和2λ的溶解,封口膜封口,震荡溶解15min;稀释时每稀释一步均应在漩涡混合器上混匀30s;(4)、加样:取鲎试剂若干支,每支加入BET水0.5ml溶解,分装至若干支无内毒素试管中,每管0.1ml。其中2支为阴性对照管,加入BET水0.1ml;2支为阳性对照管,加入2λ浓度的内毒素工作标准品溶液0.1ml;2支为样品阳性对照管,加入0.1ml含2λ内毒素标准品的样品溶液(稀释20倍的待测样品1ml+4λ的内毒素标准品溶液1ml=2ml含2λ内毒素标准品的稀释40倍样品)。样品管中加入0.1ml样品,稀释比例见表5,37±1℃水浴(或培养箱)保温60±1min;表5内毒素稀释比例及对应内毒素含量(5)、重组慢病毒载体lvCAR19-1761~lvCAR19-1769的内毒素检测结果(如表6所示),内毒素含量在0~2.5EU/ml之间,符合要求;稀释倍数原液510204080160对应EU/ml0.251.252.55102040lvCAR19-1761(+)(+)(-)(-)(-)(-)(-)lnCAR19-1762(+)(+)(+)(-)(-)(-)(-)lvCAR19-1763(+)(+)(-)(-)(-)(-)(-)lvCAR19-1764(+)(+)(-)(-)(-)(-)(-)lvCAR19-1765(-)(-)(-)(-)(-)(-)(-)lvCAR19-1766(+)(-)(-)(-)(-)(-)(-)lvCAR19-1767(+)(+)(-)(-)(-)(-)(-)lvCAR19-1768(+)(+)(-)(-)(-)(-)(-)lvCARl9-1769(+)(+)(+)(-)(-)(-)(-)表6内毒素检测结果四、支原体测定及比较;(1)在实验前三日,细胞样品用无抗生素培养基进行培养;(2)收集1ml细胞悬浮液(细胞数大于1*105),置于1.5ml离心管中;(3)13000×g离心1min,收集沉淀,弃去培养基;(4)加入500ulPBS用枪头吹吸或涡旋振荡,重悬沉淀。13000×g离心5min;(5)步骤4重复一次;(6)加入50μlCellLysisBuffer,用枪头吹吸,充分混匀后,在55℃水浴中孵育20min;(7)将样品置于95℃中加热5min;(8)13000×g离心5min后,取5μl上清作为模板,25μlPCR反应体系为:ddH206.5μl、MycoMix1μl、2xTaqPlusMixMaster(DyePlus)12.5μl、模板5μl;PCR循环条件为:95℃30sec,(95℃30sec,56℃30sec,72℃30sec)*30cycle,72℃5min。(9)支原体检测结果显示(如图10和表7所示),重组慢病毒载体lvCAR19-1761~lvCAR19-1769均不含支原体。表7支原体检测结果实施例3重组慢病毒载体lvCAR19-1761~lvCAR19-1769的功能检测。一、CAR基因的细胞水平表达检测:(1)重组慢病毒载体lvCAR19-1761~lvCAR19-1769和对照病毒MOCK感染PBMC细胞后,收集细胞采用RT-PCR进行CARmRNA转录水平的检测,验证CAR基因的表达,如果CARmRNA转录水平增高,则说明CAR基因的转录水平表达成功;(2)重组慢病毒载体lvCAR19-1761~lvCAR19-1769和对照病毒MOCK感染PBMC细胞后,收集细胞采用westernblot进行CAR蛋白表达水平的检测,验证CAR基因的表达,如果CAR蛋白表达水平增高,则说明CAR基因的翻译水平表达成功;(3)分别将MOI=15的lvCAR19-1761~lvCAR19-1769和对照病毒MOCK感染细胞,48h后提取6孔板中细胞的总RNA和总蛋白分别进行荧光定量PCR实验和免疫印迹实验。具体步骤:包被6孔板的四个孔,每个孔加入相应的PBS和RN,4℃过夜。12小时后按MOI=15包被病毒,37℃培养箱放置5h;取出的6孔板,弃掉病毒上清,用PBS洗两遍,按1*106/孔,包被PBMC(用淋巴细胞分离液从人血中分离),加入500ul培养基(含10%血清、20U/mlIL-2、Polybrene8ug/ml)。静置20min,1000g20℃离心30min,37℃培养48h。(4)Trizol法提取6孔板中PBMC细胞的总RNA,逆转录扩增cDNA,用QPCR引物(序列为SEQIDNO.63---SEQIDNO.64)进行荧光定量PCR实验,反应体系见表8,以内参Actin为对照组,验证其mRNA的转录情况。试剂体积(μl)SYBRpremixextaq:10μlROXReverseDye(50x)0.4μl上游引物(2.5μM):0.5μl下游引物(2.5μM):0.5μlcDNA1.0μlddH2O7.6μl表820μlqPCR反应体系(5)蛋白免疫印迹(WesternBlot)通过聚丙烯酰胺凝胶电泳将从PBMC中提取的总蛋白质按相对分子质量分离。采用湿转(4℃,400mA,120min),将蛋白转移到PVDF膜上。用封闭液(含5%脱脂牛奶的TBST溶液)室温封闭PVDF膜1h,封闭液1:1000稀释BiotinylatedproteinL,然后与封闭好的PVDF膜室温孵育4℃过夜。TBST洗膜3次,每次10min。封闭液1:500稀释相应的SA-HRP,室温下孵育PVDF膜2h,TBST洗膜3次,每次10min。采用Amersham公司ECL+plusTMWesternblottingsystem试剂盒进行显色。X光显影获得显示条带的胶片。(6)RT-QPCR检测显示,重组慢病毒载体感染PBMC后的CAR基因的转录水平比对照病毒MOCK和空细胞有明显升高(如图11和表9所示),说明CAR基因的转录水平表达成功。表9(7)蛋白免疫印迹(WesternBlot)的结果表明,重组慢病毒载体感染PBMC后CAR蛋白的表达水平比对照病毒MOCK和空细胞有明显升高(如图12所示),说明CAR基因的翻译水平表达成功。二、IL-6敲减效果评估(mRNA转录水平和上清中IL-6的表达水平)。(1)分别培养CD19+K562细胞和PBMC细胞;(2)实验开始前4天,MOI=15的lvCAR19-1761~lvCAR19-1769的病毒感染PBMC细胞,培养72-96h后可安排开始实验;(3)收集靶细胞(CD19+K562)4x105cells和效应细胞(lvCAR19-1761-PBMC~lvCAR19-1769-PBMC细胞)2.8x106cells,800g,6min离心,弃上清;(4)用1ml1xPBS溶液分别重悬靶细胞和效应细胞,800g,6min离心,弃上清;(5)重复步骤4一次;(6)用700ul培养基(1640培养基+10%FBS)重悬效应细胞,用2ml培养基(1640培养基+10%FBS)重悬靶细胞;(7)设置效靶比为10:1的实验孔,并设置对照组;(8)250xg,5min平板离心;(9)37℃5%CO2培养箱中共培养4小时,收集100ul共培养上清,做CBA检测IL-6含量;(10)继续37℃5%CO2培养箱中共培养至24小时,1000xg,2min平板离心,收集100ul共培养上清做CBA检测IL-6含量,收集细胞检测IL-6mRNA转录水平;(11)CBA检测IL-6含量的步骤为,IL-6标准品管、样品管、阴性对照管中各加入50ulIL-6捕获微球悬液,加样前混匀微球;各管分别加入50ulPE信号抗体;IL-6标准品管加入IL-6标准品稀释液;样品管、阴性对照管中分别加入稀释后样品和阴性对照液;室温避光孵育3h;各管加入1ml洗液,200xg离心5min;弃上清;各管加入300ul洗液,重新悬浮微球;使用NxT流式细胞仪分析样本,当日上机,上机前充分混匀3-5s;(12)Trizol法提取上述混合细胞的总RNA,逆转录扩增cDNA,用QPCR引物(序列为SEQIDNO.65---SEQIDNO.66)进行荧光定量PCR实验,反应体系见表6,以内参Actin为对照组,验证其mRNA的转录情况。(13)4h和24h的CBA检测结果(如图13所示),IL-6敲减重组慢病毒载体感染PBMC并与靶细胞孵育后,IL-6基因的上清含量比对照病毒lvCAR19-1761和空细胞有明显降低(如图14所示),说明IL-6基因的表达水平明显降低。(14)RT-QPCR检测结果显示,IL-6敲减重组慢病毒载体感染PBMC并与靶细胞孵育后,IL-6基因的mRNA比对照病毒lvCAR19-1761和空细胞有明显降低(如图15所示),说明IL-6基因的转录水平明显降低。三、细胞杀伤实验效果评估。(1)分别培养CD19+K562细胞和PBMC细胞;(2)实验开始前4天,MOI=15的lvCAR19-1761~lvCAR19-1769的病毒感染PBMC细胞,培养72-96h后可安排开始实验;(3)收集靶细胞(CD19+K562)4x105cells和效应细胞(CART细胞)2.8x106cells,800g,6min离心,弃上清;(4)用1ml1xPBS溶液分别重悬靶细胞和效应细胞,800g,6min离心,弃上清;(5)重复步骤3一次;(6)用700ul培养基(1640培养基+10%FBS)重悬效应细胞,用2ml培养基(1640培养基+10%FBS)重悬靶细胞;(7)设置效靶比为1:1、5:1、10:1的实验孔,并设置对照组,每组3个复孔;(8)250xg,5min平板离心;(9)37℃5%CO2培养箱中培养4小时;(10)250xg,5min平板离心;(11)取每个孔的50ul上清到新96孔板中,并且每孔加入50ul底物溶液(避光操作);(12)避光孵育25分钟;(13)每孔加入50ul终止液;(14)酶标仪检测490nm吸光度;(15)将3个复孔取平均值;将所有实验孔、靶细胞孔和效应细胞孔的吸光值减去培养基背景吸光值的均值;将靶细胞最大值的吸光值减去体积校正对照吸光值的均值。(16)将步骤15中获得的经过校正的值带入下面公式,计算每个效靶比所产生的细胞毒性百分比。结果如图16所示,,IL-6敲减重组慢病毒载体转导的PBMC细胞在10:1效靶比条件下杀伤效率明显高于PBMC空细胞,低于对照病毒lvCAR19-1761转导的PBMC细胞;其中lvCAR19-1763-PBMC杀伤效率略低于对照病毒lvCAR19-1761-PBMC,但是IL-6的表达水平下降超过70%,将来可以在杀伤肿瘤细胞的同时,释放较少的IL-6,有效缓解CRS。杀伤效率=(实验孔-效应细胞孔-靶细胞孔)/(靶细胞最大孔-靶细胞孔)X100%以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1