OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制作方法
本发明涉及一种OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用。
背景技术:
由稻黄单胞水稻致病变种(Xanthomonas oryzae pv.oryzae,Xoo)引起的白叶枯病是全球稻作栽培中重要的细菌性病害之一,在我国华南和东南亚稻区危害严重。水稻白叶枯病一般可导致水稻减产10%左右,严重时可减产50%-60%。利用抗性基因,培育抗病品种是防治水稻白叶枯病最经济有效的措施。采用表型鉴定、遗传分析和基因定位等方法相结合,目前,国内外已发现报道40个水稻抗白叶枯病基因。然而,在已报道的水稻白叶枯病抗性基因中,由于来源于野生稻的抗病基因难以利用、部分抗病基因的抗性仅在水稻成株期以后表达以及大多抗性基因的抗谱较窄等原因,长期以来,仅Xa3、Xa4、Xa7、Xa21和Xa23等几个基因在生产中得以应用。水稻白叶枯病菌具有复杂的多样性和高度的变异性,携带单一主效基因的抗病品种大面积推广种植后,潜在的毒性小种上升为优势小种或由于病菌变异出现新的毒性小种,品种迅速抗性丧失,这是长期困扰育种家和植物病理学家的一个难题。因此,发掘和利用新基因,提高水稻对白叶枯病的抗性,对于水稻稳产具有重要的意义。
技术实现要素:
本发明的目的是提供一种OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用。
本发明提供了一种培育转基因水稻的方法,包括如下步骤:将编码OsSAPK9蛋白的基因导入出发水稻,得到对白叶枯病的抗性提高的转基因水稻。
所述OsSAPK9蛋白,获自水稻,是如下(a)或(b):
(a)由序列表中序列2所示的氨基酸序列组成的蛋白质;
(b)将序列2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与植物白叶枯病抗性相关的由序列2衍生的蛋白质。
为了使(a)中的OsSAPK9蛋白便于纯化和检测,可在由序列表中序列2所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1标签的序列
上述(b)中的OsSAPK9可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的OsSAPK9蛋白的编码基因可通过将序列表中序列1所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。
所述“编码OsSAPK9蛋白的基因(简称OsSAPK9基因)”为如下(1)或(2)或(3):
(1)编码区如序列表的序列1自5’末端第1-1086位核苷酸所示的DNA分子;
(2)在严格条件下与(1)限定的DNA序列杂交且编码具有抗白叶枯病功能的蛋白质的DNA分子;
(3)与(1)或(2)限定的DNA序列具有90%以上同源性且编码具有抗白叶枯病功能的蛋白质的DNA分子。
上述严格条件可为用0.1×SSPE(或0.1×SSC),0.1%SDS的溶液,在DNA或者RNA杂交实验中65℃下杂交并洗膜。
所述方法中,所述OsSAPK9基因可以通过重组表达载体导入出发水稻。所述重组表达载体可通过Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化到水稻细胞或组织中。
所述重组表达载体具体可为将载体pMDC43中插入了序列表的序列1所示的双链DNA分子得到的重组质粒。
本发明还保护所述OsSAPK9蛋白的应用,为如下(c1)或(c2):
(c1)调控水稻对白叶枯病的抗性;
(c2)提高水稻对白叶枯病的抗性。
本发明还保护所述OsSAPK9基因的应用,为如下(c1)或(c2):
(c1)调控水稻对白叶枯病的抗性;
(c2)提高水稻对白叶枯病的抗性。
本发明还保护以上任一所述方法在水稻育种中的应用。
所述水稻育种的目的是选育对白叶枯病抗性高的水稻。
本发明还保护一种水稻育种方法,包括如下步骤:增加水稻中所述OsSAPK9蛋白的表达量和/或活性,从而促使水稻对白叶枯病的抗性提高。
本发明还保护一种培育转基因水稻的方法,包括如下步骤:抑制目的水稻中所述OsSAPK9基因的表达,得到对白叶枯病的抗性降低的转基因水稻。
所述“抑制目的水稻中所述OsSAPK9基因的表达”是通过导入RNAi载体实现的。
所述RNAi载体可通过Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化到水稻细胞或组织中。
所述RNAi载体具体可为含有干扰片段的重组载体;所述干扰片段如序列表的序列3所示。
所述RNAi载体具体可为将载体pH7GWIWG2(II)中插入了序列表的序列3所示的双链DNA分子得到的重组质粒。
所述序列3为OsSAPK9基因编码区终止密码子后第787位-第1339位核苷酸对应的区段。
本发明还保护一种特异DNA分子或所述特异DNA分子转录得到的RNA分子或所述特异DNA分子编码的siRNA;所述DNA分子如序列表中序列3所示。
本发明还保护一种降低水稻对白叶枯病的抗性的方法,包括如下步骤:减少目的水稻中所述OsSAPK9蛋白的表达量和/或活性,得到对白叶枯病的抗性降低的水稻。
以上任一所述水稻具体可为水稻品系9804。
以上任一所述白叶枯病是由白叶枯病致病菌引起的。所述白叶枯病致病菌具体可为水稻黄单胞菌水稻致病变种(Xoo),更具体可为生理小种ZHE173。
本发明通过研究发现,水稻植株接种水稻白叶枯病菌(水稻黄单胞菌水稻致病变种)后OsSAPK9基因上调表达,表明该基因可能参与调控水稻对白叶枯病的抗性,进一步研究发现抑制OsSAPK9表达,水稻对白叶枯病的感病性提高;OsSAPK9过表达的水稻植株对白叶枯病的抗性显著增强,表明该基因可以用于改良水稻对白叶枯病的抗性。本发明对于培育抗白叶枯病水稻新品种具有重要的意义,适合于推广应用。
附图说明
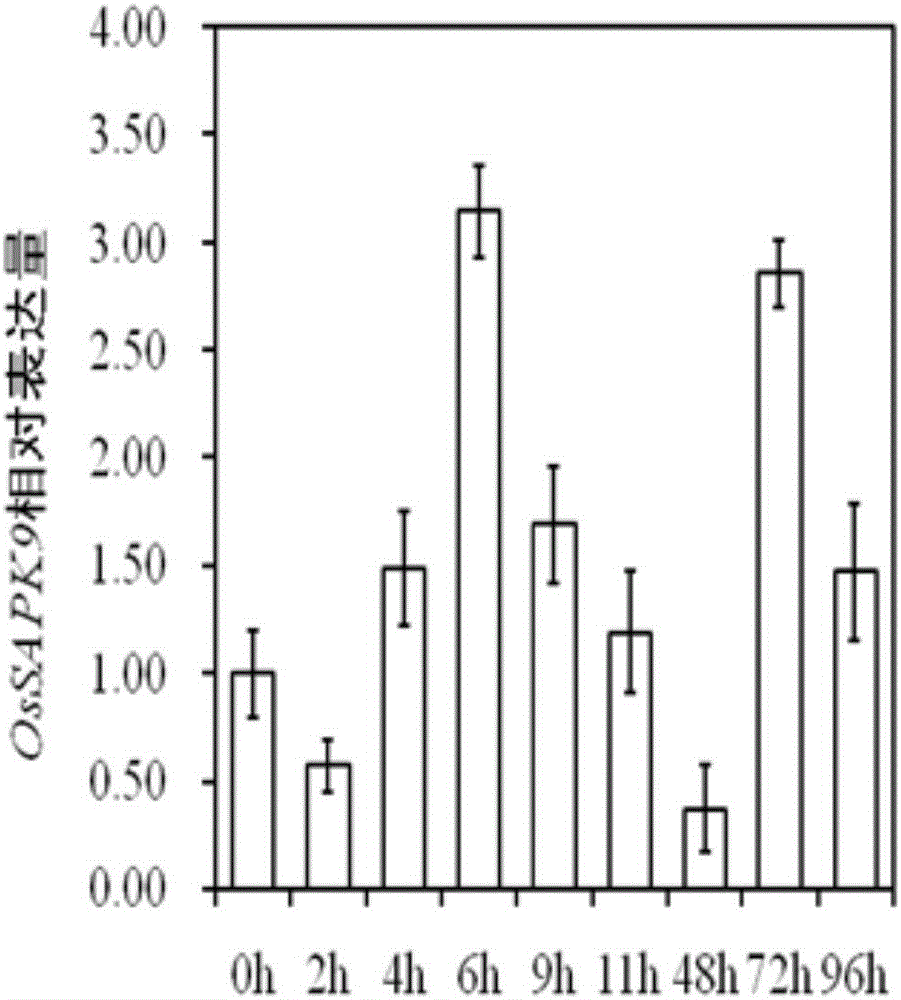
图1为实施例1中水稻品系9804接种Xoo菌株ZHE173后OsSAPK9的表达情况。
图2为实施例2中部分RNAi转基因植株的PCR鉴定结果。
图3为实施例2中野生型植株和RNAi转基因植株中OsSAPK9的表达情况。
图4为实施例2中野生型植株和RNAi转基因植株的Southern杂交结果。
图5为实施例2中野生型植株和RNAi转基因植株叶片的病斑长度。
图6为实施例3中部分转基因植株的PCR鉴定结果。
图7为实施例3中野生型植株和转基因植株的Western blot结果。
图8为实施例3中野生型植株和转基因植株叶片的病斑长度。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
OsSAPK9基因的编码区序列如序列表的序列1所示,编码序列表的序列2所示的蛋白质(OsSAPK9蛋白)。
水稻品系9804(简称9804水稻):参考文献:谢学文,于晶,徐建龙,周永力,黎志康.玉米细菌性条斑病非寄主抗性基因Rxol转化水稻的研究.生物工程学报,2007,23(4):607-611.;公众可以从中国农业科学院作物科学研究所获得。
Xoo菌株ZHE173:浙江省农业科学院植物保护研究所。参考文献:李欣,于慧春,庞新跃,等.水稻白叶枯病菌内源过氧化氢的产生及定位[J].南京农业大学学报,2009,32(3):160-163.;公众可以从中国农业科学院作物科学研究所获得。
载体pDONR201:Invitrogen公司,货号:11798-014。
载体pH7GWIWG2(II):参考文献:徐品三,白建芳,刘纪文,等.Gateway技术快速构建百合双价抗病毒RNAi表达载体[J].中国农学通报,2011,27(4):144-147.;公众可以从中国农业科学院作物科学研究所获得。
载体pMDC43:BioVector NTCC典型培养物保藏中心。
根癌农杆菌EHA105:BioVector NTCC典型培养物保藏中心。
诱导培养基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgSO4·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB6 0.5mg,烟酸0.5mg,肌醇100mg,甘氨酸2mg,2,4-D 2mg,水解酪蛋白2g,麦芽糖30g,琼脂3g,去离子水加至1L。
侵染培养基:配制方法参见参考文献:Hiei Y,Ohta S,Komari T,etal.Efficient transformation of rice(Oryza sativa,L.)mediated by Agrobacterium,and sequence analysis of the boundaries of the T-DNA[J].Plant Journal,1994,6(2):271-282.。将参考文献中乙酰丁香酮的浓度替换为200μM。
共培养培养基:在诱导培养基中加入乙酰丁香酮和葡萄糖,使乙酰丁香酮在培养基中的终浓度为200μM,葡萄糖在培养基中的终浓度为10g/L。
抑菌培养基:在诱导培养基中头孢霉素,使头孢霉素在培养基中的终浓度为500mg/L。
筛选培养基:在诱导培养基中加入潮霉素和头孢霉素,使潮霉素在培养基中的终浓度为65mg/L,头孢霉素在培养基中的终浓度为500mg/L。
预再生培养基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgSO4·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB60.5mg,烟酸0.5mg,肌醇100mg,甘氨酸2mg,水解酪蛋白2g,麦芽糖30g,琼脂3g,激动素2mg,萘乙酸1mg,去离子水加至1L;倒平板之前加入潮霉素并使其浓度为50mg/L。
再生培养基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgS04·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB6 0.5mg,烟酸0.5mg,肌醇100mg,甘氨酸2mg,水解酪蛋白2g,麦芽糖30g,琼脂6g,激动素2mg,萘乙酸1mg,去离子水加至1L;倒平板之前加入潮霉素并使其浓度为50mg/L。
DNA Maker:Biomed,货号:MD102。
实施例1、OsSAPK9基因表达分析
1、将9804水稻的种子播于盛有灭菌土壤的育秧盘中,在温室中培养25天后移栽到网室中,单株种植。
2、在步骤1水稻植株的分蘖盛期,用Xoo菌株ZHE173,采用剪叶法对水稻植株进行人工接种,每株接种5张叶片。
3、完成步骤2人工接种的0、2、4、6、9、11、48、72、96h,剪取接种的叶片,迅速放入液氮中速冻,每样品各取三个生物学重复。所有样品液氮速冻后置-70℃保存。
4、取步骤3得到的样品,提取样品的总RNA,反转录为cDNA。
5、以步骤4得到的cDNA为模板,进行qRT-PCR反应,采用引物F和引物R检测OsSAPK9基因的表达水平,采用引物Actin-F和引物Actin-R检测内参基因(Actin基因)的表达水平。
F:5′-ATCAGTCTACAAGCCAGTCCAG-3′;
R:5′-TCCTCATCGCTCAAGTCCC-3′;
Actin-F:5′-GACTCTGGTGATGGTGTCAGC-3′;
Actin-R:5′-GGCTGGAAGAGGACCTCAGG-3′。
qRT-PCR反应体系为:10×buffer 2.5μL,dNTP 10mM(Mg2+,25mM)0.5μL,TaqDNA聚合酶0.5μL,模板cDNA 2μL(200-400ng),引物F 1μL,引物R 1μL,ddH2O 17.5μL。在反应体系中,引物F和引物R的浓度均为10μM。
qRT-PCR反应条件为:95℃5min;95℃30s,55℃30s,72℃30s,30个循环;72℃10min。
qRT-PCR分析结果显示溶解曲线均为单峰,扩增产物特异性好,荧光曲线可以很好地反应扩增结果。对结果进行分析,结果如图1所示。结果表明,在接种Xoo菌株ZHE173后,9804水稻叶片中OsSAPK9的表达量随着接种时间的推移逐渐升高,接种6h后达到峰值,随后又逐渐下降,在72h后,又达到另一峰值。
实施例2、OsSAPK9基因功能分析
一、OsSAPK9基因RNAi载体构建
1、提取9804水稻叶片的总RNA,反转录为cDNA。
2、以步骤1得到cDNA为模板,采用引物attB-F和引物attB-R进行PCR扩增,得到扩增产物。
attB-F:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCCAGGTTGACACACTGCGAA-3′;
attB-R:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTAGTGCTTATCCTCAACTTCGC-3′。
3、通过BP反应,将步骤2得到的扩增产物导入载体pDONR201,得到含有序列表的序列3所示的双链DNA分子的阳性入门克隆质粒pDONR201-OsSAPK9i(已经测序验证)。
BP反应体系:扩增产物2.7μL(50-100ng),载体pDONR201 1.0μL(30-50ng),5×BP Reaction Buffer 1.0μL,BP Enzyme mix 0.3μL。
BP反应条件:25℃温浴1h。
4、取步骤3得到的阳性入门克隆质粒pDONR201-OsSAPK9i,与载体pH7GWIWG2(II)进行LR反应,得到含有序列表的序列3所示的双链DNA分子的RNAi表达载体pH7GWIWG2(II)-OsSAPK9i(已经测序验证)。
LR反应体系:入门克隆质粒pDONR201-OsSAPK9i1μL(50-100ng),载体pH7GWIWG2(II)1μL(50-100ng),LR enzyme mix 0.5μL。
LR反应条件:25℃温浴1h。
二、RNAi转基因水稻的获得
1、取9804水稻的成熟种子,机械脱壳,挑取饱满光洁无菌斑的种子进行消毒。
2、将步骤1消毒后的种子接种到诱导培养基28℃、暗培养14天左右,选取外观良好,生长力好的愈伤组织。
3、取步骤一构建的表达载体pH7GWIWG2(II)-OsSAPK9i,导入根癌农杆菌EHA105,得到重组菌EHA105/OsSAPK9i。
4、取步骤3得到的重组菌EHA105/OsSAPK9i,用侵染培养基重悬菌体,得到菌悬液。
5、将完成步骤2的愈伤组织浸泡于步骤4制备的菌悬液中,侵染20min。侵染后将菌悬液倒掉,取愈伤组织,用无菌滤纸吸干水分,然后置于共培养培养基上,培养28℃暗培养50-55h。
6、完成步骤5后,挑选表面没有明显农杆菌的愈伤组织移至抑菌培养基中,28℃暗培养3-4天。
7、完成步骤6后,将愈伤组织移至筛选培养基上28℃暗培养培养30天,每10天继代一次。
8、完成步骤7后,取新鲜潮霉素抗性的愈伤组织,接于预再生培养基中,28℃暗培养7天,然后置于光照培养间(12h光照/12h黑暗)继续培养7天后转入再生培养基上,继续光照培养,直至生长出再生植株,得到T0代植株。T0代植株自交,得到T1代植株。T1代植株自交,得到T2代植株。T2代植株自交,得到T3代植株。
三、RNAi转基因水稻的鉴定
1、取步骤二获得的各个株系的T2代植株,提取植株叶片的总RNA并反转录为cDNA。以cDNA为模板,采用引物Hyg-F和Hyg-R进行PCR鉴定。采用RNAi表达载体pH7GWIWG2(II)-OsSAPK9i作为阳性对照,采用9804水稻的cDNA作为阴性对照。
Hyg-F:5’-CTATTTCTTTGCCCTCGGAC-3’:
Hyg-R:5’-CCTGACCTATTGCATCTCCC-3’。
如果对于某一T0代植株,其抽样检测的T2代植株的PCR鉴定结果均为阳性,该T0代植株及其自交后代为一个纯合的RNAi转基因株系。
部分植株的PCR鉴定结果如图2所示。图2中,M为DNA Maker,+为阳性对照,-为阴性对照,泳道1-10依次对应10个不同株系的T2代植株。结果表明,10个株系的植株均能扩增出与质粒载体潮霉素基因一致的特异条带,表明了带如t/hyg标记基因的T-DNA已经插入并整合到受体基因组中,10个株系均为纯合的RNAi转基因株系。
2、选取步骤1RNAi转基因株系中的2个RNAi转基因株系(命名为Ri-21、Ri-27)的T2代植株,采用qRT-PCR分析各株系中OsSAPK9基因的表达量的变化,鉴定转基因株系的RNAi效率。结果如图3所示。结果显示:RNAi转基因株系Ri-21和Ri-27植株中OsSAPK9基因显著下调表达。
3、为检测外源基因OsSAPK9在水稻基因组中的整合情况,选取RNAi转基因株系Ri-21和Ri-27的T2代植株,对其基因组DNA进行HindIII单酶切,以Hyg基因标记探针进行Southern杂交。结果如图4所示,杂交结果显示转基因株系Ri-21是双拷贝整合,Ri-27是三拷贝整合。
四、转空载体株系的获得
采用表达载体pH7GWIWG2(II)替代表达载体pH7GWIWG2(II)-OsSAPK9i按照步骤二的1-8进行操作,得到转空载体株系。
五、RNAi转基因株系的白叶枯病抗性鉴定
待测植株为:9804水稻(野生型)、RNAi转基因株系Ri-21的T3代植株、RNAi转基因株系Ri-27的T3代植株、转空载体株系的T3代植株。
1、将待测植株的种子播于装有淋过土壤杀菌剂的营养土壤的育秧盘中,在温室中培养约25天后移栽至网室中进行种植,单株种植,每个株系种植20株。
2、在步骤1水稻植株的分蘖盛期,用Xoo菌株ZHE173,采用剪叶法对水稻植株进行人工接种,每株接种5张叶片(菌液浓度为1×109cfu/mL)。
3、完成步骤2后继续培养14天,14天后测量各植株叶片的病斑长度,每个叶片沿叶脉有一个病斑,每个植株测量3张接种叶片的病斑长度,计算平均值。
结果如图5所示。结果表明,野生型植株的病斑长度为15.8cm,RNAi转基因株系Ri-21植株的病斑长度为18.7cm,显著长于野生型的病斑长度;RNAi转基因株系Ri-27植株的病斑长度为19.3cm,长于野生型的病斑长度。转空载体水稻的病斑长度与野生型的病斑长度无显著差异。结果表明抑制OsSAPK9基因表达,能够提高水稻对白叶枯病的感病性。
实施例3、OsSAPK9基因在提高水稻白叶枯病中的应用
一、OsSAPK9基因过表达载体的构建
1、提取9804水稻叶片的总RNA,反转录为cDNA。
2、以步骤1得到cDNA为模板,采用引物attB-F1和引物attB-R1进行PCR扩增,得到扩增产物。
attB-F1:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCATGGAGAGGGCGGCGG-3′;
attB-R1:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTGACATGGCATATACGATCTCTCCG-3′。
3、通过BP反应,将步骤2得到的扩增产物导入载体pDONR201,得到含有序列表序列1所示的双链DNA分子的阳性入门克隆质粒pDONR201-OsSAPK9。
BP反应体系:扩增产物2.7μL(50-100ng),载体pDONR201 1.0μL(30-50ng),5×BP Reaction Buffer 1.0μL,BP Enzyme mix 0.3μL。
BP反应条件:25℃温浴1h。
4、取步骤3得到的阳性入门克隆质粒pDONR201-OsSAPK9,与载体pMDC43进行LR反应,得到含有序列表序列1所示的双链DNA分子的35S::GFP-OsSAPK9表达载体(已经测序验证)。
LR反应体系:入门克隆质粒pDONR201-OsSAPK9 1μL(50-100ng),载体pMDC431μL(50-100ng),LR enzyme mix 0.5μL。
LR反应条件:25℃温浴1h。
二、转基因植株的获得及鉴定
1、采用35S::GFP-OsSAPK9表达载体替代表达载体pH7GWIWG2(II)-OsSAPK9i按照实施例2步骤二的1-8进行操作,得到T2代植株。
2、取步骤1获得的各个株系的T2代植株,提取植株叶片的总RNA并反转录为cDNA。以cDNA为模板,采用引物Hyg-F和Hyg-R进行PCR鉴定。采用35S::GFP-OsSAPK9表达载体作为阳性对照,采用9804水稻的cDNA作为阴性对照。
Hyg-F:5’-CTATTTCTTTGCCCTCGGAC-3’;
Hyg-R:5’-CCTGACCTATTGCATCTCCC-3’。
如果对于某一T0代植株,其抽样检测的T2代植株的PCR鉴定结果均为阳性,该T0代植株及其自交后代为一个纯合的转基因株系。
部分植株的PCR鉴定结果如图6所示。图6中,M为DNA Maker,+为阳性对照,-为阴性对照,泳道1-27依次对应27个不同株系的T2代植株。结果表明,除第20个泳道(OE20)和第22个泳道(OE22)中没有扩增出明显的阳性条带,其余植株均能扩增出与质粒载体潮霉素基因一致的特异条带,表明了第20和第22泳道对应的植株为假阳性植株,其余株系的植株中带hpt/hyg标记基因的T-DNA均已经插入并整合到受体基因组中,均为纯合的过表达转基因株系。
3、待测植株为:OsSAPK9转基因株系OE1的T2代植株、OE2的T2代植株、9804水稻、OE20假阳性植株。
取500mg待测植株的叶片,提取植物总蛋白,用标签抗体GFP进行Western blot检测。
检测结果如图7所示。结果表明:野生型9804水稻、阴性对照OE20假阳性植株中均未检测到目的条带,转基因株系中均检测到目的条带,在总蛋白上样量一致的前提下,转基因株系OE2的植株中OsSAPK9的蛋白积累量显著高于转基因株系OE1植株中OsSAPK9的蛋白量。
三、转空载水稻的获得
采用表达载体pMDC43替代表达载体pH7GWIWG2(II)-OsSAPK9i按照实施例2步骤二的1-8进行操作,得到转空载体株系。
四、对照转基因株系的获得
采用序列表的序列4所示DNA分子代替步骤一、二中的序列表的序列1所示DNA分子,得到转基因株系I(所述序列4编码序列5所示的蛋白质,序列5所示的蛋白质为OsSAPK9蛋白同家族中同源性最高的蛋白)。
采用序列表的序列6所示DNA分子代替步骤一、二中的序列表的序列1所示DNA分子,得到转基因株系II(所述序列6编码序列7所示的蛋白质,序列7所示的蛋白质为OsSAPK9蛋白同源性最高的蛋白)。
五、白叶枯病抗性检测
待测植株为:野生型9804水稻、步骤二得到的OsSAPK9转基因株系OE1的T3代植株、OE2的T3代植株、步骤三得到的转空载体株系的T3代植株、步骤四得到的转基因株系I的T3代植株、转基因株系II的T3代植株。
1、将待测植株的种子播于装有淋过土壤杀菌剂的营养土壤的育秧盘中,在温室中培养约25天后移栽至网室中进行种植,单株种植,每个株系种植20株。
2、在步骤1水稻植株的分蘖盛期,用Xoo菌株ZHE173,采用剪叶法对水稻植株进行人工接种,每株接种5张叶片(菌液浓度为1×109cfu/mL)。
3、完成步骤2后继续培养14天,14天后测量各植株叶片的病斑长度,每个叶片沿叶脉有一个病斑,每个植株测量3张接种叶片的病斑长度,计算平均值。
检测结果如图8所示。野生型9804水稻的病斑长度为15.7cm,转空载体水稻的病斑长度与野生型9804水稻的病斑长度无显著差异。OsSAPK9转基因株系OE1的植株的病斑长度为11.3cm,显著短于野生型9804水稻的病斑长度;OsSAPK9转基因株系OE2的植株的病斑长度分别为8.7cm,显著短于野生型9804水稻的病斑长度。转基因株系I植株的病斑长度与野生型9804水稻的病斑长度无显著差异,转基因株系II植株的病斑长度与野生型9804水稻的病斑长度无显著差异。上述结果表明OsSAPK9基因过表达可以提高水稻对白叶枯病的抗性。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺