一种人源T淋巴细胞的培养基及其制备方法和应用与流程
本发明涉及生物细胞培养领域,具体涉及一种人源t淋巴细胞的培养基及其制备方法和应用。
背景技术:
癌症一直是困扰人类的巨大难题。虽然手术治疗、化疗、放疗等治疗方式可以较大改善癌症患者的生存率,但这些疗法对于解救全球上千万的癌症患者却远远不够。随着生物技术的飞速发展,肿瘤免疫细胞治疗已成为癌症治疗领域的第四大疗法,它可以弥补传统疗法的弊端,被认为是21世纪肿瘤综合治疗模式中最有发展前途的治疗手段。它是运用生物技术和生物制剂从患者体内分离免疫细胞进行体外培养、激活和扩增后,回输到患者体内,直接杀伤或激发机体免疫反应来杀伤肿瘤细胞,达到治疗肿瘤目的。在基因修饰免疫细胞治疗领域,car-t疗法(嵌合抗原受体t细胞免疫疗法)、tcr-t疗法(t细胞受体修饰的t细胞疗法)已经成为全球生物医学研究机构和制药公司争相“追捧”的明星。
在免疫细胞治疗过程中,经过免疫磁珠分选和病毒转染后的人源t淋巴细胞十分脆弱,不仅需要营养比例协调且丰富的培养基来帮助其维持生长,更需要培养基在能够促进其高速扩增的同时肿瘤杀伤能力不会减弱。现有的细胞培养基,例如,optmizertmt-cellexpansionsfm、rpmi1640medium,leibovitzmedium,虽然能基本维持抗原特异性t细胞的生长所需营养,但却存在不能有效促进其增殖,以及培养后肿瘤杀伤能力减弱等问题。
因此,有必要提供一种可以培养和刺激人源t淋巴细胞高效扩增,且又保持肿瘤杀伤能力的培养基。
技术实现要素:
有鉴于此,本发明的目的在于提供一种人源t淋巴细胞的培养基及其制备方法和应用,旨在解决现有技术中基因修饰后的抗原特异性t淋巴细胞扩增速度慢、肿瘤杀伤功能弱的问题。
第一方面,本发明提供了一种人源t淋巴细胞的培养基。用于培养和促进人源t淋巴细胞高效扩增,每1l所述培养基中包括如下含量的各组分:
人ab血清80-120ml,mem维生素溶液7-15ml,n-乙酰基-l-半胱氨酸7-12mm,谷氨酰胺或其衍生物1.6-2.5mm,丙酮酸钠0.8-1.2mm,4-羟乙基哌嗪乙磺酸钠(hepes钠盐)15-25mm,il-74-6μg,il-15或其异二聚体6-9μg,余量为x-vivo基本培养基;其中,所述谷氨酰胺或其衍生物包括谷氨酰胺或l-丙氨酰-l-谷氨酰胺(glutamax-i)。
可选地,所述培养基中,所述il-15或其异二聚体与所述il-7的质量比为(1-2.25):1。进一步可选为(1.2-2.2):1或(1.5-2.0):1。更可选为1.5:1。
可选地,每1l所述培养基中包括6-9μg的il-15异二聚体。il-15异二聚体相较于il-15的稳定性更好,可以更好地刺激t淋巴细胞的扩增,增强其肿瘤杀伤能力。
进一步可选地,每1l所述培养基中包括7-8μg的il-15异二聚体。
进一步可选地,每1l所述培养基中包括4.5-5.5μg的il-7。
本发明提供的培养基配方合理高效,培养基中的人ab血清较常用的胎牛血清更能维持人源t淋巴细胞的生理功能,在细胞杀伤功能上具有更好的肿瘤杀伤功能,结合使用n-乙酰基-l-半胱氨酸、谷氨酰胺或其衍生物(例如glutamax)、mem维生素等营养剂,能够提高人源淋巴细胞的活性,改善生长情况,并且能够提高其扩增数量,以及辅助提升抗原特异性t淋巴细胞的杀伤活性。该培养基将极大提升回输病人体内的基因修饰淋巴t细胞的活性和功能。其中,hepes可以防止所述培养基ph波动,丙酮酸钠可以作为细胞培养中的替代碳源;l-谷氨酰胺是细胞生长的必须氨基酸,为培养的细胞提供重要的能量来源;其中,glutamax的稳定性较高,可以被逐渐裂解释放l-谷氨酰胺以供细胞利用;mem维生素可以提供细胞生长所需的非必须氨基酸,减少细胞体外抗原蛋白合成的负荷;最重要的是,所述培养基中还添加有特定浓度的细胞因子il-7和il-15二聚体,能够特异性扩增t淋巴细胞等强效抗癌细胞,诱导t细胞的杀伤活性。
总之,本发明提供的所述培养基在用于培养人源t淋巴细胞(尤其是抗原特异性t淋巴细胞)时,通过培养基中各组分的协同作用,使人源t淋巴细胞高效扩增,并保持较高的免疫细胞功能,起到很好的肿瘤特异性杀伤功能,为后续回输病人体内的基因修饰淋巴t细胞的质量提供保障,以便能够特异杀伤其抗原靶向的肿瘤细胞。
所述x-vivo基本培养基为无血清培养基,相较于其他无血清培养基(如1640、dmem)而言,更适合于无血清条件下肿瘤浸润淋巴细胞的增殖,其配方有助于外周血中分离纯化的cd3+细胞的增殖。
可选地,所述x-vivo基本培养基包括但不限于x-vivo15、x-vivo10或x-vivo20。
进一步可选地,每1l所述培养基中包括人ab血清90-110ml。
进一步可选地,每1l所述培养基中包括如下含量的各组分:
人ab血清90-110ml,mem维生素溶液8-12ml,n-乙酰基-l-半胱氨酸9-11mm,谷氨酰胺或其衍生物1.8-2.2mm,丙酮酸钠0.9-1.1mm,4-羟乙基哌嗪乙磺酸(hepes钠盐)18-22mm,il-74.5-5.5μg,il-15或其异二聚体7-8μg,余量为x-vivo基本培养基。
进一步可选地,每1l所述培养基中包括l-丙氨酰-l-谷氨酰胺1.8-2.2mm。
更可选地,每1l所述培养基中包括如下含量的各组分:
人ab血清100ml,mem维生素溶液10ml,n-乙酰基-l-半胱氨酸10mm,l-丙氨酰-l-谷氨酰胺2mm,丙酮酸钠1mm,4-羟乙基哌嗪乙磺酸钠(hepes)20mm,il-75μg,il-15异二聚体7.5μg,余量为x-vivo基本培养基。
可选地,所述培养基的ph值为7.0-7.2。
在本发明一实施方式中,每1l所述培养基中还包括如下含量的各组分:叠氮胸苷0.8-1.2μm,利托那韦450-550nm。此种情况下,由于添加了叠氮胸苷、利托那韦,可以抑制hiv病毒的天冬氨酸蛋白酶,阻断该酶促使产生形态学上成熟hiv颗粒所需的聚蛋白,使hiv颗粒因而保持在未成熟的状态,使得以基因改造后的hiv病毒载体无复制活性,较适用于hiv病毒转染的t淋巴细胞。
可选地,每1l所述培养基中还包括如下含量的各组分:叠氮胸苷0.9-1.1μm,1um,利托那韦480-520nm。
更可选地,每1l所述培养基中还包括如下含量的各组分:叠氮胸苷1.0μm,,利托那韦500nm。
具体地,实际应用本发明提供的所述培养基时,可以不限于上述提到的x-vivo基本培养基、人ab血清、n-乙酰基-l-半胱氨酸、l-丙氨酰-l-谷氨酰胺、丙酮酸钠、4-羟乙基哌嗪乙磺酸钠、il-7、il-15或其异二聚体和mem维生素等成分上,还可以在此基础上添加其他其抑制病毒复制活性作用的组分,以更好地促进抗原特异性t淋巴细胞的扩增,以及免疫活性的保持。
本发明提供的所述培养基中,谷氨酰胺或其衍生物可以不限于上述提到的l-谷氨酰胺或l-丙氨酰-l-谷氨酰胺,根据需要,其他形式的l-谷氨酰胺衍生物也可以替代采用。
本发明提供的所述培养基可以用于免疫磁珠分选后的t淋巴细胞的培养,也可以用于经病毒(表达特定抗原的病毒)转染后得到抗原特异性t淋巴细胞的扩增培养、肿瘤杀伤实验、病毒残留检测等。
第二方面,本发明提供了一种如第一方面所述的培养基的制备方法。
取所述培养基配方的各组分,加x-vivo基本培养基至1l,混合均匀,经过滤后得到人源t淋巴细胞的培养基。
本发明中所述培养基配方中的各组分为gmp级,在将各组分混合后,可以不进行灭菌。
可选地,所述过滤是采用孔径为0.22μm的滤膜进行。过滤用于除去血清中的沉积物等。
可选地,所述n-乙酰基-l-半胱氨酸,谷氨酰胺或其衍生物,丙酮酸钠,hepes,il-7,il-15或其异二聚体先配制成一定浓度的溶液,然后再混合在一起。
可选地,本发明提供的所述培养基的制备方法为现配现用。
本发明第二方面提供的所述培养基的制备方法,制备过程简单快速。
第三方面,本发明提供了一种如第一方面所述的培养基或第二方面的制备方法制得的所述培养基在培养淋巴细胞中的应用。尤其是在免疫细胞治疗中的应用。具体可以是免疫磁珠分选后的t淋巴细胞的培养,也可以用于经病毒(表达特定抗原的病毒)转染后得到抗原特异性t淋巴细胞的扩增培养、肿瘤杀伤实验、病毒残留检测等。
可选地,所述淋巴细胞为人外周血单个核细胞中的淋巴细胞。
可选地,所述应用具体为培养抗原特异性t淋巴细胞,可以包括以下步骤:
提供抗原特异性t淋巴细胞;
取上述抗原特异性t淋巴细胞,采用所述人源t淋巴细胞培养基进行高效扩增培养7-10天,在所述高效扩增培养过程中,调整细胞的浓度为(0.5-1)×106个/ml,得到扩增后的抗原特异性t淋巴细胞。其中,所述扩增后的抗原特异性t淋巴细胞用于回输到患者体内或冻存。
进一步可选地,所述高效扩增培养时的温度为25-37℃。使所述抗原特异性t淋巴细胞达到稳定期。
可选地,所述抗原特异性t淋巴细胞是采用以下方法制备:
(1)取分离出的人外周血单个核细胞(pbmc),加入x-vivo基础培养基,配制成第一细胞悬浮液,加入免疫磁珠,室温孵育1-3小时后,经磁性分离,得到磁珠分选后的人源t淋巴细胞;
(2)取上述磁珠分选后的人源t淋巴细胞,加入本发明第一方面所述的培养基,配制成第二细胞悬浮液,培养1-2天后换液,加入表达特定抗原的病毒,再加入本发明第一方面所述的培养基,调整外周血单个核细胞的细胞浓度为(0.5-1)×106个/ml,接种,得到抗原特异性t淋巴细胞;
其中,所述人外周血单个核细胞(pbmc)是采用如下方法分离获得:
从抽取的患者血液中采集外周血单个核细胞,经ficoll离心分离后取中间层细胞,采用生理盐水或磷酸盐缓冲溶液(pbs)洗涤,得到pbmc。
进一步可选地,步骤(1)中,所述免疫磁珠与所述pbmc的加入比例(数量之比)为(2-4):1。
在本发明一实施例中,所述病毒为腺病毒。
在本发明另一实施例中,所述病毒为hiv病毒;此时,步骤(2)的所述培养基中还含有叠氮胸苷和利托那韦。
进一步可选地,步骤(2)中,加入的所述病毒的病毒滴度为1×108~5×108tu/ml(其中,tu:transducingunits,传导单位)。
本申请的有益效果:
本申请提供的所述培养基采用x-vivo作基本培养基,主要添加白介素il-7、il-15或其异二聚体,并辅以人ab血清、mem细胞培养用维生素,并添加n-乙酰基-l-半胱氨酸、谷氨酰胺衍生物、丙酮酸钠、hepes,通过调控配方中各组分的含量,构成了特定组成的人源t淋巴细胞的培养基。相比与采用市面上的常规培养养基,本发明提供的所述培养基能显著提升抗原特异性t淋巴细胞的扩增速度,扩增速度可以提高2-4倍;并且其肿瘤杀伤能力也可提升1.5-3倍。
此外,经本申请所述培养基快速扩增所得到的高活性免疫细胞(即抗原特异性t淋巴细胞)在进行自体移植后对患者机体免疫系统具有增强作用,能够特异杀伤其抗原靶向的肿瘤细胞。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
图1为本发明实施例1提供的培养基与常规培养基对抗原特异性t淋巴细胞的增殖能力的影响对比;
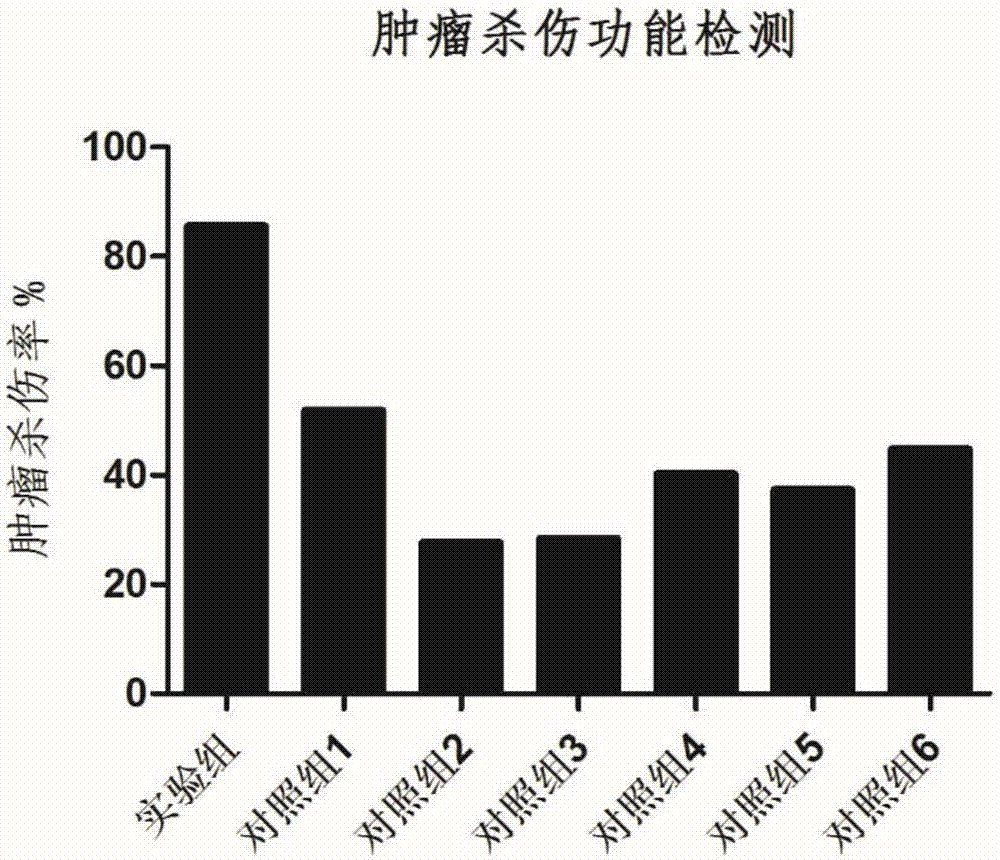
图2为本发明实施例1提供的培养基与常规培养基对抗原特异性t淋巴细胞的肿瘤杀伤能力的影响对比;
图3为本发明实施例1-3提供的培养基与对比实施例1-2提供的培养基对抗原特异性t淋巴细胞的增殖能力的影响对比;
图4为本发明实施例1-3提供的培养基与对比实施例1-2提供的培养基对抗原特异性t淋巴细胞的肿瘤杀伤能力的影响对比。
具体实施方式
以下所述是本发明的可选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明中一些常用的术语说明如下:n-乙酰-l-半胱氨酸,又称乙酰半胱氨酸;il-7:白细胞介素-7,interleukin-7;il-15:白细胞介素-15,interleukin-15。
以下为本发明实施例中所采用的各原料的厂家品牌与货号:
表1原料表
实施例1
一种培养和促进人源t淋巴细胞高效扩增的培养基,其中,每1l所述培养基中包括如下含量的各组分:
人ab血清100ml;
mem维生素10ml;
n-乙酰基-l-半胱氨酸10mm;
l-丙氨酰-l-谷氨酰胺(glutamax)2mm;
丙酮酸钠1mm;
4-羟乙基哌嗪乙磺酸钠(hepes钠盐)20mm;
il-75μg;
il-15异二聚体7.5μg;
x-vivo基本培养基848ml。
其中,上述培养基是采用如下方法配制得到:将n-乙酰基-l-半胱氨酸溶于x-vivo基本培养基中,得到浓度为1m的n-乙酰基-l-半胱氨酸溶液;将l-丙氨酰-l-谷氨酰胺(glutamax)溶于x-vivo基本培养基中,得到浓度为0.2m的glutamax溶液;将丙酮酸钠溶于x-vivo基本培养基中,得到浓度为0.1m的丙酮酸钠溶液;将4-羟乙基哌嗪乙磺酸钠(hepes)溶于x-vivo基本培养基中,得到浓度为2m的4-羟乙基哌嗪乙磺酸钠(hepes)溶液;将il-7溶于x-vivo基本培养基中,得到浓度为5μg/ml(w/v)的il-7溶液;将il-15异二聚体溶于x-vivo基本培养基中,得到浓度为7.5μg/ml(w/v)的il-15异二聚体溶液;mem维生素溶液购买自sigma公司,其浓度为100x。
分别取上述10ml的n-乙酰基-l-半胱氨酸溶液、10ml的glutamax-i溶液、10ml的丙酮酸钠溶液、10ml的4-羟乙基哌嗪乙磺酸钠hepes溶液、1ml的il-7溶液、1ml的il-15异二聚体溶液,10ml的mem维生素溶液相混合,加入100ml的人ab血清,将上述各组分混合均匀后,加入x-vivo基本培养基定容至1l,采用孔径为0.22μm的滤膜进行过滤,得到培养人源t淋巴细胞的培养基(以下统称“t细胞完全培养基”)。
实施例2
一种培养和促进人源t淋巴细胞高效扩增的培养基,其中,每1l所述培养基中包括如下含量的各组分:
本实施例中所述培养基的配制方法与实施例1的配方方法类似,这里不再描述。
实施例3
一种培养和促进人源t淋巴细胞高效扩增的培养基,其中,每1l所述培养基中包括如下含量的各组分:
本实施例中所述培养基的配制方法与实施例1的配方方法类似,这里不再描述。
实施例4
一种培养和促进人源t淋巴细胞高效扩增的培养基,其中,每1l所述培养基中包括如下含量的各组分:
为突出本发明的技术效果,针对上述实施例1设置以下2个对比实施例:
对比实施例1
一种培养基,每1l所述培养基中包括如下含量的各组分:
对比实施例2
一种培养基,每1l所述培养基中包括如下含量的各组分:
应用实施例:
采用实施例1制得的上述培养基用于免疫治疗中人源t淋巴细胞的培养,包括以下步骤:
(一)pbmc细胞(人外周血单个核细胞)的分离
1.1抽取病人血液,送样至血液分离室。
1.2用单采机采集外周血单个核细胞,ficoll离心分离后取中间层细胞;采用磷酸盐缓冲溶液(pbs,ph=7.4)洗涤,得到pbmc。
(二)免疫磁珠法分离t淋巴细胞
2.1取上述分离出的人外周血单个核细胞(pbmc),加入x-vivo基础培养基,配制成第一细胞悬浮液;
2.2加入cd3免疫磁珠,室温孵育3小时后,采用磁铁进行分离,并用pbs洗涤,得到磁珠分选后的cd3阳性t淋巴细胞,其中,所述cd3免疫磁珠与所述pbmc的加入比例为3:1。
(三)病毒转染法制备抗原特异性t淋巴细胞
3.1取上述经过免疫磁珠分离法得到的cd3阳性t淋巴细胞,加入本发明实施例1中的t细胞完全培养基,重悬制成第二细胞悬浮液,培养1天;
3.2在培养的第2天,换液(去除旧培养基,加入实施1中的t细胞完全培养基),继续培养1天;
3.3在培养的第3天,加入相应病毒滴度的病毒,其中,所述病毒为腺病毒,所述病毒的病毒滴度为1×108tu/ml(transducingunits),采用所述t细胞完全培养基来调整细胞浓度为1×106个/ml,接种,得到抗原特异性t淋巴细胞;
(四)扩增培养上述抗原特异性t淋巴细胞
4.1第3-4天,取步骤(三)得到的抗原特异性t淋巴细胞,采用所述t细胞完全培养基进行扩增培养,并注意控制细胞浓度为1×106个/ml,在扩增培养过程中观察细胞形态、检测细胞活性;
4.2待扩增培养到第11-13天,收集细胞,即得到扩增后的抗原特异性t淋巴细胞细胞。
所得到的抗原特异性t淋巴细胞进行后续肿瘤杀伤实验、细胞增殖实验、病毒残留检测实验、回输至患者体内等。也可以进行冻存,以在需要时复苏后使用。
需要说明的是,上述cd3免疫磁珠,用于纯化和筛选cd3+阳性t淋巴细胞,并且具有促进t淋巴细胞活化的功能,可刺激t淋巴细胞增殖。
上述病毒为腺病毒,具有复制和表达蛋白的性能,在转染t淋巴细胞后,可在t细胞膜表面表达腺病毒载体所携带基因的特异性抗原。
效果实施例:
同时为了评估本发明所描述的上述t细胞完全培养基(实验组)对抗原特异性t淋巴细胞培养的扩增速度和肿瘤杀伤能力的影响,选用人来源的血液进行外周血单个核细胞分离、cd3免疫磁珠法分离t淋巴细胞、病毒转染法制备抗原特异性t淋巴细胞等步骤,最后将所得的抗原特异性t淋巴细胞做体外细胞培养实验。同时设置以下6组对照组,其中,对照组1为optmizet-cellexpansionsfm培养基;对照组2为aim-vmediumcts培养基;对照组3为ham'sf-12medium;对照组4为improvedmem培养基;对照组5为rpmi1640medium;对照组6为leibovitzmedium。其中,对照组5:是向900ml的rpmi1640中添加100ml的胎牛血清(热灭活胎牛血清-澳大利亚原产;公司:gibco;货号:10100147;)。
1、评估细胞增殖情况:
将抗原特异性t淋巴细胞细胞按106/ml的浓度接种后,分别采用optmizertmt-cellexpansionsfm、aim-vmediumcts、ham'sf-12medium、improvedmem、rpmi1640medium和leibovitzmedium这6种常规培养基作为对照组(编号分别为对照组1至6)的培养基,以及本发明实施例1提供的所述t细胞完全培养基作为实验组的培养基来进行细胞培养,在37℃,5%co2下进行培养5天后,通过cfse流式细胞仪检测法来检测细胞增殖情况,结果如附图1所示。
2、评估肿瘤杀伤能力的影响:
将抗原特异性t淋巴细胞细胞按106/ml的浓度接种后,分别采用optmizertmt-cellexpansionsfm、aim-vmediumcts、ham'sf-12medium、improvedmem、rpmi1640medium和leibovitzmedium这6种常规培养基作为对照组(编号分别为对照组1至6)的培养基,以及本发明实施例1提供的所述t细胞完全培养基作为实验组的培养基,与肿瘤细胞系nalm-6在37℃,5%co2下进行共培养,其中,控制各组的效应t细胞与肿瘤细胞系的比例为1:1,分别使用流式抗体cd3(fitc)(fitcanti-humancd3antibody;公司:biolegend;货号:300406)、cd19(apc)(apcanti-humancd19antibody;公司:biolegend;货号:302212)来染色,培养16小时后通过流式细胞仪来检测肿瘤杀伤情况,结果如附图2所示。
从图1可以看出,与对照组的6种常规培养基相比,采用本发明提供的所述t细胞完全培养基,可以使抗原特异性t淋巴细胞的增殖速度分别提高97.6%、135.4%、333.5%、206.2%、50.7%和90.3%。即,较常规培养基而言,在对相同细胞采取相同的培养条件下,本发明提供的所述t细胞完全培养基可以使抗原特异性t淋巴细胞的增殖速度明显提高1-3倍。
从图2可以看出,与对照组的6种常规培养基相比,采用本发明提供的所述t细胞完全培养基,可以使抗原特异性t淋巴细胞对与之共培养的肿瘤细胞nalm-6的肿瘤杀伤能力分别提高65.1%、209.8%、201.1%、112.7%、129.2%和91.3%。即,较常规培养基而言,在相同条件下,本发明提供的所述t细胞完全培养基可以使抗原特异性t淋巴细胞的肿瘤杀伤活性提高了1-2倍。
此外,采用同样的方法分别评估本发明实施例1-4提供的t细胞完全培养基以及上述对比实施例1-2的培养基对抗原特异性t淋巴细胞的增殖情况以及其对肿瘤杀伤能力的影响。细胞增殖情况的结果如图3所示,肿瘤杀伤情况的结果如附图4所示。其中,与实施例1相比,对比例1没有采用人ab血清,对比例2没有使用il-7。
从图3可以看出,本发明实施例1-4提供的t细胞完全培养基可以使抗原特异性t淋巴细胞的增殖倍数分别达到125%、115%、120%、100%,而对比例1-2的细胞增殖倍数仅分别达到40%、90%。这说明本发明实施例提供的t细胞完全培养基可以使抗原特异性t淋巴细胞的增殖速度明显提高。
从图4可以看出,本发明实施例1-4提供的t细胞完全培养基可以使抗原特异性t淋巴细胞对与之共培养的肿瘤细胞nalm-6的肿瘤杀伤能力分别达到86%、80%、85%;而对比例1-2的肿瘤杀伤能力仅分别达到57%、60%、75%。以上对比说明本发明实施例提供的t细胞完全培养基可以使抗原特异性t淋巴细胞的肿瘤杀伤活性显著提高。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!