一种水稻MIT1基因、其编码蛋白及应用的制作方法
本发明属于基因工程领域,具体地说,涉及一种水稻MIT1基因、其编码的蛋白及其在抑制水稻分枝中的应用。
背景技术:
水稻(Oryza sativa)为禾本科单子叶植物,是世界上重要的粮食作物之一。目前,我国水稻种植面积约4.5亿亩,居世界第二位,总产量2.04亿吨,居世界第一位,单产420公斤,是世界平均水平的1.6倍。然而,随着人口的持续增长和耕地面积的不断减少,对粮食生产带来了更大的挑战。因此,通过品种的遗传改良,挖掘作物的单产潜力是解决粮食安全问题的有效途径,也是保障世界粮食产量稳步增长的根本出路所在。
分蘖是决定水稻产量的重要农艺性状之一,是单子叶植物生长发育过程中形成的一种特殊的分枝性状,存在着一定的规律。水稻分蘖发生的早晚或多少,与品种特性有关,分蘖增长速度在品种间也存在差异,即遗传因素是影响分蘖动态变化的主要原因之一。水稻分蘖分为有效分蘖和无效分蘖,有效分蘖的比例高,即分蘖的成穗率高是群体质量的重要标志。如果能控制最高分蘖数,使后期无效分蘖减少,分蘖成穗率便可大幅度提高,而有望提高产量。分蘖角度为抽穗前主茎与分蘖之间的夹角。分蘖角度过小,常规种植会使植株间的空隙较大,叶面积指数较小,浪费光能;分蘖角度过大,易使个体间遮挡,光能利用率降低。因此,分蘖角度对于水稻株型的构成具有重要意义,与植物的形态,群体密度,光能利用率和风速等水稻生理生态特性有重大的关系。从育种角度来看,丰产性好的水稻品种表现为分蘖力强,成穗率高,穗粒数多,结实率高,这也是实现超级稻高产和优质的保证,即在超级稻生物量较高的基础上提高收获指数。选育分蘖变化平稳,有效分蘖期长,成穗率高的品种,产生足够的群体数量,保证良好的群体结构,更好的协调群体与个体间的矛盾,从而进一步提高产量。
水稻矮源是带有矮秆或半矮秆基因的种质资源,大量实验证明矮化能明显提高水稻的产量。目前生产上应用的矮秆基因主要是sd1。系统分析我国育成的籼稻品种表明,利用的矮秆资源主要有六个:矮脚南特、矮仔占、低脚乌尖、花龙水田谷、矮脚水谷田和中山无名种等。其中矮仔占、矮脚南特、低脚乌尖、花龙水田谷及其衍生品种都是由一对隐性半矮杆基因sd1控制,同时还存在着不同程度的微效多基因的影响。
但是,矮秆基因利用单一和遗传背景狭隘可能造成遗传上的脆弱性,近几年来国内外新育成的许多矮秆品种产量潜力停滞不前也可能与此有关。而已鉴定出的许多半矮秆和矮秆基因不少都对水稻的农艺性状表现负面的影响,限制了它们在杂交育种中的应用。囚此,发掘和鉴定控制水稻株高的基因,开展株高基因定位、克隆及作用机理等方面的研究,实现对水稻株高的定向改良,具有十分重要的理论意义和应用价值。同时,水稻是研究禾本科植物的模式作物,水稻基因组的测序已完成,这为水稻基因的克隆及其功能提供了极为有利的条件。
研究人员从环境因素、生理生化及基因组学等多方面对植物矮化多分枝机制进行了研究,并取得了很大的进展。从不同的多分枝突变体中发现了一种新的调控植物分枝的植物激素—独脚金内酯(Strigolactones),它在植物根部产生并向上运输,从而抑制腋芽的发育和植物的分枝,对于控制植物株型具有重要的意义。独脚金内酯途径基因的突变通常会导致植物分蘖或分枝数目的增加,同时伴有植株高度的降低。研究人员从矮化多分枝/分蘖突变体中克隆了多个突变基因,如从腋生分枝增多的拟南芥突变体中克隆了MAX1至MAX4基因,从多分枝的豌豆ramous(rms)突变体中克隆了RMS1至RMS5基因,从矮化多分蘖的水稻突变体dwarf/high tillering dwarf(htd)中克隆了D3、D10、D14/D88/HTD2、D17/HTD1、D27、D53、OsTB1/FC1等基因。从顶端优势削弱的矮牵牛dad(decreased apical dominance)突变体中克隆的DAD1至DAD3也位于独脚金内酯途径中。
独脚金内酯的生物合成起源于类胡萝卜素。在植物类胡萝卜素合成过程中,八氢番茄红素合成酶(PSY)的产物—15-顺式-八氢番茄红素,通过脱氢反应和异构反应合成下游反应需要的全反式-番茄红素,被进一步转化合成胡萝卜素和叶黄素,作为某些激素的底物,如ABA和SL。在此途径中,需要两种异构酶的参与,分别为15-顺式-ζ-胡萝卜素异构酶(Z-ISO)和胡萝卜素异构酶(CRTISO)。Z-ISO在此途径中催化9,15,9'-3-顺式-ζ-胡萝卜素发生异构反应,形成9,9'-2-顺式-ζ-胡萝卜素,作为后续反应的的底物。在本发明中,将Z-ISO命名为MIT1。该酶起源于NnrU基因,它编码一个跨膜蛋白—亚硝酸盐和一氧化氮还原酶U(nitrite and nitric oxide reductase U,NnrU)。
技术实现要素:
本发明目的是提供水稻MIT1基因及其应用。
本发明首先提供了水稻MIT1蛋白,其具有:
1)如SEQ ID No.1所示的氨基酸序列;或
2)SEQ ID No.1所示的氨基酸序列经取代、缺失和/或增加一个或多个氨基酸且具有同等活性的由1)衍生的蛋白质。
本发明提供了编码水稻MIT1蛋白的基因,其具有:
1)SEQ ID No.2所示的核苷酸序列;或
2)SEQ ID No.2所示核苷酸序列经取代、缺失和/或增加一个或几个核苷酸;或
3)在严格条件下与1)限定的DNA序列杂交的核苷酸序列。
本发明提供了含有编码水稻MIT1蛋白的基因的生物材料,所述生物材料为载体、宿主细胞、转化植物细胞。
本发明提供了水稻MIT1蛋白或其编码基因在制备转基因植物中的应用。
本发明提供了水稻MIT1蛋白或其编码基因在水稻种质资源改良中的应用。
本发明提供了水稻MIT1蛋白或其编码基因在提高水稻产量中的应用。
本发明还提供一种水稻MIT1基因突变基因,其为水稻MIT1基因第二内含子3’末端的2个碱基AG和第三外显子5’端的8个碱基GTCTACTT缺失,所述水稻MIT1基因含有如SEQ ID No.2所示的核苷酸序列。
进一步地,所述生物材料为载体、宿主细胞、转化植物细胞。
本发明提供了上述突变基因或含有该突变基因的生物材料在农作物改良育种、制种中的应用。
所述的农作物为水稻、玉米、小麦或棉花。
本发明提供了上述突变基因或含有该突变基因的生物材料在提高水稻产量中的应用。
本发明的优点在于:
(1)本发明提供了水稻MIT1基因(核苷酸序列如SEQ ID No.2所示)及其编码的蛋白(氨基酸序列如SEQ ID No.1所示)。将野生型MIT1基因组DNA通过农杆菌介导转化mit1突变体的愈伤组织,发现互补转基因植株的表型完全恢复正常,分蘖数和株高都和野生型一致,因而MIT1基因具有抑制水稻分蘖的功能,有望对水稻株型的形成进行调控进而对株型定向设计,以提高水稻生产力,在水稻种质资源改良中筛选效果明显,经济价值巨大。
(2)因辐射诱变造成与野生型相比有10bp缺失,采用实验室常用的琼脂糖电泳就能开展分子检测,即能够实现鉴别,不需要特别的检测技术和方法。
附图说明
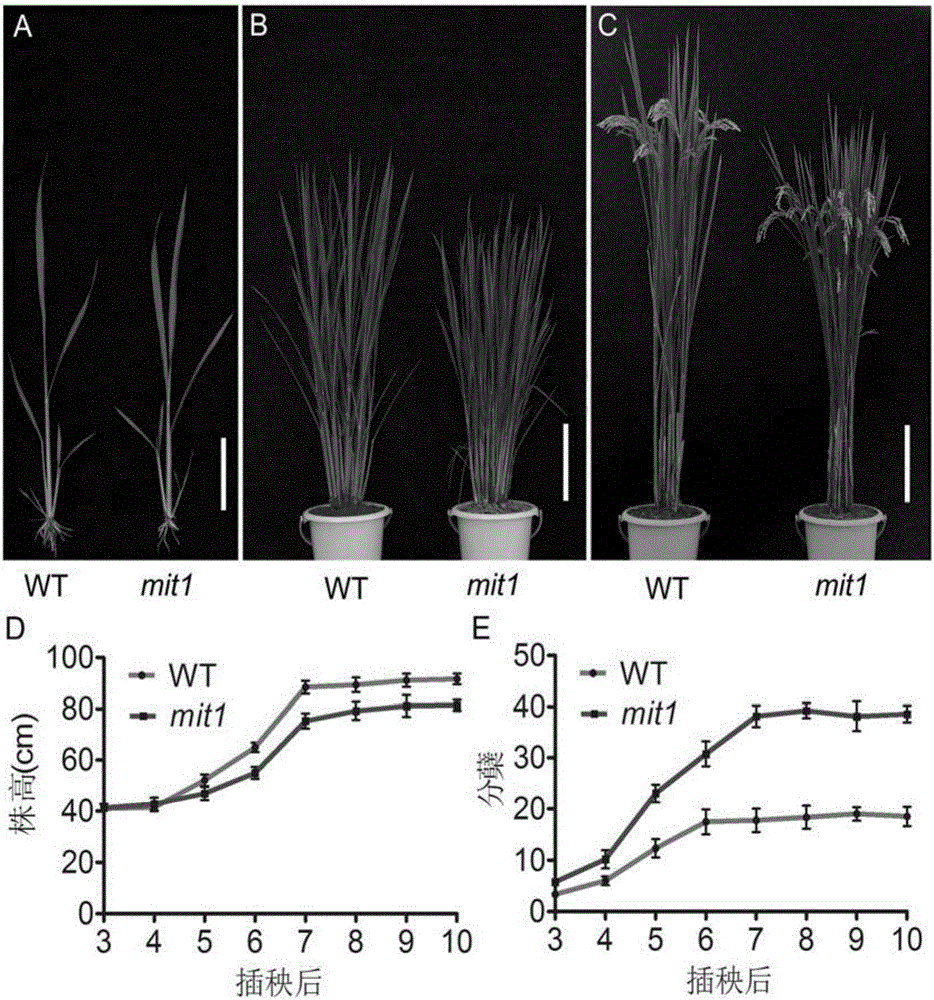
图1为野生型春江06与MIT1突变体mit1的表型。其中,A,B,C图分别为野生型和mit1的幼苗期、分蘖期和成熟期的表型;D,E图分别为插秧后野生型和mit1的株高和分蘖的动态变化。A图比例尺为5cm,B,C图比例尺为20cm。
图2为野生型和mit1的产量相关性状。A图为各节间长度比较。比例尺为5cm。B图为穗形。比例尺为5cm。C图为粒形。D图为成熟期株高。E图为有效分蘖数。F图为每穗粒数。G图为百粒重。H图为单株产量。
图3为MIT1基因的图位克隆和功能互补验证。A图为MIT1的图位克隆。B图为MIT1基因结构及在突变体mit1中的突变位点。C图为mit1突变体的互补验证。B260-1和B260-2为两个转基因回补株系。比例尺为15cm。
图4为MIT1的同源蛋白序列比对和进化分析。A图为水稻、玉米、拟南芥中的MIT1,ZmZ-ISO、AtZ-ISO的蛋白序列比对。B图为MIT1的进化分析。
图5为MIT1组织表达模式。
图6为水稻组织GUS染色结果。图中,a茎,b茎节,c根,d穗,e叶片,f叶鞘,g侧芽,h叶鞘横切面,i颖壳横切面,j根横切面。a,f,g图的比例尺为200μm,b,c,d,e图的比例尺为100μm,h,I,j图的比例尺为50μm。
图7为MIT1蛋白的亚细胞定位。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段;若未特别指明,实施例中所用试剂均为市售。
实施例1突变体的获得与表型分析
突变体mit1是经60Co-γ辐射诱变粳稻品种春江06得到(辐射剂量为200Gy,剂量率为10Gy·h-1),表型上它与野生型相比有着多方面的改变。突变体mit1表现为分蘖中度增多、株高半矮的表型,成熟期株高稍矮,约为野生型的80%,各节间等比例一定程度的缩短;分蘖数目增多,约为野生型的2倍(见图1);株型紧凑,分蘖角度和叶片角度小;插秧后的不同发育时期,mit1株高均低于野生型,分蘖均多于野生型(见图2)。突变体mit1的育性结实正常,每穗粒数约为野生型70%,但单株总粒数及产量比野生型有所增加(见图2)。
实施例2水稻MIT1基因的获得和功能互补验证
1、水稻MIT1基因的获得
本发明的MIT1基因是采用图位克隆方法通过突变体mit1克隆得到的。
经60Co-γ辐射诱变得到的突变体mit1经过多代自交种植确认该突变具有稳定遗传的特性。纯合突变体mit1与正常表型的籼稻Dular,进行杂交,所有杂交F1中个体均矮化分蘖中度增多表型。在F2种植群体中出现了明显分离,通过调查分析,发现野生型与突变体的分离比例符合3:1遗传分离比例。由此可以推测,该水稻矮化分蘖中度增多突变体的突变性状是由1对隐性基因控制。
为了定位控制该分蘖中度增多突变体基因的位置,利用F1代自交构建的F2分离群体作为定位的群体,以BSA法选取l0株F2突变单株构建DNA混池,利用能较均匀覆盖全基因组的170对Indel标记对两个亲本与基因池进行多态性筛选,发现与第12染色体上的R12-8和R12-10连锁。为了精细定位目的基因,将F2定位群体扩大到1529株矮化分蘖中度增多个体,并开发了8对新的InDel标记,最终将目的基因定位在标记M4和M7之间(图3的A图)。这两个标记之间的物理距离为2Mb,位于第12染色体的着丝粒区,包含15个候选基因。根据各基因预测的蛋白功能,首先选择功能与本研究相关的6个基因进行测序,发现基因LOC_Os12g21710发生突变。
LOC_Os12g21710基因组DNA全长2937bp,包含4个外显子和3个内含子,编码区全长1104bp,共设计8对引物进行测序(引物序列见表1)。对基因测序结果分析发现,此基因在第二内含子和第三外显子交界处发生10bp的缺失,包括第二内含子3’末端的2个碱基(ag)和第三外显子5’端的8个碱基(GTCTACTT)(见图3的B图)。这10bp的缺失造成转录过程中第二内含子没有被拼接掉而被错误读取以及第三外显子读取的提前终止,从而造成基因的突变。将该基因命名为MIT1。根据水稻基因组注释网站(http://rice.plantbiology.msu.edu/)预测,MIT1编码15-顺式-ζ-胡萝卜素异构酶(15-cis-zeta-carotene isomerase,Z-ISO),它是类胡萝卜素生物合成过程中一个重要的异构酶。
表1实施例1中涉及的引物序列
2、MIT1基因的功能互补验证
本发明将MIT1基因克隆至植物表达载体pCAMBIA 1305.1(购自pCAMBIA公司),并在大肠杆菌TOP10中扩繁。通过农杆菌介导转化方法,将pCAMBIA 1305.1携带的MIT1基因转入水稻,获得转基因互补植株。
12g21710基因组互补载体构建:因为基因组DNA片段比较大,所以分成两段扩增,以PstI位点为界限。第一个片段,5’端引入SacI位点,3’端引入PstI位点,片段长为4625bp,ATG前长度为1834bp,重组到pCAMBIA1305.1的SacI+PstI位点中去;第二个片段,两端都引入PstI位点,片段长度为1240bp,TGA后长度为1086bp,重组到含第一个片段的载体的PstI位点中去。所用引物为12g21710S1SPF:ATGATTACGAATTCGAGCTCCAGTGGACAAAGCTTACCAAACTG和12g21710S1SPR:CCAAGCTTGCATGCCTGCAGCAAAAGGAAAACACTTG;12g21710S2PPF:TGTTATTCCTTTTGCTGCAGTTATCGATGGAAGAC和12g21710S2PPR:CCAAGCTTGCATGCCTGCAGCCTGGCACTTCTGATATAGGG。
互补植株的表型完全恢复正常,分蘖数和株高都和野生型一致。基因组DNA的互补结果证明了LOC_Os12g21710就是目的基因(见图3的C图)。
实施例3 MIT1的同源蛋白序列比对和进化分析
水稻Z-ISO(MIT1)、玉米Z-ISO(ZmZ-ISO)和拟南芥Z-ISO(AtZ-ISO)序列比对显示同源性比较高。据水稻基因组注释网站(http://rice.plantbiology.msu.edu/)预测,MTI1包含368个氨基酸,ChloroP 1.1Prediction Server预测该蛋白在N端有一个叶绿体转运肽(方框部分),整个蛋白含有5个跨膜区(下划线部分),还有一个NnrU结构域(见图4的A图)。
Z-ISO为15-顺式-ζ-胡萝卜素异构酶,是参与类胡萝卜素生物合成途径的关键酶之一。进化树分析显示,MTI1在高等植物和硅藻中都有同源基因,它们都有一个共同的起源—NnrU基因,该基因在反硝化细菌中发现,如根癌土壤杆菌(Agrobacterium fabrum str.C58)和苜蓿中华根瘤菌(Sinorhizobium meliloti 1021)(见图4的B图)。NnrU编码一个跨膜蛋白—亚硝酸盐和一氧化氮还原酶U(nitrite and nitric oxide reductase U,NnrU),最初在红假单胞菌2.4.3中有描述,催化细菌反硝化作用。
实施例4水稻MIT1基因表达模式
提取粳稻品种日本晴不同组织(根、茎、叶片、叶鞘、侧芽、花、穗)的RNA,反转录为cDNA进行Real-time PCR(RT-PCR)检测,以水稻Ubiquitin基因为内参,检测MIT1基因在水稻不同组织中的表达差异。
1、RNA提取
采用RNAprep pure Plant Kit(天根)进行水稻总RNA的提取。用于分析基因组织表达模式的样品取材于抽穗期的野生型的根、茎、叶片、叶鞘、侧芽、幼穗等部位。
(1)100mg样品经液氮研磨后加入450μL裂解液,震荡混匀。将溶液转移至过滤柱中,12000rpm离心5min,收集管中上清至RNase-free的离心管中;
(2)加入1/2倍上清体积的无水乙醇,颠倒混匀后将溶液转入吸附柱中,12000rpm离心1min,弃掉废液;
(3)向吸附柱中加入350μL去蛋白液,12000rpm离心1min,弃掉废液;
(4)向吸附柱中央加入80μL DNaseⅠ工作液,室温放置15min;
(5)向吸附柱中加入350μL去蛋白液,12000rpm离心1min,弃掉废液;
(6)向吸附柱中加入500μL漂洗液,室温静置2min,12000rpm离心1min,弃掉废液;
(7)重复步骤(6),然后再12000rpm离心2min,弃掉废液。将吸附柱置于一个新的RNase-free离心管中,室温放置数分钟;
(8)向吸附膜中央滴加30μL RNase-free ddH2O,室温放置5min,12000rpm离心2min,RNA保存于-80℃;
2、cDNA合成
第一链cDNAs合成采用III First Strand Synthesis Kit(Invitrogen,USA),由于水稻基因GC含量较高,采用试剂盒推荐的高GC方法并且选用Oligo(dT)20(50μM)进行合成。具体操作方法如下:
(1)RNA/primer mixture的准备:1至5μg总RNA,1μL Oligo(dT)20(50μM),2.5μL dNTP mix(10mM),DEPC处理水补齐至25μL;
(2)将上述体系放入65℃孵环境下孵育5min后立即转移至55℃;
(3)cDNA Synthesis Mix的准备(25μL):DEPC-treated water 3μL,10×RT buffer 5μL,10μL MgCl2(25mM),5μL DTT(0.1M),RNaseOUT Recombinant RNase Inhibitor 1μL,SuperScript III RT 1μL,上述混匀后置于55℃备用;
(4)将RNA/primer mixture与cDNA Synthesis Mix轻轻混匀,置于55℃,50min后转入85℃,5min终止反应后冰上放置;
(5)最后加入1μL RNase H 37℃,20min,-20℃存储备用。
3、实时定量RT-PCR
Real-time PCR实验采用Premix Ex TaqTM II(Perfect Real Time)试剂盒(宝生物),在Applied Biosystems公司的7300HT Real-Time PCR仪上进行。以水稻ubiquitin基因作为内参。每个反应做三次生物学重复,相对表达量计算方法参见2-△△CT法。Real-time PCR程序:95℃30s;95℃5s,60℃30s,共40个循环;95℃15s,60℃1min,95℃15s。
Real-time PCR反应体系如下:
结果表明,MIT1在叶鞘中表达量高,其次是侧芽、根和花,在茎和穗中表达量较低(见图5)。
实施例5水稻组织GUS染色结果
12g21710Prom::GUS载体构建:MIT1启动子区通过PCR扩增获得,在5’端引入BamHI位点,3’端引入NcoI位点,片段长为2460bp,为翻译水平融合,包含前7个氨基酸在内。重组到pCAMBIA1305.1的BamHI和NcoI位点中去。所用引物为12g21710PromBNF:CGGTACCCGGGGATCCGGAGAACCTGTCTGCACATTC,12g21710Prom BNG:CTCAGATCTACCATGGGGAGGA GAGATGGGAGGCCAT。利用农杆菌侵染水稻愈伤的方法获得转基因植株,用于分析基因组织表达模式。
利用GUS(β-glucuronidase)基因作为报告基因,检测了MIT1基因表达的空间分布情况。MIT1表达模式与RT-PCR结果一致,在茎、节、根、颖壳、叶片和叶鞘中均能检测到GUS活性。在茎、颖壳和叶鞘中GUS活性较强(见图6)。
实施例6 MIT1蛋白的亚细胞定位
35S::MIT1-GFP载体构建:以水稻日本晴cDNA为模板扩增MIT1的全长编码区,片段长1104bp,片段5'和3'端分别引入酶切位点。用相应的高保真内切酶酶切空载体pAN580成线性载体,应用In-Fusion高保真克隆试剂盒说明书连接载体和片段,热激法转化大肠杆菌TOP10感受态细胞。PCR检测获得阳性克隆,菌液送公司测序正确后备用。所用引物为:12g21710GFPF:AGCCCAGATCAACTAGTATGGCCTCCCATCTCCTCCTC,12g21710GFPR:TTGCTCACCATGGATCCCCAAGGGAGTTGGTAGCTGGA。
琼脂糖凝胶检测,胶回收试剂盒(GenStar)回收目的片段;
(1)获得目的片段:PCR扩增
(2)载体准备:所使用的内切酶是NEB的。
37℃,酶切3h。琼脂糖凝胶检测,胶回收试剂盒(GenStar)回收目标载体。
50℃连接,15min。冰上放置2min。向其中加入50μL的感受态细胞,比那个上放置30min.
(4)转化:将上述混好的体系,42℃,热击45s。冰上放置2min。
加入无抗生素的LB培养基,37℃,摇培45min-1h。
(5)涂板,平板倒置,37℃培养14-16h。
(6)挑单克隆,测序检测正确的保菌保存,提质粒保存。
为了阐述MIT1的亚细胞定位情况,利用绿色荧光蛋白(GFP)作为标签,构建了35S::MIT1-GFP载体,将其转入到野生型的原生质体内,观察融合蛋白MIT1:GFP的瞬时表达,并以35S::GFP的瞬时表达作为对照。结果显示由35S启动子启动的GFP蛋白在在细胞膜、细胞质和细胞核内均有表达,而MIT1:GFP蛋白只在叶绿体里表达(见图7)。所以,蛋白MIT1定位在叶绿体上。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺