在CHO细胞中rhIL‑12表达系统的构建方法与流程
背景技术:
:
白细胞介素(interleukin,IL)是由多种细胞产生并作用于多种细胞的一类细胞因子,它和血细胞生长因子同属细胞因子。两者相互协调,相互作用,共同完成造血和免疫调节功能。白细胞介素在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用。
白细胞介素-12(以下简称IL-12),由抗原提呈细胞和B细胞产生,是一种异源二聚体形式的前炎症细胞因子,并以这种形式分泌到细胞外。IL-12能诱导IFN-γ产生,在体内免疫应答中(特别是在细菌或寄生虫感染中)它也是IFN-γ产生所必需。IL-12是一由p35和p40(IL-12β)两条链组成的异源二聚体,两个亚单位通过二硫键连接在一起,这种结构在已发现的IL中所罕见。通常情况下,p40的量远超出p70,在鼠中已观察到p40同源二聚体的产生,是由转染的细胞分泌的,p40同源二聚体没有生物学活性,但它能和IL-12Rβ结合,与p70竞争性争夺IL-12受体(IL-12R)而拮抗其生物学作用。单独的p35不具有生物学活性,但却是合成p70的限速因子。
根据p35,p40两个亚基表达效率不同,前人研究CN200610123433.1曾将p35,p40基因插入不同效率表达载体来解决这个技术问题。然而其操作复杂,转化率低,表达不稳定,影响了其在工业上的应用。因此目前亟需获得一种操作简单,转化率高,表达稳定的载体来制备rhIL-12。
有鉴于此,提出本发明。
技术实现要素:
:
本发明是利用同源性不低于95%的人白细胞介素12的p35亚基和p40亚基的人工设计核苷酸编码序列,利用基因工程的方法,人工合成表达人源重组白细胞介素IL-12的重组基因,将该重组基因序列插入载体,转化宿主细胞,表达得到p35和p40两条链组成的异源二聚体,两个亚单位通过二硫键连接在一起,该异源二聚体有生物学活性;并得到一种高效表达人IL-12真核细胞株。
发明的技术方案为:
本发明提供了一种改造过的重组人白细胞介素-12基因,其特征在于:经过优化的p35亚基的编码序列如SEQ ID NO.1所示;经过优化的p40亚基的编码序列如SEQ ID NO.2所示。该基因表达的rhIL-12蛋白不仅生物活性高于野生型,其在pcDNA3.1(+)质粒和CHO细胞中表达量也要更大。
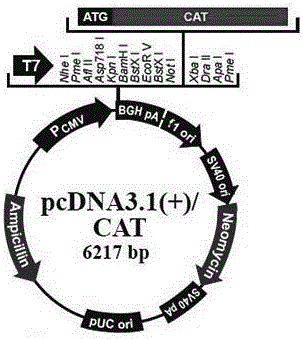
本发明还提供一种重组人白细胞介素-12的真核表达载体,其特征在于:将如权利要求1所述的两段基因装载到该表达载体上。该载体可以为pcDNA3.1(+)质粒(pcDNA3.1(+)质粒标准图谱见图1所示),也可以为pcDNA3.1(+)质粒(pcDNA3.1(+)质粒标准图谱见图2所示)。将目的基因装载到表达载体的方法为本领域常规技术。例如,如要将SEQ ID NO.1,SEQ ID NO.2连接到pcDNA3.1(+)质粒上,用限制性内切酶Kpn I和Not I对合成的SEQ ID NO.1基因及pcDNA3.1(+)质粒进行双酶切,用连接酶将二者连接。用限制性内切酶Kpn I和Xho I对合成的SEQ ID NO.2基因及pcDNA3.1(+)质粒进行双酶切,用连接酶将二者连接。
优选的,SEQ ID NO.1和SEQ ID NO.2基因序列分别由各自的带有SV40增强子元件的CMV启动子控制。一种可行的方式是,在合成目的基因时,将带有SV40增强子元件的CMV启动子这一段基因与目的基因合成在一条链上。如合成SV40增强子-CMV启动子-SEQ ID NO.1或SV40增强子-CMV启动子-SEQ ID NO.2这样一段基因。
优选的,p35亚基的编码序列与启动子之间有一段可以增加表达效率的内含子片段。此段内含子可以是表达载体携带的(如pCI-neo载体中携带的intron元件),也可以是外源的内含子,内含子通过酶切,连接布置在p35亚基的编码序列与启动子之间,引用外源内含子的技术手段采用本领域常规技术。
在构建好的表达载体中,p35表达单元的结构为:SV40增强子-CMV启动子-可以增加表达效率的内含子片段-SEQ ID NO.1,p40表达单元的结构为:SV40增强子-CMV启动子-SEQ ID NO.2。
优选的,可以增加表达效率的内含子片段为玉米adh1基因内含子片段adh1intron。
优选的,将如上所述的任一种表达载体,转化入CHO细胞系制备获得,或者所述细胞用权利要求1所述的核酸序列转染。
本发明的技术效果:1.本发明所提供的改造过的rhIL-12基因,其表达的蛋白,生物活性比野生型更高。2.本发明提供的构建rhIL-12表达载体的方法,操作简便,转化率高。3.本发明提供的表达rhIL-12真核细胞株,表达量也更高。
附图说明:
图1为pcDNA3.1(+)质粒标准图谱。
图2为pCI-neo质粒标准图谱。
具体实施方式:
实验例1
将SEQ ID NO.1,SEQ ID NO.2基因片段插入pcDNA3.1(+)载体中,p35表达单元的结构为:SV40增强子-CMV启动子-SEQ ID NO.1,p40表达单元的结构为:SV40增强子-CMV启动子-SEQ ID NO.2。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为3.6μg/ml,细胞培养罐连续培养平均浓度为8.9μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为9.7×106IU/mg。
实验例2
筛选适宜的具有表达增强作用的内含子。构建如实验例1所述的表达载体。根据表1所示的引物获得这三段内含子,将此三段内含子插入到p35表达单元中,形成SV40增强子-CMV启动子-内含子-SEQ ID NO.1结构。
构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法分别检测不同表达载体的rhIL-12含量。检测结果如表2所示,可知,插入adh1内含子序列后,rhIL-12的表达量提高最多。
表1内含子及克隆内含子所需的引物
表2插入不同内含子后rhIL-12的表达量
对比例1
将p40cDNA和p35cDNA片段分别插入两个效率不同的表达载体中,p40cDNA插入pcDNA3.1(+)载体;p35cDNA插入pCI-neo载体,并位于其intron元件的下游。然后共转染CHO细胞。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为4.2μg/ml,细胞培养罐连续培养平均浓度为10.4μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为8.3×106IU/mg。
对比例2
将SEQ ID NO.1,SEQ ID NO.2基因片段插入两个效率不同的表达载体中,SEQ ID NO.2片段插入pcDNA3.1(+)载体;SEQ ID NO.1片段插入pCI-neo载体,并位于其intron元件的下游。然后共转染CHO细胞。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为4.3μg/ml,细胞培养罐连续培养平均浓度为10.2μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为9.7×106IU/mg。
实施例1
将p40cDNA和p35cDNA片段插入pcDNA3.1(+)载体中,并将adh1intron基因插入在CMV启动子与p35cDNA之间。p35表达单元的结构为:SV40增强子-CMV启动子-adh1intron-p35cDNA,p40表达单元的结构为:SV40增强子-CMV启动子-p40cDNA。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为6.7μg/ml,细胞培养罐连续培养平均浓度为16.9μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为8.3×106IU/mg。
实施例2
将SEQ ID NO.1,SEQ ID NO.2基因片段插入pcDNA3.1(+)载体中,并将adh1intron基因插入在CMV启动子与SEQ ID NO.1之间。p35表达单元的结构为:SV40增强子-CMV启动子-adh1intron-SEQ ID NO.1,p40表达单元的结构为:SV40增强子-CMV启动子-SEQ ID NO.2。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为6.8μg/ml,细胞培养罐连续培养平均浓度为17.1μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为9.7×106IU/mg。
实施例3
将SEQ ID NO.1,SEQ ID NO.2基因片段插入pCI-neo载体中,并将SEQ ID NO.1连接到intron下游。p35表达单元的结构为:SV40增强子-CMV启动子-intron-SEQ ID NO.1,p40表达单元的结构为:SV40增强子-CMV启动子-SEQ ID NO.2。构建成功表达rhIL-12的CHO细胞株应用Gibco的CHO-S-SFM II进行静止培养,再应用Sartorius BiosSTAT plus细胞培养罐进行批培养和连续培养,采用ELISA法检测rhIL-12的含量,静止培养平均浓度为6.0μg/ml,细胞培养罐连续培养平均浓度为16.2μg/ml。
将发酵后的培养液纯化后,将产物采用PBMC IFNγ诱生法测定生物活性。具体为,取健康人新鲜外周血,分离淋巴细胞。用含10%灭活胎牛血清的RPMI1640基础培养液配制细胞悬液(台盼蓝检测细胞活力>95%),在96孔培养板中,每孔加入100μl细胞悬液及相应稀释浓度的rhIL-12国际标准品和纯化的rhIL-12,空白对照组加RPMI1640基础培养液,阳性对照加Anti-human CD3(终浓度0.2μg/ml),37℃,5%CO2条件下培养48h后,收集细胞培养上清液,每孔50μl,离心处理后,ELISA法测定IFNγ含量:在酶标仪450nm处测定各孔吸光度A值,Ascent software version2.6软件曲线定量计算IFNγ含量。根据IFNγ含量来计算rhIL-12的生物活性。测得生物活性为9.7×106IU/mg。
上述实验结果如表3所示。实验例1将改造后的基因插入pEGFP-N1载体中,在p35表达单元的结构中没有插入具有表达增强作用的内含子,导致其培养后细胞液浓度相比实施例2有着显著的下降。对比例1及实施例1均为野生型rhIL-12表达载体的构建,由实验数据可知,野生型rhIL-12的生物活性(8.3×106IU/mg)要比改造序列后rhIL-12的生物活性(9.7×106IU/mg)低。同时,对比例1,2均采用现有技术的方法构建工程菌。实施例1-3采用本发明中的方法构建工程菌。实验证明,无论是构建野生型rhIL-12,还是改造后的rhIL-12,采用该方法发酵的细胞培养液,其静止培养浓度,以及细胞培养罐连续培养浓度,都要显著低于本发明的构建方法。
表3各实验例、对比例、实施例其蛋白发酵后的浓度及活性
- 还没有人留言评论。精彩留言会获得点赞!