一种泽陆蛙基因及其编码的多肽和该多肽的用途的制作方法
本发明涉及来自动物的抵抗物质,具有涉及源于泽陆蛙的基因及其编码的多于20个氨基酸的肽。
背景技术:
:
抗菌肽是一类分子量小于1万,由10-50个氨基酸组成的、具有杀灭或抑制微生物生长的活性多肽。最新研究表明:抗菌肽不但具有广谱的抗微生物活性,同时具有“传统抗生素”无法比拟的优越性:如,除了可以直接杀灭微生物和很难诱导菌株产生耐药性外,还可以调节宿主的免疫功能、抑制炎症反应,间接地在感染性疾病治疗中发挥作用(Nat Rev Microbiol,2012,10(4):243-254)。此外,在严重细菌感染时,抗菌肽还能够中和内毒素、减轻脓毒症,在快速杀灭病原微生物的同时迅速停止或限制感染扩散(Antimicrob Agents Chemother,2014,58(9):5363-5371)。因此,抗菌肽有希望成为新一代抗微生物药物。
目前,对多肽类抗微生物药物的研制受到了日益广泛的重视(Future Med Chem,2013,5(3);315-337)。据国内外文献报道,截至目前,至少有20种从不同生物分离得到的活性多肽候选药物进入了临床试验阶段(Future Med Chem,2013,5(3):315-337)。如,Xoma公司研发的用于治疗脑膜炎球菌血症的孤儿药Neuprex和Cutanea life science公司研发的用于治疗红斑痤疮的Omiganan外用乳膏均进入三期临床研究(Curt Protein Pept Sci,2012,13(7):611-619);另外,Ellceutix公司研发的用于治疗MRSA引起的皮肤感染药物PMX-30063已经进入开发临床前研究(Expert Rev Anti Infect Ther,2014,12(12):1477-1486)。
很多两栖类动物作为中国传统中药和民族药物被广泛应用。如中华蟾蜍(Bufo gargarizans)、大蹼铃蟾(Bombina maxima)、黑斑蛙(Pelophylax nigromaculata)和泽蛙(Euphlyctis limnocharis)等。这些两栖类动物的皮肤和内脏具有广泛的药理活性和临床疗效。已报道药理活性有:抗微生物、抗肿瘤、镇痛、局部麻醉、免疫调节、对心血管系统作用等(Dongwuxue Yanjiu,2015,36(4):183-222;Chem Rev.2015,115(4):1760-1846)。现代研究表明,两栖动物居住在阴暗潮湿细菌滋生的环境,容易受各种病原微生物感染。并且裸露的皮肤使其容易受到各种理化损害。在长期的进化过程中,两栖动物在其皮肤内形成了许多防御物质,这些物质包括抗菌肽、蛋白酶抑制剂、抗氧化多肽和凝集素样多肽等以便抵御环境中的生物和理化损害。目前从2000多种两栖动物的皮肤中鉴定了数千中防御多肽,并且其中有些多肽同时兼有几种活性,如ranacyclin-B、KPHTI、HV-BBI、HJTI、hylaserpin S2、OGTI、PYR、PSKP-1、PSKP-2、BOTI、BVTI、BMTI、BPTI、pLR和BSTI等既是抗菌肽又是蛋白酶抑制剂;pleurain-A1,D1,E1,J1等既是抗氧化肽又是抗菌肽(Chem Rev.2015,115(4):1760-1846)。因此这些多功能肽是潜在的候选药物分子。如从爪蟾(Xenopus laevis)皮肤分泌物获得的活性多肽Magainin具广谱抗微生物作用,同时具有抗肿瘤活性,在美国已获准作为广谱抗菌药物,其基因工程产品已经作为抗菌药物被microbiological biotech公司用于治疗糖尿病人足部溃疡(Curr Protein Pept Sci,2012,13(8):723-738.)。
中国博大的多物种生物资源是结构多样性小分子有机化合物的重要来源,其中一些生物活性物质早已被中医记载和采用。很多两栖类动物作为中国传统中药和民族药物而广泛应用。泽陆蛙(Fejervarya_limoncharis)是传统中药材,其全体有清热解毒,健脾消积功效。可用于治疗痈肿、疔疖、乳痈、小儿疳积、热痢等多种病症。但是由于泽陆蛙个体小和捕捉困难,目前对其皮肤药理活性物质的结构与功能研究在世界范围内还未见报道,其作为中药疗效的物质基础仍不为人们所知。
技术实现要素:
:
本发明所要解决的技术问题是提供一种源于泽陆蛙皮肤的基因,该基因编码的多肽具有具有具有抗菌、抗H5N1型病毒和抗氧化的活性。
本发明解决上述技术问题的方案如下:
一种源于成熟泽陆蛙皮肤的基因,该基因的核酸序列如SEQ ID NO.4所示。
上述基因中第118-216位核苷酸编码的多肽的氨基酸序列如SEQ ID NO.1所示。
上述多肽为由33个氨基酸组成的环肽,其第二十七半胱氨酸和第三十三位半胱氨酸形成成分子内二硫键,分子量为3385.78道尔顿,等电点9.481。
上述多肽具有抗菌、抗H5N1型流感病毒和抗氧化的活性可用于制备治疗微生物感染性疾病的药物和具有抗氧化作用的美容护肤药物。
本发明所述基因中第118-216位核苷酸编码的多肽具有结构简单、人工合成方便、活性强等优点。
附图说明:
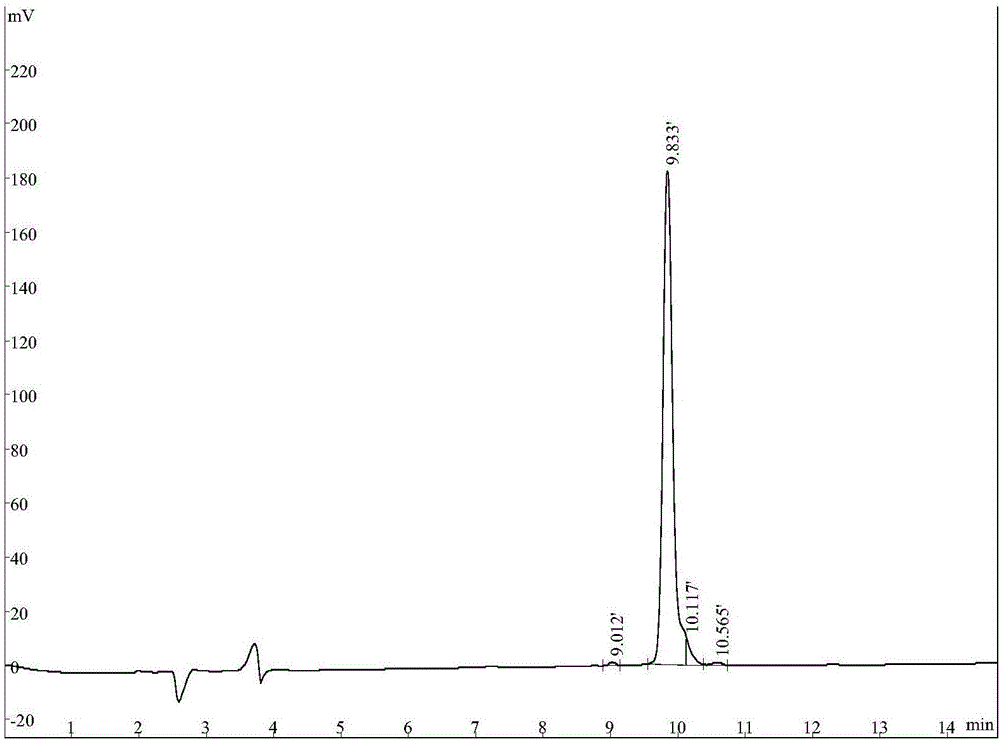
图1为本发明所述多肽的色谱图。
图2为本发明所述多肽的色谱图。
图3为本发明所述多肽清除DPPH和ABTS自由基“量-效”关系曲线。
具体实施方式:
为了便于理解,先将下述实施例中所涉及的基因和多肽名称作如下说明:
下述的泽陆蛙抗菌肽即为SEQ ID NO.4所示序列第118-216位核苷酸编码的多肽,其氨基酸序列如SEQ ID NO.1所示;下述泽陆蛙抗菌肽的编码基因即为SEQ ID NO.4所示的源于成熟泽陆蛙皮肤的基因。
实施例1(基因克隆)
I、泽陆蛙皮肤总RNA提取:活体泽陆蛙用水清洗干净,放入液氮中速冻4h,取皮肤组织,称重,取300mg皮肤组织,加入10m1总RNA提取缓冲液(Trizol溶液,美国GIBCOBRL公司产品),于20m1玻璃匀浆器中匀浆30min。加入等体积酚/氯仿溶液,剧烈混匀,室温放置10min,4℃,12000rpm离心10min,弃除沉淀。向上清中加入等体积的异丙醇,室温放置10min,4℃,12000rpm离心10min,沉淀用75%乙醇洗一次,晾干,管底的沉淀物即为泽陆蛙皮肤总RNA。
II、泽陆蛙皮肤mRNA的纯化:泽陆蛙皮肤mRNA分离纯化采用美国PROMEGA公司的mRNA Isolation Systems试剂盒。具体如下:取泽陆蛙皮肤总RNA 500μg溶于500μl DEPC水中,放入65℃水浴10min,加人3μl Oligo(dT)探针和13μl 20×SSC溶液,混匀,放置室温冷却,称为A液。将磁珠轻弹混匀,至磁力架吸附30S,弃上清,加0.5×SSC 0.3m1,至磁力架吸附30S,最后加0.1ml 0.5×SSC悬浮,称之为B液。将A液加入B液中,室温放置10分钟,至磁力架吸附30sec,弃上清,用0.1×SSC洗涤4次,最后弃上清,加0.L ml DEPC水悬浮,至磁力架上吸附30sec,将上清移至新的试管,再加入0.15m1DEPC水重新悬浮,至磁力架吸附30S,移上清至上述试管,则上清中为纯化的泽陆蛙皮肤mRNA。加入1/10体积3M乙酸钠,pH5.2,等体积异丙醇,于-70℃放置30分钟,4℃,12000rpm离心10min,弃上清,沉淀溶解于10μl DEPC水中得到泽陆蛙皮肤mRNA。
III、泽陆蛙皮肤cDNA文库构建:采用CLONTECH公司CreatorTM SMART TM cDNA Library Construction Kit质粒cDNA文库构建试剂盒。
A.cDNA第一链合成(mRNA反转录):在0.5ml无菌的离心管加入1μl泽陆蛙皮肤mRNA、1μl SMART IV寡聚核苷酸、1μl CDS III/3’PCR引物,加2μl去离子水使总体积达到5μl。混匀离心管中的试剂并以12000rpm离心15sec,72℃保温2min。将离心管在冰上孵育2min。在离心管中加入以下试剂2.0μl 5×第一链缓冲、1.0μl 20mM二硫苏糖醇、1.0μl10mM dNTP混合物、1.0μl PowerScript反转录酶。混合离心管中试剂并以12000rpm离心15sec,在42℃保温1h。将离心管置于冰上中止第一链的合成。从离心管取2μl所合成的cDNA第一链备用。
B.采用长末端聚合酶链式反应(LD-PCR)方法扩增第二链:95℃预热PCR仪。将2μl cDNA第一链(mRNA反转录)、80μl去离子水、10μl 10×Advantage 2PCR缓冲、2μl 50×dNTP混合物、2μl 5’PCR引物、2μl CDS III/3’PCR引物以及2μl大肠杆菌聚合酶离心管进行反应。在PCR仪中按以下程序扩增:95℃20sec,95℃5sec,68℃6min,22个循环。循环结束后,将离心管中合成的cDNA双链进行抽提。
C.PCR产物用PROMEGA公司的SV Gel and PCR Clean-Up System试剂盒进行抽提回收,步骤如下:将通过PCR得到的cDNA双链加入等体积的膜结合缓冲颠倒混匀,然后将混和液转入离心纯化柱,室温静置5分钟,使DNA充分与硅胶膜结合。以12000rpm离心30sec,倒掉收集管中的废液。加入700μl的洗脱液(含乙醇)于离心纯化柱中,以12000rpm离心30sec,倒掉收集管中的废液。重复步骤上述步骤。12000rpm离心5min。将离心纯化柱置于新的离心管中。加入30μl超纯水,在室温下静置5min。以12000rpm离心30sec,管底溶液即为所纯化过的cDNA双链。
D.酶切、连接以及连接产物的转化:在微量离心管中加入1μl Takara pMD18-T载体、4μl泽陆蛙cDNA双链溶液,全量为5μl。加入5μl的连接酶缓冲混合物。16℃反应2h。全量(10μl)加入至100μl DH5α感受态细胞中,冰中放置30min。42℃加热90Sec后,再在冰中放置1分钟。加入37℃孵育过的LB培养基890μl,37℃缓慢振荡培养60min。取200μl涂布于含有X-Gal、IPTG、Amp的LB培养基上37℃培养16h,形成单菌落。每个LB平皿用5m1LB液体培养基洗涤菌落,加30%甘油冻存。构建的cDNA大约含1×106个单独克隆。
Ⅳ、泽陆蛙抗菌肽基因克隆筛选:扩增引物长度为25个核苷酸,其序列为5’ATGTTCACCTTGAAGAAATCCCTG 3’(SEQ ID NO.2),PCR另一扩增引物为CLONTECH公司SMARTTMcDNA Library Construction Kit中的3’PCR Primer引物,其序列为5’ATTCTAGAGGCCGAGGCGGCCGACATG 3’(SEQ ID NO.3)。PCR反应在如下条件下进行:94℃30sec,50℃45sec和72℃2.5min,35个循环。
首先滴定构建的细菌cDNA文库,然后用含100μg/ml氨苄青霉素的LB培养基稀释至适当的细菌浓度(大约5000个细菌/毫升和30个细菌/毫升分别用于首轮筛选第二轮筛选),在96孔培养板上按8×8矩阵铺板(共64孔,每孔100μ1),37℃过夜培养。按行、列分别合并细菌培养液,有16个样品进行PCR鉴定,交叉阳性孔细菌样品进入第二轮筛选。
Ⅴ、泽陆蛙抗菌肽基因序列测定和结果:提取质粒DNA用双脱氧法测定核苷酸序列,使用仪器为美国Applied Biosystems 373A全自动核苷酸序列测定仪,测序引物为BcaBESTTM Sequencing Primer RV-M和BcaBESTTM Sequencing Primer M13-47,BcaBESTTM Sequencing Primer RV-M序列:5`GAGCGGATAACAATTTCACACAGG 3’(SEQ ID NO.5),BcaBESTTM Sequencing Primer M13-47:5’CGCCAGGGTTTTCCCAGTCACGAC 3’(SEQ ID NO.6)。基因测序结果自5’端至3’端序列如SEQ ID NO.4所示。
泽陆蛙抗菌肽基因核苷酸的序列表为:序列长度为219个碱基;序列类型:核酸;链数:单链;拓扑学:直链状;序列种类:cDNA;来源:泽陆蛙皮肤。
根据泽陆蛙抗菌肽的基因推断编码由功能的成熟活抗菌肽为第118-216位核苷酸,氨基酸序列为:GFSSLFKAGAKYLLKQVGKAGAQQLACKAANNC(见序列SEQ ID NO.1)
实施例2(泽陆蛙抗菌肽的制备)
Ⅰ、泽陆蛙抗菌肽的制备方法:根据泽陆蛙抗菌肽的基因推断编码有功能的成熟抗菌肽氨基酸序列后用自动多肽合成仪合成多肽。通过HPLC反相C18柱层析脱盐、纯化。纯化时A液体为0.05%TFA+2%CH3CN,B液为0.05%TFA+90%CH3CN,B液浓度梯度为15min内28-43%,检测波长为220nm,多肽出现在9.833分钟。
Ⅱ、分子量测定采用快原子轰击质谱法(Fast atom bombardment mass spectrometry,FAB-MS),以甘油:间硝基苄醇:二甲亚砜(1:1:l,V:V:V,体积比)为底物,Cs+作为轰击粒子,电流为1μA,发射电压为25Kv。
Ⅲ、纯化的泽陆蛙抗菌肽用高效液相色谱(HPLC)方法鉴定其纯度,等电聚焦电泳测定等电点,用自动氨基酸测序仪测定氨基酸序列结构。
泽陆蛙抗菌肽是中国两栖类动物泽陆蛙抗菌肽基因编码的一种环状多肽,分子量3385.78道尔顿,等电点9.481,多肽全序列一级结构为:GFSSLFKAGAKYLLKQVGKAGAQQL ACKAANNC,其第二十七半胱氨酸和第三十三位半胱氨酸形成分子内二硫键。
实施例3(泽陆蛙抗菌肽的活性实验)
Ⅰ、抑制细菌生长能力测定
抗菌活性检测采用杯碟法,细菌培养基为普通琼脂培养基,真菌培养基为改良沙保氏(Sabousand)培养基分别注入加热融化的培养基20ml于平皿中作为底层,使其在皿底内均匀摊布,凝固后,另取培养基适量加热融化后,分别在每皿中加入5m1菌悬液,摇匀,使其在底层上均匀摊布,作为菌层。冷却后,在平皿中等距离均匀放入已消毒的不锈钢杯6个。第一个钢杯加入0.1-0.3mg/ml浓度的待测化合物溶液0.l ml,其余钢杯采用二倍稀释法加入样品液,37℃培养,观察抑菌圈大小。抑菌圈l0mm以上的作为最小抑菌浓度(Minimal inhibitory concentration,MIC)。细菌菌株来源于广东省微生物研究所,此试验重复四次,取平均值,结果如表1所示,合成的泽陆蛙抗菌肽能显著的抑制细菌生长。
表1.泽陆蛙抗菌肽抑制细菌生长活性
Ⅱ、对五种不同H5N1假病毒的进入抑制能力测定
H5N1假病毒的制备与药物处理:细胞用含10%小牛血清、1%谷氨酰胺、2%青/链霉素的DMEM培养液培养。将处于对数生长期的293T细胞以3x105/ml密度接种于6孔细胞培养板,每孔2ml,37℃、5%CO2培养过夜。待细胞密度达到80%左右时,按照PEI转染试剂说明书步骤操作。在一支无菌小管中加入15μl PEI转染试剂和200μl不含血清和双抗的DMEM培养基,混匀室温静置5min。往PEI-DMEM混合液中加入3μg pNL4-3.luc.R-E-,1μg HA,1μg NA质粒,混匀室温静置30min,以便形成转染复合物。将转染复合物加入细胞中,轻轻转动六孔板,使其分布均匀。5%CO2,37℃培养10h,将培养液更换成含10%小牛血清的DMEM培养液继续培养48h,2000rpm离心5min收集细胞培养,含假病毒的上清液在96孔板中被稀释到每孔1ng/p24浓度后分别与2倍稀释到不同浓度的泽陆蛙抗菌肽和阳性对照药物CL385319在37℃孵育30min。
假病毒进入的抑制作用检测:1X104个/孔MDCK细胞以接种于96孔细胞培养板,培养24h。将上述孵育好的假病毒混合液分别加入到含MDCK细胞的96孔板中在37℃继续培养48h。吸走培养上清,用PBS洗两次细胞,每孔加50μl裂解液,震荡20min,待细胞裂解后吸取40μl裂解物到白板,加入荧光素酶显色底物(Promega,Madison,WI,US),在多功能酶标仪(Genios Pro,Tecan,US)上检测化学发光值,判断药物抑制病毒进入的活性。化合物抑制率(%)=[1-(E-N)/(P-N)]×100,其中E代表实验组的化学发光值,P代表阳性也就是不加药物只加病毒的化学发光值,N代表阴性对照组的化学发光值。化合物的半数抑制浓度(IC50)作为化合物抗病毒活性的指标,通过Calccusyn软件计算得出。如表3所示,泽陆蛙抗菌肽对各种不同H5N1假病毒均有很好的抑制活性。
表2.泽陆蛙抗菌肽抗H5N1禽流感假病毒感染的抑制活性
Ⅲ、抗氧化能力测定
1)DPPH自由基清除能力的测定
利用DPPH(1,1-diphenyl-2-picryl-hydrazyl)自由基清除率测定法研究抗氧化多肽。配制浓度为1×10-5mol/L的DPPH乙醇溶液,避光保存。将2ml,0.1mM的DPPH无水乙醇溶液加入到含有2ml不同酶解样品的洁净试管中,混匀。室温下放置30min后,于517nm处测定吸光度,吸光值越小,表明自由基清除能力越强。
清除率(%)=【1-(Ai-Aj)/A0】*100%
式中,A0为2ml,0.1mM的DPPH无水乙醇溶液+2ml的样品试剂,空白对照,Ai为2ml,0.1mM的DPPH无水乙醇溶液+2ml的样品,Aj为2ml的无水乙醇+2ml的样品。
2)ABTS自由基清除活性的测定
以去离子水将ABTS溶解,使ABTS浓度达到7mmol/L,加入过硫酸钾,使过硫酸钾的浓度为2.45nmol/L。之后将该溶液在室温下置于暗处过夜12~16h。将生成的ABTS自由基溶液用磷酸缓冲液(PBS,0.2mol/L,pH 7.4)稀释,使其在734nm下的吸光值为0.70。取0.1ml酶解液与2.9ml ABTS自由基液混合,摇匀30秒钟,暗处反应10分钟,然后在734nm下测定反应液的吸光值。以蒸馏水代替水解液作空白。
清除率(%)=(Ai-Aj)/A0*100%
式中,A0为2.9ml ABTS试剂与0.1ml蒸馏水混合液的吸光值,Aj为2.9ml ABTS+0.1ml的酶解液混合液的吸光值。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺