含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制作方法
本发明涉及一种具有很好的抗酶解稳定性的含D型非天然抗菌肽类似物,本发明同时还涉及该含D型非天然抗菌肽类似物的和成功及其在制备抗菌药物的应用,属于生物化学技术领域。
背景技术:
近年来,滥用抗生素产生的耐药性问题日益严重,对人类疾病造成了巨大的威胁。寻找新的可替代抗生素的新药迫在眉睫。抗菌肽(Antimicrobial peptides),是生物体经诱导产生的一类具有抗菌活性的小分子多肽,来源广泛,其分子量小,大约在 3~6 kD 之间,有耐热、 耐酸性强,水溶性好,快速的杀菌能力等特点(Hancock REW, Scott MG. Proc Natl AcadSci USA,2000,97(16):8856~ 8861)。抗菌肽的抗菌机制不同于普通抗生素,抗菌机制一般包括①快速破坏菌膜,使菌体内容物泄露,细菌死亡②抗菌肽与细菌细胞内容物(如DNA或RNA)作用,干扰细菌细胞正常的合成和代谢,导致菌体死亡(刘立伟,邓磊. 抗菌肽作用机制研究进展[J].河北化工,2012,35(7):13-15)。所以,抗菌肽不易诱导耐药性的产生,使其成为生物医药领域的热门研究内容。
但是天然抗菌肽也存在一些弊端,比如:酶解稳定性差,生物利用度低;选择性不强,对哺乳动物细胞会产生破坏作用等,都会限制天然抗菌肽的进一步发展。因此,对天然抗菌肽进行改造成为研究的热点,其中非天然的D型氨基酸的引入常被作为一种常用的手段,优化抗菌肽,以提高耐受酶降解的能力(Di Grazia A, Cappiello F, Cohen H.et.al.D-Amino acids incorporation in the frog skin-derived peptide esculentin-1a(1-21)NH2 is beneficial for its multiple functions[J].Amino Acids,2015,47(12):2505-19.)。
技术实现要素:
本发明的目的是提供一种含D型非天然氨基酸的抗菌肽类似物;
本发明的另一目的是提供上述含D型非天然氨基酸的抗菌肽类似物的合成方法;
本发明的还有一个目的,就是提供上述含D型非天然氨基酸的抗菌肽类似物在制备抗菌药物中的应用。
一、含D型非天然氨基酸的抗菌肽类似物的设计
本发明含D型非天然氨基酸的抗菌肽类似物,是在抗菌肽Anoplin的亲水面、疏水面分别引入D型非天然氨基酸,对天然抗菌肽Anoplin进行修饰而得。
在抗菌肽Anoplin的疏水面引入的D型氨基酸为D型Leu,引入位点分别为9和10位,命名为Anoplin-D9,10;其结构式为: GLLKRIKTLL-NH2。
在抗菌肽Anoplin的疏水面引入的D型氨基酸为D型Leu,引入位点分别为9,10和3位,命名为Anoplin-D9,10,3;其结构式为:GLLKRIKTLL-NH2。
在抗菌肽Anoplin的亲水面引入的D型氨基酸为D型Lys,引入位点分别为4和7位,命名为Anoplin-D4,7;其结构式为: GLLKRIKTLL-NH2。
在抗菌肽Anoplin的亲水面引入的D型氨基酸为D型Arg和D型Lys,引入位点分别为5和7位,命名为Anoplin-D5,7;其结构式为:GLLKRIKTLL-NH2 。
二、含D型非天然氨基酸的抗菌肽类似物的合成
以Rink-MBHA Resin 为起始原料, 采用Fmoc固相合成方法,按照设计的替换位点在天然抗菌肽Anoplin的相应位置引入非天然D型氨基酸,然后按序列延长肽链即得。
在天然抗菌肽Anoplin的亲水面引入的D型非天然型氨基酸为D型Arg或/和D型Lys:在天然抗菌肽Anoplin的疏水面引入的D型非天然氨基酸 为D型Leu。
三、含D型氨基酸抗菌肽类似物的体外抑菌实验
1. 对标准菌株的抑菌实验
采用常见的二倍稀释法测定药物的最小抑菌浓度,即MIC值。结果重复三次以上的、平行实验。结果见表1:
2. 酶解稳定性试验
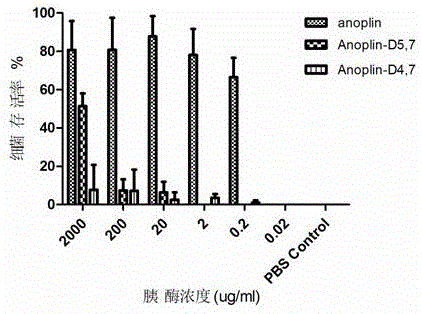
具体方法: 将胰蛋白酶或糜蛋白酶配成一系列浓度 2000,200,20,2, 0.2, 0.02μg/ml。将抗菌肽Anoplin; Anoplin-D9,10;Anoplin-D9,10,3;Anoplin-D4,7; Anoplin-D5,7 用PBS配成相应浓度,将母液与不同浓度的胰酶孵育(1:4, v/v),不含胰酶的PBS做对照,孵育物37℃孵育6小时,随后,取出60℃烘箱灭活10min, 后用MH肉汤稀释到2×MIC,加入96孔板中,每孔100μl,设定3个复孔,然后加菌,每孔加菌100μl, 37℃孵育过夜,随后酶标仪测定OD600nm, 根据给药组的OD值比阴性组的OD值作为细菌存活率。
图1为耐受胰酶6小时稳定性试验结果。可以看出,Anoplin-D5,7和Anoplin-D4,7 耐受胰酶降解的能力显著提高,跟母肽Anoplin相比,耐受胰酶分别提高104和105倍。
图2 为耐受糜蛋白酶6小时稳定性试验结果。可以看出,四条D型类似物耐受糜蛋白酶的能力较母肽Anoplin显著提高,Anoplin-D5,7和Anoplin-D4,7 耐受糜蛋白酶降解的能力提高100倍,Anoplin-D9,10和Anoplin-D9,10,3 耐受糜蛋白酶降解的能力提高10倍。
3. RP-HPLC降解率曲线
抗菌肽Anoplin,与其D型类似物D-4,7; D-5,7 与200 μg/ml的胰酶37摄氏度孵育,在不同时间段,吸取孵育液,进行RP-HPLC分析,绘制降解率-时间曲线(图3)。可以看出,母肽Anoplin在120min时间内就被完全快速100%降解,而类似物D-5,7和D-4,7 降解率显著降低,在共孵育24小时(1440min),降解率仅为20%左右。
抗菌肽Anoplin,与其D型类似物D-4,7; D-5,7 与20μg/ml的糜蛋白酶37摄氏度孵育,在不同时间段,吸取孵育液,进行RP-HPLC分析,绘制降解率-时间曲线(图4)。可以看出,母肽Anoplin在300min时间内就被完全快速100%降解,而类似物D-5,7和D-4,7 降解率显著降低,在共孵育24小时(1440min),降解率仅为20%和15%左右。
抗菌肽Anoplin,与其D型类似物D-9,10; D-9,10,3与2μg/ml的糜蛋白酶37摄氏度孵育,在不同时间段,吸取孵育液,进行RP-HPLC分析,绘制降解率-时间曲线(图5)。可以看出,在相同时间间隔,母肽Anoplin的降解率均高于类似物D-9,10和D-9,10,3。
4. 抑制生物膜形成试验
孵育方法:将标准铜绿假单孢菌分别用胰蛋白胨大豆肉汤含0.5%葡萄糖(TSBG)培养到中间对数期,最终用TSBG稀释到5×105 CFU/ml. 将其加到96孔板中,每孔20 μl, 然后将抗菌肽按二倍稀释的方法,使其浓度分别是2×MIC,1×MIC, 0.5×MIC, 0.25×MIC, 0.125×MIC, 0.0625×MIC. 然后将药物分别加到孔中,每个浓度6个平行,将共孵育物37℃孵育24小时。
处理方法:到时间后将平板取出,吸去上清液,加入PBS洗,每孔洗2遍,然后加无水甲醇固定生物膜,固定15min,然后吸去,空气中晾干,然后每孔加入200μl ,0.1% 结晶紫染色15min, 染色后,将其吸去,用去离子水洗,每孔洗2遍,最后加入95%无水乙醇,释放染料15min, 快速测定595nm处的吸光值。
生物膜形成率=(OD给药组-OD阴性组)/OD阴性组
抑制生物膜形成率%= 1-生物膜的形成率
试验结果见图6。横坐标是药物浓度,纵坐标是抑制铜绿假单胞菌生物膜形成率,发现生物膜抑制率呈现出剂量依赖性,母肽Anoplin和类似物D-9,10; D-9,10,3; D-4,7; D-5,7在高浓度2×MIC时,呈现出98%以上的抑膜形成率。在低浓度1×MIC时,母肽Anoplin 和类似物D-9,10; D-5,7抑膜形成率有所降低,但D-9,10,3仍然保留了很强的抑制率。在0.5×MIC时, 母肽Anoplin,D-4,7, D-5,7几乎丧失了抑膜能力,抑制膜形成率低于10%。只有类似物D-9,10和D-9,10,3仍然可以抑制生物膜的形成,抑制率40%。在浓度低于0.5×MIC时,所有肽都不能表现出抑制生物膜形成的能力。
附图说明
图1为本发明含D型氨基酸抗菌肽类似物耐受胰酶6小时稳定性试验。
图2为本发明含D型氨基酸抗菌肽类似物耐受糜蛋白酶6小时稳定性。
图3为Anoplin、D型类似物D-4,7、D-5,7 与200 μg/ml的胰酶37摄氏度孵育不同时间的RP-HPLC降解率曲线。
图4为Anoplin、D型类似物D-4,7、D-5,7 与20 μg/ml的胰酶37摄氏度孵育不同时间的RP-HPLC分析。
图5为Anoplin、D型类似物D-9,10、D-9,10,3与2μg/ml的糜蛋白酶37摄氏度孵育不同时间的RP-HPLC分析。
图6为本发明含D型氨基酸抗菌肽类似物抑制生物膜形成试验。
图7为纯肽Anoplin-D9,10的RP-HPLC分析谱图。
图8为纯肽Anoplin-D9,10,3的RP-HPLC分析谱图。
图9为纯肽Anoplin-D4,7的RP-HPLC分析谱图。
图10为纯肽Anoplin-D5,7的RP-HPLC分析谱图。
具体实施方式
下面通过具体实施例对本发明D型氨基酸抗菌肽类似物的结构、合成作进一步说明。
实施例1、类似物Anoplin-D9,10的合成
称取Rink-MBHA 树脂,取代值为0.43mmol/g, 合肽量为0.15mmol,加入重蒸的二氯甲烷溶液,充分搅拌溶胀树脂,时间为30min, 然后加入10%的六氢吡啶脱树脂Fmoc保护,每次洗2min, 共洗4遍,然后用重蒸DMF溶液洗树脂,同样每次2min, 共洗4遍,最后使用茚检指示剂(苯酚:氰化钾吡啶:茚三酮=1:2:1)检验树脂是否脱去Fmoc保护基团,沸水煮树脂1min,立即观察,树脂显蓝色,则证明Fmoc基团已脱出,按合肽的序列,从C末端开始,称取第一个氨基酸为d-Leu,1.5倍过量,加入HOBT (1倍过量),HBTU(1倍过量),待氨基酸溶解后,加入启动剂DIEA (4倍过量)。上述氨基酸与树脂共同搅拌反应,时间1h,反应结束后,茚检试剂检验,沸水煮树脂1min, 树脂变为无色,说明D型Leu氨基酸成功接上,如此重复操作,直至后续接完d-leu-Thr-Lys-Ile-Arg-Lys-Leu-Leu-Gly氨基酸序列。经RP-HPLC制备纯化,使用C18柱纯化,洗脱条件为20%-60%乙腈,8ml/min。纯肽Anoplin-D9,10的RP-HPLC分析谱图见附图说明7。
实施例2 类似物Anoplin-D9,10,3的合成
称取Rink-MBHA 树脂,取代值为0.43mmol/g, 合肽量为0.25mmol,加入重蒸的二氯甲烷溶液,充分搅拌溶胀树脂,时间为30min, 然后加入15%的六氢吡啶脱树脂Fmoc保护,每次洗2min, 共洗4遍,然后用重蒸DMF溶液洗树脂,同样每次2min, 共洗4遍,然后茚检指示剂(苯酚:氰化钾吡啶:茚三酮=1:2:1)检验,树脂显蓝色,证明树脂上的Fmoc基团已脱出,按合肽的序列,从C末端开始,称取第一个氨基酸d-Leu氨基酸,2倍过量,加入HOBT (3倍过量),HBTU(3倍过量),待氨基酸溶解后,加入启动剂DIEA (6倍过量)。上述氨基酸与树脂共同搅拌反应,时间1.5h,反应结束后,茚检试剂检验,树脂变为无色,说明第一个氨基酸成功接上,如此重复操作,后续接完d-leu-Thr-Lys-Ile-Arg-Lys-d-Leu-Leu-Gly氨基酸序列。经RP-HPLC制备纯化,使用C18柱纯化,洗脱条件为20%-60%乙腈,8ml/min。纯肽Anoplin-D9,10,3的RP-HPLC分析谱图见附图说明8。
实施例3、类似物Anoplin-D4,7的合成
称取Rink-MBHA 树脂,取代值为0.43mmol/g, 合肽量为0.2mmol,加入重蒸的二氯甲烷溶液,充分搅拌溶胀树脂,时间为30min, 然后加入15%的六氢吡啶脱树脂Fmoc保护,每次洗2min, 共洗4遍,然后用重蒸DMF溶液洗树脂,同样每次2min, 共洗4遍,然后茚检指示剂(苯酚:氰化钾吡啶:茚三酮=1:2:1)检验,树脂显蓝色,证明Fmoc基团已脱出,按合肽的序列,从C末端开始,称取第一个氨基酸Leu,3倍过量,加入HOBT (5倍过量),HBTU(5倍过量),待氨基酸溶解后,加入启动剂DIEA (6倍过量)。上述氨基酸与树脂共同搅拌反应,时间1h,反应结束后,茚三酮检验,若树脂变为无色,说明氨基酸成功接上,如此重复操作,直至接完后面的序列leu-Thr-d-Lys-Ile-Arg-d-Lys-Leu-Leu-Gly。经RP-HPLC制备纯化,使用C18柱纯化,洗脱条件为20%-60%乙腈,8ml/min。纯肽Anoplin-D4,7的RP-HPLC分析谱图见附图说明9.
实施例4、类似物Anoplin-D5,7的合成
称取Rink-MBHA 树脂,取代值为0.43mmol/g, 合肽量为0.2mmol,加入重蒸的二氯甲烷溶液,充分搅拌溶胀树脂,时间为30min, 然后加入15%的六氢吡啶脱树脂Fmoc保护,每次洗2min, 共洗4遍,然后用重蒸DMF溶液洗树脂,同样每次2min, 共洗4遍,然后然后茚检指示剂(苯酚:氰化钾吡啶:茚三酮=1:2:1)检验,树脂显蓝色,显蓝色,证明Fmoc基团已脱出,按合肽的序列,从C末端开始,称取第一个氨基酸Leu,3.4倍过量,加入HOBT (6倍过量),HBTU(6倍过量),待氨基酸溶解后,加入启动剂DIEA (8倍过量)。上述氨基酸与树脂共同搅拌反应,时间2h,反应结束后,茚检指示剂检验,若树脂变为无色,说明氨基酸成功接上,如此重复操作,直至按序列接完剩下的氨基酸leu-Thr-d-Lys-Ile-d-Arg- Lys-Leu-Leu-Gly。经RP-HPLC制备纯化,纯肽Anoplin-D5,7的RP-HPLC分析谱图见附图说明10。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺