一种酶活提高的天冬酰胺酶突变体的制作方法
本发明涉及一种酶活提高的天冬酰胺酶突变体,属于酶工程技术领域。
背景技术:
L-天冬酰胺酶(EC 3.5.1.1)是一种有抗癌活性的蛋白酶,能专一催化L-天冬酰胺水解成天冬氨酸和NH3。L-天冬酰胺酶的生理作用主要表现为对某些肿瘤的抑制作用,尤其对急性白血病和恶性淋巴肿瘤有效。L-天冬酰胺酶已成为治疗白血病非常有效的药物,对骨髓细胞没有抑制作用。
L-天冬酰胺酶可以减少食物中丙烯酰胺的生成。丙烯酰胺主要是由食品原料中的还原糖和天冬酰胺在高温加热过程中通过美拉德反应生成,在食物中加入天冬酰胺酶可以水解天冬酰胺,从源头上减少丙烯酰胺的生成。
一些微生物、哺乳动物及植物被证实含有L-天冬酰胺酶。因为动物血清中L-天冬酰胺酶含量低,且提取工艺复杂,微生物具有易培养,成本低等优点,成为学者研究的重点,目前研究的产L-天冬酰胺酶微生物主要包括Escherichia coli、Erwinia carotovora、Erwinia chrysanthemi等,但野生菌株L-天冬酰胺酶产量低,近年来利用基因工程技术将L-天冬酰胺酶基因克隆到大肠杆菌中,获得L-天冬酰胺酶的高效表达,利用工程菌产L-天冬酰胺酶已成为一个重要来源。
L-天冬酰胺酶有两种类型,L-天冬酰胺酶I和L-天冬酰胺酶II,Escherichia coli、Erwinia chrysanthemi、B.subtilis等均包含这两种L-天冬酰胺酶,研究证实仅L-天冬酰胺酶II具有抗癌作用,来自Escherichia coli和Erwinia chrysanthemi的L-天冬酰胺酶II已被开发为治疗急性淋巴细胞白血病的有效药物,目前研究的大部分是具有抗肿瘤效果的L-天冬酰胺酶II。
目前的研究表明,基因工程手段是提高天冬酰胺酶产量的主要方法,不同来源的天冬酰胺酶已在大肠杆菌,枯草芽孢杆菌,酵母等不同宿主中获得表达,但其产量仍不高。目前报道的最高产量为228U/mL(Wang Y,Qian S,Meng G,Zhang S(2001)Cloning and expression of L-Asparaginase gene inEscherichiacoli.Appl BiochemBiotechnol 95(2):93-101)。另外,常规的提高的重组蛋白表达水平的方法主要是更换强启动子,高分泌能力高的信号肽等等。
技术实现要素:
本发明的第一个目的是提供一种天冬酰胺酶突变体,是将SEQ ID NO.1所示天冬酰胺酶氨基酸序列第29位谷氨酸定点突变为其它氨基酸;所述其它氨基酸包括:谷氨酰胺,精氨酸,苏氨酸,赖氨酸,天冬酰胺。
在本发明的一种实施方式中,所述其他氨基酸还包括丙氨酸、半胱氨酸、组氨酸、异亮氨酸、甘氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、色氨酸、酪氨酸、缬氨酸。
在本发明的一种实施方式中,所述的天冬酰胺酶突变体序列如SEQ ID NO.2,或SEQ ID NO.3,或SEQ ID NO.4,或SEQ ID NO.5,或SEQ ID NO.6所示。
本发明的第二个目的是提供编码所述天冬酰胺酶突变体的基因。
本发明的第三个目的是提供含有所述基因的载体或细胞系。
本发明的第四个目的是提供一种表达所述突变体的基因工程菌。
在本发明的一种实施方式中,所述基因工程菌以pP43NMK为载体,以枯草芽孢杆菌为宿主。
在本发明的一种实施方式中,所述枯草芽孢杆菌是枯草芽孢杆菌WB600。
本发明的第五个目的是提供一种提高天冬酰胺酶的方法,是对天冬酰胺酶活性位点附近氨基酸进行定点饱和突变;所述活性位点氨基酸是第29位谷氨酸。
在本发明的一种实施方式中,所述天冬酰胺酶序列如SEQ ID NO.1所示。
本发明的第六个目的是提供所述突变体在制备药物方面的应用。
本发明还提供所述基因工程菌在制备含天冬酰胺的产品中的应用。
本发明的有益效果:本发明通过定点饱和突变改变蛋白质分子活性位点附近氨基酸残基,提高天冬酰胺酶催化效率,进一步提高天冬酰胺酶产量。本发明构建的天冬酰胺酶分泌能力增强的重组枯草芽孢杆菌可将天冬酰胺酶酶活较出发菌株提高2.37倍。改造后的基因工程菌产酶能力显著提高,摇瓶发酵生产天冬酰胺酶酶活达到320U/mL,为目前报道的摇瓶的最高的产量,更适合工业应用,可降低生产成本,提高生产效率。
附图说明
图1定点突变E29后ASN产量;
图2定点突变E29后ASN蛋白表达水平;泳道1~6分别为原始菌株WT,突变体E29Q,突变体E29R,突变体E29T,突变体E29K,突变体E29N;
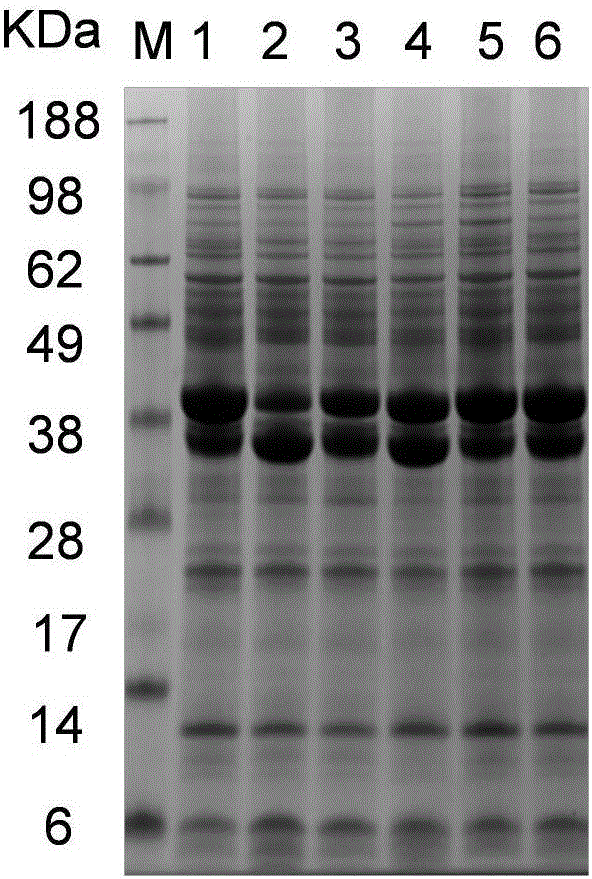
图3 SDS-PAGE分析突变体的纯化水平;泳道1~6分别为原始菌株WT,突变体E29Q,突变体E29R,突变体E29T,突变体E29K,突变体E29N。
具体实施方式
培养基:
LB培养基:胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,pH7.0;
发酵培养基:大豆蛋白胨10g/L,玉米浆5g/L,尿素1g/L,蔗糖35g/L,磷酸氢二钾2.3g/L,磷酸二氢钾1.7g/L,硫酸镁0.75g/L,氯化钠5g/L;调节pH6.8-7.0。
天冬酰胺酶酶活力的测定:
采用分光光度法测定天冬酰胺酶酶活。1个单位天冬酰胺酶酶活定义为:在37℃反应条件下,每分钟内能催化L-天冬酰胺释放1μmol NH3所需要的酶量为一个酶活单位(U/ml)。酶活测定条件:37℃条件下,1ml 10mM K2HPO4-KH2PO4(pH7.5),0.1ml 189mM天冬酰胺,0.1ml发酵上清液,保温30分钟,0.5ml 1.5M TCA终止反应。利用ShimadzuUV-1240在436nm处测定吸光值,通过硫酸铵绘制标准曲线,根据标准曲线计算酶活。
表1引物序列
实施例1枯草芽孢杆菌来源天冬酰胺酶晶体结构模拟
以已报道的Erwinia chrysanthemi天冬酰胺酶(PDB code:1hg0)为模板(Structural basis for the activity and substrate specificity ofErwinia chrysanthemi L-Asparaginase,2001年公开)(两者氨基酸相似度为58.1%),利用在线模拟软件SWISS-MODEL,模拟枯草芽孢杆菌来源的天冬酰胺酶的晶体结构。
实施例2定点突变E29天冬酰胺酶菌株构建
设计的上下游引物P1、P2(如表1所示),以pP43H-D30质粒为模版进行PCR,构建E29饱和突变菌株。PCR条件为:98℃3min,98℃30S,55℃90S、72℃8min,34个循环。PCR扩增体系:模板1μL,上下游引物各1μL,dNTP Mix4μL,5×primeSTARBuffer10μL,灭菌的双蒸水32.5μL,prime STARDNA聚合酶0.5μL。采用胶回收试剂盒对PCR产物进行纯化和回收,电泳检验回收产物的浓度。DpnI消化处理PCR回收产物,将其转化到感受态E.coil JM109,用氨苄青霉素LB平板,挑取阳性菌落。37℃摇床过夜培养后提取质粒,命名为pP43H-D30/E29X,再转入枯草芽孢杆菌WB600,以获得E36饱和突变的突变菌株WB43H-D30/E29X(X表示突变后的氨基酸)。
实施例3高分泌能力天冬酰胺酶生产菌株的验证
挑选实施例2中转化子接种到装有LB液体培养基96孔板中,37℃,培养6h,转接到发酵培养基中,接种量按体积比为5%,培养48h。收集发酵上清,检测发酵上清酶活。挑选产量提高的菌株进行摇瓶发酵,对天冬酰胺酶活力进行测定,结果如图1所示。与出发菌株比较,突变株的酶活显著提高,其中E29R酶活达到320U/mL。蛋白电泳显示,突变后菌株目标蛋白表达水平均没有显著变化(图2)。同时表明E29定点饱和突变后并没有影响ASN在B.subtilis中的分泌。
发酵上清液经Ni2+亲和层析柱纯化得到电泳纯的ASN饱和突变体(图3),并检测酶学性质,如表2所示,与野生酶相比,Km降低1.3-1.8倍,Kcat值提高1.41-2.2倍,而催化效率(Kcat/Km)提高为野生酶的1.8-2.8倍。与之相对性的,我们发现产量提高的突变体的比酶活也显著提高,其中E29Q比酶活较野生酶提高2.15倍,达到258.8U/mg。通过检测突变体在65℃的半衰期表明,除E29K外,突变体半衰期(t1/2)显著的提高,其中E29Q达到150min,较野生酶提高2.37倍。分析自由能结果表明,突变体自由能分别提高1.5-2.2kJ·mol-1。上述结果表明,定点饱和突变E29能显著的提高ASN的底物结合能力、催化效率和热稳定性。
表2突变体酶学性质
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!