呼吸道感染相关腺病毒的通用型核酸等温检测试剂的制作方法
本发明涉及生物
技术领域:
,尤其涉及一种呼吸道感染相关腺病毒的通用型核酸等温检测试剂。
背景技术:
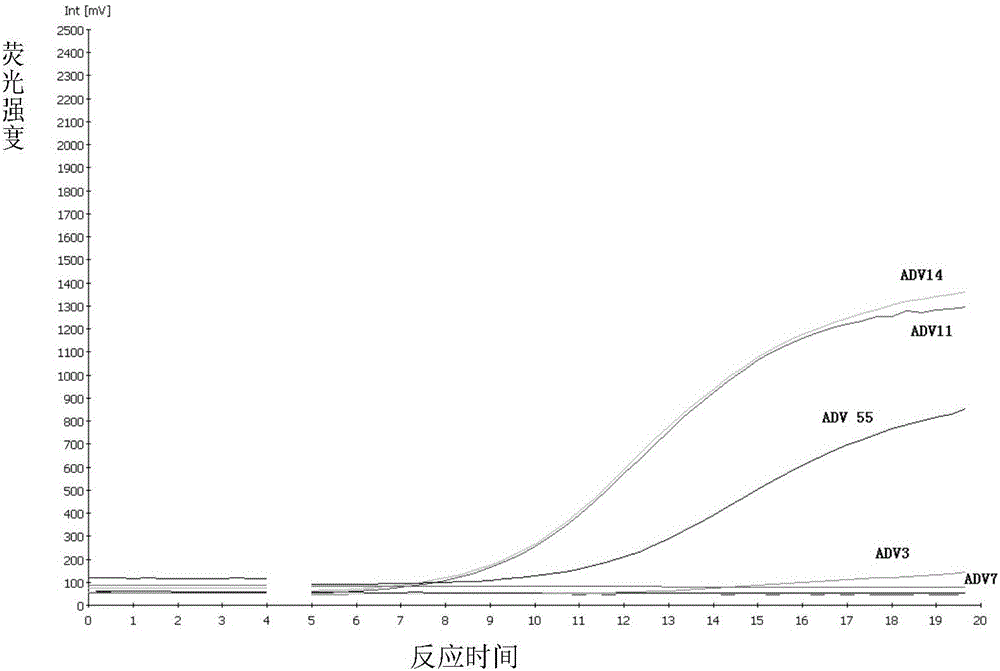
:腺病毒属于腺病毒科哺乳动物腺病毒属,是无包膜的DNA病毒。病毒粒子呈球形,二十面体立体对称。分为6个亚群(A-F),包括50多个基因型。腺病毒对呼吸道、胃肠道、尿道和膀胱、眼、肝脏等均可感染,人腺病毒约1/3的已知血清型通常与人类疾病相关,但一种血清型可引起不同的临床疾患;相反,不同血清型也可引起同一种疾患。在聚集性呼吸道感染中,腺病毒是主要的病原体之一。主要型别包括3型、7型、11、14、55等型别。主要症状为咳嗽、鼻塞和咽炎,同时伴有发热、寒战、头痛和肌肉痛。准确快速地鉴定病原,对于腺病毒感染的防控具有重要意义。目前腺病毒感染的检测,主要以荧光定量PCR为主。荧光定量PCR具有较高的灵敏性,但反应过程时间长、仪器体积大,不适于现场检测。基于重组酶-多聚酶的核酸检测技术(Recombinase-polymeraseassay,RPA)模拟了细胞内核酸合成的机制,在重组酶、多聚酶及单链结合蛋白的作用下,不需解链即可对双链模板在室温条件下完成等温扩增,反应仅需10-20分钟,利用简易的荧光检测仪即可进行结果的读取输出,是一种适于病原体核酸现场快速检测的技术方法。RPA是一种新型的核酸检测技术,可在室温条件下实现核酸的快速扩增,有望应用于对病原体的现场快速筛查和检测。与普通PCR和荧光定量PCR相比,具有更好的应用前景。针对常见的腺病毒感染,目前尚没有可用的RPA检测试剂。技术实现要素:本发明一个目的是提供用于鉴定呼吸道感染腺病毒的重组酶多聚酶核酸检测成套核酸。本发明提供的成套核酸,由引物对和探针组成;所述引物对由序列表中序列1所示的单链DNA分子和序列表中序列2所示的单链DNA分子组成;所述探针依次由A-dt-发光基团-四氢呋喃-dt-淬灭基团-B组成,其中A的核苷酸序列为序列3,B的核苷酸序列为序列4。各个组分之间是共价连接。上述的成套核酸,所述发光基团为FAM,所述淬灭基团为BHQ1;或所述引物对中两条引物和所述探针的摩尔比为1:1:0.3。本发明第二个目的是提供用于鉴定呼吸道感染腺病毒的重组酶多聚酶核酸检测试剂。本发明提供的试剂,包括上述的成套核酸;上述试剂还包括重组酶和多聚酶,源于exokit(公司产品,货号PFERT0205)中的PCR扩增八连管(内已装有含重组酶和多聚酶的冻干粉)。上述的检测试剂中,所述引物对中两条引物和所述探针的浓度分别为0.4μM、0.4μM和0.12μM。本发明第三个目的是提供用于鉴定呼吸道感染腺病毒的重组酶多聚酶核酸检测试剂盒。本发明提供的试剂盒,包括上述的成套核酸或上述的检测试剂。上述的成套核酸或上述的检测试剂或上述的试剂盒在鉴定呼吸道感染腺病毒中的应用也是本发明保护的范围;或上述的成套核酸或上述的检测试剂或上述的试剂盒在制备鉴定呼吸道感染腺病毒产品中的应用也是本发明保护的范围。上述的成套核酸或上述的检测试剂或是上述的试剂盒在检测待测样本是否感染或含有呼吸道感染腺病毒中的应用也是本发明保护的范围;或上述的成套核酸或是上述的检测试剂或上述的试剂盒在制备待测样本是否感染或含有呼吸道感染腺病毒产品中的应用也是本发明保护的范围。本发明第四个目的是提供一种检测待测样本是否含有呼吸道感染腺病毒的方法。本发明提供的方法,包括如下步骤:用上述的成套核酸或上述的检测试剂或上述的试剂盒对待测样本的核酸进行重组酶多聚酶核酸扩增,通过观察反应曲线的拐点确定待测样本中是否感染呼吸道感染腺病。上述方法中,所述重组酶多聚酶核酸扩增的反应温度为37-42℃,反应时间10-20min;实施例中具体条件为:反应温度为39℃,本底荧光值100-300,扩增15min,10分钟内出现拐点,反应仪器为tubescanner检测仪。上述方法中,所述根据扩增结果判定待测样本是否含有呼吸道感染腺病为若结果为阳性,则待测样本有或候选有病毒,若结果显示阴性,则待测样本不含有或候选不含有病毒;或,所述腺病毒3型、7型、11型、14型或55型。本发明的实验证明,本发明针对5种呼吸道感染相关的腺病毒,设计了通用的RPA检测引物和探针,建立了呼吸道相关腺病毒的RPA检测体系和方法,该技术对呼吸道相关腺病毒的现场快速筛查和检测,具有重要价值,可实现对未知样本的快速筛查。附图说明图1为引物探针组1对5种型别腺病毒的RPA扩增结果。图2为引物探针组2对5种型别腺病毒的扩增结果。图3为引物探针组3对5种型别腺病毒的扩增结果。图4为引物探针组2的特异性检测。图5为引物探针组3的特异性检测。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、RPA引物和探针的设计从NCBI的Genbank数据库中下载腺病毒3型、7型、11型、14型和55型的hexon基因序列,用MEGA5.0对所有基因序列进行比对分析,选保守区进行引物及探针的设计。共设计并合成2套引物探针,序列如下表1所示。表1为引物探针序列实施例2、RPA反应体系及方法的建立和优化一、基因组DNA的提取1、病毒的培养和滴定将腺病毒3型、7型、11型、14型、55型(全军传染病专业委员会,腺病毒感染诊疗指南,解放军医学杂志,2013(8),529-534;黄国虹,腺病毒新型别的研究进展,病毒学报,2013(29),342-348)分别接种Hep2细胞(购自ATCC,CAT.CCL10),置37度CO2培养箱中培养,然后逐日观察细胞病变。待培养瓶中细胞病变的比例超过75%,将培养瓶置-70℃冻融一次,然后将含有病毒的细胞培养上清分装。检测每种腺病毒的滴度:将腺病毒3型、7型、11型、14型、55型培养上清分别进行10倍系列稀释(10-108,共8个浓度,10倍系列稀释),每个稀释浓度的病毒上清分别感染培养于96孔细胞板中的Hep2细胞,每个细胞孔接种100ul,每个浓度重复4个孔。同时设未感染病毒的正常细胞对照。接种后每日观察不同浓度下的细胞生长情况,连续观察5日。若病毒成功感染培养细胞并增埴,则可使细胞病变并死亡。将可致4个复孔中2个细胞孔内出现明显的病变死亡的病毒量定义为1TCID50,通过观察各个微孔中细胞病变情况确定病毒培养上清原液中的病毒滴度。结果表明,上述病毒培养上清原液中腺病毒3型、7型、11型、14型、55型的滴度分别为106PFU/ml、105PFU/ml、2×106PFU/ml、107PFU/ml、2×105PFU/ml。然后将腺病毒置-70℃保存待用。以上实验操作均在BSL-2实验室中进行。同时培养其他呼吸道感染相关病毒:呼吸道合胞病毒(RSV)(林立等,呼吸道合胞病毒感染发病机制,中华儿科杂志,2006(44),673-675)、H3N2(黄维娟等,2011-2012年度中国H3N2亚型流感病毒病原学特征分析,2013(29),258-262;)、H1N1亚型流感病毒(韩一芳等,2009年新型甲型H1N1流感流行特征及防控措施,第二军医大学学报,2009(30),610-612;、副流感病毒1型(郭珊珊等,栀子提取物ZG对副流感1型感染后宿主细胞膜的影响,病毒学报,2007(24),384-388;)和3型(何建凡等,荧光定量RT-PCR快速检测人副流感3型病毒,现代预防医学,2008(35),2953-2955),作为阴性对照。2、核酸提取在BSL-2实验室的生物安全柜中将5种型别的腺病毒病毒培养物分别取200ul,用invitrogen的DNA/RNA核酸提取试剂盒进行病毒核酸提取,具体操作步骤按照试剂盒说明书进行,得到腺病毒3型、7型、11型、14型、55型的核酸。分别提取呼吸道合胞病毒(RSV)、H3N2、H1N1亚型流感病毒、副流感病毒1型和3型的核酸作为阴性对照。二、RPA反应1、引物探针的选择与荧光定量PCR和普通PCR相比,RPA反应体系需要引的物探针序列更长,但尚没有可用的设计软件可用,因此,在RPA技术方法建立中,需要设计多套引物探针序列,通过RPA实验分别确定每套引物探针的特异性和灵敏性,从中筛选出特异性强、灵敏性高的引物探针。根据表1中所列出的引物探针序列,adeno-RPA-F,adeno-RPA-R,adeno-RPA-PROBE组合为引物探针组1;adeno-RPA-F-3,adeno-RPA-R-3,adeno-RPA-PROBE-3组合为引物探针组2;adeno-RPA-F-11,adeno-RPA-R-11,adeno-RPA-PROBE-4组合为引物探针组3。将上述一得到的每种腺病毒的核酸分别作为扩增模板,利用exokit(公司产品,货号PFERT0205)和上述3组引物探针组分别进行RPA扩增,取出试剂盒内的PCR扩增八连管,内已装有含重组酶和多聚酶的冻干粉,然后在每管中加入表2所示的组分:表2反应体系中部分组分每管的反应体系共47.5ul,置蜗旋混合液上震荡30s,使每个反应管中的干粉充分溶解。然后在每个反应管中加2.5ul的醋酸镁(280nM)。将反应管置于tubescanner检测仪中进行反应,反应条件:反应温度为39℃,本底荧光值100-300,扩增15min,10分钟内出现拐点。若显示结果为阳性,则待测样本中含有目标基因;若显示结果为阴性,则待测样本中不含有目标基因。结果如图1-3和表3,3套引物探针中,引物探针组1仅可扩出3个型别的病毒核酸(11型,14型,55型);引物探针组2和引物探针组3可扩增出所有5个型别的腺病毒核酸。因此,舍弃引物探针组1,仅检测引物探针组2和引物探针组3的特异性和灵敏性,以从中选取检测效果更好的引物和探针。表33套引物对对5个型别腺病毒核酸的检测结果2、灵敏度检测将上述一得到的每种腺病毒的核酸分别进行10倍系列稀释后(100-106)作为扩增模板,分别用引物探针组2和引物探针组3进行RPA扩增,反应体系和条件如上述1中所述。结果如表4和表5所示,表4引物探针组2的灵敏性检测结果表5引物探针组3的灵敏性检测结果从灵敏性检测结果中可以看出,引物探针组3仅对腺病毒7型和55型的检测灵敏性与引物探针组2相当,其他几个型别的病毒,引物探针组3均低于引物探针组2,作为呼吸道腺病毒的通用型核酸检测引物探针,引物探针组2的灵敏性高于引物探针组3。3、特异性检测将上述一得到呼吸道合胞病毒(RSV)、H3N2、H1N1亚型流感病毒、副流感病毒1型和3型的核酸分别作为扩增模板,分别用引物探针组2和引物探针组3进行RPA扩增,反应体系和条件如上述1中所述。结果如图4-5和表6所示,引物探针组2和引物探针组3的特异性均高,都能特异检测呼吸道腺病毒,而不能检出其他病毒。表6引物探针组2和引物探针组3的特异性检测实施例3、RPA引物和探针在检测待测样本中的应用1、核酸提取收集10例呼吸道相关的病毒感染咽拭子标本,腺病毒7型5例(编号分别为S1,S2,S3,S4;腺病毒55型3例(编号分别为S5,S6,S7),流感病毒感染3例(编号分别为S8,S9,S10),已用腺病毒实时荧光定量PCR检测试剂确定样本S1-S7核酸为阳性,S8-S10的样本核酸为阴性。利用DNA/RNA提取试剂盒提取样本中的病毒核酸。2、RPA扩增将上述一得到各个样本的病毒核酸分别作为扩增模板,用引物探针组2进行RPA扩增,反应体系和条件如实施例2中的二的1中所述。结果如表9所示。3、荧光定量PCR扩增(对比例)将上述一得到各个样本的病毒核酸分别作为扩增模板,利用一步法realtimeRT-PCRkit(Takara,DRR064A)进行扩增,扩增引物和探针为腺病毒通用型的荧光定量PCR引物和探针,序列见表7:表7为腺病毒通用型的荧光定量PCR引物和探针腺病毒(通用1)ForwardPrimerATGGCCACCCCATCGATReversePrimerACTCAGGTACTCCGAAGCATCCTProbeFAM-TGGGCATACATGCACATCGCCG-BHQ1每管中的组分如下表8:表8混合后置荧光定量PCR反应仪中(RocheLightCycler2.0)进行反应,反应条件如下:利用系统自带的分析软件进行结构分析,阴性对照和阳性对照均成立的前提下,待测样本的CP≤35可判为阳性。结果如表9所示。表9RPA对腺病毒临床样本的检测从上述两种方法的检测结果可以看出,RPA对腺病毒临床样本的检测结果与荧光定量PCR检测结果一致,证明本发明的正确性。目前做的结果RPA方法虽然没有比荧光定量PCR灵敏度高,但它反应快速,10-15min即可完成检测;反应在恒温条件(37-42度)下即可进行,仪器设备简单,摆脱了体积较大的变温设备(荧光定量PCR仪),因此,具有独特的特点和优势。有望应用于基层单位及现场的病原检测。序列表<110>中国人民解放军军事医学科学院微生物流行病研究所<120>呼吸道感染相关腺病毒的通用型核酸等温检测试剂<160>4<170>PatentInversion3.5<210>1<211>30<212>DNA<213>人工序列<220><221>misc_feature<222>(13)<223>m为a或c<222>(15)<223>v为a或g或c<400>1gagtggaacttcmgvaaggatgtgaacatg30<210>2<211>31<212>DNA<213>人工序列<220><221>misc_feature<222>(14)<223>r为a或g<222>(17)<223>n为a,c,g,t或u<222>(23)<223>d为a,g,t或u<400>2ggtagagcatgttrgcngcagadaggtagtc31<210>3<211>30<212>DNA<213>人工序列<220><221>misc_feature<222>(6),(30)<223>y为t/u或c<222>(18)<223>b为t/u或g/c<222>(27)..(27)<223>n为a,c,g,t或u<400>3accttyttccccatggcbcacaacacngcy30<210>4<211>17<212>DNA<213>人工序列<220><222>(3)<223>b为t/u或g/c<400>4acbcttgaagccatgct17当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1