一种环丙烷类化合物及其制备方法和应用与流程
本发明涉及环丙烷的衍生物技术领域,具体涉及一种环丙烷类化合物及其制备方法和应用。
背景技术:
雌激素在哺乳动物组织的多效性已有文献报道,现在发现雌激素可以影响许多器官系统。除对卵巢、子宫、乳腺等女性生殖系统的直接作用外,雌激素具有保护女性心血管系统,调节血脂、防止和延缓粥样硬化形成,降低冠心病(CHD)发病率和死亡率以及提高女性CHD患者生存率和生活质量等作用。雌激素还具有提高骨细胞的活性,增加钙质的吸收和在骨骼上的沉着,减少骨丢失量,促进骨质致密的作用。
雌激素主要通过雌激素受体(Estrogen Receptor,ER)的介导发挥其生理功能。已描述有大量的化合物可以模拟或阻断17β-雌二醇。具有与效力最强的内源雌激素17β-雌二醇大概相同的生物学效应的化合物被称为“雌激素受体激动剂”。当与17β-雌二醇组合时,会阻断其效应的化合物称为“雌激素受体拮抗剂”。实际上,在雌激素受体激动剂与拮抗剂活性之间存在连续区,一些化合物在一些组织作为雌激素受体激动剂,在另一些组织作为雌激素受体拮抗剂。这些具有混合活性的化合物称为选择性雌激素受体调节剂(SERMs),在治疗上非常有用,已经有他莫西芬(tamoxifen)、雷洛昔芬(raloxifen)、bazedoxifene和拉索昔芬(lasofoxifene)等上市,用于乳腺癌、骨质疏松等症,但这些药物因为仅仅具有组织选择性,仍存在一定的副作用,如潮热、腿痛、乳房促痛和静脉栓塞等。
近年来,发现ER主要包括ERα和ERβ两种亚型,且有不同的组织分布和不同的功能:ERα主要存在于乳腺、卵巢、肾上腺、子宫、肾脏,在脑组织、卵巢颗粒细胞和发育中的精细胞中无表达,而ERβ在前列腺和卵巢颗粒细胞中为高表达,在子宫、骨骼、血管、大脑、肺、膀胱、睾丸、卵巢和肠管中为中表达,在垂体、附睾和脊髓组织为低表达,在肌肉组织无表达[Kuiper等,Proceedings of the National Academy of Sciences of the United States of America 93:5925-5930(1996)]。
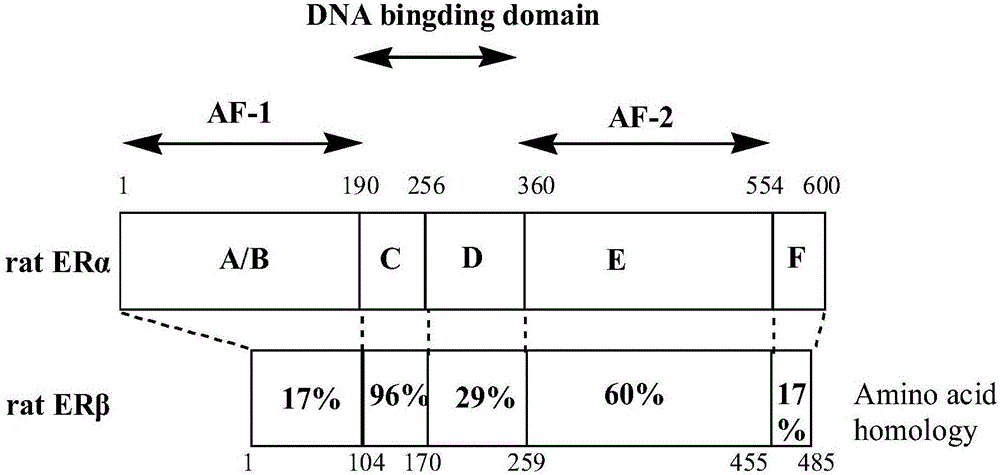
研究发现:如图1所示,ERα和ERβ在C区有96%的同源性,这两种亚型对DNA有相似的亲和力;而LBD的E区ERα和ERβ只有不足60%的同源性,这就预示着ERα和ERβ在协同因子的识别和响应上可能存在很大的不同,这为ER亚型选择性调节剂的设计奠定了分子基础。
研究发现:天然存在的异黄酮类化合物Genistein具有很好的选择性ERβ激动活性(EC50=10nmol/L),它与ERβ的亲和力是与ERα的41倍(即对ERβ和ERα的选择性比值为41)[Kozerski L,et al.Solution and solid state 13-C NMR and X-ray studies of genistein complexes with amines.Potential biological function of the C27,C25,and C24’-OH groups.Org Biomol Chem,2003,1(20):3578]。Moon等从DPN出发,经苯环上的结构修饰得到了数个化合物,从中筛选ERβ高选择性的配体,发现5-F取代物的选择性比值由DPN的72倍提高到272倍[Moon BS,et al.Synthesis and evaluation of aryl-substituted diarylpropionitriles,selective ligands for estrogen receptor b,as positron-emission tomographic imaging agents.Bioorg Med Chem,2009,17:3479]。除此之外,多篇文献报道了其它母核的ERβ选择性激动剂,如吡唑、呋喃、哌嗪及咪唑啉类化合物,选择性ERβ激动剂成为目前研究的热点之一,Minutolo等对此进行了综述[Minutolo F,Macchia M,Katzenellenbogen BS,et al.Estrogen Receptor b Ligands:Recent Advances and Biomedical Applications.Med Res Rev,2011,31(3):364]。
相对而言,选择性ERα调节剂的研究较少。最常见的是PPT和MPP,对ERα显示出很高的亲合性,对ERα和ERβ的选择性比值为200以上[Labouesse MA,et al.Effects of selective estrogen receptor alpha and beta modulators on prepulse inhibition in male mice[J].Psychopharmacology,2015,232(16):2981-2994]。Yeo等报道了三个以三元环为母体结构的化合物,亲合性研究表明,其中两个化合物显示出对ERα更好的亲合性,其对ERα和ERβ的选择性比值为64和18[Yeo HL,et al.Design,synthesis,and biological evaluation of cyclopropyl analogues of stilbene with raloxifene side chain as subtype selective ligands for estrogen receptor.Arch Pharm Res,2013,36:1096–1103]。但目前报道的化合物均对ERβ显示出亲合性,连纯抗雌激素物质Fulvestrant(ICI 182780)都显示出对ERβ的亲合性,未见仅对ERα显示出亲合性的特异性配体的报道。
技术实现要素:
本发明的目的是针对现有技术的不足,提供一种多取代环丙烷类化合物及其制备方法与应用。
本发明的目的是通过以下技术方案来实现的:一种环丙烷类化合物,为式I结构:
其中,R1为卤素、氢、羟基、或是NR5R6(开链或环状的仲(叔)胺结构NR5R6);
R2、R4为H、羟基、或YR7;
R3为氢、羟基、酮基、卤素、或ZR8;
R5、R6独立地选自H、C1-C4烷基、C1-C4烯基、C1-C4卤代烷基、C1-C4氧杂烷基、C1-C4氮杂烷基、芳基、烷芳基、烷氧基芳基、卤代芳基,或与N构成氮杂多元环,所述的与N构成氮杂多元环为三元环至八元环(即三元环、四元环、五元环、六元环、七元环或八元环),所述的与N构成氮杂多元环可进一步优选为,氮杂环丙烷、氮杂环丙烯、氮杂环丁烷、氮杂环丁烯、吡咯基、吡咯烷基、恶唑基、咪唑基、吡唑基、哌啶基、嘧啶基、吡嗪基、哒嗪基、哌嗪基、哌嗪基、吗啉基或高哌啶基,及其取代物;
R7、R8独立地选自C1-C10烷基、C1-C10烯基、C1-C10卤代烷基、C1-C10氧杂烷基、C1-C10氮杂烷基;
X、Y、Z独立地为氧、硫或氮;
n=1~10。
进一步地,所述的环丙烷类化合物选自以下结构:
其中,R1为卤素、氢、羟基、或是NR5R6(开链或环状的仲(叔)胺结构NR5R6);
R2、R4为H、羟基、苄基、苄氧基、苯基、苯氧基、苯甲酰基、苯甲酰氧基、甲基、甲氧基、乙基、乙氧基、乙酰基、乙酰氧基、三氟甲基、三氟甲氧基;
R3为氢、羟基、酮基、苄氧基、苯氧基、苯甲酰基、苯甲酰氧基、甲基、甲氧基、乙基、乙氧基、乙酰基、乙酰氧基、三氟甲基、三氟甲氧基或卤素;
R5、R6独立地选自H、甲基、乙基、丙基、异丙基,或与N构成四元、五元、六元或七元环,所述的与N构成四元、五元、六元或七元环为氮杂环丁烷、吡咯烷基、哌啶基、哌嗪基、甲基哌嗪基、高哌嗪基、吗啉基或高哌啶基,或其取代物;
X、Y、Z独立地为氧、硫;
n=2~6。
更进一步地,所述的环丙烷类化合物选自以下结构:
其中,R1选自如下结构:
R2、R4为氢、羟基、苄氧基、苯氧基、苯甲酰氧基、甲氧基、乙氧基、乙酰氧基或三氟甲氧基;
R3为氢、羟基、或酮基;
X、Y、Z独立地为氧或硫;
n=2~4。
进一步优选,所述的环丙烷类化合物,为以下结构的化合物:
所述的环丙烷类化合物可以单独使用,也可以用常规的方法制备成药学上可接受的盐使用,所述药学上可接受的盐为盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、磷酸盐、乙酸盐、丙酸盐、丁酸盐、草酸盐、酒石酸盐、甲磺酸盐、对甲苯磺酸盐、富马酸盐、牛磺酸盐、柠檬酸盐、琥珀酸盐中的一种,或其混合盐。
同时提供一种环丙烷的衍生物或其盐作为雌激素受体亚型选择性调节剂的应用,该应用具体为:环丙烷的衍生物用于制备预防或治疗因雌激素受体表达过多、缺乏或相对不足引起的疾病的药物制剂。
该应用具体为:用于制备预防或治疗因雌激素受体表达过多、或相对不足引起的疾病的药物制剂,其中,所述的疾病为乳腺癌、卵巢功能早衰、更年期综合征、骨质疏松以及青春期卵巢功能低下、结直肠肿瘤、多囊卵巢综合症、不孕症、子宫萎缩、冠心病及神经系统变性疾病如阿尔茨海默病、帕金森氏病。即所述的疾病为乳腺癌、卵巢功能早衰、更年期综合征、骨质疏松、青春期卵巢功能低下、结直肠肿瘤、多囊卵巢综合症、不孕症、子宫萎缩、冠心病或者神经系统变性疾病。
本发明同时提供一种环丙烷类化合物的制备方法,具体为:以式IV所示的重氮化合物和式III所示的不饱和酮化合物为原料,通过第一步反应(步骤1)在硫代物和催化剂存在下于有机溶剂中反应得到式II所示的环丙烷酮类化合物,并通过第二步反应(步骤2)得到式I所示的环丙烷类化合物。
视反应产物的不同,步骤1和步骤2可以合并为一步反应。即步骤1和步骤2前后分开进行或者同时进行,所述反应和结构式如下:
其中,式III中R2、R1、X、n,式IV中R4、式II中R2、R1、X、n、R4与式I中R2、R1、X、n、R4具有相同含义。
在步骤1中,所述硫代物为硫化环戊烷、硫化环己烷、氧硫杂环己烷,或其取代物;所述催化剂为金属有机物,包括乙酰丙酮铜、醋酸铑及其二聚体、醋酸钴、乙酸铷、醋酸钯、三氯化铟、铂、乙酰丙酮铁、三氯化铝、四氯化锡、或其混合物;所述有机溶剂为苯、甲苯、二甲苯、环己烷、正己烷、四氢呋喃、二氯甲烷、二甲基甲酰胺、或其混合物。
即所述的硫代物为硫化环戊烷、硫化环己烷、氧硫杂环己烷中的至少一种;
所述的催化剂为乙酰丙酮铜、醋酸铑、乙酰丙酮铜与醋酸铑二聚体、醋酸钴、乙酸铷、醋酸钯、三氯化铟、铂、乙酰丙酮铁、三氯化铝、四氯化锡中的至少一种;
所述的有机溶剂为苯、甲苯、二甲苯、环己烷、正己烷、四氢呋喃、二氯甲烷、二甲基甲酰胺中的至少一种。
在步骤2中包括还原反应、缩合反应、取代反应中的一种或上述反应的组合。
其中,还原反应的还原剂选自氢化铝、二异丁基氢化铝、叔丁醇铝、红铝、四氢铝锂、硼氢化钾、硼氢化钠中的至少一种;所述的有机溶剂独立地选自乙醚、石油醚、正已烷、二氯甲烷、三氯甲烷、苯、甲苯中的至少一种,即一种或它们的混合物;所述还原反应的反应温度为-30~30℃,反应时间1~12小时。
式IV所示的重氮化合物可以根据文献[Overberger CG,Anselme JP.A Convenient Synthesis of Phenyldiazomethane.J Org Chem,2002,28(2):324.]来制备。
与现有技术相比,本发明的有益效果是:
本发明以重氮化合物和不饱和酮为原料,在催化剂存在下,在有机溶剂中反应得到环丙烷甲酮类化合物,并可进一步反应得到环丙烷类化合物。本发明环丙烷类化合物的制备方法,具有原材料来源广泛、成本低、方法操作简单、条件温和等特点。
本发明环丙烷类化合物对ER均显示出亲合性,特别是显示对ERα的高选择性亲合作用;尤其是其中五个化合物,在实验所用浓度之内,对ERβ不显示亲合性,可以认为是ERα亚型的特异性配体。因此,在制备预防或治疗因雌激素受体表达过多、缺乏或相对不足引起的疾病的药物制剂中有所应用,如乳腺癌、卵巢功能早衰、更年期综合征、骨质疏松以及青春期卵巢功能低下、结直肠肿瘤、多囊卵巢综合症、不孕症、子宫萎缩、冠心病及神经系统变性疾病如阿尔茨海默病、帕金森氏病等。
附图说明
图1为两种ER亚型功能区及同源性的示意图。
具体实施方式
下面结合实施例对本发明的结构、制备方法及在制备预防或治疗因雌激素受体表达过多、缺乏或相对不足引起的疾病的药物制剂方面的应用作进一步阐述,但不限制本发明。
样品的分析数据由以下仪器测定:
温度计;Bruker DRX400核磁共振仪;安捷伦5975型质谱仪;Bruker Vector 22红外光谱仪。
实施例1
1、4-苄氧基苯甲醛的合成
将4-羟基苯甲醛45g、碳酸钾55g加入500ml三颈瓶,进行无水无氧操作,加入无水的丙酮350ml,搅拌溶解。注射器加入溴苄52.3ml,65℃下回流反应8h。反应完全后,加入蒸馏水淬灭反应。分液,Ea萃取水相三次,水洗有机相一次,加入无水硫酸钠干燥,浓缩至小体积,加入Hex结晶。得到白色晶体70.79g,得率90.88%。
2、1-(4-(3-氯丙氧基)苯基)乙酮的合成
将4-羟基苯乙酮34.04g、碳酸钾41.37g加入500ml三颈瓶,进行无水无氧操作,加入无水的丙酮250ml,搅拌溶解,加入1,3-溴氯丙烷30ml,65℃下回流反应18h。反应完全后,加入蒸馏水淬灭反应。分液,Ea萃取水相三次,水洗有机相一次,加入无水硫酸钠干燥,浓缩至干。得到微黄色油状53.17g,得率100%。
3、(E)-3-(4-(苄氧基)苯基)-1-(4-(3-氯丙氧基)苯基)丙烯酮的合成
将所得的1-(4-(3-氯丙氧基)苯基)乙酮53.17g,水合氢氧化锂加入三颈瓶,加入无水乙醇,室温25℃下搅拌10分钟,加入所得的4-苄氧基苯甲醛,室温下搅拌反应8h。反应完全后,加入蒸馏水,固体析出,过滤,蒸馏水洗滤饼三次。将固体溶于95%乙醇重结晶,结晶得到黄色固体84.44g,得率83.03%。
4、重氮甲基苯的合成
将甲醇钠10.56g加入1L三颈瓶,进行无水无氧操作,加入无水乙醚400ml,无水甲醇200ml,搅拌,室温下缓慢多次加入N-苄基-4-甲基-N-亚硝基苯磺酰胺56.31g,油浴35℃下回流反应5h。反应完全后,加入蒸馏水溶解无机盐,分液,乙醚萃取水相三次,水洗有机相一次,无水硫酸钠干燥。浓缩至小体积,加入甲苯再次浓缩除去乙醚。得到红色溶液,低温保存待用。
实施例2(2-(4-(苯甲氧基)苯基)-3-苯基环丙烷基)(4-(3-氯丙氧基)-苯基)甲酮的合成
将所得的(E)-3-(4-(苄氧基)苯基)-1-(4-(3-氯丙氧基)苯基)丙烯酮19.90g、醋酸铑0.22g加入到500ml三颈瓶,进行无水无氧操作,加入甲苯200ml搅拌溶解,加入硫化环己烷5g,恒压低液漏斗分次缓慢滴加所得到的重氮甲基苯的甲苯溶液100ml,室温25℃下搅拌反应5天,反应结束后,沙星漏斗过滤,二氯甲烷多次洗涤,浓缩至干。过柱纯化,展开剂:石油醚:乙醚=5:1。二氯甲烷:石油醚=2:1重结晶。得到白色固体:7.49g,得率30.83%。
该化合物表征数据如下:IR(KBr)νmax:cm-1:3025,1603,1513,1264,1171,1021,972,748,695;1H NMR(CDCl3,400MHz)δ7.93(d,J=8.8Hz,2H),7.43-7.31(m,5H),7.24-7.14(m,7H),6.94(d,J=8.8Hz,2H),6.89(d,J=8.8Hz,2H),5.06(s,2H),4.14(t,J=6.0Hz,2H),3.72(t,J=6.0Hz,2H),3.54(t,J=6.0,1H),3.26-3.22(m,1H),3.17-3.13(m,1H),2.26-2.01(m,2H).MS(EI)m/z(%):501(M+,10.0),405(10.0),299(100.0),199(100.0),121(100.0),91(100.0),65(66.0),41(25.0).
实施例3(4-(3-(氮杂环丁基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8a)的合成
将(2-(4-(苯甲氧基)苯基)-3-苯基环丙烷基)(4-(3-氯丙氧基)-苯基)甲酮740mg、碳酸钾221.14mg、碘化钠27mg置于50ml三颈瓶中,进行无水无氧操作,在N2保护下加入新蒸乙腈5ml,搅拌溶解,注射器加入丫叮啶0.16ml,60℃下反应24h,TLC(石油醚:乙酸乙酯:三乙胺=10:1:0.3%)监测反应完全,降至室温25℃。加入甲醇10ml,硼氢化钠32mg,室温25℃下搅拌反应12h,TLC(石油醚:乙酸乙酯:三乙胺=2:1:0.3%)监测反应完全,冰浴下,加入冰水淬灭反应,静置半小时,过滤,蒸馏水多次洗涤滤饼,干燥固体,得到白色固体,mp 128-129℃。
实施例4(4-(3-(1-吡咯烷基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8b)的合成
合成方法同实施例3。用吡咯烷代替丫叮啶,得到白色固体,mp 142-143℃。
实施例5(4-(3-(1-哌啶基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8c)的合成
合成方法同实施例3。用哌啶代替丫叮啶,得到白色固体,mp 152-153℃。
实施例6(4-(3-(4-甲基-1-哌啶基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8d)的合成
合成方法同实施例3。用4-甲基哌啶代替丫叮啶,得到白色固体,mp123-124℃。
实施例7(4-(3-(3,5-二甲基-1-哌啶基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8e)的合成
合成方法同实施例3。用3,5-二甲基哌啶代替丫叮啶,得到白色固体,mp106-107℃。
实施例8(4-(3-(4-甲基-1-哌嗪基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8f)的合成
合成方法同实施例3。用甲基哌嗪代替丫叮啶,得到白色固体,mp144-145℃。
实施例9(4-(3-(4-苯基-1-哌嗪基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8g)的合成
合成方法同实施例3。用4-苯基哌嗪代替丫叮啶,得到白色固体,mp177-178℃。
实施例10(4-(3-(1H-吡唑基)丙氧基)苯基)(2-(4-(苄氧基)苯基)-3-苯基环丙烷基)甲醇(8h)的合成
合成方法同实施例3。用吡唑代替丫叮啶,得到白色油状物。
实施例11 4-(2-((4-(3-丫叮啶基)丙氧基)苯基)(羟基)甲基)-3-苯基环丙基)苯酚(9a)的合成
将化合物8a 400mg,5%钯碳30mg置于试管反应器中。抽真空通H2,在H2氛围下,加入四氢呋喃5mL,室温25℃搅拌反应72h。TLC(乙酸乙酯:乙醇=2:1)监测反应完全。过滤,滤饼用甲醇(25mL×3)洗涤,合并滤洗液,浓缩至干。过柱,用乙酸乙酯:乙醇=2:1洗脱机洗脱,洗脱液浓缩至干,得白色油状126mg,得率:38.2%。
该化合物表征数据如下:IR(KBr)νmax:cm-1 2954,1607,1513,1245,1173,1045,830,736,700;1H NMR(400MHz,CDCl3)δ7.44(d,J=7.6Hz,2H),7.34(t,J=7.2Hz,2H),7.25(s,3H),6.88(d,J=8.4Hz,2H),6.75(d,J=8.4Hz,2H),6.66(d,J=8.4Hz,2H),4.07(d,J=9.6Hz,1H),3.86-3.83(m,2H),3.24(t,J=6.8Hz,4H),2.63-2.58(m,3H),2.40(t,J=5.6Hz,1H),2.07-2.04(m,2H),1.87-1.82(m,1H),1.81-1.86(m,2H).13C NMR(100MHz,CDCl3)δ158.2,155.5,137.9,136.1,131.7,129.0,128.7,128.0,127.2,126.5,115.6,114.4,77.2,72.9,65.7,56.0,54.8,36.4,31.3,26.9,25.9.MS(EI)m/z(%):431(M+,6.0),221(100.0),209(53.0),115(55.0),98(100.0).
实施例12 4-(2-(羟基(4-(3-吡咯烷基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9b)的合成
合成方法同实施例11,用化合物8b代替化合物8a,得到白色油状40mg,得率33.3%。
该化合物表征数据如下:IR(KBr)νmax:cm-1 2958,2927,1726,1460,1381,1283,1074,801,743;1H NMR(CDCl3,400MHz)δ7.44(d,J=7.2Hz,2H),7.36(t,J=7.2Hz,2H),7.28(s,3H),6.87(d,J=8.8Hz,2H),6.76(d,J=9.2Hz,2H),6.71(d,J=8.4,2H),4.08(d,J=9.6Hz,1H),3.91(t,J=6.0Hz,2H),2.90-2.80(m,7H),2.40(t,J=5.6,1H),2.10-2.05(m,2H),1.91-1.80(m,4H),1.84-1.77(m,1H);13C NMR(CDCl3,100MHz)δ157.9,155.2,137.8,136.2,131.9,128.9,128.6,127.9,127.3,126.6,115.5,114.0,77.2,72.9,65.6,53.8,36.6,31.3,27.2,25.9,23.3.MS(EI)m/z(%):445(M+,45.0),235(28.0),149(86.0),112(100.0),84(100.0).
实施例13 4-(2-(羟基(4-(3-哌啶基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9c)的合成
合成方法同实施例11。用化合物8c代替化合物8a,得到白色油状79mg,得率49.67%。IR(KBr)νmax:cm-1 2928,1607,1511,1450,1243,1170,1122,1038,830,734,700;1H NMR(CDCl3,400MHz)δ7.44(d,J=7.6Hz,2H),7.35(t,J=7.2Hz,2H),7.26(s,3H),6.87(d,J=8.0Hz,2H),6.73(t,J=8.4Hz,4H),4.07(d,J=9.6Hz,1H),3.87-3.84(m,2H),2.71-2.68(m,5H),2.61(t,J=6.8Hz,2H),2.39(t,J=4.2,1H),2.09-2.04(m,2H),1.82-1.80(m,1H),1.73(m,5H),1.49-1.46(m,2H),13C NMR(CDCl3,100MHz)δ157.9,155.2,137.8,136.2,131.9,128.9,128.6,127.8,127.3,126.6,115.6,114.4,77.2,72.9,65.7,55.6,53.9,36.6,31.4,29.7,25.9,25.2,24.1.MS(EI)m/z(%):457(M+,7.0),439(91.0),346(16.0),314(21.0),249(58.0),207(22.0),126(100.0),107(20.0),98(100.0),55(35.0).
实施例14 4-(2-(羟基(4-(4-甲基-哌啶基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9d)的合成
合成方法同实施例11。用化合物8d代替化合物8a,得到白色油状119mg,得率70.8%。IR(KBr)νmax:cm-1 2923,1609,1513,1451,143,1174,1124,1036,829,735,699;1H NMR(CDCl3,400MHz)δ7.43(d,J=7.6Hz,2H),7.35(t,J=7.6Hz,2H),7.25(s,3H),6.87(d,J=8.4Hz,2H),6.75(d,J=8.4Hz,2H),6.65(d,J=8.4Hz,2H),4.06(d,J=9.6Hz,1H),3.86-3.83(m,2H),2.96-2.94(m,2H),2.62-2.58(m,1H),2.54-2.50(m,2H),0.88(d,J=6.4,3H).13C NMR(CDCl3,100MHz)δ158.2,155.2,137.9,136.1,131.8,129.0,128.6,127.9,127.3,126.5,115.7,114.5,77.3,72.9,66.2,55.6,53.7,36.5,33.3,31.4,30.4,25.9,21.6.MS(EI)m/z(%):472(M+,20.0),453(40.0),263(100.0),209(34.0),165(19.0),154(52.0),140(100.0),126(68.0),112(100.0),98(25.0),70(66.0),44(49).
实施例15 4-(2-(羟基(4-(3,5-二甲基哌啶基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9e)的合成
合成方法同实施例11。用化合物8e代替化合物8a,得到白色油状111mg,得率79.3%。IR(KBr)νmax:cm-1 2953,1609,1513,1456,1377,1243,1172,1045,829,736,700;1H NMR(CDCl3,400MHz)δ7.44(d,J=7.2Hz,2H),7.34(t,J=7.2Hz,2H),7.28-7.25(m,3H),6.89(d,J=8.4Hz,2H),6.76(d,J=8.4Hz,2H),6.65(d,J=8.4Hz,2H),4.06(d,J=9.6Hz,1H),3.86(t,J=6.0Hz,2H),2.89(d,J=9.6Hz,2H),2.63-2.60(m,1H),2.53-2.49(m,2H),2.40(t,J=5.6Hz,1H),1.98-1.91(m,2H),1.87-1.81(m,2H),1.73-1.67(m,1H),1.51(t,J=11.2Hz,2H),0.82(d,J=6.4,6H).13C NMR(CDCl3,100MHz)δ158.2,155.1,137.8,136.0,131.8,128.9,128.5,127.9,127.2,126.5,115.6,114.3,77.2,72.9,66.3,61.1,55.5,41.8,36.4,31.4,30.3,25.9,19.6.MS(EI)m/z(%):487(M+,45.0),467(17.0),277(88.0),209(20.0),154(100.0),126(100.0),107(47.0),91(40.0),55(53.0).
实施例16 4-(2-(羟基(4-(4-甲基哌嗪基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9f)的合成
合成方法同实施例11。用化合物8f代替化合物8a,得到白色固体153mg,得率45.3%,mp 135-136℃。IR(KBr)νmax:cm-1 2959,2836,1734,1646,1599,1471,1250,1168,1030,892,829,782,735;1H NMR(400MHz,d-DMSO)δ7.47(d,J=7.2Hz,2H),7.33(t,J=7.2Hz,2H),7.27(d,J=8.8Hz,2H),7.23(t,J=7.6Hz,1H),6.87-6.84(m,4H),6.63(d,J=8.4Hz,2H),3.98(m,3H),2.62-2.58(m,2H),2.55-2.51(m,7H),2.30-2.23(m,5H),1.96-1.92(m,2H),1.80-1.75(m,2H).13C NMR(100MHz,d-DMSO)δ162.7,160.6,143.6,143.4,137.0,134.3,133.1,132.3,132.2,131.0,120.3,119.1,75.9,71.0,60.0,59.6,58.0,51.0,42.6,37.3,31.5,30.6.MS(EI)m/z(%):473(M+,7.0),454(33.0),264(100.0),209(79.0),165(27.0),142(100.0),113(100.0),98(100.0),86(64.0),70(100.0),58(29.0),43(52.0).
实施例17 4-(2-(羟基(4-(4-苯基哌嗪基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9g)的合成
合成方法同实施例11。用化合物8g代替化合物8a,得到白色固体87mg,得率85.3%,mp 142-143℃。IR(KBr)νmax:cm-1 3244,2879,1603,1513,1450,1246,1174,1044,997,925,881,838,755,696,652,613;1H NMR(CDCl3,400MHz)δ:7.43(d,J=7.6Hz,2H),7.35(t,J=7.2Hz,2H),7.29(d,J=8.8Hz,2H),7.27-7.23(m,4H),6.91(d,J=8.4Hz,4H),6.82(d,J=8.8Hz,2H),6.65(d,J=8.4Hz,2H),4.09(d,J=10Hz,1H),3.96(t,J=6.4Hz,2H),3.77-3.73(m,3H),3.20-3.18(m,4H),2.65-2.62(m,5H),2.57(t,J=7.2Hz,2H),2.42(t,J=6.4,1H),2.01-1.94(m,2H),1.97-1.80(m,1H).13C NMR(CDCl3,100MHz)δ:158.3,154.6,151.2,137.7,135.9,132.4,129.1,128.9,128.6,128.0,127.2,126.6,119.8,116.1,115.4,114.4,77.2,72.9,66.2,55.2,53.2,36.5,31.4,26.5,25.6.MS(EI)m/z(%):533(M+,1.0),516(44.0),423(10.0),325(53.0),203(100.0),175(73.0),132(24.0),105(18.0),91(10.0),70(51.0),56(11.0),42(20.0).
实施例18 4-(2-((4-(3-(1H吡唑基丙氧基)苯基)(羟基)甲基)-3-苯基环丙基)苯酚(9h)的合成
合成方法同实施例11。用化合物8h代替化合物8a,得到白色油状88mg,得率73.1%。IR(KBr)νmax:cm-1 3278,2928,1610,1512,1449,1398,1242,1173,1048,828,745,702,621;1H NMR(CDCl3,400MHz)δ:7.53(d,J=1.6Hz,1H),7.38(t,J=2.4Hz,1H),7.23(d,J=7.6Hz,2H),7.17-7.09(m,5H),6.87(dd,J=14,8.4Hz,2H),6.76(dd,J=8.8,2Hz,2H),6.68(t,J=8.4Hz,2H),6.23(q,J=4.4Hz,1H),4.60(dd,J=14.8,4Hz,1H),4.34(t,J=6.8Hz,2H),3.86-3.83(m,2H),2.74-2.67(m,1H),2.54(d,J=14Hz,1H),2.32-2.24(m,3H);13C NMR(CDCl3,δ,100MHz)157.7,154.2,141.0,139.4,135.8,132.3,130.1,129.8,129.1,128.3,127.4,125.8,115.2,114.2,105.6,77.2,73.8,64.3,49.5,36.3,34.9,30.1.MS(EI)m/z(%):442(M+,75.0),231(100.0),149(28.0),109(100.0),91(77.0),81(83.0),41(23.0).
实施例19 4-(2-(羟基(4-(3-哌啶基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9c)盐酸盐的制备
实施例13所合成的4-(2-(羟基(4-(3-哌啶基)丙氧基)苯基)甲基)-3-苯基环丙基)苯酚(9c)46mg加至丙酮中溶解,搅拌下慢慢通入干燥的HCl气体至过饱和。置冰水浴中析出白色晶体,为其盐酸盐,收率80%。
实施例20雌激素受体亲和力测定:
采用荧光偏振技术,用Synergy 2SLFPA型多检测酶标仪(BioTek公司)测定17β-雌二醇和测试化合物抑制荧光标记雌激素ES2(Invitrogen公司)与重组人ERα或ERβ(Invitrogen公司)结合的荧光偏振值,使用GraphPad Prism软件(GraphPad软件公司)进行曲线拟合,计算IC50值,即为17β-雌二醇或试验化合物能够抑制荧光雌激素ES2(9nM)对ERα和ERβ的结合50%的浓度,以他莫昔芬(Tamoxifen,TAM,购自国际实验室)为阳性对照。结果如下表1所示:
表1相对亲和力和化合物对ER亚型的选择性
aRBA=(IC50Estradiol/IC50compound)×100
b在实验测试浓度内未检测到
由上表可见,本发明所述化合物,均显示与ER的亲合性,特别是显示对ERα的高选择性亲合力,如化合物9c、9g,对ERα的亲合力是ERβ亲合力的十倍以上;尤其是化合物9a、9b、9d、9e、9f,在实验所用浓度之内,对ERβ不显示亲合性,可以认为是ERα亚型的特异性配体。
本发明所述化合物对ER的亲合性,或者其对ER不同亚型的选择性甚至特异性亲合作用,可能在制备预防或治疗因雌激素受体表达过多、或相对不足引起的疾病的药物制剂中有所应用,如乳腺癌、卵巢功能早衰、更年期综合征、骨质疏松以及青春期卵巢功能低下、子宫萎缩、冠心病、阿尔茨海默病、结直肠肿瘤、多囊卵巢综合症、不孕症等。
- 还没有人留言评论。精彩留言会获得点赞!