一种用于检测药物性耳聋相关位点的非标记探针的制作方法
本发明属于生物医药领域,具体而言,涉及一种用于检测药物性耳聋相关位点的非标记探针。
背景技术:
耳聋是导致语言交流障碍的最常见的疾病之一,严重影响了患者的日常交流,降低患者的生活质量。据世界卫生组织(who)估计,全球有2.78亿人患有中度以上的听力障碍,且三分之二在发展中国家[1]。耳聋可以由单一基因突变或多基因复合突变引起,也可由环境因素造成,或基因与环境共同作用而导致[2]。由于部分人对耳毒性药物如氨基糖苷类药物有易感性,使用正常剂量或者微量的药物就可造成听力损伤[3]。氨基糖甙类抗生素会在耳蜗毛细胞中的线粒体和溶酶体积聚,且代谢缓慢,从而对听力产生伤害[4]。线粒体12srrna基因突变和大多数的耳聋有关。1993年,prezant等人通过对患病家族线粒体基因序列分析,首次报道了线粒体12srrna上a1555g突变与药物性耳聋的关系[5];2004年,zhao等人首次在一个汉族家系中发现了c1494t突变与药物性耳聋的相关性[6]。
目前的检测方法主要采用测序法[7]、pcr-rflp法[8][9]、基因芯片法[10]和高分辨率熔解曲线法[11]。但是这些方法都有一些局限性。其中,测序法和基因芯片法都需要特定的仪器和试剂盒,价格昂贵,不利于推广使用。pcr-rflp法必须先进行pcr扩增后再对产物进行开盖处理,有可能产生污染而出现假阳性结果。高分辨率熔解曲线法野生型和突变型之间tm值之差较小,容易造成误判。因此,目前迫切需要一种低成本、操作简便、结果准确明显、易于推广的技术,对药物性耳聋相关位点12srrna的c1494t、a1555g突变进行检测。
[1]brownsd.hardisty-hughesre,mburup.quietasamouse:dissectingthemolecularandgeneticbasisofhearing[j].natrevgenet,2008,9(4):277-90.
[2]刘学忠,欧阳小梅,yand,etal.中国人群遗传性耳聋研究进展.中华耳科学杂志,2006,4(2):81-89.
[3]周乐,徐克,唐少华.120例非综合征性耳聋患者线粒体a1555g和c1494t突变分析[j].中国优生与遗传杂志,2014,12:100-101+108.
[4]丁大连,richardsalvi.氨基糖苷类抗生素耳毒性研究[j].中华耳科学杂志,2007(02):125-131.
[5]prezanttr,agapianjv,bohlmanmc,etal.mitochondrialribosomalrnamutationassociatedwithbothantibiotic-inducedandnon-syndromicdeafness.[j].naturegenetics,1993,4(3):289-294.
[6]zhaoh,lir,wangq,etal.maternallyinheritedaminoglycoside-inducedandnonsyndromicdeafnessisassociatedwiththenovelc1494tmutationinthemitochondrial12srrnageneinalargechinesefamily[j].americanjournalofhumangenetics,2004,74(1):139-52.
[7]林文津,郭舜民,徐榕青,等.荧光定量pcr法检测线粒体基因a1555g与c1494t突变[j].中国医药导报,2013,10(28):159-161.
[8]刘振,虞幼军,王跃建,等.佛山地区耳聋儿童gjb2235delc突变和线粒体dnaa1555g突变的研究[j].中华耳科学杂志,2006(3):227-230.
[9]luispablog,maríaeugeniaf,rosauracarone,etal.carrierfrequencyofthe35delganda1555gdeafnessmutationsintheargentineanpopulation.impactonthenewbornhearingscreening.[j].internationaljournalofpediatricotorhinolaryngology,2007,71(4):639–643.
[10]王国建,戴朴,韩东一,等.基因芯片技术在非综合征性耳聋快速基因诊断中的应用研究[j].中华耳科学杂志,2008(1):61-66.
[11]余剑敏,沈智君,肖薇薇.线粒体基因a1555g和c1494t突变检测试剂盒临床应用研究[j].山西医药杂志,2011(12):1189-1190.。
技术实现要素:
本发明的目的在于克服现有的相关位点检测方法的缺陷,提供一种针对氨基糖甙类抗生素诱导的非综合征型耳聋相关位点12srrnac1494t、a1555g突变检测方法,以实现对这两个位点简便准确、低成本的检测。
本发明是按如下技术方案实现的:
一种药物性耳聋相关位点12srrnac1494t、a1555g突变的检测方法,包括以下步骤:
a、在12srrna基因1494、1555位点的上下游分别合成一对引物,1494位点对应的引物对(引物1、2)之间的扩增片段长度为113bp,1555位点对应的引物对(引物3、4)之间的扩增片段长度为125bp。
b、分别针对1494和1555两个位点设计合成一个非标探针(1494位点对应探针1,1555位点对应探针2),其3’末端采用氨基封闭,使用evagreen染料进行检测;
c、提取待测标本的dna,使用步骤a中1494位点或1555位点对应的引物、步骤b中1494位点或1555位点对应的探针,与其他pcr反应体系成分混合,配制成单重检测体系,加入待测标本的dna,进行pcr反应,扩增靶基因片段;
d、反应结束后,进行一次高分辨率熔解曲线分析,根据熔解曲线中熔解峰的位置,对待测标本dna的基因型进行分析。
本发明方法的pcr反应体系与常规pcr反应体系相似,包括聚合酶(taq)、dntps、缓冲体系、引物、探针、饱和荧光染料及模板。每管均为单重反应,仅检测单个位点的情况,采用不对称扩增的方式,便于后续探针的杂交。
靶序列(seqidno.1)为:
1gagtagagtgcttagttgaacagggccctgaagcgcgtacacaccgcccg
51tcaccctcctcaagtatacttcaaaggacatttaactaaaacccctacgc
101atttatatagaggagacaagtcgtaacatggtaagtgtactggaaagtgc
151acttggacgaaccagagtgtagcttaacacaaagcacccaacttacactt
所述的引物序列为:
引物1(seqidno.2):5’gagtagagtgcttagttgaacaggg3’;
引物2(seqidno.3):5’cctctatataaatgcgtaggggtt3’;
引物3(seqidno.4):5’ggacatttaactaaaacccctacg3’;
引物4(seqidno.5):5’aagtgtaagttgggtgctttgtg3’;
所述的非标记探针序列为:
探针1(seqidno.6):5’cttgaggagagtgacgggcg3’;
探针2(seqidno.7):5’cgacttgcctcctctatataaa3’;
本发明方法中的阴性对照可以选用双蒸水。
本发明方法的pcr反应在rochelightcyclernano荧光实时pcr仪,本发明中pcr反应采用三步法,pcr扩增温度条件如下:95℃预变性5min,扩增阶段共60个循环,包括95℃变性15s,58℃退火20s,72℃延伸20s,循环结束后,72℃延伸5min。扩增结束后直接进行熔解曲线检测,样品先95℃变性60s,再迅速冷却到45℃并保持60s,然后以0.05℃/s的升温速率进行熔解,检测温度范围为45~95℃,熔解曲线使用pcr仪器对应软件进行分析,分析时所选荧光通道为sybrgreeni。
本发明的基因分型采用高分辨率熔解曲线分析,曲线的熔解峰表示有一半双链解链时的温度,通常理解为单链与探针杂交时的tm值。其中1494位点野生型熔解峰在63℃,突变型熔解峰在67℃,温度差为4℃;1555位点野生型熔解峰在53℃,突变型熔解峰在61℃,温度差为8℃。
本发明还涉及一种通过高分辨率熔解曲线分析检测氨基糖甙类抗生素诱导的非综合征型耳聋相关位点12srrnac1494t、a1555g突变基因型的试剂盒,所述的试剂盒包括:
(1)扩增c1494t和a1555g突变区域的两组引物对;
所述的两组引物对的核酸序列分别为:
扩增c1494t引物对:
引物1(seqidno.2):5’gagtagagtgcttagttgaacaggg3’;
引物2(seqidno.3):5’cctctatataaatgcgtaggggtt3’;
扩增a1555g引物对:
引物3(seqidno.4):5’ggacatttaactaaaacccctacg3’;
引物4(seqidno.5):5’aagtgtaagttgggtgctttgtg3’;
(2)两条分别特异性结合由两组引物对扩增的片段的非标记探针;
所述的非标记探针的序列为:
探针1(seqidno.6):5’cttgaggagagtgacgggcg3’;
探针2(seqidno.7):5’cgacttgcctcctctatataaa3’。
(3)必要的核酸扩增和杂交试剂。
本发明还涉及一组用于检测氨基糖甙类抗生素诱导的非综合征型耳聋相关位点12srrnac1494t、a1555g突变的引物组和非标记探针,所述的引物组的核酸序列分别为:
扩增c1494t引物对:
引物1(seqidno.2):5’gagtagagtgcttagttgaacaggg3’;
引物2(seqidno.3):5’cctctatataaatgcgtaggggtt3’;
扩增a1555g引物对:
引物3(seqidno.4):5’ggacatttaactaaaacccctacg3’;
引物4(seqidno.5):5’aagtgtaagttgggtgctttgtg3’;
所述的非标记探针的序列为:
探针1(seqidno.6):5’cttgaggagagtgacgggcg3’;
探针2(seqidno.7):5’cgacttgcctcctctatataaa3’。
本发明还涉及所述的试剂盒或所述的引物组和非标记探针在检测氨基糖甙类抗生素诱导的非综合征型耳聋中的应用。
本发明是针对药物性耳聋相关位点12srrnac1494t、a1555g突变的临床检测而设计,具有快速准确、检测成本低等特点。突出特点在于利用了非标记探针与不同基因型的片段杂交时有不同的tm值,通过高分辨率熔解曲线分辨tm值来将不同基因型分开。本发明的有益效果是:可以快速灵敏的扩增出12srrna上药物性耳聋相关位点1494和1555附近的靶序列,并且通过非标记探针结合高分辨率熔解曲线分析实现分型,可以据此判断患者是否携带这两个易感突变,从而能够对病人的用药进行指导。检测手段采用荧光实时pcr方法,具有很高的灵敏度;体系使用饱和染料,避免了不饱和染料荧光不稳定导致的熔解峰位移现象;所采用的非标记探针仅需对探针的3’末端进行氨基封闭处理,而无需进行荧光基团的修饰,不仅减少了合成的时间,也降低了探针的合成成本;扩增反应和检测全程闭管,避免了开管造成的交叉污染;扩增与检测均在同一仪器中进行,操作简便快捷,利于在医疗机构中推广使用。
附图说明
图1、非标记探针结合高分辨率熔解曲线进行分型的原理图,图中显示本发明中实际引物、探针在靶序列上的分布情况。
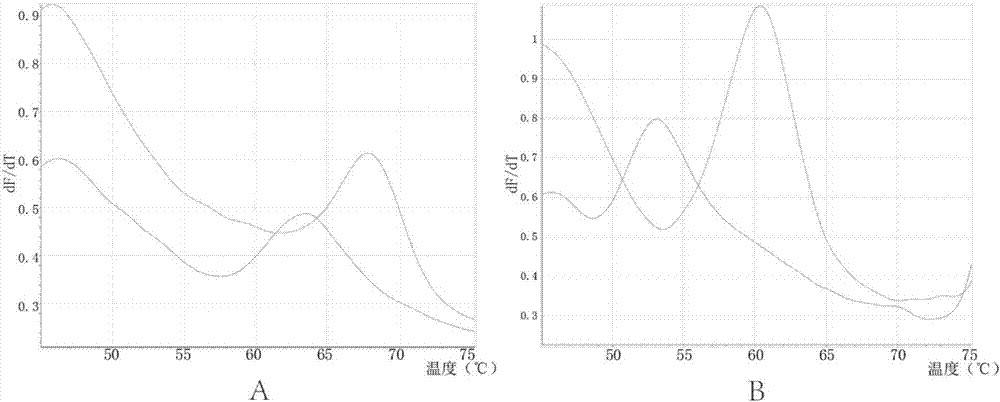
图2、两个位点典型野生型和突变型的分型结果图,
2a、探针1与野生型、突变型的tm值,其中,野生型为63℃(蓝色曲线),突变型为68℃(红色曲线),△tm为5℃;
2b、探针2与野生型、突变型的tm值,其中,野生型为53℃(蓝色曲线),突变型为61℃(红色曲线),△tm为8℃。
具体实施方式
实施例1、药物性耳聋相关位点12srrnac1494t、a1555g突变检测试剂盒(非标记探针法)的组成
(1)靶序列为人12srrna编码基因上的一段,其中包含了待测的两个位点,两个位点的扩增产物总共覆盖200bp的一段序列,其中,1494位点对应的引物对(引物1、2)之间的扩增片段长度为113bp,1555位点对应的引物对(引物3、4)之间的扩增片段长度为125bp。每个非标记探针的杂交区域位于相对应的引物对之间,且覆盖待测位点。
引物序列为:
引物1(seqidno.2):5’gagtagagtgcttagttgaacaggg3’;
引物2(seqidno.3):5’cctctatataaatgcgtaggggtt3’;
引物3(seqidno.4):5’ggacatttaactaaaacccctacg3’;
引物4(seqidno.5):5’aagtgtaagttgggtgctttgtg3’;
非标记探针序列为
探针1(seqidno.6):5’cttgaggagagtgacgggcg3’;
探针2(seqidno.7):5’cgacttgcctcctctatataaa3’;
(2)试剂盒的配制过程如下:
配制pcr反应液:
每人份单个位点反应液:
实施例2、使用药物性耳聋相关位点12srrnac1494t、a1555g突变检测试剂盒(非标记探针法)进行双盲实验考察
样品采集
经过测序证实突变类型的基因组标本总计56份。样品由中国优生优育协会遗传与健康专家指导中心提供,为口腔黏膜样本,采用qiaampdnaminikit试剂盒,按照说明书进行dna的抽提。其中男13例,女43例,年龄2~59岁,包括汉族、蒙古族、维吾尔族等多个民族,采集了样本提供者的耳聋程度、氨基糖甙类药物史等信息。所有标本提供者均签署了知情同意书,操作均符合科研伦理。获得样品时仅有编号,并未获得对应的任何信息。获得样本后首先测定浓度进行质控,其中有4份样品由于浓度过低无法进行后续实验,因而不纳入考察,其余均为20ng/μl。
基因分型
按照上文中每人份反应液的体积和顺序,按照检测的人数配制总管,配制完成后颠倒混匀,分装至每个pcr反应管中,分别加入待测模板,盖好反应管后放入rochelightcyclernano荧光实时pcr仪,采用以下程序进行pcr反应:95℃预变性5min,扩增阶段共60个循环,包括95℃变性15s,58℃退火20s,72℃延伸20s,循环结束后,72℃延伸5min。扩增结束后直接进行熔解曲线检测,样品先95℃变性60s,再迅速冷却到45℃并保持60s,然后以0.05℃/s的升温速率进行熔解,检测温度范围为45~95℃。熔解曲线使用pcr仪器对应软件进行分析,分析时所选荧光通道为sybrgreeni。
结果
经过筛查,在52份合格的样品中,在1494位点上2个样品检测到突变型信号,其余为野生型;在1555位点上共有9个样品检测到突变型信号,其余均为野生型。将结果反馈至样品提供方,其经过核对后确认,检测结果与先前的测序的结论完全符合。
结论
非标记探针法相较传统的高分辨率熔解曲线法,采用较短的探针序列,从而将一个位点的两个基因型之间tm值差距拉大,能够更准确的进行分型。而与探针法相比,其无需荧光标记的探针,从而降低了探针的合成成本,减少了合成的时间。同时,此法仍然使用荧光实时pcr仪,而无需特殊仪器,便于其推广。以上结果表明,使用药物性耳聋相关位点12srrnac1494t、a1555g突变检测试剂盒(非标记探针法)可以用于临床检测和风险预测,具有较高的临床应用前景。
最后需要说明的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,并不用作对本发明保护范围的限定。
sequencelisting
<110>复旦大学
<120>一种用于检测药物性耳聋相关位点的非标记探针
<160>7
<170>patentinversion3.3
<210>1
<211>200
<212>dna
<213>人工序列
<400>1
gagtagagtgcttagttgaacagggccctgaagcgcgtacacaccgcccgtcaccctcct60
caagtatacttcaaaggacatttaactaaaacccctacgcatttatatagaggagacaag120
tcgtaacatggtaagtgtactggaaagtgcacttggacgaaccagagtgtagcttaacac180
aaagcacccaacttacactt200
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
gagtagagtgcttagttgaacaggg25
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
cctctatataaatgcgtaggggtt24
<210>4
<211>24
<212>dna
<213>人工序列
<400>4
ggacatttaactaaaacccctacg24
<210>5
<211>23
<212>dna
<213>人工序列
<400>5
aagtgtaagttgggtgctttgtg23
<210>6
<211>20
<212>dna
<213>人工序列
<400>6
cttgaggagagtgacgggcg20
<210>7
<211>22
<212>dna
<213>人工序列
<400>7
cgacttgcctcctctatataaa22
- 还没有人留言评论。精彩留言会获得点赞!