一种来源于Aquifexaeolicus菌株的嗜热酯酶及其功能验证的制作方法
本发明涉及一种来源于Aquifex aeolicus菌株的嗜热酯酶及其功能验证,属于生物工程技术领域。
背景技术:
极端微生物是适合生活在极端环境中的微生物的总称,包括嗜热、嗜冷、嗜酸、嗜碱、嗜压、嗜盐、嗜金属离子、抗辐射、耐干燥和极端厌氧等多种类型。嗜热菌(高温菌,也称嗜热微生物),是一类生活在50℃以上高温环境中的微生物。常见的嗜热微生物的来源有温泉、火山口、海洋沉积物、废水废物、地热性土壤等。近30年来,在水的沸点和沸点以上温度条件下能生活的细菌被发现后,更促进了对嗜热微生物的研究。在发酵工业中,可以利用嗜热菌耐高温的特性,提高反应温度,增大反应速度,减少中温型杂菌污染的机会。最适反应温度低于80℃的称为嗜热酶,最适反应温度高于80℃的称为超嗜热酶,人类发现的第一个嗜热酶是应用于现代生物技术的聚合酶—Taq酶。此后,许多嗜热酶已不断被从嗜热菌中发现且用于生产,例如纤维素酶、蛋白酶、淀粉酶、脂肪酶、菊糖酶等。
脂类水解酶(EC 3.1.1.X)主要包括脂肪酶和酯酶。脂肪酶和酯酶的区别主要有3点:一是作用的底物不同:酯酶是催化含短链脂肪酸的酯类水解酶,脂肪酶是催化含长链脂肪酸的脂肪(三酰基甘油)水解为甘油和脂肪酸的酶;二是作用底物的物理状态不同:酯酶水解水溶性底物,反应体系主要处于油水界面。脂肪酶只能在异相系统(即油水界面)或有机相中作用,水解脂溶性底物;三是界面的激活效应:脂肪酶在水-油界面催化活性较高,在单一溶液中催化活性低。所有的脂类水解酶一级结构都相似,包括1)重要区域His-Gly-X-Ser-Gly和Gly-X-Ser-X-Gly;2)活性部位的Ser被α-螺旋掩盖,当脂肪酶与界面接触时,α-螺旋打开。3)普遍认为其活性位点由3个催化残基组成:亲核残基(Ser、Cyc、Asp)、催化残基(Asp、Glu)、His残基。
近几年,关于耐热酯酶/脂肪酶的研究愈来愈多,许多嗜热菌株酯酶/脂肪酶已被研究。嗜热酯酶/脂肪酶微生物来源主要有原核生物、真核生物和古生菌。根据脂类水解酶氨基酸序列和基础生化性质的不同,Arpigny和Jaeger等人将细菌脂类水解酶分为8个家族,其中嗜热酶多属于第4家族(HSL家族)和第5家族(嗜热酶家族)。目前,国内外已研究的关于嗜热酯酶/脂肪酶来源的嗜热菌株主要有:Fervidobacterium属,Thermotoga属,Aureobasidium属,Pseudomonas属,Geobacillus属,Sulfolobus属等。酯酶作为一种高效的生物催化剂,由于嗜热酯酶具有高温反应活性和良好的热稳定性,以及对有机溶剂、去污剂和变性剂的较强抗性,使其极广泛的应用于食品加工、医药工业、皮革制造、动物饲料、化妆品行业和污水治理等行业。
随着科学技术的进步,科学家们逐渐从一些特殊高热环境中分离得到超嗜热微生物,也从而使人们对嗜热酶的认识进一步深入。然而,大多数嗜热菌生长速度较慢,培养条件严格,因此通过培养野生菌来获得大量嗜热酶极其困难。然而,随着基因工程技术的发展,人们开始把在嗜热菌中发现的目的基因在一些常见的易培养宿主中表达,从而在温和条件下获得大量的嗜热酶。目前,已有一些嗜热酯酶基因实现在大肠杆菌中的成功表达。但在工业化生产应用中,考虑到酶制剂下游分离处理和安全问题,异源表达宿主的选择尤为重要。毕赤酵母和巨大芽孢杆菌都是食品级表达宿主,且可以胞外分泌重组蛋白。
目前对嗜热酶的研究还处于初级阶段,从超嗜热微生物中发现新型嗜热酶是目前新型酶制剂的主要方法。此外,面对嗜热酯酶的广泛应用,发现新型嗜热酯酶并选择合适的表达宿主尤为重要。
技术实现要素:
为了解决上述问题,本发明发现了一种新的来源于Aquifex aeolicus的嗜热酯酶。本发明通过实现了新发现的酯酶基因的异源表达,并验证了基因功能。
本发明要解决的第一个技术问题是定义一种具有嗜热酯酶活性的新型基因,所述嗜热酯酶基因的氨基酸序列如1)或2)所示:
1)是SEQ ID NO.2所示的氨基酸序列;或
2)在1)限定的氨基酸序列基础上经氨基酸的缺失、取代、插入或突变而成且具有编码有活性的酯酶的氨基酸序列。
所述嗜热酯酶基因来源于Aquifex aeolicus(风产液菌)菌株。Aquifex aeolicus是一种超嗜热真细菌,发现于美国国家黄石公园的温泉中,以H2/CO2/O2及其他无机物质为生长介质,最高生长温度在95℃,属目前已知的几种最耐热细菌之一。
本发明要解决的第二个问题是提供一种表达嗜热酯酶的基因工程菌或者转基因细胞系,所述基因工程菌或转基因细胞系表达氨基酸序列如1)或2)所示的基因:
1)氨基酸序列是SEQ ID NO.2所示的序列;或
2)氨基酸序列是在1)限定的序列基础上经氨基酸的缺失、取代、插入或突变而成且具有编码有活性的酯酶的序列。
在本发明的一种实施方式中,所述基因的核苷酸序列如3)或4)所示:
3)其核苷酸序列是SEQ ID NO.4或者SEQ ID NO:6所示的序列;
4)在3)限定的核苷酸序列基础上经碱基的缺失、取代、插入或突变而成且具有编码有活性的酯酶的核苷酸序列。
在本发明的一种实施方式中,所述基因工程菌可以是以毕赤酵母、大肠杆菌或者巨大芽孢杆菌为宿主构建得到的。
在本发明的一种实施方式中,所述毕赤酵母可选择GS115、KM71或SMD1168等。
在本发明的一种实施方式中,所述基因工程菌为毕赤酵母工程菌,先构建重组毕赤酵母表达载体,以毕赤酵母为宿主进行表达;所述重组毕赤酵母表达载体可以是在pPIC9、pPIC3K、pPIC9K、PAO815或pPICZα等的基础上构建得到的。
在本发明的一种实施方式中,所述基因工程菌是以pPIC9K为载体构建重组毕赤酵母表达载体,以毕赤酵母GS115为宿主构建得到的。
在本发明的一种实施方式中,所述毕赤酵母工程菌表达核苷酸序列如SEQ ID NO:6所示的基因。
在本发明的一种实施方式中,所述大肠杆菌可选择BL21、Rosctta 2、Origami 2、Rosctta-gami 2或Origami B等。
在本发明的一种实施方式中,所述基因工程菌为大肠杆菌工程菌;先构建重组大肠杆菌表达载体,以大肠杆菌为宿主进行表达;所述重组大肠杆菌表达载体可以是在pET28T、MBP3、pBR系列、pUC系列或pAT153载体等的基础上构建得到的。
在本发明的一种实施方式中,所述基因工程菌是以MBP3为载体构建重组大肠杆菌表达载体,以BL21或者Origami 2为宿主构建得到的。
在本发明的一种实施方式中,所述大肠杆菌工程菌表达的核苷酸序列在SEQ ID NO:6基础上稍作改造,不含有组氨酸标签(即去除了SEQ ID NO:6上的第678位至第705位的碱基)。
在本发明的一种实施方式中,所述巨大芽孢杆菌可选WH320、MS941、YYBm1等。
在本发明的一种实施方式中,所述基因工程菌为巨大芽孢杆菌工程菌;先构建重组巨大芽孢杆菌表达载体,以巨大芽孢杆菌为宿主进行表达;所述重组巨大芽孢杆菌表达载体可以是在pHIS1525、pHIS1522、pSTREP1525、pSTREPHIS1525、pSTOP 1622等的基础上构建得到的。
在本发明的一种实施方式中,所述基因工程菌是以pHIS1525为载体构建重组巨大芽孢杆菌表达载体,以巨大芽孢杆菌YYBm1为宿主构建得到的。
在本发明的一种实施方式中,所述巨大芽孢杆菌工程菌表达核苷酸序列为SEQ ID NO:6。本发明要解决的第三个问题是提供一种表达嗜热酯酶的重组载体,所述重组载体含有氨基酸序列如1)或2)所示的基因:
1)氨基酸序列是SEQ ID NO.2所示的序列;或
2)氨基酸序列是在1)限定的序列基础上经氨基酸的缺失、取代、插入或突变而成且具有编码有活性的酯酶的序列。
在本发明的一种实施方式中,所述重组载体是以在pPIC9、pPIC3K、pPIC9K、PAO815或pPICZα等的基础上构建得到的。
在本发明的一种实施方式中,所述重组载体是以在pET 28T、MBP3、pBR系列、pUC系列或pAT153载体等的基础上构建得到的。
在本发明的一种实施方式中,所述重组载体是以在pHIS1525、pHIS1522、pSTREP1525、pSTREPHIS1525或者pSTOP 1622等的基础上构建得到的。
本发明要解决的第四个问题是提供一种生产嗜热酯酶的方法,其特征在于,所述方法是利用本发明的表达嗜热酯酶的重组载体、表达嗜热酯酶的基因工程菌或者表达嗜热酯酶的转基因细胞系。
在本发明的一种实施方式中,所述方法,是将SEQ ID NO.6的序列连接到pPIC9K得到重组表达载体pPIC9K-Aaeo2,然后将重组表达载体电转化到毕赤酵母GS115中,筛选得到阳性转化子即为重组毕赤酵母工程菌;将得到的阳性重组毕赤酵母GS115/pPIC9K-Aaeo2在30℃、200rpm条件下培养至OD600=2.0-6.0,随后离心将菌体转入新鲜培养基中,28℃、200rpm条件下培养并加入终浓度为1.0%的甲醇,诱导表达30-120h。
本发明要解决的第五个问题是提供所述表达嗜热酯酶的重组载体、表达嗜热酯酶的基因工程菌或者表达嗜热酯酶的转基因细胞系的应用。
在本发明的一种实施方式中,所述应用,是应用于食品加工、生物催化、制备药物、皮革制造、动物饲料、化妆品、污水治理等领域。
本发明要解决的第六个问题是提供一种水解対硝基苯酚类或者甘油脂类底物的方法,所述方法是表达氨基酸序列如1)或2)所示的基因,以基因表达产物为催化剂进行水解;其中基因:
1)氨基酸序列是SEQ ID NO.2所示的序列;或
2)氨基酸序列是在1)限定的序列基础上经氨基酸的缺失、取代、插入或突变而成且具有编码有活性的酯酶的序列。
在本发明的一种实施方式中,所述対硝基苯酚类底物为p-NPC4、p-NPC5、p-NPC8、p-NPC12、p-NPC14或者p-NPC16。
在本发明的一种实施方式中,所述甘油脂类底物为三乙酸甘油脂、三丁酸甘油酯、三辛酸甘油酯、三葵酸甘油酯、三酸肉豆蔻甘油酯、三棕榈酸甘油酯或者橄榄油。
本发明的有益效果:
本发明发现了一种新的嗜热酯酶,并重组表达了该嗜热酯酶。本发明对纯化得到的嗜热酯酶进行了一系列酶学性质研究分析,包括最适作用底物、最适作用pH及pH稳定性、最适作用温度及温度稳定性、有机溶剂对重组酶稳定性影响、金属离子对重组酶稳定性影响、表面活性剂对重组酶稳定性影响、抑制剂对重组酶稳定性影响。结果表明重组酶Aaeo2最适底物为p-NPC4,最适作用温度和pH为90℃和8.0,且具有很好的热稳定性,对金属离子和有机溶剂等具有一定的耐受性。
附图说明
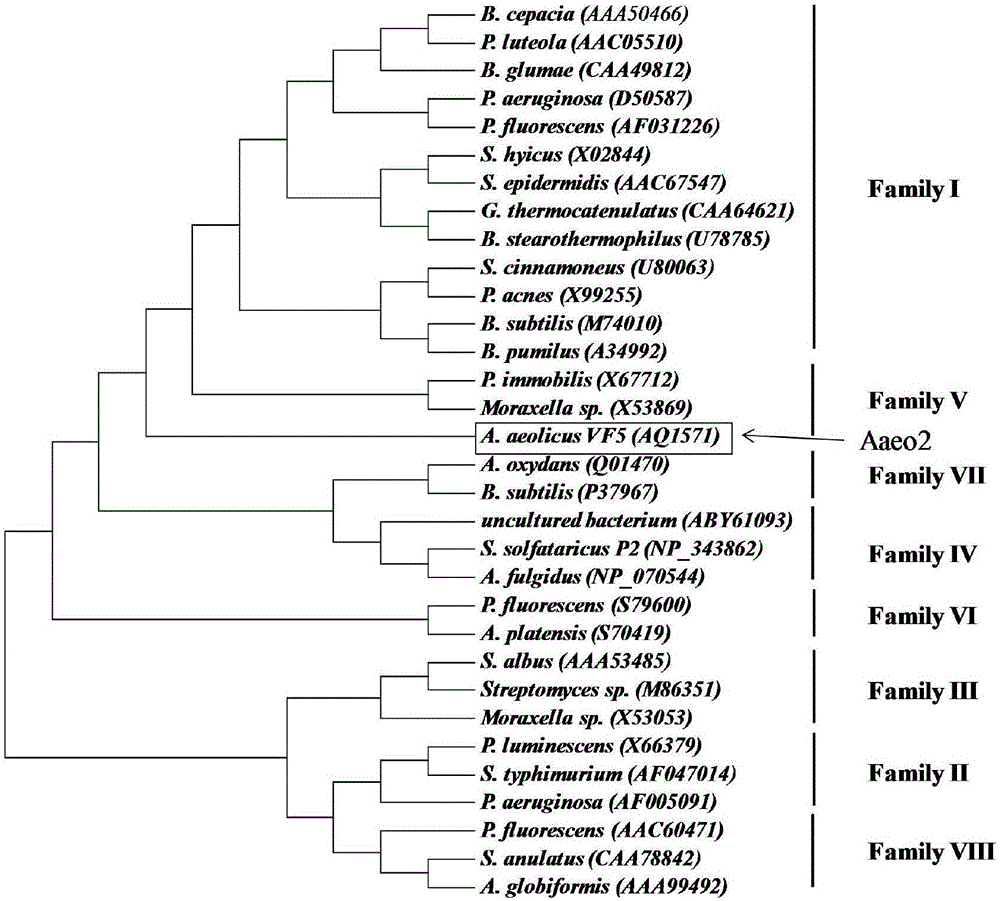
图1是本发明实施例1的A.aeolicus嗜热酯酶Aaeo2的进化树构建图;
图2是本发明实施例2的A.aeolicus嗜热酯酶Aaeo2信号肽预测结果图;
图3是本发明实施例2利用“同源建模”法预测及其软件分析的A.aeolicus嗜热酯酶Aaeo2功能结构图示;
图4是本发明实施例3的pPIC9K-Aaeo2双酶切鉴定图;
图5是本发明实施例3的pPIC9K-Aaeo2重组酶SDS-PAGE电泳结果图;M为蛋白Marker;泳道1为发酵上清液中重组酶蛋白Aaeo2,泳道2为纯化重组酶蛋白Aaeo2;
图6为纯化的A.aeolicus重组嗜热酯酶Aaeo2底物特异性分析;
图7为纯化的A.aeolicus重组嗜热酯酶Aaeo2最适作用温度(图7A)和温度稳定性(图7B)分析;
图8为纯化的A.aeolicus重组嗜热酯酶Aaeo2的Tm值分析;
图9为纯化的A.aeolicus重组嗜热酯酶Aaeo2最适作用pH(图9A)和pH稳定性(图9B)分析。
具体实施方式
在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
下面结合具体的制备实施例和应用实施例,并参照数据进一步详细地描述本发明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
实施例1:A.aeolicus重组嗜热酯酶基因的获得和基因序列分析
根据酯酶一级结构中保守序列“Gly-Xaa-Ser-Xaa-Gly”和关键酶活性位点“Ser,His,Asp”的特征,从A.aeolicus菌株的基因组选择两种假定蛋白序列,在SWISS-PROT数据库中对其进行Blast分析,得到Aaeo1序列与来源于Nitrosomonas europaea的一种methyl ester esterase(Reference sequence:Q82SL8.2)有27%的相似性。Aaeo2序列与来源于Bos taurus的一种mycophenolic acid acyl-glucuronide esterase(Reference sequence:Q5E9H9.1)有25%的相似性。因此,可以初步猜测这两种序列可编码酯酶蛋白。
选择5种已研究的嗜热酯酶/脂肪酶,与A.aeolicus两种嗜热酯酶进行序列比对分析,5种已知酯酶/脂肪酶分别为Sulfolobus solfataricus来源的esterase(GenBank NO.:CCQ48704)、S.acidocaldarius来源的lipolytic enzyme(GenBank NO.:AAC67392)、Archaeoglobusfulgidus来源的carboxylesterase(GenBank NO.:WP_010879825)、F.changbaicum来源的lipase(GenBank NO.:EF138832)和Thermotoga maritima来源的lipase(GenBank NO.:AAD36421)。结果发现,A.aeolicus两种假定蛋白具有典型的酯酶保守区域和关键酶活性位点,除此之外,还有其他相同区域的存在。Aaeo1的关键酶活性位点为Ser62、Asp163、His190,序列Gly60-Gly64为保守区域。Aaeo2的关键酶活性位点为Ser82、Asp185、His212,序列Gly80-Gly84为保守区域。
基于Arpigny和Jaeger等人对细菌来源酯酶/脂肪酶的分类,将其分为8个家族;使用MEGA5.0,采用neighbor-joining法,设定bootstrap为1000,构建进化树(见图1)。由图1可以看出,Aaeo2序列编码的重组酶归为Family VIII家族。
其中,Aaeo1的氨基酸序列如SEQ ID NO:1所示,核苷酸序列如SEQ ID NO:3所示。
Aaeo2的氨基酸序列如SEQ ID NO:2所示,核苷酸序列如SEQ ID NO:4所示。
实施例2利用“同源模建”法获得A.aeolicus两种嗜热酯酶三维预测结构
来源于A.aeolicus的一种嗜热酯酶基因Aaeo1长度为621bp,编码207个氨基酸,分子量大小为23.4kDa,该蛋白的核酸序列和蛋白序列见SEQ ID NO:3和SEQ ID NO:1。另一种嗜热酯酶基因Aaeo2长度为678bp,编码226个氨基酸,分子量大小为26.8kDa,该蛋白的核酸序列和蛋白序列见SEQ ID:4和SEQ ID NO:2。
根据SignalP预测,假定蛋白Aaeo2的N端均没有信号肽存在的可能性(见图2)。
将A.aeolicus两种嗜热酯酶的氨基酸序列分别提交I-TASSER蛋白质在线模建服务器(http://zhanglab.ccmb.med.umich.edu/I-TASSER/)进行同源建模,随后利用Pymol软件对A.aeolicus两种嗜热酯酶同源建模结构进行分析(见图3)。由图3可以看出酶活性位点(红色标记)、负氧离子洞(蓝色标记)和cap结构(白色标记)。Aaeo2蛋白同源建模的模板为2wtmA,2wtmA是来源于瘤胃细菌Butyrivibrio Proteoclasticus的麦麸酯酶。Aaeo2的model(图3)和模板之间的序列同源相似性为25%,催化三联体为Ser82、Asp185、His212,构成负氧离子洞的两个残基Leu19和His83。
实施例3A.aeolicus两种嗜热酯酶真核表达载体的构建,重组表达及其蛋白表达
一、真核表达载体的构建
A.aeolicus两种嗜热酯酶基因根据毕赤酵母密码子偏好性,在DNA编码框的C末端引入6xHis标签,并在5’和3’两侧分别引入AvrII和NotI限制性酶切位点,由生物公司合成优化后的序列,即SEQ ID NO:5(Aaeo1)和SEQ ID NO:6(Aaeo2),并连接在表达载体pPIC9K上,得到重组表达载体pPIC9K-Aaeo1和pPIC9K-Aaeo2。
用AvrII和NotI双酶切重组表达载体质粒pPIC9K-Aaeo2,37℃酶切30min。双酶切进行简单鉴定,1%琼脂糖核酸凝胶如图4所示,阳性pPIC9K-Aaeo2质粒双酶切图(AvrII和NotI),M为15000bp Marker。
二、重组载体pPIC9K-Aaeo1和pPIC9K-Aaeo2在毕赤酵母GS115中的表达。
1)电转化甲醇毕赤酵母及阳性转化子的筛选
据毕赤酵母表达系统操作手册,将测序正确的重组质粒pPIC9K-Aaeo2用限制性内切酶SacI线性化后,电激转化毕赤酵母GS115,涂布于MD平板(含G418)上筛选目标基因整合到受体菌染色体上的转化子。挑取转化子,提取总DNA,以其为模板,以5’AOX和3’AOX为引物进行PCR鉴定,以空载体转化菌作对照,验证目的基因已经整合进酵母基因组中。
2)重组pPIC9K-Aaeo2载体在毕赤酵母中的诱导表达
重组毕赤酵母在25mL BMGY培养基(250mL三角瓶)中30℃培养至OD为2.0~6.0,离心收集菌体,加入到100mL BMMY培养基后于28℃,200rpm条件下继续培养,每12-24h补加1.0%(v/v)甲醇,定时取样,测定菌体密度和蛋白浓度,同时进行培养液的SDS-PAGE和酶活测定。蛋白浓度采用Bradford法。
3)重组酶的纯化及其SDS-PAGE凝胶电泳分析(见图5)
蛋白质纯化参考GE Healthcare指南,SDS-PAGE分析按照《分子克隆实验指南》(第三版),使用的凝胶分离胶浓度为12%,浓缩胶浓度为5%,上样量为5-25μL。蛋白质用考马斯亮蓝R-250染色。在图5可以看出,land2条带显示得到的单一纯化蛋白Aaeo2,分子量为25kDa左右。
4)嗜热酯酶酶活检测
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008):使用p-NPC4作为底物,pH8.0Tris-HCl缓冲液,在70℃条件下测定酶活性。酶活定义为一定反应条件下每分钟产生1μmol対硝基苯酚的酶量为一个酶活国际单位。
酶活性测定显示具有酯酶活性。
实施例4活性位点定点突变进一步鉴定A.aeolicus两种假定嗜热酯酶
为进一步鉴定A.aeolicus两种假定嗜热酯酶,设计引物,通过全质粒PCR对关键酶活性位点(Ser-His-Asp)进行定点突变,构建突变菌株。对于Aaeo1酯酶的酶活性位点(Ser62、Asp163、His190),依次使用引物g9和g10、g11和g12、g13和g14。Aaeo2酯酶的酶活性位点(Ser82、Asp185、His212)依次使用引物g15和g16、g17和g18、g19和g20。(突变位点用粗体表示)
所述PCR引物(序列如SEQ ID NO:7~SEQ ID NO:18所示):
g9:5’-CATGACGTAGTTGGTTGGGCTTTGGGAGGTTCTCTTGC-3’
g10:5’-GCAAGAGAACCTCCCAAAGCCCAACCAACTACGTCATG-3’
g11:5’-GATACACGGCGTCTCCAATCGAATTGTTCCCTAT-3’
g12:5’-ATAGGGAACAATTCGATTGGAGACGCCGTGTATC-3’
g13:5’-CTAATTTTATTAGGTGGCGGAAATTTTCCTGTTCGTAACGAAG-3’
g14:5’-CTTCGTTACGAACAGGAAAATTTCCGCCACCTAATAAAATTAG-3’
g15:5’-GAAATCACTTTGTGTGGATCTGCTCATGGTGGATATATTGCTA-3’
g16:5’-TAGCAATATATCCACCATGAGCAGATCCACACAAAGTGATTTC-3’
g17:5’-CCTGTTGAAATTGTTATTATGCATGGTATTAGAAACGACATTGTTCCTATT-3’
g18:5’-AATAGGAACAATGTCGTTTCTAATACCATGCATAATAACAATTTCAACAGG-3’
g19:
5’-GTTAAAAAGTTTTTGAAAGTTGACGATGATAACCAATTGAATGAATCTTTGCAAA-3’
g20:5’-TTTGCAAAGATTCATTCAATTGGTTATCATCGTCAACTTTCAAAAACTTTTTAAC-3’
将突变菌株表达的重组酶进行纯化,测定酶活性,发现酶活性消失,说明这三个位点对重组酶的重要性,也进一步证实了这两个假定蛋白为酯酶。
实施例5:纯化的A.aeolicus嗜热酯酶的底物特异性
分别测定两种重组嗜热酯酶对対硝基苯酚类和甘油脂类的底物特异性。
作用于対硝基苯酚类底物的酶活性如实施例3酶活测定。分别选用p-NPC4、p-NPC5、p-NPC8、p-NPC12、p-NPC14、p-NPC166种底物,测定酶活性,选择最适底物。
作用于甘油酯类底物的酶活性测定方法参照玉崧成论文(嗜热脂肪酶分子克隆及酶学性质研究,吉林大学,2008)。选用三乙酸甘油脂、三丁酸甘油酯、三辛酸甘油酯、三葵酸甘油酯、三酸肉豆蔻甘油酯、三棕榈酸甘油酯和橄榄油为底物,在50mM pH 8.0的磷酸缓冲液的缓冲液体系中,在70℃条件下测定酯酶活力,确定重组酶对三甘油酯类为底物时的最适底物。
结果如图6所示,图6重组酶Aaeo2倾向于水解短链底物,对中长链底物具有较低的相对酶活性,因此重组酶Aaeo2最适底物为p-NPC4,Aaeo2对甘油酯类几乎没有酶活性。
实施例6:纯化的A.aeolicus嗜热酯酶最适作用温度和温度稳定性分析
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)
对纯化获得的重组嗜热酯酶进行了最适作用温度及温度稳定性分析。如图7所示,结果表明,以p-NPC4为底物时,重组酶Aaeo2的最适温度为90℃,在70和80℃放置2h仍保留65%残余酶活性。在90℃的半衰期2h。
实验结果充分表明重组嗜热酯酶Aaeo1和Aaeo2均具有满足于工业生产中的高温条件。
实施例7:纯化的A.aeolicus嗜热酯酶的Tm值测定
采用圆二色谱的方法,测定纯化重组酶的蛋白热稳定性,即Tm值(熔解温度),溶解曲线斜率最大的点对应的温度即为Tm值,如图8所示,可以看出重组酶Aaeo2的熔解曲线显示在88℃时曲线变化最快,在高于90℃的温度下曲线逐渐趋于平衡。因此Tm值为88℃,这也充分进一步验证了重组酶Aaeo2的热稳定性实验。
实施例8:纯化的A.aeolicus嗜热酯酶最适作用pH和pH稳定性分析
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)
对纯化获得的重组嗜热酯酶Aaeo2进行了最适作用pH及pH稳定性分析.如图9A所示,在pH8.0时,相对酶活最高,因此最适反应pH值为8.0。重组酶Aaeo2的pH稳定性如图9B所示,分别测定重组酶在pH7.0-9.0条件下的稳定性,随着放置时间的增加,相对酶活急剧下降,半衰期依次为54min、50min和46min。
实施例9:各种金属离子对纯化的A.aeolicus嗜热酯酶稳定性的影响
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)。
由表1可以看出,对于重组酶Aaeo2,EDTA可以抑制其酶活性,说明其为金属离子依赖性酶。对于Aaeo2,低浓度Fe3+、Co2+、Mn2+可以提高酶活性,低浓度Ca2+对酶活性影响不大,而高浓度Ca2+对重组酶具有轻微的抑制作用。
表1各种金属离子对纯化的A.aeolicus重组嗜热酯酶稳定性的分析
实施例10:各种有机溶剂对纯化的A.aeolicus嗜热酯酶稳定性的影响
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)。
表2各种有机溶剂对纯化的A.aeolicus重组嗜热酯酶稳定性的分析
由表2可以看出,重组酶Aaeo2具有很好的有机溶剂耐受性,环己烷可以激活酶活性,而高浓度正己烷、正丁醇和异丁醇对重组酶具有较强的抑制作用。低浓度的有机溶剂对酶活性影响不大。
实施例11:各种表面活性剂对纯化的A.aeolicus嗜热酯酶稳定性的影响
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)。
由表3可以看出,表面活性剂对重组酶Aaeo2有一定的抑制作用,随着表面活性剂浓度的增加,抑制作用增强,但低浓度对酶活性影响较小。
表3各种表面活性剂对纯化的A.aeolicus重组嗜热酯酶稳定性的分析
实施例12:各种抑制剂对纯化的A.aeolicus嗜热酯酶稳定性的影响
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008)。
由表4可以看出,对于重组酶Aaeo2,PMSF(丝氨酸蛋白酶和巯基蛋白酶抑制剂)和DEPC(His残基修饰物)对重组酶具有较强的抑制作用。而DTT(主要用于蛋白质中二硫键的还原)可以提高酶活性。这表明Ser、His和Asp对酶活性的重要性。
表4各种抑制剂对纯化的A.aeolicus重组嗜热酯酶稳定性的分析
实施例13:A.aeolicus嗜热酯酶大肠杆菌表达载体的构建,重组表达及其蛋白表达
一、大肠杆菌表达载体的构建
1)引物设计:从优化后的基因设计引物,不包含C末端6xHis标签(序列如SEQ ID NO:19~SEQ ID NO:22所示)
g1:5’-GCTCATATGATGCTGAAGAACCCTTTGT-3’
g2:5’-GCTGGATCCTTAATACCCCTTTAAAATAGCTTT-3’
g3:5’-GCCCATATGATGTACTTCTACGATATTAACAA-3’
g4:5’-GGCGGATCCTTACAACAATTCCTCAATATATTTTTG-3’
2)PCR反应,g1和g2以载体pPIC9K-Aaeo1为模板,退化温度为50℃;g3和g4以载体pPIC9K-Aaeo2为模板,退化温度为55℃。
反应条件:98℃,3min预变性;变性,98℃,30s,退火,50℃(或55℃),1min,复性,72℃,45s,第二步到第四步进行30个循环;72℃,10min;10℃保温。电泳检测PCR扩增产物,获得大小为650和700bp左右的DNA片段,利用omega公司提供的凝胶纯化试剂盒纯化目的DNA片段。
3)NdeI和BamHI双酶切Aaeo1和Aaeo2的PCR产物和质粒MBP3,37℃酶切4h。利用omega公司提供的凝胶胶回收试剂盒回收目的DNA片段和载体
4)连接
取T4DNA ligase 1μl、10x T4DNAligase Buffer 1μl、目的基因+载体(n1:n2=1:3)8μl,混合均匀,在16℃连接16h。
5)转化
取10μl连接产物加入感受态细胞BL21和Origami 2中,置于冰上30min,42℃热激90s后立即放在冰上,放置2min后,加入1ml不含抗生素的LB培养基,37℃摇床培养1h,将转化的菌液涂于LB(Amp)平板上,37℃培养过夜。在平板上分别挑取多个菌落转接到试管,37℃培养8h。
6)提取质粒
用omega公司的质粒抽提试剂盒提取质粒,送至生物公司进行测序鉴定。
二、重组表达载体MBP3-Aaeo1和MBP3-Aaeo2在大肠杆菌BL21和Origami 2中的表达
1)重组载体在两种宿主中的诱导表达
在LB平板(含Amp)上挑取阳性重组菌株转化子接种于5mL LB液体培养基(含Amp)中,在37℃、200rpm过夜培养8h,得到种子液。
将种子液以1%接种量接种于50-100mL LB培养基(250mL三角瓶)中,37℃、200rpm培养至OD600为0.6左右时,加入终浓度为0.2mM的IPTG,同时降温至17℃培养,进行重组蛋白的诱导表达,培养12h左右即可。
2)重组酶的收集和纯化
离心收集菌体,使用BufferA重悬菌体,进行超声破碎。低温离心破碎后的菌体溶液,收集上清液进行蛋白纯化。纯化方法参考GE Healthcare指南。第一次蛋白纯化得到MBP-Aaeo1和MBP-Aaeo2融合蛋白,通过超滤除去咪唑,加入适当已纯化的TEV酶进行蛋白酶切,16℃酶切16h,进行第二次蛋白纯化,收集穿透峰,即为纯化的重组蛋白Aaeo1和Aaeo2。SDS-PAGE进行电泳分析。
分别对宿主胞外组分、周质空间组分、细胞质组分、全细胞组分、细胞沉淀组分进行电泳分析,可见重组蛋白主要存在于细胞质组分中。毕赤酵母蛋白表达量为0.32mg/mL,大肠杆菌蛋白表达量为1.2mg/mL。与毕赤酵母相比,表达量提高。
3)酶活测定
大肠杆菌表达得到融合蛋白(两个蛋白之间有TEV蛋白酶酶切位点),使用TEV在16℃放置16h,分别测定TEV酶酶切前后的酶活性,结果显示Origami2/MBP3-Aaeo2重组菌株表达的重组酶,酶切后比酶活力增加。
实施例14:A.aeolicus两种嗜热酯酶巨大芽孢杆菌表达载体的构建,重组表达及其蛋白表达
一、巨大芽孢杆菌表达载体的构建
1)引物设计:从优化后的基因设计引物(序列如SEQ ID NO:23~SEQ ID NO:26所示)
g5:5’-TAGAGATCTATATGCTGAAGAACCCTTTGTT-3’
g6:5’-TCAGGATCCTTAGTGATGATGATGGTGGT-3’
g7:5’-TAGAGATCTATATGTACTTCTACGACATCAACAA-3’
g8:5’-TGCGGATCCTTAGTGGTGATGATGGTGGTG-3’
2)按照常规PCR反应,g5和g6以载体pPIC9K-Aaeo1为模板,退化温度为51℃;g7和g8以载体pPIC9K-Aaeo2为模板,退化温度为57℃。电泳检测PCR扩增产物,获得大小为650和700bp左右的DNA片段,利用omega公司提供的凝胶纯化试剂盒纯化目的DNA片段。
3)BglII和BamHI双酶切Aaeo1和Aaeo2的PCR产物和质粒pHIS1525,37℃酶切4h。利用omega公司提供的凝胶胶回收试剂盒回收目的DNA片段和载体。
4)按照常规方法16℃连接16h。热击转化至DH5α感受态中。提取质粒,送去生物公司测序鉴定。
二、重组表达载体pHIS1525-Aaeo1和pHIS1525-Aaeo2在巨大芽孢杆菌YYBm1中的表达
1)转化巨大芽孢杆菌及阳性转化子的筛选
采用原生质体转化法将重组载体转化到巨大芽孢杆菌YYBm1原生质体细胞中,原生质体的制备和原生质体转化方法参考“Bacillus megaterium Protein Production System”手册。在含四环素抗性的LB平板上筛选得到阳性转化子,提取质粒双酶切鉴定。
2)重组载体pHIS1525-Aaeo1和pHIS1525-Aaeo2在巨大芽孢杆菌YYBm1中的诱导表达
从抗性平板上挑取阳性转化子接种于5mL LB液体培养基(含Tet)中,37℃、220rpm振荡过夜培养,得到种子液。
按照1%接种量,将种子液接种于200mL新鲜的LB液体培养基(含Tet)中,37℃、220rpm振荡培养,重组菌培养生长至OD600为0.3-0.4之间,加入0.5%(w/v)(D)-木糖作为诱导剂,仍保持37℃、220rpm震荡培养,每30-60min取一次样品,测定OD600nm和蛋白浓度,直到诱导后6h结束培养。
3)重组酶的纯化和SDS-PAGE分析
离心样品收集菌体细胞和样品上清,9000r/min,离心10min。胞外蛋白直接进行蛋白纯化,胞内蛋白使用裂解缓冲液进行裂解获得。纯化方法参考GE Healthcare指南。12%分离胶的SDS-PAGE进行电泳分析。
4)酶活性测定
嗜热酯酶酶活测定方法参照王乐乐论文(华根霉脂肪酶的基因克隆、表达、纯化和酶学性质研究,江南大学,2008):使用p-NPC4作为底物,pH8.0Tris-HCl缓冲液,在70℃条件下测定酶活性。酶活定义为一定反应条件下每分钟产生1μmol対硝基苯酚的酶量为一个酶活国际单位。
酶活性测定显示具有酯酶活性。
这些实例表明,来源于超嗜热菌Aquifex aeolicus的两种假定蛋白为酯酶蛋白。随着分子生物学,基因工程和酶工程等的迅猛发展,本发明首次鉴定并证实了两种Aquifex aeolicus来源的新型嗜热酯酶基因,并对酯酶蛋白进行了详细的性质研究。这些为新型嗜热酯酶的工业化应用奠定了基础。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
<110> 江南大学
<120> 一种来源于Aquifex aeolicus菌株的嗜热酯酶及其功能验证
<160> 22
<170> PatentIn version 3.3
<210> 1
<211> 207
<212> PRT
<213> 人工序列
<400> 1
Met Leu Lys Asn Pro Leu Phe Ile His Gly Trp Ala Phe Ser Ser Lys
1 5 10 15
Val Phe Asn Asp Phe His Gly Ile Lys Tyr Asp Leu Pro Gly His Gly
20 25 30
Lys Asn Lys Asn Pro Tyr Glu Ser Ile Glu Lys Val Val Glu Glu Ile
35 40 45
Gly Lys Ile Ala Thr Ser Lys His Asp Val Val Gly Trp Ser Leu Gly
50 55 60
Gly Ser Leu Ala Leu Leu Phe Ala Tyr Arg Tyr Pro Glu Lys Val Asn
65 70 75 80
Arg Leu Ile Leu Ile Gly Thr Thr Pro His Phe Lys Gly Ala Trp Ser
85 90 95
Glu Lys Asn Ile Arg Ala Met Lys Leu Leu Ile Lys Lys Lys Gly Ile
100 105 110
Lys Ala Phe Arg Glu Leu Ala Tyr Gly Lys Phe Glu Asp Phe Phe Asp
115 120 125
Glu Glu Gln Gly Met Arg Phe Leu Glu Asp Tyr Val Asn Leu Asn Leu
130 135 140
Tyr Thr Val Leu Pro Tyr Ile Lys Lys Glu Val Tyr Leu Ile His Gly
145 150 155 160
Val Ser Asp Arg Ile Val Pro Tyr Ser Glu Ala Tyr Lys Leu His Arg
165 170 175
Ala Leu Lys Cys Ser Lys Leu Ile Leu Leu Gly Gly Gly His Phe Pro
180 185 190
Val Arg Asn Glu Glu His Leu Arg Lys Ala Ile Leu Lys Gly Tyr
195 200 205
<210> 2
<211> 226
<212> PRT
<213> 人工序列
<400> 2
Met Tyr Phe Tyr Asp Ile Asn Asn Glu Lys Arg Leu Trp Leu His Leu
1 5 10 15
His Gly Leu Ala Thr Asn Val Leu Gly Arg Lys Ile Glu Phe Leu Arg
20 25 30
Asn Tyr Phe Lys Glu Lys Lys Leu Tyr Ser Phe Phe Ala Asn Asp Met
35 40 45
Asp Tyr Glu Lys His Thr Thr Thr Asn Thr Leu Asp Phe Leu Glu Val
50 55 60
Leu Val Arg Gly Phe Ser Gln Lys Phe Glu Glu Ile Thr Leu Cys Gly
65 70 75 80
Ser Ser His Gly Gly Tyr Ile Ala Met Asn Tyr Val Arg Lys Arg Pro
85 90 95
Leu Phe Asn Val Lys Arg Leu Val Leu Leu Ala Pro Ser Tyr Asn Thr
100 105 110
Leu Ser Leu Ile Ile Lys Glu Leu Gly Glu Asp Lys Val Lys Pro Trp
115 120 125
Leu Glu Gly Lys Glu Glu Leu Thr Ile Leu Glu Glu Asp Arg Glu Val
130 135 140
Thr Phe Ile Lys Asp Trp Ala Lys Asp Ile Ile Gln Asn Asp Tyr Glu
145 150 155 160
Ile Ile Lys Asp Gly Arg Val Asp Phe Pro Glu Glu Pro Pro Val Glu
165 170 175
Ile Val Ile Met His Gly Ile Arg Asp Asp Ile Val Pro Ile His Tyr
180 185 190
Ser Glu Thr Phe Ala Lys Ser Val Lys Val Lys Lys Phe Leu Lys Val
195 200 205
Asp Asp Asp His Gln Leu Asn Glu Ser Leu Gln Lys Tyr Ile Glu Glu
210 215 220
Leu Leu
225
<210> 3
<211> 624
<212> DNA
<213> 人工序列
<400> 3
atgctcaaaa atcccctctt tatccacgga tgggcgtttt cctcaaaggt atttaatgac 60
tttcacggta taaagtacga ccttcccggg cacggaaaaa ataaaaatcc ctacgagagt 120
atagaaaaag tagtggaaga aattggaaaa atagccactt caaaacacga cgttgtaggc 180
tggtcccttg gaggaagtct ggcacttctt ttcgcttaca ggtatccaga aaaggtaaac 240
aggttgatcc ttatagggac cactccccac tttaaaggag cgtggagcga aaagaatata 300
agggctatga aactcctgat aaagaagaag gggataaaag ctttcaggga actagcctac 360
gggaaatttg aggacttctt tgacgaggag cagggcatga gatttcttga ggactacgtg 420
aacctgaact tgtacactgt acttccctat ataaagaagg aggtttacct gatacacgga 480
gtttcggaca gaatagttcc gtattcagaa gcttacaaac tgcatagagc tttaaaatgc 540
tctaaattaa tccttctcgg aggaggacac ttccctgtca gaaatgaaga acaccttagg 600
aaggcaattc tcaagggcta ctga 624
<210> 4
<211> 681
<212> DNA
<213> 人工序列
<400> 4
atgtactttt acgatatcaa caacgagaag agactctggc ttcaccttca cggacttgcg 60
acaaacgtcc tcggaaggaa gatagagttt ttgaggaatt actttaagga aaagaagctt 120
tattcgtttt ttgcgaatga tatggactac gaaaagcaca caactacaaa caccttggat 180
tttttggaag ttctcgtcag aggattttcc cagaagtttg aagaaattac cctttgcggg 240
agttcccacg gcggttacat agcgatgaac tatgtaagga aaaggcctct ctttaatgta 300
aagagactcg tcttactcgc accctcatac aacacactat ccctgataat taaagagctc 360
ggagaagata aggtaaagcc atggcttgag ggaaaggaag aactcaccat acttgaagag 420
gacagggaag tgacctttat aaaggattgg gcaaaggaca taatacagaa cgactacgag 480
attataaaag acggaagggt ggatttcccc gaagagcctc ccgtggaaat agtgataatg 540
cacgggataa gggacgatat agtgccaatc cattattccg agacctttgc aaagagcgta 600
aaggtgaaaa aattcctcaa agtggacgac gaccaccagc taaacgaaag tctgcagaag 660
tatatagaag aactccttta g 681
<210> 5
<211> 651
<212> DNA
<213> 人工序列
<400> 5
atgctgaaga accctttgtt catccacggt tgggcatttt catctaaggt tttcaacgac 60
ttccatggta tcaagtacga tttgccagga catggaaaaa acaagaaccc atacgaatct 120
atagagaagg tggtagaaga gatcggtaaa atcgcaacat ctaagcatga cgtagttggt 180
tggagtttgg gaggttctct tgcattgctt tttgcttaca gatacccaga gaaagttaat 240
agactaattc tgataggtac tacccctcat ttcaaaggag cttggtcaga gaagaatatc 300
agagctatga aactgttgat taagaagaaa ggcattaagg ccttcagaga gctggcttat 360
ggtaaatttg aggatttctt tgatgaagaa caagggatga ggtttcttga agactatgtc 420
aatttgaatc tttacacggt gttgccctac attaagaaag aagtctattt gatacacggc 480
gtctccgatc gaattgttcc ctattccgaa gcctacaagc tacacagggc cttgaaatgt 540
tccaaactaa ttttattagg tggcggacat tttcctgttc gtaacgaaga acacttacgt 600
aaagctattt taaaggggta tggatcaagt caccaccatc atcatcacta a 651
<210> 6
<211> 708
<212> DNA
<213> 人工序列
<400> 6
atgtacttct acgacatcaa caacgagaag agattgtggt tgcacttgca tggtttggct 60
actaatgttt tgggtagaaa aatcgaattt ttgagaaact acttcaagga gaagaagttg 120
tactctttct tcgctaatga catggattac gagaagcata ctactactaa cactttggat 180
ttcttggagg ttttggttag aggattctct cagaaattcg aagaaatcac tttgtgtgga 240
tcttctcatg gtggatatat tgctatgaac tatgttagaa agagaccatt gtttaatgtt 300
aaaagattgg ttttgttggc tccatcttac aatactttgt ctttgatcat caaggagttg 360
ggagaggata aggttaagcc ttggttggaa ggtaaagaag aattgactat tttggaagaa 420
gatagagaag ttacttttat caaggattgg gctaaagata tcattcagaa cgattatgag 480
attattaagg acggaagagt tgactttcca gaagagccac ctgttgaaat tgttattatg 540
catggtatta gagacgacat tgttcctatt cattattctg agacttttgc taaatctgtt 600
aaagttaaaa agtttttgaa agttgacgat gatcaccaat tgaatgaatc tttgcaaaaa 660
tatattgagg aattgttggg ttcttctcac caccatcatc accactaa 708
<210> 7
<211> 38
<212> DNA
<213> 人工序列
<400> 7
catgacgtag ttggttgggc tttgggaggt tctcttgc 38
<210> 8
<211> 38
<212> DNA
<213> 人工序列
<400> 8
gcaagagaac ctcccaaagc ccaaccaact acgtcatg 38
<210> 9
<211> 34
<212> DNA
<213> 人工序列
<400> 9
gatacacggc gtctccaatc gaattgttcc ctat 34
<210> 10
<211> 34
<212> DNA
<213> 人工序列
<400> 10
atagggaaca attcgattgg agacgccgtg tatc 34
<210> 11
<211> 43
<212> DNA
<213> 人工序列
<400> 11
ctaattttat taggtggcgg aaattttcct gttcgtaacg aag 43
<210> 12
<211> 43
<212> DNA
<213> 人工序列
<400> 12
cttcgttacg aacaggaaaa tttccgccac ctaataaaat tag 43
<210> 13
<211> 43
<212> DNA
<213> 人工序列
<400> 13
gaaatcactt tgtgtggatc tgctcatggt ggatatattg cta 43
<210> 14
<211> 43
<212> DNA
<213> 人工序列
<400> 14
tagcaatata tccaccatga gcagatccac acaaagtgat ttc 43
<210> 15
<211> 51
<212> DNA
<213> 人工序列
<400> 15
cctgttgaaa ttgttattat gcatggtatt agaaacgaca ttgttcctat t 51
<210> 16
<211> 51
<212> DNA
<213> 人工序列
<400> 16
aataggaaca atgtcgtttc taataccatg cataataaca atttcaacag g 51
<210> 17
<211> 55
<212> DNA
<213> 人工序列
<400> 17
gttaaaaagt ttttgaaagt tgacgatgat aaccaattga atgaatcttt gcaaa 55
<210> 18
<211> 55
<212> DNA
<213> 人工序列
<400> 18
tttgcaaaga ttcattcaat tggttatcat cgtcaacttt caaaaacttt ttaac 55
<210> 19
<211> 28
<212> DNA
<213> 人工序列
<400> 19
gctcatatga tgctgaagaa ccctttgt 28
<210> 20
<211> 33
<212> DNA
<213> 人工序列
<400> 20
gctggatcct taatacccct ttaaaatagc ttt 33
<210> 21
<211> 32
<212> DNA
<213> 人工序列
<400> 21
gcccatatga tgtacttcta cgatattaac aa 32
<210> 22
<211> 36
<212> DNA
<213> 人工序列
<400> 22
ggcggatcct tacaacaatt cctcaatata tttttg 36
- 还没有人留言评论。精彩留言会获得点赞!