细胞分离装置以及细胞分离方法与流程
本发明涉及临床医学和生物科学领域,特别是细胞分离装置以及细胞分离方法。
背景技术:
细胞分选是细胞生物学、分子生物学最重要的技术方法及必要前提,目前技术比较成熟且应用较广泛,主要有:密度梯度离心法、免疫密度离心法、免疫磁珠法和流式技术等。其中,密度梯度离心法是根据细胞的密度来实现特定类型细胞的分离,其操作简单,成本低,但只能对细胞群体进行粗略的分离,不能满足临床和科研上复杂的细胞分离需要;免疫密度离心法、免疫磁珠法和流式分选法都是基于抗体捕获细胞的原理,结合其他技术实现特定类型的细胞分离,这些分离技术虽然能够实现特定类型细胞的分离,但操作复杂、分离效率低、成本高,限制了其在临床上的大规模应用。
三维抗体网细胞分离法,是结合三维细胞培养(3D培养)和抗体捕获细胞的原理,开发的一种新的细胞分离方法。
三维细胞培养就是将细胞置于具有三维立体结构的载体中,如水凝胶、多孔PLGA支架等,再加入培养液在体外进行培养,使得细胞感到好像仍然在体内的微环境中一样,可以在三维空间中迁移、生长,形成多细胞聚集体等。三维培养基质是在细胞培养过程当中为细胞提供黏附、增殖和分化所需要的支撑材料,也充当支架。三维培养基质需要具有良好的细胞相容性,有一定的机械力学性能,内部有大量的孔隙结构。目前常用的三维培养基质主要包括动物性凝胶、非动物性基质材料和合成高分子凝胶类。
基于抗体分离细胞的方法,利用细胞表面特定的标志物,通过抗体和细胞表面的抗原结合,从而特异性捕获细胞。基于该原理的细胞分选方法很多,但大多效率较低。
技术实现要素:
为了解决现有技术细胞分离效果差的技术问题,本发明提出一种细胞分离装置以及使用该装置的细胞分离方法。
本发明的技术问题通过以下的技术方案予以解决:一种细胞分离装置,包括内管和外管,所述内管的开口端设有向外延伸的凸缘以让所述内管套设在所述外管的开口端,所述内管的底部与所述外管的底部之间设有预设距离,用于容纳进入到所述外管中的未被三维抗体网捕获的单细胞,所述内管的底部为多孔结构,用于分离所述未被三维抗体网捕获的单细胞和被三维抗体网捕获的细胞;所述未被三维抗体网捕获的单细胞可通过所述多孔结构进入到所述外管,所述被三维抗体网捕获的细胞随三维抗体网一起被所述多孔结构截留在所述内管。本发明还提供了利用细胞分离装置的细胞分离方法,包括S1、制备生物样本的单细胞悬液;S2、生物相容性高的高分子材料偶联抗体,制备三维抗体网溶液;S3、将制备的三维抗体网溶液和单细胞悬液先后加入到细胞分离装置的内管中,颠倒混匀,室温孵育;S4、离心处理,被三维抗体网捕获的细胞留在内管,未被三维抗体网捕获的单细胞进入到外管。
本发明与现有技术对比的有益效果包括:采用细胞分离装置进行细胞分离时,通过采用三维抗体网捕获细胞在提高对样本中稀有细胞捕获效率的基础上,实现了对表达某一特定抗原的细胞的高准确性捕获,有效的实现了细胞的分离,而且操作简单,只需要一次离心就可以实现细胞的快速分选,大大节约了分选的时间,降低了分选实验的难度;另外三维抗体网由生物相容性高的高分子材料和抗体构成,对细胞无毒无损伤,获得的细胞可用于后面的检测或实验。
附图说明
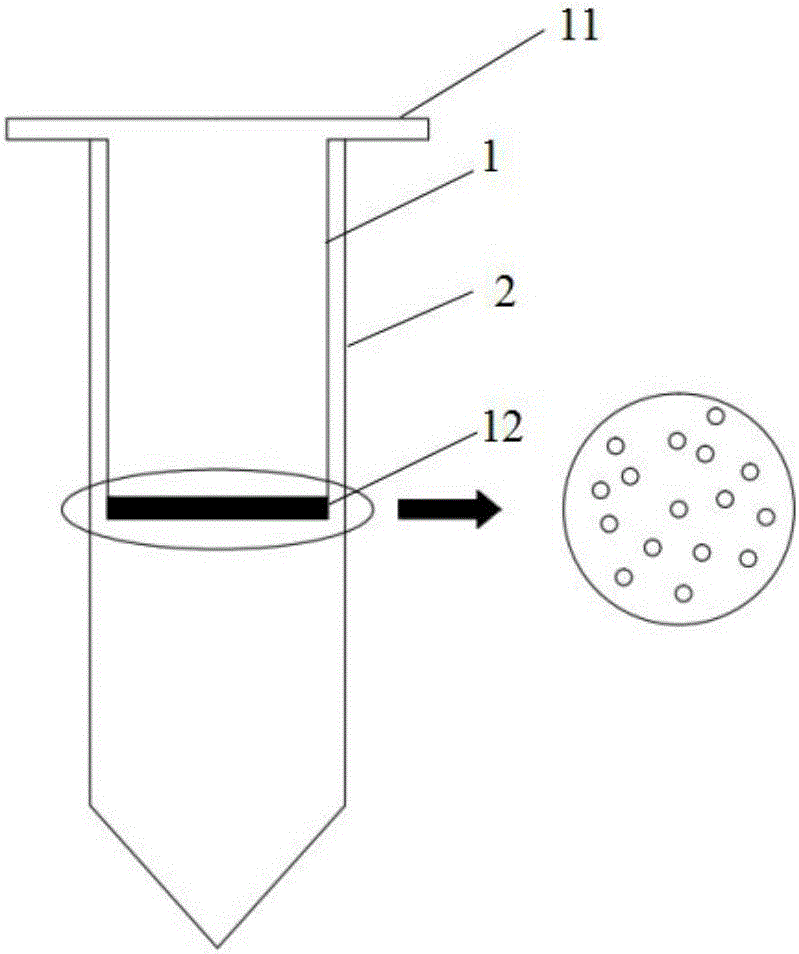
图1是本发明高效细胞分离装置示意图。
图2是本发明应用流式细胞术分析样本中CD3+T淋巴细胞比例图。左图为分离前样本中CD3+T淋巴细胞的比例,右图为分离后样本中CD3+T淋巴细胞的比例。
图3是本发明应用流式细胞术分析样本中CD45+细胞比例图。左图为分离前样本中CD45+细胞的比例,右图为分离后样本中CD45+细胞的比例。
具体实施方式
下面对照附图并结合优选的实施方式对本发明作进一步说明。
本发明提供了一种细胞分离装置,如图1所示,包括内管1和外管2,所述内管1的开口端设有向外延伸的凸缘11以让所述内管1套设在所述外管2的开口端,所述内管的底部与所述外管的底部之间设有预设距离,用于容纳进入到所述外管中的未被三维抗体网捕获的单细胞,所述内管1的底部12为多孔结构,用于分离所述未被三维抗体网捕获的单细胞和被三维抗体网捕获的细胞;所述未被三维抗体网捕获的单细胞可通过所述多孔结构进入到所述外管,所述被三维抗体网捕获的细胞随三维抗体网一起被所述多孔结构截留在所述内管。
在本具体实施方式中,所述的三维抗体网由生物相容性高的高分子材料分散在水中形成的三维立体网状结构和偶联到所述三维立体网状结构的抗体组成。优选地,所述生物相容性高的高分子材料包括改性胶原、改性聚糖或小分子高聚物。
需要说明的是,所述生物相容性高的高分子材料是一种三维培养基质,可以分散在水溶液中形成三维立体网结构,该网状结构不改变液体的流动性。
在本具体实施方式中,所述偶联方式包括物理吸附或共价结合,所述三维立体网状结构的孔径为30-1000μm。优选地,所述三维立体网状结构的孔径为50-500μm。更优选地,所述三维立体网状结构的孔径为100-300μm。
在本具体实施方式中,所述多孔结构的孔径为20-100μm。优选地,所述多孔结构的孔径为30-70μm。
在本具体实施方式中,所述多孔结构包括筛网或筛板。
同时本发明提供了一种利用细胞分离装置的细胞分离方法,包括以下步骤:
S1、制备生物样本的单细胞悬液;
S2、生物相容性高的高分子材料偶联抗体,制备三维抗体网溶液;
S3、将制备的三维抗体网溶液和单细胞悬液先后加入到细胞分离装置的内管中,颠倒混匀,室温孵育;
S4、离心处理,被三维抗体网捕获的细胞留在内管中,未被三维抗体网捕获的单细胞进入到了外管中。
在本具体实施方式中,在步骤S3中所述室温孵育的时间为20-60min;在步骤S4中所述离心处理的离心力为250-800g,所述离心处理的离心时间为10-30min。
需要说明的是,当样本加入到三维抗体网中,特定类型的细胞会被三维抗体网上的抗体捕获,捕获后的细胞与抗体网形成较大的交联结构,离心时无法通过多孔结构而被截留,在多孔结构的上层即可收获到特定类型的细胞。
本发明还提供了一种细胞分离方法在外周血单个核细胞中T淋巴细胞的富集、外周血单个核细胞中CD45+细胞的去除、或全血中循环肿瘤细胞的富集的应用。
实施例1
外周血单个核细胞中T淋巴细胞(CD3+T)细胞的富集,包括以下步骤:
a、密度梯度离心法分离50ml全血中的外周血单个核细胞(PBMCs),用磷酸盐缓冲溶液(PBS)将细胞密度调整到1×107个/ml,制成PBMCs的单细胞悬液;
b、将固化了CD3单克隆抗体(anti-CD3mAb)的FP001(一种改性聚糖,购买于Nissan Chemical Industries,LTD,货号:385-07981)和PBS溶液按1:5的比例加入到50ml锥形离心管中,轻轻颠倒混合均匀,制备20ml固化了的anti-CD3mAb三维抗体网溶液;
c、将三维抗体网溶液加入到细胞分离装置的内管中,同时将分离获得的PBMCs加入到内管中,轻轻颠倒混合均匀,室温孵育20min;
d、在500g的离心力下离心10min,加入5ml PBS溶液将筛网截留的三维抗体网和细胞转移到另一只锥形离心管中;
e、加入3倍以上体积的PBS溶液稀释收获的上清液,在800g离心力下离心10min,收集细胞沉淀即为富集到的CD3+T细胞;
f、流式细胞术分析所富集的CD3+T淋巴细胞的纯度,从图2可知,平均纯度为92±3%。
实施例2
外周血单个核细胞中CD45+细胞的去除,包括以下步骤:
a、密度梯度离心法分离30ml全血中的外周血单个核细胞,用PBS溶液将细胞密度调整到1×107个/ml;
b、将固化了CD45单克隆抗体的FP001和PBS溶液按1:6的比例加入到50ml锥形离心管中,轻轻颠倒混合均匀,制备15ml anti-CD45mAb三维抗体网溶液;
c、将三维抗体网溶液加入到细胞分离装置的内管中,同时将分离获得的PBMCs加入到内管中,轻轻颠倒混合均匀,室温孵育20min;
d、在500g离心力下离心10min,收集外管中的细胞沉淀即为去除CD45+细胞后的PBMCs;
e、流式细胞术分析CD45+细胞去除率,从图3可知,去除率为84±3%。实施例3
全血中循环肿瘤细胞的富集,包括以下步骤:
a、肝素抗凝抽取肿瘤患者外周血10ml;
b、将固化了上皮细胞粘附分子单克隆抗体(anti-EpCAM mAb)的FP001和PBS溶液按1:4的比例加入到50ml锥形离心管中,轻轻颠倒混合均匀,制备30ml固化anti-EpCAM mAb三维抗体网溶液;
c、将三维抗体网溶液加入到细胞分离装置的内管中,同时将分离获得的PBMCs加入到内管中,轻轻颠倒混合均匀,室温孵育20min;
d、在离心力为500g下离心10min,加入5ml PBS于内管将筛网截留的三维抗体网和细胞转移到另一只锥形离心管中;
e、加入3倍以上体积的PBS溶液稀释收获的上清,在800g离心力下离心10min,收集细胞沉淀即为富集到的EpCAM阳性的循环肿瘤细胞。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的技术人员来说,在不脱离本发明构思的前提下,还可以做出若干等同替代或明显变型,而且性能或用途相同,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!