可检测与区分羊巴贝斯虫未定种新疆株的引物对与试剂盒的制作方法
本发明涉及一种用于快速检测与区分动物血液原虫病的试剂盒。确切讲本发明涉及一种不仅能用于检测,而且能准确区分我国分布的两种感染羊的巴贝斯虫,即莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的引物对及检测试剂盒。
背景技术:
羊的巴贝斯虫病是一种经蜱传播的血液原虫病,由绵羊巴贝斯虫、莫氏巴贝斯、粗糙巴贝斯虫和羊巴贝斯虫未定种等引起,使感染动物出现发热、黄疸、贫血、血红蛋白尿、甚至死亡。该病在热带、亚热带、温带均有流行,给世界畜牧业造成严重的危害。其中绵羊巴贝斯虫(Babesia. ovis)与莫氏巴贝斯虫(B. motasi)是引起羊巴贝斯虫病的主要病原;绵羊巴贝斯虫虫体小,对小反刍动物致病力高,传播媒介是囊形扇头蜱(Uilenberg et al., 1980)。莫氏巴贝斯虫虫体较大,刻点血蜱为其传播媒介(Alani and Herbert, 1988; Uilenberg et al.,1980)。粗糙巴贝斯虫(B. crass)是一种大型的非致病性的巴贝斯虫,与莫氏巴贝斯虫和绵羊巴贝斯虫在形态、血清学、分子进化方面有很大差异(Hashemi-Fesharki and Uilenberg, 1981; Schnittger et al., 2003)。
在我国,羊的巴贝斯虫病最早在1982 年 和1986年由陈德明和赵锡荣等分别在四川和黑龙江省发现并报道,当时并未引起兽医防治部门的重视。自1997年以来,笔者所在实验室,即中国农业科学院兰州兽医研究所寄生虫与虫媒病团队先后对我国部分省区羊的巴贝斯虫病进行了选点调查,采用血液接种和蜱传播试验的方法先后自辽宁、 河北、 甘肃和新疆等省份分离获得了羊的巴贝斯虫不同地方株,并发现这些地区该病流行比较严重,病原对外地引进良种羊致病性较强,严重制约了羊的品种改良。依据真核生物核糖体 18S rRNA 和 ITS 基因的特点,设计合适的引物,对这些地方分离株进行测序分析,序列比对结果显示:这些感染羊的巴贝斯虫可分为两组;一组为莫氏巴贝斯虫(包括莫氏巴贝斯虫临潭株、莫氏巴贝斯虫宁县株、莫氏巴贝斯虫天祝株、莫氏巴贝斯虫麻当株和莫氏巴贝斯虫河北株),另一组为羊巴贝斯虫未定种新疆株(Guan et al., 2009; Liu et al., 2007b; Niu et al., 2009a)。另外,经传播实验证实,莫氏巴贝斯虫宁县株和临潭株的传播媒介为青海血蜱和长角血蜱(Bai et al., 2002; Guan et al., 2010c);羊巴贝斯虫未定种新疆株的传播媒介为小亚璃眼蜱。这三种蜱在我国广范分布(Chen et al.,2010; Yin and Luo,2007; 陈泽等,2008; 邓国藩, 1960);同时,还建立了各种分子生物学和血清学检测技术,通过流行病学调查显示,在中国,羊巴贝斯虫病的感染率为11.2%~31.7%,在甘肃甘南牧区高达82.38%(Guan et al, 2012)。且我国分离的感染羊的巴贝斯虫,即莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株在流行区内常呈混合感染或隐性感染状态,不同病原之间的鉴别诊断一直是困扰该病流行病学调查的技术瓶颈。
目前常用的诊断该病的方法为血涂片染色法,但在感染率很低或在感染早期时很难在显微镜下检查出病原,而且操作熟练程度将直接影响诊断结果的准确性。还有很多血清学方法,但都存在一定的假阳性或假阴性以及交叉反应。分子生物学诊断方法有套式PCR检测方法, LAMP检测方法(Guan et al., 2010e;Guan et al, 2012),但套式PCR检测过程中容易造成环境污染,LAMP检测过程中容易出现假阳性。
技术实现要素:
本发明提供一种可克服现有技术的不足,能快速、特异、灵敏的检测绵羊、山羊和自然媒介蜱体内羊巴贝斯虫感染,而且能准确区分我国分布的两种感染羊的巴贝斯虫,即莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的引物对及试剂盒。
本发明的可用于检测羊莫氏巴贝斯虫的引物对基因序列为:SEQ ID No.1和SEQ ID No.2。本发明的可用于检测羊巴贝斯虫未定种新疆株的引物对基因序列为:SEQ ID No.4和SEQ ID No.5。
本发明的可检测与区分羊莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的试剂盒内包括有:a)用于检测羊莫氏巴贝斯虫的引物对SEQ ID No.1和SEQ ID No.2,b) 可用于检测羊巴贝斯虫未定种新疆株的引物对SEQ ID No.4和SEQ ID No.5,c)荧光探针序列Motasi-Prob和d)荧光探针序列OBXJ-Prob,其中荧光探针SEQ№3和SEQ№6的5端结合有荧光发光基团FAM,3端结合有荧光猝灭基团BHQ1。
为方便使用,本发明的可检测与区分羊莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的试剂盒中还可有特异性检测羊莫氏巴贝斯虫的标准阳性质粒模板pGEM-Teasy-18S rRNABLT,特异性检测羊巴贝斯虫未定种新疆株的标准阳性质粒模板pGEM-Teasy-18S rRNABXJ,适用于两种检测方法的公用试剂荧光定量PCR反应液及阴性质控标准品。
在本发明应用时的扩增条件是:扩增羊莫氏巴贝斯虫的反应条件为:95℃预变性30s,然后95℃ 5s、56℃ 10s、72℃ 30s,45个循环;扩增羊巴贝斯虫未定种新疆株的反应条件为95℃预变性30s,然后95℃ 5s、61℃ 10s、72℃ 30s,45个循环。
本发明实际上是一种利用核糖体18S rRNA基因检测与区分绵羊、山羊和自然媒介蜱体内羊巴贝斯虫的实时荧光定量PCR方法。实时荧光定量PCR( real- time fluorescent quantitative polymerasechain reaction,real-time FQ-PCR)技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR技术相比,它具有的特异性强、灵敏度高、重复性好、定量准确、自动化程度高、速度快和全封闭反应等优点,使其很快成为科研、临床诊断的热点技术。目前,国内尚无检测与区分两种感染羊的巴贝斯虫,即莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的实时荧光定量PCR方法的报道。由于自然界中媒介蜱与宿主的关系非常复杂,且每种病原都能独立的引起疾病,其混合感染和隐性感染的现象比较多。对流行区内放牧羊群和自然界存在媒介蜱感染状况进行调查过程中,如何提高检测的快速性与敏感性和对不同病原进行鉴别诊断是巴贝斯虫流行病学研究的弱点问题。
本发明利用梨形虫(巴贝斯虫和泰勒虫)常用来做为鉴别诊断的靶标基因核糖体18S rRNA基因,该基因在梨形虫中高度保守,但在不同虫种之间存在可变区,本发明准确利用该基因的这一特点,将作为实时荧光定量PCR检测的靶标基因,分别设计针对莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的特异性引物和探针,两对引物和探针不但能特异性的检测感染羊的莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株;而且能准确区分这两种巴贝斯虫,可作为鉴别诊断莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的方法。且特异性较好,未能检测到感染羊的其它相关病原,最主要是这两种巴贝斯虫之间没有交叉反应,检测结果良好。从而提供了一种快速、灵敏、准确又操作方便的检测与区分我国感染羊的两种巴贝斯虫的鉴别诊断方法,填补了技术空白。本发明中,所用的检测莫氏巴贝斯虫的特异性引物和探针虽然是通过莫氏巴贝斯虫临潭株的18S rRNA基因设计的,但该引物和探针也适用于其它几株莫氏巴贝斯虫(如莫氏巴贝斯虫宁县株、莫氏巴贝斯虫天祝株和莫氏巴贝斯虫河北株),检测羊巴贝斯虫未定种新疆株的特异性引物和探针是通过羊巴贝斯虫未定种新疆株的18S rRNA基因设计的,它只能特异性的检测到羊巴贝斯虫未定种新疆株,而无法检测到其它几株莫氏巴贝斯虫。通过对实时荧光定量PCR反应条件的优化,使本发明具有良好的特异性、敏感性和重复性,可用于检测与区分绵羊、山羊和自然媒介蜱体内两种感染羊的巴贝斯虫—莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株。
本发明采用荧光定量PCR诊断技术,因其具有灵敏度高、速度快、特异性强等优点在病原体的定性和定量检测方面有独特的优势,且使用本发明的试剂盒时是在封闭体系中进行扩增和实时检测,因此可以避免环境污染,缩短检测时间,尤其适用于急性及亚临床感染的大批量样品的检测与诊断。
附图说明
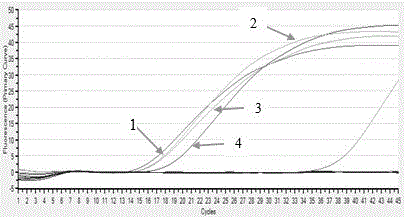
图1 莫氏巴贝斯虫实时荧光定量PCR特异性扩增曲线。
图2 莫氏巴贝斯虫实时荧光定量PCR敏感性扩增曲线。
图3 莫氏巴贝斯虫实时荧光定量PCR敏感性检测的标准曲线。
图4 羊巴贝斯虫未定种新疆株实时荧光定量PCR特异性扩增曲线。
图5羊巴贝斯虫未定种新疆株实时荧光定量PCR敏感性扩增曲线。
图6羊巴贝斯虫未定种新疆株实时荧光定量PCR敏感性检测的标准曲线。
具体实施方式
本发明的试剂盒中最主要的是检测莫氏巴贝斯虫的如下两条引物和一条探针序列,即SEQ ID No.1Motasi-S(正向引物):5’-ACCTCTGAACGTAACAAAC-3’;SEQ ID No.2 Motasi-AS(反向引物):5’-CACGGAGCAACAGTAGAA-3’;SEQ ID No.3 Motasi-Prob(荧光探针): 5’(FAM)-CTACAGCACACGCTCCAACG-(BHQ1)3’。检测羊巴贝斯虫未定种新疆株的如下两条引物和一条探针序列,即SEQ ID No.4 OBXJ-S(正向引物):5’-AGACCTCTGAACGTAACC-3’;SEQ ID No.5OBXJ-AS(反向引物):5’-GCTGATAATTAATGCCACATAC-3’;SEQ ID No.6 OBXJ-Prob(荧光探针):5’(FAM)-CACACCGCCTCTGCTCGCAT-(BHQ1)3’。其中的荧光探针SEQ ID No.3和SEQ ID No.6的5端结合有荧光发光基团FAM, 3端结合有荧光猝灭基团BHQ1。其扩增的目的片段大小分别是莫氏巴贝斯虫为159bp,而羊巴贝斯虫未定种新疆株171bp,上述引物和探针均由大连宝生物工程有限公司合成。在具体应用时应有如下三部分:1)特异性检测莫氏巴贝斯虫的标准阳性质粒模板pGEM-Teasy-18S rRNABLT、正向引物SEQ№1和反向引物SEQ№2(10μΜ)各0.5μL,荧光探针SEQ№3(5μM)1.0μL;2)特异性检测巴贝斯虫未定种新疆株的标准阳性质粒模板pGEM-Teasy-18S rRNABXJ、正向引物SEQ№4和反向引物SEQ№5(10μΜ)各0.5μL,荧光探针SEQ№6(5μM)1.0μL;3)适用于两种检测方法的公用试剂荧光定量PCR反应液、阴性质控标准品。其中的荧光定量PCR反应液由Premix Ex TaqTM(2×)12.5μL,ROX Reference Dye Ⅱ(50×)0.5μL,灭菌蒸馏水8.0μL组成。
本发明的试剂盒应用实例
1.构建重组质粒标准品。
(1)根据感染羊的莫氏巴贝斯虫临潭株核糖体18S rRNA基因序列,使用Primer premier 5.0和Oligo 7设计引物,预获得的目的片段大小分别是莫氏巴贝斯虫临潭株661bp和羊巴贝斯虫未定种新疆株678bp,由宝生物生物工程(大连)有限公司合成。引物对序列为:SEQ ID No.7 BLTC-S(正向引物):5’-AGAAACGGCTACCACATC-3’,SEQ ID No.8 BLTC-AS(反向引物): 5-CTTGCGACCATACTCCC-3’。
(2)以实验室保存的莫氏巴贝斯虫临潭株和羊巴贝斯虫未定种新疆株的DNA为模板进行扩增,采用50μL的PCR反应体系,反应条件为94℃预变性4min,然后94℃1min、56℃1min、72℃1min,30个循环,72℃延伸7min。取5μL扩增产物用琼脂糖凝胶电泳鉴定。鉴定为阳性的PCR产物用琼脂糖凝胶回收纯化试剂盒(TaKaRa,大连)进行纯化回收,将回收产物连接到pGEM-Teasy载体(Promega,America)后转化到大肠杆菌感受态细胞JM-109(TaKaRa,大连)中,进行蓝白斑筛选,挑取阳性克隆(白班)进行PCR和测序鉴定。
(3)对鉴定为阳性的克隆提取质粒,使用NanoDrop 2000/2000C(Thermo Scientific,America)超微量分光光度计测定质粒浓度,并将其换算成拷贝/μL,以此作为质粒标准品。将构建好的质粒标准品,系列稀释为终浓度为1.0×109 -1.0×100 拷贝/μL,以便进行实时荧光定量PCR扩增。
2.实时荧光定量PCR方法
(1)反应性分析
1)莫氏巴贝斯虫:定量PCR反应体系为25μL:Premix Ex TaqTM(2×)12.5μL ,正向引物SEQ№1和反向引物SEQ№2(10μΜ)各0.5μL,荧光探针SEQ№3(5μM)1.0μL,ROX Reference Dye Ⅱ(50×)0.5μL,基因组DNA模板2μL,灭菌蒸馏水8.0μL。反应条件为:95℃预变性30s,然后95℃ 5s、56℃ 10s、72℃ 30s,45个循环。
2)羊巴贝斯虫未定种新疆株:定量PCR反应体系为25μL:Premix Ex TaqTM(2×)12.5μL ,正向引物SEQ№4和反向引物SEQ№5(10μΜ)各0.5μL,荧光探针SEQ№6(5μM)1.0μL,ROX Reference Dye Ⅱ(50×)0.5μL,基因组DNA模板2μL,灭菌蒸馏水8.0μL。反应条件为:95℃预变性30s,然后95℃ 5s、61℃ 10s、72℃ 30s,45个循环。在1)与2)的反应体系当中,在每一个循环的延伸温度结束时设定荧光信号采集点进行实时检测,每个模板浓度做3个重复,取平均值计算变异系数,实验均设阴性对照。其结果显示:模板量与对应的Ct值呈线性相关,扩怎曲线呈S型。
(2)特异性分析
1)莫氏巴贝斯虫:利用上述所建立的实时荧光定量PCR方法,每个样品重复两次分别检测感染羊的莫氏巴贝斯虫临潭株、莫氏巴贝斯虫宁县株、莫氏巴贝斯虫天祝株和莫氏巴贝斯虫河北株;同时设羊巴贝斯虫未定种新疆株、羊的吕氏泰勒虫、尤氏泰勒虫、绵羊泰勒虫、绵羊无浆体、干净羊基因组和灭菌水为阴性对照。结果显示:只有1-莫氏巴贝斯虫临潭株、2-莫氏巴贝斯虫天祝株、3-莫氏巴贝斯虫宁县株和4-莫氏巴贝斯虫河北株呈阳性反应,而羊巴贝斯虫未定种新疆株、羊的其它相关病原和水均呈阴性(图1)。
2)羊巴贝斯虫未定种新疆株:利用上述所建立的实时荧光定量PCR方法,每个样品重复两次检测羊巴贝斯虫未定种新疆株,同时设莫氏巴贝斯虫临潭株、莫氏巴贝斯虫宁县株、莫氏巴贝斯虫天祝株和莫氏巴贝斯虫河北株;羊的吕氏泰勒虫、尤氏泰勒虫、绵羊泰勒虫、绵羊无浆体、干净羊基因组和灭菌水为阴性对照。结果显示:只有羊巴贝斯虫未定种新疆株呈阳性反应,而莫氏巴贝斯虫临潭株、莫氏巴贝斯虫天祝株、莫氏巴贝斯虫宁县株、莫氏巴贝斯虫河北株和羊的其它相关病原和水均呈阴性(图4)。
(3)敏感性分析
取不同稀释浓度1.0×109-1.0×100拷贝/μL的质粒标准品pGEM-Teasy-18S rRNABLT和pGEM-Teasy-18S rRNABXJ分别进行莫氏巴贝斯虫和羊巴贝斯虫未定种新疆株的灵敏度试验。结果显示:莫氏巴贝斯虫实时荧光定量PCR方法最低检出限为101拷贝/μL(图2、3);而羊巴贝斯虫未定种新疆株的实时荧光定量PCR方法最低检出限为106拷贝/μL(图5、6),与此同时,在两种检测方法中,每个浓度进行三个平行样品,且每个浓度平行样品之间的Ct值差异甚小。
(4)稳定性与重复性分析
就不同的检测方法而言,进行分析时所选浓度亦不同;对莫氏巴贝斯虫,取浓度为1.0×108 -1.0×103 拷贝/μL的6个浓度的标准品进行稳定性分析;对羊巴贝斯虫未定种新疆株,取浓度为1.0×109 -1.0×107 拷贝/μL的3个浓度的标准品进行稳定性分析。两种方法均先进行批内重复性试验,对同一批次稀释的标准品,每个浓度重复检测四次,分析Ct值的变异系数。然后再进行批间重复性试验,对3个不同批次的稀释的标准品进行检测,经分析Ct值变异系数来判定其稳定性。反复重复这两个实验三次,获得的数据差异无显著意义,说明其不同批次之间的检测结果具有其可比性,具有良好的重复性。
<110> 中国农业科学院兰州兽医研究所
<120> 可检测与区分不同种羊巴贝斯虫的引物对与试剂盒
<160> 8
<210> 1
<211> 19
<212> DNA
<213> 人工序列(正向引物 Motasi-S)
<400>
acctctgaac gtaacaaac 19
<210> 2
<211> 18
<212> DNA
<213> 人工序列(反向引物 Motasi-AS)
<400>
cacggagcaa cagtagaa 18
<210> 3
<211> 20
<212> DNA
<213> 人工序列(荧光探针Motasi-Prob)
<400>
ctacagcaca cgctccaacg 20
<210> 4
<211> 18
<212> DNA
<213> 人工序列(正向引物 OBXJ-S)
<400>
agacctctga acgtaacc 18
<210> 5
<211> 22
<212> DNA
<213> 人工序列(反向引物 OBXJ-AS)
<400>
gctgataatt aatgccacat ac 22
<210> 6
<211> 20
<212> DNA
<213> 人工序列(荧光探针 OBXJ-Prob)
<400>
cacaccgcct ctgctcgcat 20
<210> 7
<211> 18
<212> DNA
<213> 人工序列(正向引物 BLTC-S)
<400>
agaaacggct accacatc 18
<210> 8
<211> 17
<212> DNA
<213> 人工序列(反向引物 BLTC-AS)
<400>
cttgcgacca tactccc 17
- 还没有人留言评论。精彩留言会获得点赞!