一组广谱高效的抗菌肽及其应用的制作方法
本发明涉及抗菌肽,特别是能抑制和杀灭细菌的抗菌肽,具体是一组能抑制和杀灭多种耐药性细菌广谱高效的抗菌肽及其应用。
背景技术:
:抗生素滥用导致病原微生物产生高水平抗药性和多药物抗性(multidrugresistance,MDR)已经成为世界性的难题。近几年来,具有MDR的“超级病菌”在世界各地相继爆发,严重威胁着人类的生命和健康安全。大量研究表明,致病菌通过基因的水平转移等机制可获得MDR,并抵抗多种临床一线使用的抗生素。为了应对来自“超级耐药细菌”日益严峻的挑战,人们除了对现有抗生素进行修饰改良和发掘新型抗生素外,更寄希望于挖掘抗生素的替代物以缓解“超级耐药细菌”所造成的世界卫生安全危机。技术实现要素:本发明的目的是提供一组广谱高效的抗菌肽,以解决上述
背景技术:
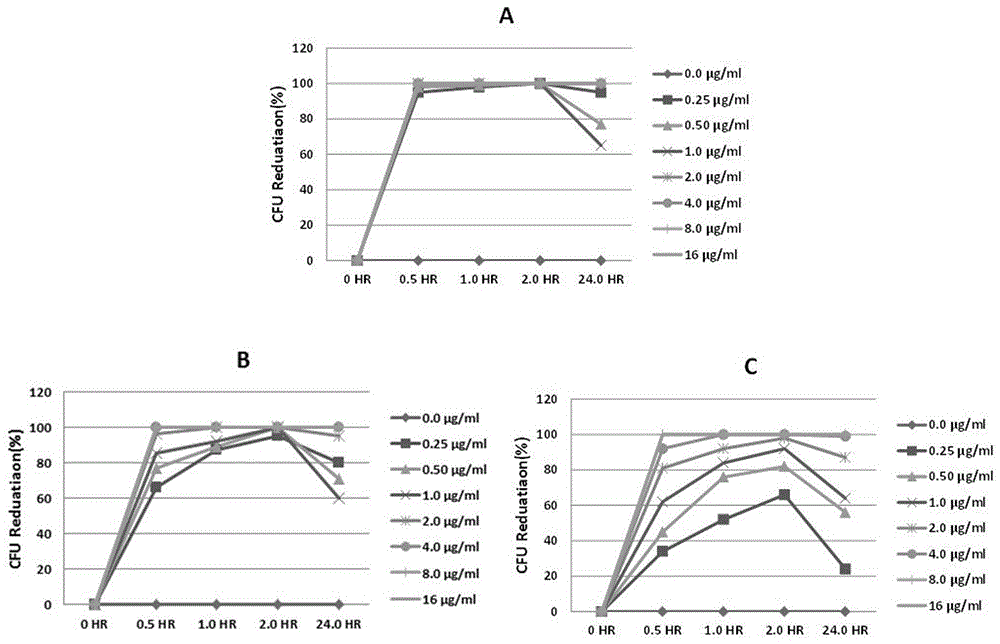
中存在的问题。本发明提供的一组广谱高效的抗菌肽,特别是能抑制和杀灭细菌的广谱高效抗菌肽,具体是一组能抑制和杀灭多种耐药性细菌的广谱高效的抗菌肽,更具体的是一组能抑制和杀灭以耐甲氧西林金黄色葡萄球菌、李斯特菌为代表的革兰氏阳性菌,或以大肠杆菌为代表的革兰氏阴性菌的抗菌肽。本发明提供的一组广谱高效的抗菌肽,其氨基酸序列如SEQIDNO.1-5所示。上述SEQIDNO.1-5所对应的被命名的编码为XC-16A、XC-17、XH-14B、XH-12A或XH-14C,其序列如下:XC-16A:Lys-Leu-Leu-Asp-Ile-Val-Lys-Lys-Arg-Val-Arg-Ala-Phe-Trp-Ser-Leu(SEQIDNO.1)XC-17:Lys-Trp-Lys-Leu-Phe-Lys-Arg-Lys-Ile-Lys-Phe-Leu-His-Ser-Ala-Lys-Lys(SEQIDNO.2);XH-14B:Phe-Ile-Lys-Arg-Ile-Ala-Arg-Leu-Leu-Arg-Lys-Ile-Lys-Arg(SEQIDNO.3);XH-12A:Phe-Phe-Arg-Lys-Val-Leu-Lys-Leu-Ile-Arg-Lys-Ile(SEQUDNO.4)XH-14C:Phe-Ile-Lys-Arg-Ile-Ala-Arg-Leu-Leu-Arg-Lys-Ile-Trp-Arg(SEQIDNO.5)。上述抗菌肽的制备方法,采用现有的固相化学合成法中的BOC法制备。具体包括:一、树脂合成1)PeptideacidMerrifieldResinandPAMResin2)PeptidecarboxamideMBHAResin二、肽链合成1)氨基酸的偶联;2)N-端Boc基团的切除;在HF切割以前须将N-端Boc保护基团用TFA除去。手工切割N-端Boc基团方法是用TFA/DCM比为1:1的溶液在室温条件下洗涤反应15min。三、切割1)切割前的树脂准备:所有树脂在切割前必须完全的洗净和干燥。特殊情况处理:A)His的Dnp保护基团的切割:用最小体积的DMF溶胀树脂;用20mol的苯硫酚处理1-2h;将树脂转移到黏结玻璃漏斗中,在用HF液体或TFMSA处理前以DMF,甲醇和冷乙醚频繁冲洗。B)含Trp的多肽树脂的脱甲酰基:以体积比为1:10哌啶/DMF液放入圆底烧瓶中,并在冰浴中冷却;加入多肽树脂(1g/10mL),在0℃下搅拌反应2h;用DMF(5倍体积)洗两次,DCM两次,MeOH两次;用HF切割前高真空干燥上述所得树脂至少4h。2)HF切割标准HF切割法(0.2mmol)A)将多肽树脂,聚四氟乙烯管和净化剂混合物加入反应容器中。含Cys的多肽用HF/苯甲醚/DMS/p-苯甲硫酚(10:1:1:0.2),而不含Cys的用HF/DMS/苯甲醚(10:1:1)。B)将盖子旋紧,切割前在冰的纯甲醇中冷却至少5min。C)在参照生产商的说明下蒸馏10mL的HF到瓶中。因为含Arg(Tos)的多肽切割会持续2h以上。D)反应最后,通过氮气流蒸发HF和DMS。E)用TFA从树脂上吸取出切除下的多肽。F)负压下过滤移走树脂,用TFA洗树脂两次。过滤筛选,加入8-10倍的冷乙醚。有时需要蒸发大多数TFA以得到粗品的沉淀物。3)切割后期处理:A)沉淀,在真空下在Hirsch漏斗中用硬滤纸过滤沉淀的肽。用冷醚冲洗沉淀物,在合适的缓冲溶液中溶解,然后冻干。B)离心,加入少量体积的叔丁甲醚在残留物中,研磨,直到得到悬浮物,将悬浮物转移到一个干净的离心管中,密闭离心,自动离心机在这过程中是必须的。然后将醚从管中小心的倒出,并用醚重复洗涤,在合适的缓冲溶液里溶解残留物,然后冻干。C)水溶性肽,沉淀后,加水到残留物中,然后把混合物转移到分液漏斗中,可以加入少量乙醇助溶。D)充分摇晃堵塞的漏斗,分散混合物,静止分离,分离下层液(水)。E)加少量水到漏斗中,重复上述的摇晃-静止-分离三次,移去上层液,然后放置于干净的烧瓶中,将混合液转移到分液漏斗中。F)加少量的新配二乙基醚,重复上述的摇晃-静止-分离二到三次,每次都把醚层移去,把水层放到分液漏斗中,收集水层到干净的烧瓶,冻干。本发明的第二个目的是提供包括上述所定义的抗菌肽的组合物。所述组合物包含一种或者一种以上本发明上述所定义的抗菌肽,以及为实现组合物的功能和作用而添加的非抗菌肽的成份。上述组合物可以根据本领域的已知方法制备。本发明的第三个目的是提供上述抗菌肽及其组合物的用途。所述用途是:在制备治疗以耐甲氧西林金黄色葡萄球菌、李斯特菌为革兰氏阴性菌,或以大肠杆菌为代表的革兰氏阴性菌感染药物中的应用;进一步是在制备治疗或预防兽用或人用的药物中的应用,用以杀灭和抑制耐甲氧西林金黄色葡萄球菌、李斯特菌、大肠杆菌。所述的药物,包含上述抗菌肽中的一种或一种以上,并混合有一种或一种以上医药上可接受的载体或添加剂,如为了增加分散能力的表面活性剂等。所述用途还涉及在制备畜禽用的饲料和/或饲料添加剂方面的应用。本发明的抗菌肽及其组合物在上述的应用中的剂量和使用条件,可以根据本领域已知的方法来确定。本发明经实验表明,用于抑制和杀灭以耐甲氧西林金黄色葡萄球菌、李斯特菌为代表的革兰氏阳性菌或以大肠杆菌为代表的革兰氏阴性菌有显著的效果。附图说明图1是抗菌肽XC-16A杀灭耐甲氧西林金黄色葡萄球菌(A)、李斯特菌(B)、大肠杆菌(C)的效果图;图2是抗菌肽XC-17杀灭耐甲氧西林金黄色葡萄球菌(A)、李斯特菌(B)、大肠杆菌(C)的效果图;图3是抗菌肽XH-14B杀灭耐甲氧西林金黄色葡萄球菌(A)、李斯特菌(B)、大肠杆菌(C)的效果图;图4是抗菌肽XH-12A杀灭耐甲氧西林金黄色葡萄球菌(A)、李斯特菌(B)、大肠杆菌(C)的效果图;图5是抗菌肽XH-14C杀灭耐甲氧西林金黄色葡萄球菌(A)、李斯特菌(B)、大肠杆菌(D)的效果图;具体实施方式:实施例1最小抑菌浓度(MIC)评估,采用微量肉汤稀释法。A、抗菌药物和培养基制备抗菌药物和培养基制备,同常量肉汤稀释法。药敏试验用抗菌药物浓度范围:根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值。培养基:NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。需氧菌及兼性厌氧菌在此培养基中生长良好。接种物的制备,用接种环挑取形态相似待检菌落3~5个,接种于4~5mL的水解酪蛋白(MH)肉汤中,35℃孵育2~6h。增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/mL。B、MIC板制备MIC板制备:无菌操作,将倍比稀释后不同浓度的抗菌药物溶液分别加到灭菌的96孔聚苯乙烯板中,第1至第11孔加药液,每孔10WμL,第12孔不加药作为生长对照,冰冻干燥后密封,-20℃以下保存备用。C、接种物制备将用生长法或直接菌悬液法制备的浓度相当于0.5麦氏比浊标准的菌悬液,经MH肉汤1:1000稀释后,向每孔中加100μL,密封后置35℃普通空气孵箱中,孵育16~20h判断结果。此时,第1孔至第11孔药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125μg/mL。D、结果判断结果判断:以在小孔内完全抑制细菌生长的最低药物浓度为MIC。当阳性对照孔(即不含抗生素)内细菌明显生长试验才有意义。当在微量肉汤稀释法出现单一的跳孔时,应记录抑制细菌生长的最高药物浓度。结果见下表 耐甲氧西林金黄色葡萄球菌单核细胞增生李斯特菌大肠杆菌XC-16A16μg/ml16μg/ml64μg/mlXC-178μg/ml16μg/ml16μg/mlXH-14B32μg/ml16μg/ml32μg/mlXH-12A4μg/ml4μg/ml32μg/mlXH-14C16μg/ml8μg/ml32μg/ml本实验中使用:大肠杆菌(Escherich)ATCC25922、李斯特菌(Monocuteproliferation)ATCC19115。实施例2最低杀菌浓度测试(MBC)最低杀菌浓度测试(MBC)最小杀菌浓度(minimumbactericidalconcentration,MBC):杀死99.9%(降低3个数量级)的供试微生物所需的最低药物浓度。二倍稀释测最小杀菌浓度:就是将药物浓度依次减半(倍比稀释),比如在96孔板的某行/列做MBC,每个孔均加入10μL药液,第一个孔药液浓度是100μg/mL,第二个孔是50μg/mL,第三个25μg/mL……。操作起来就是比如第一个孔加20μL药液,从第一个孔吸取10μL药液到第二孔,加培养液10μL,混匀后,从中吸取10μL加进第三孔里,再加培养液10μL混匀……。最低至哪个浓度,已经没有活细菌了,该浓度即为MBC。结果见图1~5。其中,HR---小时,μg/ml---浓度,CFUreduction%---菌落减少百分比。本实验中使用:大肠杆菌(Escherich)ATCC25922、李斯特菌(Monocuteproliferation)ATCC19115。XC-16A:Lys-Leu-Leu-Asp-Ile-Val-Lys-Lys-Arg-Val-Arg-Ala-Phe-Trp-Ser-Leu(SEQIDNO.1)XC-17:Lys-Trp-Lys-Leu-Phe-Lys-Arg-Lys-Ile-Lys-Phe-Leu-His-Ser-Ala-Lys-Lys(SEQIDNO.2)XH-14B:Phe-Ile-Lys-Arg-Ile-Ala-Arg-Leu-Leu-Arg-Lys-Ile-Lys-Arg(SEQIDNO.3)XH-12A:Phe-Phe-Arg-Lys-Val-Leu-Lys-Leu-Ile-Arg-Lys-Ile(SEQUDNO.4)XH-14C:Phe-Ile-Lys-Arg-Ile-Ala-Arg-Leu-Leu-Arg-Lys-Ile-Trp-Arg(SEQIDNO.5)当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1