一种预防牛支原体疾病的特异性卵黄抗体及其制备方法与应用与流程
本发明属于家畜疾病预防与控制
技术领域:
,涉及制备牛支原体的灭活疫苗和一种预防牛支原体疾病的特异性卵黄抗体的制备方法及在预防奶牛感染牛支原体中的应用。
背景技术:
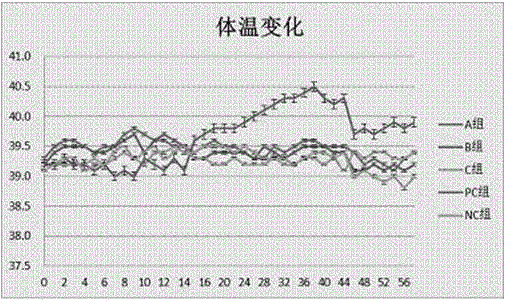
:牛支原体(Mycoplasmabovis)又被称为牛霉形体,是感染牛的一种重要的致病性支原体。主要引起牛呼吸系统疾病、乳腺炎、关节炎等多种疾病。该病分布广泛,遍布欧洲、美洲、大洋洲和亚洲等地区,使全世界养牛业蒙受了巨大的经济损失,其中尤以欧洲最为严重。在美国,牛支原体所造成的损失每年达1.4亿美元,单独由牛支原体引起的牛只生长缓慢所致的损失每年就高达3200万美元,单个牛场的牛支原体感染可高达70%。在欧洲,每年因牛病损失的5.79亿欧元中有1/3是由牛支原体引起的。在英国,约有190万头牛患有牛支原体肺炎,死亡可达15.7万头,经济损失超过5400万英镑,在这些呼吸道感染牛中,至少有1/4是由牛支原体引起的。自2008年以来,我国部分地区新从外地引进肉牛暴发了以坏死性肺炎为主要特征的“传染性牛支原体肺炎”疫情,发病率为50%~100%,病死率高达10%~50%,给我国养牛业造成了随巨大的经济损失。随着牛支原体感染范围的扩大和牛支原体引起疾病的发展及造成的经济损失巨大,这引起了人们的广泛关注,使如何有效防控牛支原体病逐渐成为养牛业研究关注的焦点。目前,牛支原体对世界的养牛业危害严重,药物治疗效果不明显,疫苗研制已成为开发重点。但是目前国内外缺乏安全有效的牛支原体疫苗,造成牛支原体疾病近几年不断的传播和蔓延,加之抗生素的滥用导致很多疾病对抗生素的耐药性增加,研制一种像益生菌、中草药一样的没有耐药性的治疗及预防的药物成了目前科学家研究的重点。因此,研发一种高效安全易于服用的抗体疫苗,是本病防治急需解决的问题然而随着卵黄抗体(IgY)的研究深入,国内外学者发现并报道了利用卵黄抗体可预防和治疗畜禽各种疾病,并取得了良好效果。卵黄抗体是鸡被外来抗原刺激后,所产生的特异性抗体聚集在卵黄内,通过相应技术对卵黄抗体进行提取,制成卵黄抗体制剂。卵黄抗体具有特异性,针对性,无耐药性,安全,制备简单,稳定性好,耐热、耐酸,耐碱,抗离子强度,并具有一定抗酶解能力,且无残留等优点,已成为了疫苗研究的热点。研究表明,IgY能够抵抗幼龄动物肠道中胰蛋白酶和胰凝乳蛋白酶的消化。家禽免疫系统的特性决定小剂量的抗原便可发挥作用,因此可以用少量抗原在较长时间获得大量高滴度特异性抗体。一个母鸡每年大约能产280枚鸡蛋,每个卵黄里面含有100~150mgIgY,因此每只鸡每年能够产生40g特异性卵黄抗体,具有很大的生产潜力。因此,与其他哺乳动物制备多克隆抗体相比,特异性IgY制备有着经济、易操作、产量大等优点。卵黄抗体与初乳中母源抗体的作用机理相似,都是以被动免疫的方式使幼畜获得免疫力,达到保护幼畜的目的。因此研制抗牛支原体病的卵黄抗体,用于牛支原体病的防制具有重要意义。技术实现要素:本发明目的在于研制一种特异性卵黄抗体,它能预防牛支原体对奶牛的感染。该抗体的制备具有成本低,产量高、特异性强、操作简单、对环境无污染等优点,是一种绿色的抗生素替代品。本发明通过以下技术方案实现:一种预防牛支原体的特异性卵黄抗体,是将灭活的牛支原体悬液与弗氏佐剂混合制成特异免疫原,用该免疫原免疫健康开产母鸡,并收集其产的鸡蛋,所述的鸡蛋蛋黄中含有预防奶牛牛支原体病的特异性卵黄抗体,其中所述的牛支原体菌株为NP2。制备预防奶牛牛支原体病的特异性卵黄抗体的方法,其中制备特异免疫源的方法采用改良的Thiaucourt,s液体培养基,首先复活牛支原体(NP2)菌株,然后传代培养3代达到菌浓度后扩大培养,再用0.4%甲醛灭活2~3h,离心制备成抗原悬液,然后与弗氏佐剂混合而成。所述的特异免疫原免疫健康产母鸡,分离所产鸡蛋的蛋黄,提取IgY,该鸡蛋的蛋黄中含有所述的能够预防奶牛牛支原体病的特异性卵黄抗体。所述的免疫产蛋母鸡的免疫步骤是:在健康开产蛋鸡的双翼、胸腹部和背部皮下及肌肉多位点注射500ul浓度为1mg/ml的用弗氏完全佐剂(FCA)混合的特异性免疫原,在基础免疫后的15、30、45d后,同样经鸡双翼、胸腹部和背部皮下及肌肉多位点先后注射500ul、750ul、1ml浓度为2.0mg/ml的用弗氏不完全佐剂(FIA)混合的特异性免疫原。一种预防牛支原体疾病的特异性卵黄抗体,它被全卵黄粉作为抗生素的替代品用于饲料,预防牛支原体病。本发明细节由下列步骤所示:一、牛支原体抗原的制备1.培养牛支原体,测定菌体浓度牛支原体(NP2)菌株来自宁夏大学农学院临床兽医实验室。菌株复活以后,按1%的接种量接种于改良的Thiaucourt,s液体培养基培养,于37℃震荡培养2~3d。传代培养至少传3代。期间每隔2~3d采用颜色变化单位法(CCU)测定菌体浓度,要求达到109ccu/ml以上。2.牛支原体抗原的制备将达到指定菌浓度的菌液按1%的比例扩大培养,37℃振荡培养4~5d,然后在菌液中加入终浓度为0.4%的甲醛,置于37℃的培养箱中灭活2~3d。收集灭活后的液体培养物,置于高速冷冻离心机离心,4℃、10000rpm/min离心30min,收集沉淀,沉淀用适量的PBS(磷酸盐缓冲液)重悬菌液,重复上述步骤3次。洗涤完成后用适量的PBS(磷酸盐缓冲液)悬浮为牛支原体抗原悬液。抗原悬浮液进行无菌检测,检测合格后-20℃保存备用。3.牛支原体灭活疫苗的制备将制备好的牛支原体抗原逐滴加入等体积的弗氏佐剂(弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司),边加边振荡使其充分混匀,完全乳化,制成油包水型油乳疫苗。疫苗抗原的最终浓度:弗氏完全佐剂混合的疫苗为1.0mg/ml,弗氏不完全佐剂混合的疫苗为2.0mg/ml。二、卵黄抗体的制备1.实验动物和免疫免疫方式均为产蛋鸡双翼、胸腹部和背部皮下及肌肉多位点注射,共免疫四次。基础免疫一次、加强免疫(二免、三免、四免)三次,间隔时间均为两周。基础免疫接种500ul浓度为1.0mg/ml的弗氏完全佐剂(FCA)混合的特异性免疫原,加强免疫(二免、三免、四免)分别接种500ul、750ul、1ml浓度为2.0mg/ml的弗氏不完全佐剂(FIA)混合的特异性免疫原。2.母鸡抗体水平的监测首次免疫前一周开始每隔7天鸡翅下静脉采血液2ml,分离血清并做好标记,然后采用比利时Bio-XMycoplasambovisElisaKit试剂盒检测抗体滴度,监测母鸡抗体水平变化。待母鸡体内抗体达到一定较高的稳定水平,收集鸡蛋,编号标记后放入4℃冰箱内保存。3.鸡蛋内抗体水平的评估1)卵黄的采集:卵黄先用酸化水稀释法进行粗提。将卵黄与8倍体积的0.04mol/L柠檬酸缓冲液(PH5.2)稀释,用磁力搅拌器搅拌均匀,分装于离心管中4℃静置过夜。然后以10000r/min低温超速离心25min,收集上清经0.45μm滤膜过滤即获得粗提卵黄抗体。2)卵黄抗体的纯化:将粗提的卵黄抗体中加入饱和硫酸铵使其终浓度达到40%,混匀后4℃静置5~8h,5000r/min离心25min,弃上清取沉淀,加适量灭菌超纯水溶解;再加入饱和硫酸铵使其终浓度为60%,混匀后4℃静置5~8h,同上步离心,用灭菌超纯水重悬沉淀至原体积;用截留分子量为100KD的超滤离心管超滤除盐,然后再用0.22μm滤膜过滤除菌,分别加入青、链霉素1000IU/mL和0.01%的硫柳汞,4℃保存。收集的滤液即为提取的卵黄抗体。3)卵黄抗体效价的检测:采用Bio-XMycoplasambovisElisaKit试剂盒检测抗体滴度,倍比梯度稀释纯化的IgY,将酶标二抗换为兔抗鸡-HRP,稀释度为1:2000,其余操作按说明书进行。以颜色反应深于对照组判为阳性,并以出现阳性反应的最高稀释度为抗体效价。三、卵黄抗体应用效果的评价1.卵黄抗体的制备卵黄抗体的制备与上述步骤二的操作方法相同,测定卵黄抗体的效价,效价达104以上用于下述牛支原体病的预防。2.预防犊牛牛支原体试验选择2月龄、检测鼻试子、血清无支原体病原的荷斯坦犊牛25头,其体重、胎次相对一致,饲养一周适应后,随机分为3组,分别为试验组、阴性对照组(NC)和阳性对照组(PC),每组5头犊牛。每天饲喂相同的日粮,自由饮水,空白对照组不作任何处理;试验组分为3组,分别为高剂量组,中等剂量组和低剂量组,高剂量组灌服3个卵黄量,中等剂量组灌服2个卵黄量,低剂量组灌服1个卵黄量,每周灌服1次,连续灌服3周,第三次人工被动免疫2周后进行牛支原体毒株感染试验,每头牛的感染剂量和频次与PC组相同;阳性对照(PC)组隔离饲养,饲养一段时间后进行牛支原体的感染,感染剂量为喷鼻5ml、注射3ml支原体菌液(菌浓度为109ccu/ml以上)/只,每天感染1次,连续感染3天;阴性对照(NC)组前3周每周注射一次生理盐水,后期肌肉注射与PC组感染剂量和频次相同的Thiaucourt’s液体培养基。试验期间每头犊牛每周采血1次,并测量体温,直至感染结束3周后结束。试验结束后,每组选取1只犊牛进行剖检,并取组织进行病理组织切片的制作。动物感染后开始,每周对3组试验牛采集鼻拭子1次,接种于Thiaucourt’s液体、固体培养基培养,观察菌落形态;并将培养物提取DNA且利用16SrRNA引物进行支原体鉴定和uvrC引物进行牛支原体和无乳支原体鉴定。将感染后剖检犊牛的关节液、胸腔积液、心包液和肺脏组织进行牛支原体的鉴定。本发明所提供的抗牛支原体病的特异性卵黄抗体,制备工艺简单,成本低、无毒、无害、无残留、无污染且使用方便,是通过提高奶牛机体牛支原体的抗体水平来预防牛支原体病的,抗牛支原体卵黄抗体与现有技术相比:预防牛支原体病效果好,方便、灵活,并且省工、力、正对性强,性价比高,可避免牛发病后滥用药而导致药物在牛体内残留,有助于畜产品质量的提高,还可避免牛发病后大量被动用药而导致病菌产生耐药性,有利于牛支原体病的防制,实际使用表明:牛支原体卵黄抗体具有良好的使用效果而无任何毒副作用,将来可制成针剂、粉剂、饲料添加剂等等,拥有广阔的应用前景。附图说明图1抗牛支原体卵黄及全卵黄抗体粉图2犊牛体温变化图图3PC组病理剖检病变组织:A肺脏组织黏连;B肺脏出血淤血;C肺脏组织发生实质性肉变及大小不等的灰白色干酪样或化脓性坏死灶;D肺脏组织内部出血并有化脓性和干酪样坏死灶图4试验组肺脏、喉头、气管的剖检图5试验组心脏、肝脏、脾脏、肾脏的剖检图6PC组光学显微镜下肺脏和气管的显微结构图7牛支原体的鉴定:A为牛支原体的液体培养;B为牛支原体固体培养物光学显微镜下图;C为牛支原体的分子生物学鉴定(其中1是16SrRNA引物扩增片段为1500bp,2是uvrC引物扩增片段为1600bp)具体实施方式实施例1:制备牛支原体抗原一、材料与方法1.1菌株牛支原体(NP1)菌株来自宁夏大学农学院临床兽医实验室1.2培养基和试剂改良的Thiaucourt,s培养基:PPLO肉汤(21g/L)、灭活马血清(200mL/L)、25%酵母浸出液(100Ml/L)、10%醋酸铊(1mL/L)、青霉素(0.1g/L)、葡萄糖(1.0g/L)、丙酮酸钠(2.0g/L)、0.4%酚红(4.5mL/L);0.01MPBS缓冲液(PH7.2):NaCl8.0g、KCl0.2g、KH2PO40.2g、Na2HPO4•12H2O3.14g,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L,高压灭菌,室温或4℃冰箱保存;弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)均购自Sigma公司。1.3牛支原体菌体浓度的测定菌株复活以后,按1%的接种量接种于改良的Thiaucourt,s液体培养基,于37℃震荡培养。期间每隔2~3d采用颜色变化单位法(CCU)测定菌体浓度,要求达到109ccu/ml以上。传代培养至少传3代,每代培养2~3d。最后取2ml进行固体培养和PCR鉴定,保证所培养的菌液无任何杂菌污染方可。1.4牛支原体抗原的制备将达到指定菌浓度的菌液按1%的比例扩大培养,37℃振荡培养4~5d,然后在菌液中加入终浓度为0.4%的甲醛,置于37℃的CO2培养箱中灭活2~3d,期间每隔几小时摇动培养基使其充分灭活。收集灭活后的液体培养物,4℃离心(10000rpm)30min,弃去上清,收集沉淀,沉淀用适量的PBS(磷酸盐缓冲液)重悬菌液,重复上述步骤,离心、弃上清。洗涤3次后用适量的PBS(磷酸盐缓冲液)悬浮为牛支原体抗原悬液。抗原悬浮液进行灭活检验,检测合格后置于-20℃保存备用。1.5牛支原体灭活疫苗的制备及检测将制备好的牛支原体抗原悬液利用核酸蛋白分析仪测定菌体蛋白含量,并稀释成合适的浓度,然后液逐滴加入等体积的弗氏佐剂(弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司),边加边振荡使其充分混匀,再用超声波破碎仪使其完全乳化,制成油包水型油乳疫苗。将制备好的疫苗进行无菌检测、稳定性试验和安全性试验。二、实施效果在改良的Thiaucourt,s液体培养基中生长2~3d,培养基颜色略微变为橙黄色,澄清透明;在固体培养基中生长3~5d,可形成针尖状大小且具有明显中心脐的透明小菌落,显微镜下呈油煎蛋状,菌体姬姆萨染色呈蓝色或蓝紫色。在振荡培养条件下,牛支原体菌株在接种16~32h进入对数生长期,30h左右达到生长平台期,且最大平均生长滴度维持在109ccu/ml数量级。抗原悬液灭活检验:取抗原悬液接种牛支原体固体培养基并置于37℃、5%CO2培养3~5d,观察未见牛支原体典型“煎蛋样”菌落,表明灭活完全。疫苗无菌检验:将疫苗分别接种普通营养琼脂培养基和鲜血琼脂培养基,在37℃、5%CO2培养3~5d,观察均无杂菌生长。疫苗稳定性试验:取疫苗10ml置于离心管,1000rpm/min离心5min,未见将疫苗析出水相;将疫苗置于4℃,观察放置后的1d、3d、7d、30d,均未出现分层现象。说明所制备的疫苗稳定性好。疫苗安全性试验:小鼠每只腹腔注射0.2mL,观察其精神状态良好、采食正常,注射部位均正常,未见化脓及红肿现象。证明疫苗安全可靠。疫苗抗原的最终浓度:弗氏完全佐剂混合的疫苗为1.0mg/ml,弗氏不完全佐剂混合的疫苗为2.0mg/ml。实施例2:制备牛支原体特异性卵黄抗体一、材料与方法1.1试剂与仪器0.04M柠檬酸-柠檬酸钠缓冲液(PH5.2):0.04M柠檬酸C6H8O7•H2O(8.40g/L)7.3ml、0.04M柠檬酸钠Na3C6H5O7•2H2O(11.76g/L)12.7ml;兔抗鸡-HRP购自protein;真空冻干试验机(JDG-0.2)购自兰州科近真空冻干技术有限公司。1.2实验动物和免疫免疫方式均为产蛋鸡双翼、胸腹部和背部皮下及肌肉多位点注射,共免疫四次。基础免疫一次、加强免疫(二免、三免、四免)三次,间隔时间均为两周。基础免疫接种500ul浓度为1.0mg/ml的弗氏完全佐剂(FCA)混合的特异性免疫原,加强免疫(二免、三免、四免)分别接种500ul、750ul、1ml浓度为2.0mg/ml的弗氏不完全佐剂(FIA)混合的特异性免疫原。1.3母鸡抗体水平的监测首次免疫前一周开始每隔7天鸡翅下静脉采血液2ml,分离血清并做好标记,然后用Bio-XMycoplasambovisElisaKit试剂盒检测抗体滴度,监测母鸡抗体水平变化。待母鸡体内抗体达到一定较高的稳定水平,收集鸡蛋,编号标记后放入4℃冰箱内保存1.4鸡蛋内抗体水平的评估1)卵黄的采集:卵黄用水稀释法进行粗提。先将鸡蛋清水洗净后浸入0.1%的新洁尔灭水溶液中消毒15min后,再75%精酒擦拭外壳,晾干后在无菌条件下打开蛋壳,用卵黄分离器尽量去除蛋白,之后将卵黄于无菌滤纸上滚动,吸干残留蛋清,用注射器针头刺破卵黄膜,吸取卵黄液10mL与灭菌烧杯中,再加入9倍体积0.04mol/L柠檬酸缓冲液(PH5.2)稀释,用磁力搅拌器搅拌均匀,分装于离心管中4℃静置过夜。然后以10000r/min低温超速离心25min,收集上清经0.45μm滤膜过滤即获得粗提卵黄抗体。2)卵黄抗体的纯化:将粗提的卵黄抗体中加入饱和硫酸铵使其终浓度达到40%,混匀后4℃静置5~8h,5000r/min离心25min,弃上清取沉淀,加适量灭菌超纯水溶解;再加入饱和硫酸铵使其终浓度为60%,混匀后4℃静置5~8h,同上步离心,用灭菌超纯水重悬沉淀至原体积;用截留分子量为100KD的超滤离心管超滤除盐,然后再用0.22μm滤膜过滤除菌,分别加入青、链霉素1000IU/mL和0.01%的硫柳汞,4℃保存。收集的滤液即为提取的卵黄抗体。3)卵黄抗体效价的检测:采用Bio-XMycoplasambovisElisaKit试剂盒检测抗体滴度,倍比梯度稀释纯化的IgY,将酶标二抗换为兔抗鸡-HRP,稀释度为1:2000,其余操作按说明书进行。以颜色反应深于对照组判为阳性,并以出现阳性反应的最高稀释度为抗体效价。1.5全卵黄抗体粉的制备收集抗体滴度检测达104以上的鸡蛋,分离卵黄,利用冷冻真空干燥机冻干,制成全卵黄粉。二、实施结果一个卵黄中含抗牛支原体卵黄抗体(IgY)约100~150mg,制成全卵黄抗体粉重量为6.5~7.5g(图1)。实施例3:卵黄抗体应用效果的评价一、试验步骤与方法1.卵黄抗体的制备卵黄抗体的制备与上述步骤二的操作方法相同,测定卵黄抗体的效价,效价达104以上方用于下述牛支原体病的预防。2.犊牛牛支原体病预防试验2.1试验犊牛的选择和分组选择2月龄、且检测鼻试子、血清无支原体病原的荷斯坦犊牛25头,保证其体重、胎次月龄相对一致,饲养一周适应后,随机分为3组,每组5头,分栏饲养。2.2饲养管理水槽自由饮水,干粉料,青干草自由采食,日喂3次;及时清理食槽、水槽中的脏物,保证食入的草料、饮水干净健康;每日清理一次圈舍内的粪便,保证犊牛生活的环境干净、舒适。2.3试验分组与设计试验采用单因子设计。共分为3组,即分别为试验组、阴性对照组(NC)和阳性对照组(PC);试验组分为3组,分别为高剂量组,中等剂量组和低剂量组,高剂量组灌服3个卵黄量,中等剂量组灌服2个卵黄量,低剂量组灌服1个卵黄量,每周灌服1次,连续灌服3周,第三次人工被动免疫2周后进行牛支原体毒株感染试验,每头牛的感染剂量和频次与PC组相同;阳性对照(PC)组隔离饲养,饲养一段时间后进行牛支原体的感染,感染剂量为喷鼻5ml、注射3ml支原体菌液(菌浓度为109ccu/ml以上)/只,每天感染1次,连续感染3天;阴性对照(NC)组前3周每周注射一次生理盐水,2周后肌肉注射与PC组感染剂量和频次相同的Thiaucourt’s液体培养基。2.4犊牛体温变化监测在0-15d,每天7:00-8:00测量体温一次,15d以后每隔一天测一次体温,直至感染试验结束,记录每次所测体温,并绘制出体温变化折线图。2.5犊牛体内抗体水平的检测0d(第一次免疫)前一周采集血清1次,0d后,每周分别对3组试验牛采集血液并分离血清1次,直至感染结束后3周结束,将采集的血液分离出血清,并标记置于-20℃保存待测。将每组分离出的血清采用比利时Bio-XMycoplasambovisElisaKit试剂盒进行抗体滴度的检测。2.6犊牛剖检病理变化感染后28d,将PC、NC和试验组牛只进行病理剖检,并采集牛只肺脏、气管、喉头、心脏、肾脏组织固定于10%福尔马林溶液,固定7d后,石蜡包埋,HE染色,光学显微镜下观察。2.7感染后犊牛支原体的鉴定动物感染后开始,每周对3组试验牛采集鼻拭子1次,并用PBS进行稀释。将鼻拭子接种在Thiaucourt’s液体培养基中和固体培养基CO2培养箱5%CO237℃培养,培养2d后镜检固体培养基上的菌落形态;,利用0.22μm细菌过滤器过滤菌液,并接种于液体培养基进行培养,培养2d后提取培养物DNA并利用16SrRNA引物进行支原体鉴定和uvrC引物进行牛支原体和无乳支原体鉴定。动物感染试28d后进行牛只病理剖检,采集牛只关节液、胸腔积液、心包液和肺脏组织。将采集的肺脏组织表面用火焰灭菌,剪取肺脏深部组织一小块,然后无菌操作条件下接种于牛支原体Thiaucourt’s液体筛选培养基中和牛支原体Thiaucourt’s固体筛选培养基,每份病料样品接种3个液体培养基和3个固体培养基。固体培养基置于CO2培养箱5%CO237℃培养2d后,显微镜下观察菌落形态;液体培养基于37℃恒温摇床培养2d后观察培养基颜色变化情况,将变黄的培养液用0.22um除菌滤膜过滤,重复培养过滤液后提取DNA进行牛支原体分子生物学鉴定。二、结果与分析1犊牛体温变化在试验期间,NC组体温一直维持39.10℃~39.50℃之间,在牛正常体温之内;PC组从第15d开始高于39.50℃,并呈升高的趋势,最高体温40.50℃,与NC组的最大体温差为1.50℃,差异显著(P<0.05);试验组第1次灌服卵黄抗体后,A、B组体温均略有升高,C组体温变化不明显,第2次灌服卵黄抗体后体均A、B、C组体温均略有升高,A、B组体温变化明显,最高体温均高于正常值,分别升至39.80℃、39.70℃,与NC组差异显著(P<0.05),C组体温虽略有升高,但均在体温正常范围内。感染试验后试验组体温变化不明显,A组最高体温39.6℃,与NC组相比差异不显著(P>0.05)(图2)。2犊牛剖检变化及病理组织学观察PC组剖检发现:肺脏组织黏连、肺脏出血淤血、肺脏组织发生实质性肉变及大小不等的灰白色干酪样或化脓性坏死灶、肺脏组织内部出血并有化脓性和干酪样坏死灶,其他组织均无肉眼可见病理变化(图3)。试验组剖检发现:肺脏、喉头、气管、心脏、肝脏、肾脏和关节组织均无肉眼可见病变(图4、图5)。试验组肺脏和气管组织无明显病理组织学变化;PC组可见细支气管缩小,皱襞增多,官腔内有少量脱落的上皮细胞,肺泡塌陷、肺泡隔增厚,组织增生,肺泡腔内有少量细胞脱落(图6)。注:A:肺泡塌陷、肺泡隔增厚,组织增生;B:肺泡塌陷,肺泡隔增厚,肺泡腔内有少量细胞脱落;C:肺细支气管缩小,皱襞增多,官腔内有少量脱落的上皮细胞;D:细支气管缩小,皱襞增多。3犊牛抗体水平变化表1犊牛抗体水平变化(周)012345678910A--+++++++++---B--++++++----C---++------NC组-----------PC组--+++++++++++++++++4犊牛支原体鉴定PC组剖检所取的组织样经37℃培养箱培养2~3d,接种过牛支原体的液体培养基由红色变为澄清透亮的橙黄色,培养管底部无沉淀。在固体培养基上出现肉眼可见的针尖样大小菌落,40倍光学显微镜下观察菌落常呈圆形、边缘整齐、表面光滑、周边薄中央厚的“油煎蛋状”。用DNA提取试剂盒对培养的菌株进行基因组提取,进一步进行PCR检测,结果均得到目的基因条带,所以PC组经过牛支原体液体培养、固体培养、PCR鉴定,均检测到牛支原体;而试验组均未检测到牛支原体(图7)。综上所述:牛支原体卵黄抗体在临床应用中与阴性和阳性对照相比,可产生牛支原体抗体,预防牛支原体病,其中A组产生的抗体可维持在较高水平,且维持时间最长,说明A、B组剂量合适;C组产生的抗体滴度低、维持时间短,说明让机体产生抗体的剂量不够。动物感染试验后,A、B、C组临床表现均无明显变化,均未出现牛支原体病的临床特征性表现,犊牛剖检无肉眼可见变化,无病理组织学变化,而且未检测到牛支原体病原的存在。说明,本发明的牛支原体卵黄抗体对于牛支原体病原的预防具有良好的效果,且该卵黄抗体相比抗生素有着成本低、无毒、无害、无残留、无污染且使用方便等突出优点,也可起到良好的预防保健作用。若作为饲料添加剂IgY建议剂量为200~450mg。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺