基于sanger测序测重组HPV腺病毒基因组的方法与流程
本发明涉及基因工程领域,具体涉及一种基于sanger测序测重组HPV腺病毒基因组的方法。
背景技术:
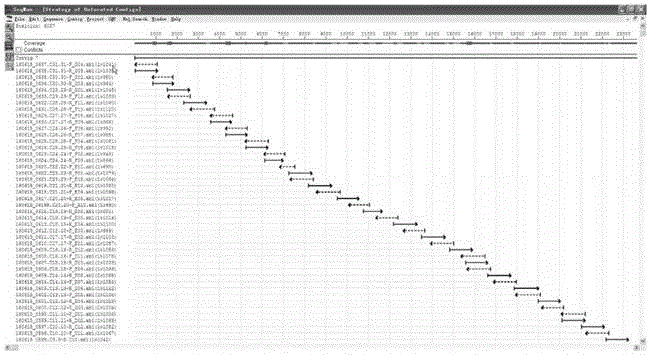
:宫颈癌是女性生殖系统常见的恶性肿瘤,研究显示90%以上的宫颈癌与人乳头瘤病毒的感染有关,其中超过2/3的宫颈癌与HPV16或l8感染相关,约50%是人乳头瘤病毒16型(HPV16)感染引起的。HPV具有严格的嗜人类组织的特性,自然状态下不感染任何实验动物,这就给研究HPV的感染过程及致病机理带来了不便。腺病毒可跨越种属特性,并且在不同细胞、组织中都可以表达。使HPV感染更类似于临床宫颈癌的发生过程。这对于构建HPV-16动物模型以及开发治疗HPV感染的药物等也有着重要的作用。腺病毒在生物医药和基因治疗中因其具有以下优点,被广泛用作于载体:外源基因容量大,最大承载可达37kb;感染范围广,能将目的基因转移到分裂或静息的细胞中;安全性高,感染细胞时其DNA不整合到宿主染色体中,潜在的致癌危险小;能同时表达多个基因,它是第1个可以在同一细胞株或组织中用来设计表达多个基因的表达系统;外源基因表达水平较高,病毒滴度高,易于制备和纯化。腺病毒载体的安全性问题主要在于外源基因插入片段序列是否正确以及该片段在病毒连续复制几个周期后是否仍保持不变。目前的检测方法都是基于PCR扩增或者基因组酶切图谱鉴定,但是这些方法只能定性评估重组腺病毒载体构建成功与否,没有精确到碱基序列的完全匹配,实际应用过程中是可能存在安全风险的。本文提供了一种基于sanger测序法测重组HPV腺病毒基因组的方法,为满足疫苗研发对病毒种子的要求,以及下一步的中试研发提供了技术保障。技术实现要素:本发明的目的在于克服上述现有技术存在的不足,提供一种基于sanger测序测重组HPV腺病毒基因组的方法。本发明的目的是通过以下技术方案来实现的:一种基于sanger测序测重组HPV腺病毒基因组的方法,所述方法包括如下步骤:S1、病毒DNA提取;S2、根据NCBI数据库中已知的重组HPV腺病毒序列设计覆盖线粒体全长的引物对,对病毒DNA进行PCR扩增;S3、回收PCR扩增产物;S4、对所述回收产物进行测序;用Seqman序列拼接软件对测得的序列根据引物对与引物对之间的序列重叠区进行拼接,组装得到重组HPV腺病毒基因组全序列。优选的,步骤S2中,所述引物对包括:如SEQIDNO.1所示的1-F和如SEQIDNO.2所示的1-R构成的引物对;如SEQIDNO.3所示的2-F和如SEQIDNO.4所示的2-R构成的引物对;如SEQIDNO.5所示的3-F和如SEQIDNO.6所示的3-R构成的引物对;如SEQIDNO.7所示的4-F和如SEQIDNO.8所示的4-R构成的引物对;如SEQIDNO.9所示的5-F和如SEQIDNO.10所示的5-R构成的引物对;如SEQIDNO.11所示的6-F和如SEQIDNO.12所示的6-R构成的引物对;如SEQIDNO.13所示的7-F和如SEQIDNO.14所示的7-R构成的引物对;如SEQIDNO.15所示的8-F和如SEQIDNO.16所示的8-R构成的引物对;如SEQIDNO.17所示的9-F和如SEQIDNO.28所示的9-R构成的引物对;如SEQIDNO.19所示的10-F和如SEQIDNO.20所示的10-R构成的引物对;如SEQIDNO.21所示的11-F和如SEQIDNO.22所示的11-R构成的引物对;如SEQIDNO.23所示的12-F和如SEQIDNO.24所示的12-R构成的引物对;如SEQIDNO.25所示的13-F和如SEQIDNO.26所示的13-R构成的引物对;如SEQIDNO.27所示的14-F和如SEQIDNO.28所示的14-R构成的引物对;如SEQIDNO.29所示的15-F和如SEQID.NO.30所示的15-R构成的引物对;如SEQIDNO.31所示的16-F和如SEQIDNO.32所示的16-R构成的引物对;如SEQIDNO.33所示的17-F和如SEQID.NO.34所示的17-R构成的引物对;如SEQIDNO.35所示的18-F和如SEQIDNO.36所示的18-R构成的引物对;如SEQIDNO.37所示的19-F和如SEQIDNO.38所示的19-R构成的引物对;如SEQIDNO.39所示的20-F和如SEQIDNO.40所示的20-R构成的引物对;如SEQIDNO.41所示的21-F和如SEQIDNO.42所示的21-R构成的引物对;如SEQIDNO.43所示的22-F和如SEQIDNO.44所示的22-R构成的引物对;如SEQIDNO.45所示的23-F和如SEQIDNO.46所示的23-R构成的引物对;如SEQIDNO.47所示的24-F和如SEQIDNO.48所示的24-R构成的引物对;如SEQIDNO.49所示的25-F和如SEQIDNO.50所示的25-R构成的引物对;如SEQIDNO.51所示的26-F和如SEQIDNO.52所示的26-R构成的引物对;如SEQIDNO.53所示的27-F和如SEQIDNO.54所示的27-R构成的引物对;如SEQIDNO.55所示的28-F和如SEQIDNO.56所示的28-R构成的引物对;如SEQIDNO.57所示的29-F和如SEQIDNO.58所示的29-R构成的引物对;如SEQIDNO.59所示的30-F和如SEQIDNO.60所示的30-R构成的引物对;如SEQIDNO.61所示的31-F和如SEQIDNO.62所示的31-R构成的引物对;如SEQIDNO.63所示的32-F和如SEQIDNO.64所示的32-R构成的引物对;优选的,步骤S2中,所述PCR扩增中,每50.0ul扩增反应体系包括:基因组DNA1.0ul,含2.5mMMg2+的10×LABuffer5.0ul,5u/μL的LATaq聚合酶1.0ul,10mM的dNTP1.0ul,10uM的正向引物1.5ul,10uM的反向引物1.5ul,ddH2O39.0ul。优选的,步骤S2中,所述PCR扩增中,PCR反应参数为:预变性95℃,5min;变性95℃,30s;退火58℃,30s;延伸72℃,1min30s;终延伸72℃,7m;循环数35。优选的,步骤S3中,所述回收是用AxyPrepDNA凝胶回收试剂盒进行回收。优选的,步骤S4中,所述测序是基于Sanger双脱氧链终止法进行一代测序。该方法的基本原理是通过已知的重组HPV腺病毒序列设计出覆盖基因组全长的引物对,分段扩增出特定的基因片段,然后用ABI3730xl测序仪测出这些基因的序列,然后通过序列与序列之间的重叠区将这些序列拼接成一个完整的重组HPV腺病毒载体。与现有技术相比,本发明具有如下有益效果:本发明通过对重组腺病毒载体的全基因组测序,从碱基序列上保证了重组质粒的准确性,进而确保了疫苗生产的安全性问题。附图说明图1为测得的序列根据引物对与引物对之间的序列重叠区进行拼接的效果示意图。具体实施方式下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。实施例本实施例涉及一种基于sanger测序测重组HPV腺病毒基因组的方法;具体包括如下步骤:一、病毒DNA提取1、取病毒上清液0.5ml,12000rpm离心5min,尽量吸尽上清使用,弃去沉淀。2、向病毒上清中加入20ul10mg/ml的蛋白酶K,充分混匀,65℃消化10-20min,期间可颠倒离心管混匀数次。3、向管中加入500ul结合液,充分混匀。再向管中加入400ul无水乙醇,充分混匀,此时可能会出现絮状沉淀,不影响DNA的提取,可将溶液和絮状沉淀都加入吸附柱中,静置2min。(吸附柱的最大容积为750ul,可分两次加入。一次吸附完离心后再将余下的混合液体加入柱中静置离心。)4、12000rpm离心2min,弃废液,将吸附柱放入收集管中。5、向吸附柱中加入700ul漂洗液(使用前请先检查是否已加入无水乙醇),12000rpm离心1min,弃废液,将吸附柱放入收集管中。6、向吸附柱中加入500ul漂洗液,12000rpm离心1min,弃废液,将吸附柱放入收集管中。7、12000rpm离心2min,将吸附柱置于室温或50℃温箱放置数分钟,目的是将吸附柱中残余的漂洗液去除,否则漂洗液中的乙醇会影响后续的实验如酶切、PCR等。8、将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加50ul-100ul经65℃水浴预热的洗脱液,室温放置5min,12000rpm离心1min。9、离心所得洗脱液再加入吸附柱中,室温放置2min,12000rpm离心2min,即可得到高质量的病毒基因组二、引物设计与合成根据NCBI数据库中已知的重组HPV腺病毒序列设计覆盖线粒体全长的引物对,对病毒DNA进行PCR扩增,这些引物由上海派森诺生物科技有限公司合成,引物序列如下:三、PCR扩增:对总DNA进行扩增,得到特定的基因片段3.1PCR扩增反应体系表1基因组DNA1.0ul10×LABuffer(含2.5mMMg2+)5.0ulLATaq聚合酶(5u/μL)1.0uldNTP(10mM)1.0ul正向引物(10uM)1.5ul反向引物(10uM)1.5ulddH2O39.0ul总体积50.0ul在0.2ml离心管中加入表1所示成分,混匀,瞬时离心收集管壁上的液滴至管底,在PCR扩增仪上进行PCR反应,反应参数如下表2所示:表23.2PCR产物的回收PCR产物用AxyPrepDNA凝胶回收试剂盒回收,具体操作按试剂盒说明书进行,步骤如下:3.2.1在紫外灯下切下含有目的DNA的琼脂糖凝胶放入干净的离心管中,称取重量。3.2.2加入3个凝胶体积的BufferDE-A,混合均匀后于75℃加热直至凝胶块完全熔化。3.2.3加0.5个BufferDE-A体积的BufferDE-B,混合均匀;当分离的DNA片段小于400bp时,加入1个凝胶体积的异丙醇。3.2.4将混合液,转移到DNA制备管12,000×g离心1min。弃滤液。3.2.5将制备管置回2ml离心管,加500μlBufferW1,12,000×g离心30s,弃滤液。3.2.6将制备管置回2ml离心管,加700μlBufferW2,12,000×g离心30s,弃滤液。以同样的方法再用700μlBufferW2,12,000×g离心1min。3.2.7将制备管置回2ml离心管中,12,000×g离心1min。3.2.8将制备管置于洁净的1.5ml离心管(试剂盒内提供)中,在制备膜中央加25-30μl去离子水,室温静置1min。12,000×g离心1min洗脱DNA。四、一代测序利用基于Sanger双脱氧链终止法的技术进行一代测序,所用测序仪为ABI3730xl。五、序列拼接用Seqman软件对测得的序列根据引物对与引物对之间的序列重叠区进行拼接,拼接效果如图1所示,由图1可知,将测得的序列根据引物对与引物对之间的序列重叠区进行拼接,得到完整的基因组序列。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1