多基因座STR分析方法与流程
本发明涉及DNA荧光标记以及多基因座基因小片段检测技术领域,具体涉及一种DNA片段的化学连接技术和通过毛细管电泳的荧光光谱采集和分析技术。
背景技术:
随着人类基因组计划的完成,人类对自身遗传信息的了解和掌握有了前所未有的进步。DNA检测技术得到了迅猛发展,DNA检测效率不断提高。DNA检测技术在个体识别、遇难者身份识别、亲子鉴定、血缘鉴定、刑事案件侦破、食品与种子安全、疾病诊断,精准医疗等方面发挥着十分重要的作用。
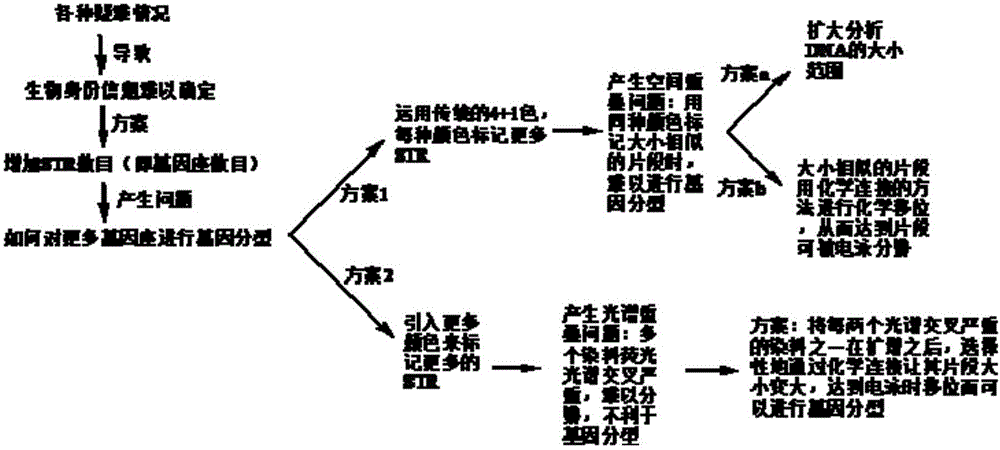
每个人的DNA都不同,因此理论上讲,通过全基因测序可以确定每个人的独特身份。但是人体的DNA包含近30亿个碱基,而且不同人之间99.5%以上的DNA序列是相同的,因此,通过全基因测序确定个人身份的做法会耗时耗力,而且完全没有必要,只需要对人类在存在差别的基因座上进行检测甄别即可。目前商业上的做法是通过多基因座下的STR片段检测来建立每个人的DNA数据库,用于鉴定个人身份。
身份鉴定技术通常又称为基因扫描技术,其原理如下:正常人体有23对染色体,共46条染色体。每一条染色体由两条双链DNA组成,每一条双链DNA是由两条碱基互补的单链DNA构成。每一条单链DNA上有很多的编码区(即基因区)和非编码区,它们以线形交替形式排列在DNA链上。这些非编码区通常是一段以某短碱基序列(一般在2到6个碱基)作多次重复出现的DNA片段,简称短序列串联重复单元(Short Tandem Repeats,STR)。大量的研究发现,每个非编码区内的STR呈现多态性,即不同的生物个体在同一个非编码区内的STR重复数目可能不同,而且不同的非编码区内STR重复单元的碱基序列和重复数目也是完全独立的,彼此不关联。因此,这些非编码区内的DNA序列是用来区分不同生物个体(包括人类本身)的绝佳对象。例如,如果一个基因座下存在10种多态性(即10个不同的重复数目),那么选取10个基因座,理论上存在1010=100亿种多态性。因此通过检测多个非编码区内的STR片段,就可区分每个人的独特身份。目前英国采用11个基因座,美国采用13个基因座,而中国采用18-22个基因座。但是,在很多情况下,这么多的基因座数目还不足以确定一个人的身份或特点,就需要增加更多的基因座来进行更准确可靠的身份鉴定。
多基因座的STR多态性可通过精心设计特定的双向引物(其中正向引物用某个特定的染料标记),经PCR技术实现对DNA模板链上包含重复单元的非编码区短序列进行复制和扩增,再利用毛细管电泳和荧光检测技术确定各片段的重复单元数目和基因座归属,即基因分型。
目前市场上通常使用五色荧光染料来实现基因扫描,不同试剂盒所检测的DNA片段长度范围略有变化,大致在80-350bp之间。其中,一种荧光染料标记一组长度不同的片段,用作内标(即确定DNA长度的标尺),其余四种染料分别用来标记多个基因座。当用四色染料标记18个基因座时,显然多个基因座必须共用同一种染料来标记。基因座归属是根据颜色和片段长度两个参数来确定的。因此,为了能够确定同一种染料标记下的不同片段基因座的归属,这些片段长度必须预先精心设计,让不同基因座下的STR片段在80-350bp之间各占据一个特定的区间,彼此长度范围不能出现重叠。在实际工作中,很多检材采用通用试剂盒检测分析还不能作出准确判断时,就需要设计具有更多基因座数目的试剂盒,通过扩大DNA片段长度的检测范围以容纳更多的STR片段或增加更多荧光染料实现对增加的基因座进行标记。在一些情况下,例如刑事犯罪中生物样品高度降解时,样品的DNA模板链发生断裂,其相应的完整基因座STR片段就难以通过PCR技术复制,因而不仅造成相关基因座的信息丢失,而且因复制失败只能产生较小的片段,这些片段与其他小片段区发生重叠,严重干扰检测结果。因此,通过扩大DNA片段长度的检测范围以容纳更多的STR片段的策略受到极大的限制,市场上多采用增加荧光染料来标记更多基因座的方法。目前商业上使用的五色染料体系难以在80-350bp的狭窄区间之内实现对更多基因座的荧光标记并且序列长度不交叉排布。
显而易见,这种五色体系的应用有较大的局限性。其具体表现在:(1)基因座数目不够多。在多样品混合的情况下,采用较少的基因座数目作基因扫描时不一定能够准确检出混合样品中各组分对应的单个身份。尤其是当样品发生降解时,一些基因座的STR片段因不能被PCR技术扩增出来而无效,那么可以用作鉴定身份的有效基因座STR数目大大下降,从而无法作出准确的身份鉴定;(2)因一种染料已用于标记内标,仅有的四种荧光染料不足以用来标记更多基因座。在样品高度降解的情况下,由于DNA模板断裂不完整,通过PCR技术难以复制和扩增较大的片段。因此在高度降解的生物样品上,广泛采用小卫星或微卫星片段的分析法,即对每个基因座的STR片段尽量选最短的序列,以降低因模板母链降解而不能通过PCR扩增所需的各个基因座STR片段的风险;但是,在一个有限的DNA片段长度范围内,单一染料标记的基因座数目将受到极大限制。
技术实现要素:
本发明的目的在于提供一种多基因座STR分析方法,本发明方法针对五色荧光染料在多基因座STR检测时的局限性,不仅可以扩展单个荧光染料可标记的基因座STR片段数,而且能够解决多色(5色以上)染料在标记STR片段时因较严重的荧光光谱交叉问题而导致仪器检测时难以确定各个染料标记的片段基因座归属。
本发明的基本原理如下:每一个基因座中多次重复的STR长度是具有高度多态性的,是现代身份鉴定的基础。仅仅包含多次重复的STR单元本身是很小的。为了让毛细管电泳能够同时分析多个STR片段,这些片段必须在碱基数目,即片段长度上有差别,才能被区分。因此在选择多个基因座的STR长度时,有意在STR重复单元之外多选一些碱基,造成各基因座的STR片段之间不至于发生碱基数相同。在一些情况下,例如高度降解的生物样品中,通过PCR技术复制长的DNA片段非常困难,尽量缩小基因座的STR片段,即采用微卫星片段,是实现样品成功被检测的关键。本发明通过预先合成一段与被检样品的序列无关、长度特定的单链DNA片段,然后通过特殊高效的化学连接方法实现与众多小STR片段选择性地对接,让可能重叠的片段发生空间移位从而可被电泳分离。特别指出的是,由于连接所用的长度特定的单链DNA片段与被测样品没有任何关联,因此尽管样品母链因降解发生断裂,但是通过本发明的方法仍可以制备片段长度不同且包含各基因座的特征STR片段。
本发明在不改变目前市场上常用DNA片段长度检测范围的前提下,可以让每一种染料分别标记比原来试剂盒多一倍的基因座STR片段,设计时新增的被标记基因座被编成一组,让组内的各基因座STR片段互相不重叠,而不用考虑与原来同色标记基因座片段长度是否重叠的问题。对新增的基因座,在染料和引物之间需要引入一个带有三个官能团的脚手架小分子,其中的两个官能团与DNA主链构成基本骨架,用于引物和染料之间的连接,第三个则用于与一段外来的长度特定的单链DNA片段进行化学连接。
当经过PCR扩增和提纯后,新增的一组片段即可与预先合成的长度特定的DNA片段发生化学反应连接在一起,连接后的DNA片段长度将会增大,而未经脚手架分子修饰的普通方法标记的一组因不能发生化学连接反应,其片段长度不会发生改变。因此,用新方法标记的新增基因座就可与原普通方法标记的一组基因座在电泳中完全分离,从而实现基因分型。
在多色荧光(多于5色)染料标记多基因座STR片段的情况下,由于染料之间的荧光光谱交叉问题,当片段长度相似时,光谱彼此严重干扰,难以准确分辨各自所标记的染料,因而基因分型会变得很困难。本专利的方法是将光谱相互交叉的染料标记片段通过上述类似的方法实现彼此移位,在空间上不相互重叠,从而实现光谱交叉最小化,以利于荧光检测和基因分型。
为达到上述目的,本发明采用如下的技术方案:
一种多基因座STR分析方法,该方法包括在使用被荧光染料标记的引物对多基因座STR片段进行PCR复制和扩增之后能够将一个长度特定的单链DNA片段有选择地连接到扩增后的某些DNA片段产物上。
优选地,所述被荧光染料标记的引物为双向引物中的正向引物或反向引物,且在被荧光染料标记之前,在部分所述正向引物或部分所述反向引物上引入一个脚手架分子。
优选地,所述脚手架分子包括一个基本骨架和一个位于所述基本骨架上能发生化学连接的官能团。
优选地,所述荧光染料、脚手架分子与所述正向引物或所述荧光染料、脚手架分子与所述反向引物两两之间可以设有间隔分子;在同一个多基因座STR片段内,所述间隔分子的结构可以相同或不同,所述间隔分子的结构包括线性结构或分叉结构。
优选地,所述官能团是马来酰亚胺、卤代乙酰基、氨基、巯基、叠氮基、炔基、肼基、胺氧基、醛基或酮基中的至少一种。
优选地,所述氨基还包括通过化学转换反应由氨基进一步转换生成的巯基;所述化学转换反应包括与Traut试剂或与N-乙酰基-DL-高半胱氨酸硫代内酯试剂发生的化学反应。
优选地,所述马来酰亚胺具有如式(6)或式(7)所示的结构,
式(7)中R为直链烷基;
所述醛基或酮基具有如式(14)所示的结构,
式(14)中,R1=H或直链烷基,R2为直链烷基或烷氧基。
优选地,所述基本骨架包括具有式(1)或(2)所示的结构,
式(1)和(2)中,n=1,2,3,4,R为所述骨架上的官能团;
或具有式(3)所示的结构,
式(3)中,n=1,2,3,R为所述骨架上的官能团;
或具有式(4)所示的结构,
式(4)中,n=1,2;
或具有式(5)所示的结构,
优选地,所述单链DNA片段是通过化学合成带特定官能团的引物和生物合成PCR复制扩增获得的一段长度特定的片段,其序列通常与被测样品无关,其长度和序列可依据检测要求做调整和变化。
本发明的有益效果如下:
(1)本方法能够将单个荧光染料可标记的STR片段数目扩大一倍甚至更多;
(2)解决了多色(5色以上)染料标记STR片段时因有较严重的荧光交叉问题而导致仪器检测时难以确定各个染料标记的片段归属(即基因分型)问题。
本发明方法将各染料的光谱交叉对检测的影响降低到最小。因此,本发明对未来的STR检测中需要增加更多基因座提供了一个独特而有效的解决方案,可望成为今后的DNA检测诊断技术中一个强大的技术平台。
附图说明
图1为本发明的设计思路示意图;
图2a为化学合成荧光染料标记的引物和利用PCR技术合成STR片段;
图2b为利用移位方法实现染料能够标记更多片段的原理示意图;
图2c为染料荧光光谱交叉示意图;
图3为四色荧光交叉的染料标记相同长度的DNA引物的设计策略示意图;
图4为本发明方法的应用示意图;
图5为本发明方法的应用示意图;
图6为间隔分子与染料,脚手架分子,引物的连接情况示意图。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
本发明针对基于五色荧光标记多基因座STR检测体系的局限性,独创性地提出利用化学连接法将一个特定长度的DNA片段有选择地连接到不同荧光标记的STR片段上,从而达到两个目的:(1)单个荧光染料能够标记的STR片段数可以扩展一倍甚至更多倍;(2)当多色染料(多于5色)用来标记更多STR片段时,会因染料间较严重的荧光光谱交叉问题而在被检测时难以确定各个特定的染料,从而不能确定所标记片段的基因座归属(即基因分型);本方法通过化学连接实现序列长度在识别空间排布上移位,从而将光谱交叉的染料标记片段错位,不再同时被检测,因而可以准确确定片段标记所用的染料。
本发明利用化学连接方法改变被检片段的原有长度,达到被检片段在识别空间上有序地错位和扩大片段长度检测范围,从而不仅能够扩展单个荧光染料可标记的基因座STR片段数,而且能够解决多色染料(5色以上)在标记STR片段时因较严重的荧光光谱交叉问题而导致仪器检测时难以确定各个染料标记的片段基因座归属(基因分型)问题。
本发明的设计思路如图1所示。
本发明方法包括两个部分,分别针对两种不同的用途:
1.拓展单个荧光染料能够标记的STR片段数目。
图2中示意了拓展单个荧光染料标记STR片段数目的方法,如图2a所示,首先,单独通过化学合成和生物合成PCR技术复制扩增获得一长度特定(例如,220bp)的单链DNA片段,这些合成的单链DNA片段上带有用于化学连接的官能团;然后,在设计引物时,对荧光标记的正向引物作一个化学结构上略有变化的设计,让一些基因座下的引物保持正常的染料标记结构,而另一些基因座下的引物在染料标记之前先引入一个带有可用于化学连接的脚手架分子;引入的每个脚手架分子上至少含有三个可发生化学反应的官能团三个官能团中的一个官能团与引物连接,一个官能团与染料连接,还有一个官能团与单链DNA片段连接,这样即可使引物的5’端带上一个可与脚手架分子发生化学连接的单链DNA片段;这个单链DNA片段的长度可依据不同的检测要求作调整和变化;如图2b和2c所示,在对STR片段进行PCR复制或扩增之后,把预先合成的长度特定的单链DNA片段加入到PCR纯化产物的溶液中,被连接有脚手架分子的引物扩增的STR片段则与预先合成的长度特定的单链DNA片段通过脚手架分子和单链DNA片段上的各自的官能团发生化学连接反应,反应时间一般为15-20分钟,反应完毕后溶液体系即可产生两种不同长度的片段,一种是没有发生化学连接反应的原PCR片段(片段1),其长度没有变化;另一种是已经发生化学连接反应导致长度增长的新片段(片段2),将含片段1和片段2的混合溶液的样品可通过正常的仪器分析进行检测,原本长度相同的片段因为一个长度增长,在电泳时发生检测时间上的分离而被准确检测到。
利用本方法,每一种染料能够标记的基因座数可增加约一倍,从而可将目前各种STR检测中的有限基因座数扩展约一倍;例如,目前身份鉴定中使用的21个位点就可扩展到40个位点以上。
本发明方法中用到的引入脚手架分子的染料标记的引物在结构上可以在染料、脚手架分子,引物三者之间设有间隔分子,在同一个片段上,间隔分子可以是相同的,也可以是不同的,所用到的间隔分子可以是线性的,也可以是分叉的,例如线性结构为NH2-(CH2)n-COOH(n=1,2,3,4,….16),间隔分子与染料,脚手架分子,引物的连接情况如图6所示。
单独通过化学和生物合成PCR技术合成一段长度特定且在5’端带一个可与脚手架分子的官能团发生化学连接的单链DNA片段的序列和长度的设计策略:
上述的单链DNA片段序列可以使用任意的DNA序列,但是选择序列时须遵循以下原则:
(1)序列有足够的稳定性,包括难以形成发夹结构,及避开酶切位点等;
(2)易于合成;
单链DNA片段的长度主要是根据传统的检测序列长度范围而定,一般而言,这个片段的序列长度达到或恰好超过传统的检测范围即可,例如,当传统的检测序列长度范围为80-350bp时,设计的片段长度即可使用该范围的跨度,即270bp(350-80=270)。
引入的脚手架分子是带有化学反应官能团的分子,通常是由一个基本骨架和可用于化学连接的基团组成。
骨架可包括如下三种:
a.以D-,或L-,或DL-赖氨酸或其他类似侧链为氨基的氨基酸为骨架的脚手架分子,骨架结构如式(1)或(2)所示:
其中,式(1)和(2)中n=1,2,3,4,R为用于与单链DNA片段连接的官能团,骨架上的氨基可以被包括在R官能团之内;
b.以D-,或L-,或DL-冬氨酸,谷氨酸或其他类似的侧链为羧基的氨基酸为骨架的脚手架分子,骨架结构如式(3)所示:
其中,式(3)中,n=1,2,3,R为用于与单链DNA片段连接的官能团,骨架上羧基可以被包括在R官能团之内;
c.以D-,或L-,或DL-半胱氨酸或其他类似的侧链为巯基的氨基酸为骨架的脚手架分子,骨架结构如式(4)所示:
其中,式(4)中,n=1,2;
d.以核苷酸单元为基本骨架,在其碱基上引入其他化学官能团的脚手架分子,骨架结构如式(5)所示:
骨架上用于化学连接的基团具有式(6-14)所示的结构:
式(6)和(7)为马来酰亚胺,式(7)中R为直链烷基;
式(8)为碘代乙酰基;
式(9)为巯基;
当连接的基团为氨基时,包括可以通过化学转换反应,如与Traut试剂反应,与N-乙酰基-DL-高半胱氨酸硫代内酯反应转换成巯基的氨基;
式(10)为叠氮基;
式(11)为炔基;
式(12)为肼基,式(13)为胺氧基
式(14)中,R1=H或直链烷基,R2为直链烷基或烷氧基;
单链DNA片段上的官能团可以为具有式(6)至(14)所示的结构。
实施例1
在DNATyper 15 Plus身份鉴定试剂盒中,用染料FAM标记12个基因座(Amelogenin*2,D5S818*2,D21S11*2,D7S820*2,CSF1P0*2,D3S1358*2),在染料FAM和引物DNA片段之间加入一个连接着具有式(8)所示结构官能团的脚手架分子;当PCR完成后,将预先合成好的长度特定(300bp)的一段单链DNA片段加入到通过PCR扩增纯化后得到的混合溶液中,20分钟后化学连接反应完成;所得的溶液进行毛细管电泳和荧光检测;新增的基因座尽管所用标记的染料相同,但是标记的片段尺寸不同,在识别空间排布上发生了一定距离的位移,与原来检测的尺寸范围完全不重叠,因此这些新增的基因座可以被检测和分辨,从而实现基因分型。
2.以四色染料为例,解决标记STR片段的多色染料较严重的荧光光谱交叉问题。
如图3,4,5所示,在引物设计中,将荧光光谱交叉严重的染料(D1,D2,D3,D4,如图3所示)先划分成两组(D1和D3为一组,D2和D4为另一组,让每组的染料荧光光谱的交叉尽可能小),对其中一组的染料在标记引物时采用常规标记方法,而另一组采用拓展单个荧光染料标记STR片段数目的方法,即在染料和DNA引物片段之间先引入一个脚手架分子;在对STR片段进行PCR扩增后,将预先合成好的长度特定的单链DNA片段加入到该PCR纯化产物的混合溶液中,被连接有脚手架分子的引物扩增的STR片段则与预先合成的长度特定的单链DNA片段通过脚手架分子和单链DNA片段上的各自的官能团发生化学连接反应,待化学连接反应结束后,该混合溶液中包含保持长度不变的片段1和片段3,还有长度已经增长的片段2和片段4(如图4所示);通过仪器对混合溶液进行检测分析时,由于部分STR片段连接了一个长度特定的单链DNA片段,容,导致电泳时停留时间滞后,因此避免了被发生光谱交叉的染料标记的片段同时被检测到的情况,从而避免了多种染料间较严重的荧光交叉问题。
图3中显示了四条被染料标记的引物,图中D1,D2,D3,D4为染料,D1和D3标记的引物结构相同,D2和D4标记的引物在染料和引物之间加入一个脚手架分子。图4表示图3中的4个引物用于STR片段经PCR扩增后再和长度特定的单链DNA片段进行化学连接,只有染料D2和D4标记的片段2和片段4才可以发生片段连接,长度增长,而染料D1和D3标记的片段1和片段3因不能发生化学连接,长度不变。
图5表示四个片段在电泳时发生分离,其中染料D1和D3标记的片段1和片段3因长度相同,电泳移动速度相同处于一组,而染料D2和D4标记的片段2和片段4在空间排布上发生位移,与染料D1和D3标记的片段1和的片段3分离处于另一组,这样D1和D2、D2和D3、D3和D4彼此间荧光光谱因片段1,片段2,片段3,片段4不同不再在同时被检测到,从而避免荧光光谱交叉干扰。
实施例2
在八色荧光染料标记40个基因座的身份鉴定中,八色染料可以为FAM,HEX,TMR,ROX,Cy5,Cy5.5,Cy7,Cy7.5;由于荧光光谱交叉的原因,可将八色染料分为两组,A组为FAM,TMR,Cy5,Cy7;B组为HEX,ROX,Cy5.5,Cy7.5;对于A组标记的引物,采用常规的标记方法;而对于B组染料标记的引物则采用拓展单个荧光染料标记STR片段数目的方法,即在染料和DNA引物片段之间先引入一个脚手架分子;在对STR片段进行PCR扩增后,将预先合成好的长度特定的单链DNA片段加入到该PCR纯化产物的混合溶液中,被连接有脚手架分子的引物扩增的STR片段则与预先合成的长度特定的单链DNA片段通过脚手架分子和单链DNA片段上的各自的官能团发生化学连接反应,20分钟后化学连接反应完成。所得的溶液进行毛细管电泳和荧光检测,由于容易产生荧光光谱交叉的染料标记DNA片段均与一个特定长度的DNA片段发生化学连接从而导致片段增长,与原来有光谱交叉的片段在空间排布上有位移,不再同时被检测,因而各个片段均可较容易被检测和分辨,达到基因分型的目的。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!