控制大白菜生长的BrVQ3‑1基因及其应用的制作方法
本发明涉及一种控制大白菜生长的BrVQ3-1基因及其应用,特别是一种负调控大白菜生长的BrVQ3-1基因及其应用,属于分子生物学技术领域。
背景技术:
大白菜(Brassica rapa L.ssp.pekinensis)起源于中国,是我国乃至世界性的重要蔬菜作物之一。叶球是大白菜食用的最主要器官,其大小是目前开展大白菜育种工作所要考虑的一个重要经济性状。多年的生产实践表明,大白菜叶球的大小受严格的遗传控制,受相关基因表达调控的影响。开展大白菜叶球大小相关基因的研究对于遗传上控制叶球的大小,提高作物产量和品质有重要的理论意义和实用价值。
不同物种间,植物器官的大小有着显著的差异,但在物种内个体之间器官的大小相对一致,说明植物器官的大小受到严格的遗传控制。已有的研究表明,在植物体中存在多个控制器官大小的基因,例如ANT、AtGRF1-AtGRF5、ARGOS、BrARGOS、AtGIF1、STN1、AtMRB1、ANGUSTIFOLIA、AtEXP10、ARL、ROT3、RON2/LUG以及BPE基因等。它们可通过协调细胞分裂和生长来决定器官大小。例如,过量表达AtGRF1和AtGRF2的拟南芥产生较大的叶片和子叶。相反,atgrf1-atgrf2-atgrf3三突变体产生较小的叶片和子叶,这些表型变化是由于细胞体积的增加或减小所致,这表明AtGRF蛋白调节叶片和子叶组织细胞的延伸。由于在叶宽轴方向上的细胞数目减少,GIF1功能缺失突变体产生了较窄的叶片和花瓣,说明GIF1基因控制叶片和花瓣的生长和形状。
VQ蛋白是一类与生长发育以及响应外界环境胁迫等功能相关的植物特异性转录调控辅助因子,其氨基酸序列仅在VQ结构域:“FxxxVQxLTG”(其中x代表任意氨基酸)处高度保守,而其他位置的序列则相对多变。对拟南芥部分VQ基因的生物学功能的研究发现,其在调控种子、下胚轴、花、叶等器官的生长发育过程中具有重要作用。例如,Cheng等对拟南芥VQ8基因的研究发现,其功能缺失突变株在其整个生长发育期都表现出叶片黄绿和生长发育迟缓等表型,而且VQ17、VQ18和VQ22的过量表达植株的生长也受到了严重的抑制。由于VQ基因仅在近几年才被科学家所认知,所以大部分生物VQ基因的功能未知,甚至作为模式植物的拟南芥的大部分VQ家族成员的生物学功能也未被研究。
技术实现要素:
本发明针对现有技术的不足,提供一种控制大白菜生长的BrVQ3-1基因及其应用。
一种控制大白菜生长的BrVQ3-1基因,核苷酸序列如SEQ ID No.1所示。
上述BrVQ3-1基因全长693bp,编码230个氨基酸,在进化上,与BrVQ3-1基因具有较近亲缘关系的为拟南芥AtVQ3基因;二者的核苷酸序列一致性仅为72.22%,氨基酸序列一致性仅为67.35%,种间差异较大。另外,到目前为止关于拟南芥等生物的VQ3基因功能仍未知。
一种由上述BrVQ3-1基因编码的调控因子,氨基酸序列如SEQ ID No.2所示。
一种插入上述SEQ ID No.1所示核苷酸序列的重组载体。
上述BrVQ3-1基因、重组载体在经济作物生产改良中的应用。
根据本发明优选的,所述经济作物为大白菜。
有益效果
本发明从大白菜中首次克隆了BrVQ3-1基因,并验证了该基因具有负调控植物细胞生长的功能,经试验,通过过量表达该基因,可以获得比野生型植株体型小的转基因植株。本发明的基因可为培育农作物新品种提供理论依据和基因来源。
附图说明
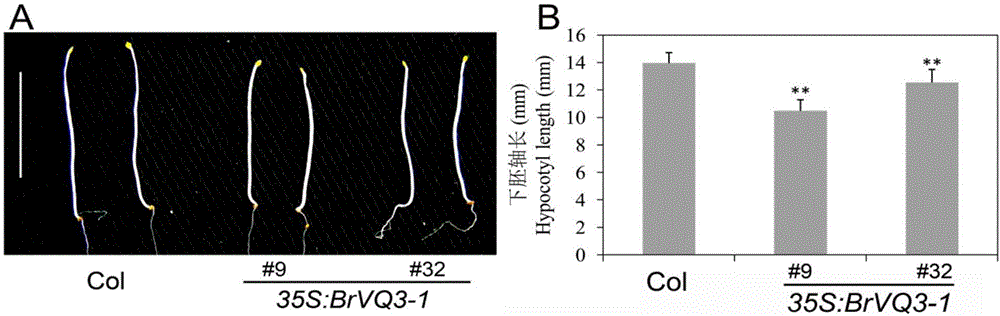
图1为1/2MS培养基上暗处生长6天的野生型和转基因拟南芥植株下胚轴的对比图;
图中:A为野生型和转基因植株下胚轴的表型照片,B为野生型和转基因植株下胚轴的测量数据柱状图;
图2为1/2MS培养基上生长10天的野生型和转基因拟南芥植株根的对比图;
图中:A为野生型和转基因植株根的表型照片,B为野生型和转基因植株根的测量数据柱状图;
图3为蛭石上生长30天的野生型和转基因拟南芥植株的对比图;
图中:A为野生型和转基因植株整体表型照片,B为野生型和转基因植株不同叶位叶的表型照片,C为野生型和转基因植株不同叶位叶的面积测量数据柱状图。
具体实施方式
下面结合实施例及说明书附图对本发明的技术方案做进一步说明,但本发明所保护范围不限于此。
实施例
大白菜mRNA的提取
以大白菜品种福山包头10天苗龄幼苗的地上部分为材料,置于液氮预冷的研钵中,加入液氮快速磨成粉末,将100mg粉末装入1.5ml离心管中,加入1ml Trizol(购自Invitrogen公司)颠倒混匀,室温静置10分钟。在4℃,12000rpm离心10分钟,取上清液移至新的1.5ml离心管中。加入200μl氯仿,用手剧烈摇晃15秒钟,室温静置2-3分钟。4℃,12000rpm离心10分钟。取无色上层水相至一新的离心管中,加入600μl-20℃冰箱预冷异丙醇,颠倒混匀,室温静置10分钟。4℃,12000rpm离心10分钟,除上清液。加入1ml 75%(v/v)乙醇,涡旋震荡。4℃,7500rpm离心3分钟。室温干燥3-5分钟,加入30μl的无RNase的水溶解沉淀,然后置于55℃水浴中溶解10分钟,迅速冰浴5分钟后瞬时离心,制得mRNA。
BrVQ3-1基因的获得
利用RT-PCR方法扩增BrVQ3-1基因的核苷酸序列,具体操作方法如下:
将制得的mRNA反转录成第一链cDNA,所用反转录酶为Takara公司生产的M-MLV reverse transcriptase,反应体系为20μl。依次加入1μl oligo dT、2μg RNA和无RNase水至13.5μl,在70℃水浴中变性5分钟,迅速冰浴5分钟,瞬时离心,然后依次加入1μl 10mM dNTP,4μl 5×RT缓冲液,0.5μl RNase inhibitor和1μl反转录酶。混合均匀,42℃反应60分钟,70℃水浴10分钟使酶失活,制得第一链cDNA。
以第一链cDNA为模板扩增目的基因,引物核苷酸序列如下:
BrVQ3-1-C-F:5'-GCTCTAGACGGGATCCATGGATAATAAATCTC-3'(SEQ ID NO.3)
BrVQ3-1-C-R:5'-AACTGCAGGCGACCTAACAATCAAAAAAA-3'(SEQ ID NO.4)
PCR反应体系为25μl,依次加入10×PCR缓冲液2.5μl,2.5mM dNTP 2μl,第一链cDNA 2μl,10mM正向引物0.5μl,10mM反向引物0.5μl,5U/μl Taq DNA聚合酶0.25μl,最后加水至25μl。
PCR反应条件:预变性94℃3分钟;变性94℃30秒,退火58℃30秒,延伸72℃2分钟,30个循环;最后延伸10分钟,4℃保存。
将上述PCR产物经琼脂糖凝胶电泳后,加入pUC18 DNA vector中:pUC18 DNA vector由Takara公司产售,经连接反应,然后将连接产物转化大肠杆菌DH5α感受态细胞进行检测,取阳性菌株,制得连接好的载体;
上述连接体系10μl,各组分为:1μl pUC18 DNA vector,2μl PCR产物,1μl T4 DNA连接酶,1μl 10×反应缓冲液,加水补至10μl;上述连接条件为:16℃水浴中反应12-16小时。
将连接好的载体进行测序,确认正确无误,经检测,BrVQ3-1基因的核苷酸序列如SEQ ID NO.1所示,全长693bp,编码230个氨基酸。在进化上BrVQ3-1基因与拟南芥AtVQ3基因具有较近的亲缘关系;二者的核苷酸序列一致性为72.22%,氨基酸序列一致性为67.35%。
转基因植株的获得
将上述连接好的载体用Takara公司生产的XbaI和PstI内切酶酶切,操作如下:
反应体系50μl,包括7.5μl 10×T缓冲液,20μl连接好的载体,2μl XbaI内切酶,2μl PstI内切酶和18.5μl水;反应条件为:在37℃水浴4个小时;
将酶切后的BrVQ3-1基因经琼脂糖凝胶电泳后,用杭州博日科技有限公司产售的Biospin Gel Extraction Kit回收基因片段,操作如下:用干净、锋利的手术刀,将含有BrVQ3-1基因的琼脂糖凝胶切下,并放入1.5ml离心管中。按体积比1:3的比例加入Extraction buffer。于50℃恒温水浴中直到凝胶融化。将混合液全部转入Spin column内,于6000rpm离心1分钟,弃去接液管内液体。向Spin column中加入500μl Extraction buffer,于12000rpm离心1分钟,弃去接液管内液体。向Spin column中加入750μl Wash Buffer,于12000rpm离心1分钟,弃去接液管内液体。再次于12000rpm离心1分钟,然后将Spin column转移至无菌的1.5ml离心管内。向Spin column中加入50μl Elution Buffer,并于室温放置1分钟。12000rpm离心1分钟,收集含有BrVQ3基因的溶液。上述详细操作可参见Biospin Gel Extraction Kit的产品使用说明书。
将上述酶切回收的BrVQ3-1基因片段连接入植物表达载体pCAMBIA2300-35S-OCS(购自Biovector公司)中,操作如下:
反应体系10μl,包括1μl pCAMBIA2300-35S-OCS,5μl含有BrVQ3-1基因的溶液,1μl10×T4连接酶缓冲液和1μl T4连接酶,加水至10μl;反应条件为:在16℃下连接12~16小时;
经上述反应,制得质粒DNA,然后将质粒DNA转化大肠杆菌DH5α感受态细胞,提取质粒进行鉴定,制得构建好的质粒DNA。
将构建好的质粒DNA转入农杆菌LBA4404(购自Biovector公司)中,操作如下:
取100μl农杆菌LBA4404细胞溶液经电击制备农杆菌感受态细胞,加入3μl构建好的质粒DNA,冰浴5分钟,液氮冷冻1分钟,37℃水浴5分钟,然后加入1ml LB培养基(1升LB培养基含:5g酵母提取物、10g胰蛋白胨、10g氯化钠),28℃,200rpm振荡3小时。10000rpm离心1分钟,弃上清,加入100μl LB培养基重悬细胞,涂布于含有50mg/L卡那霉素、50mg/L利福平的LB平板培养基上(1升LB平板培养基含:5g酵母提取物、10g胰蛋白胨、10g氯化钠、15g琼脂),28℃培养2~3天,选取经转化后的农杆菌LBA4404;
通过浸花法将上述经转化后的农杆菌LBA4404转化拟南芥(Columbia ecotype),操作如下:
将经转化后的农杆菌LBA4404接种于5ml LB培养基中,28℃,200rpm振荡过夜,按2wt%的接种量接种于200ml新鲜LB培养基中,继续培养至OD600为1.0,4500rpm离心5分钟收集菌体,重悬于侵染液中,将拟南芥的花序浸入侵染液中30秒,把花盆侧放于托盘中,蒙上地膜避光24小时,第二天取下地膜,将花盆直立;
上述侵染液含有5wt%蔗糖,0.03wt%Tween(吐温)-20。
制备1/2MS筛选平板(1/2MS培养基加50mg/L卡那霉素,100mg/L羧苄青霉素),T1代种子用70%(v/v)乙醇消毒5分钟,2wt%次氯酸钠消毒10分钟后播种于1/2MS筛选平板,每板播种100μg的拟南芥种子。4℃春化3天后放于培养箱(22℃,16小时光照/8小时黑暗)中。6天后选出绿色的生长正常的阳性植株,移入蛭石中培养,单株收获T2代种子。繁殖后获得T3代,鉴定T3代,获得纯合的转基因株系10株。
BrVQ3-1基因功能的鉴定
纯合的转基因株系和野生型拟南芥种子在4℃冰箱中春化3天,消毒后将种子播于1/2MS培养基平板。一部分于22℃,16小时光照/8小时黑暗培养箱中6天,选取转基因株系中的任意两株检测下胚轴的长度(结果如图1所示)。一部分置于培养间(22℃,16小时光照/8小时黑暗)中培养,生长10天时检测根的长度(结果图2所示)。
待1/2MS培养基平板上生长的幼苗的子叶完全张开后,将转基因株系和野生型幼苗转入蛭石中,然后置于培养间(22℃,16小时光照/8小时黑暗)中培养,培养30天后观察纯合的转基因株系和野生型植株的表型(结果如图3所示)。通过观察发现纯合的转基因株系比野生型植株显著减小,说明BrVQ3-1基因的过量表达抑制了植物的生长,从而使得植物器官减小。
SEQUENCE LISTING
<110> 山东省农业科学院蔬菜花卉研究所
<120> 控制大白菜生长的BrVQ3-1基因及其应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 693
<212> DNA
<213> Brassica rapa L. ssp. Pekinensis
<400> 1
atggataata aatctccaag atcaaaagaa atcttgggac caagaccaac tccattgaaa 60
atccgtaaag actctcacaa gatcatcaag aagccaccac tagcgccaca accactacaa 120
tcacaaccac cgcagctaca cgagcaagaa ccatcacaac tattgcctcc acgcggtcca 180
gtgataatat acactgtatc tcccaagatt atacatacac atcctaataa cttcatgaca 240
ttggttcaac gtctcacagg caaaacctct acccccacaa ttccatcctc ctcttctcca 300
taccccttag cactagacta cacatctgca tcaagagaca cgtcagcagt gttcgatgca 360
tcccgtggtt cgatatctcc ggcggctagg tatgctgcga tggagaaagc taatgtttca 420
aatgaactag ggtttgtggg tggcatagag agcacgaatc aatattacca acatgaccat 480
catcaaaacc gagctaccga acgtgctgga atcttgtctc cagggcccgc ttctctaccg 540
cagatatcgc cagatttctt ttctacggtt ggaggatctg atcctcaagg tttttcgtcg 600
ttcttcaatg actttagctc aatcctacaa gccactccaa cgatcccgtc tccttcttcc 660
atggaccttt tcacaaattt ttttgattgt tag 693
<210> 2
<211> 230
<212> PRT
<213> Brassica rapa L. ssp. Pekinensis
<400> 2
Met Asp Asn Lys Ser Pro Arg Ser Lys Glu Ile Leu Gly Pro Arg Pro
1 5 10 15
Thr Pro Leu Lys Ile Arg Lys Asp Ser His Lys Ile Ile Lys Lys Pro
20 25 30
Pro Leu Ala Pro Gln Pro Leu Gln Ser Gln Pro Pro Gln Leu His Glu
35 40 45
Gln Glu Pro Ser Gln Leu Leu Pro Pro Arg Gly Pro Val Ile Ile Tyr
50 55 60
Thr Val Ser Pro Lys Ile Ile His Thr His Pro Asn Asn Phe Met Thr
65 70 75 80
Leu Val Gln Arg Leu Thr Gly Lys Thr Ser Thr Pro Thr Ile Pro Ser
85 90 95
Ser Ser Ser Pro Tyr Pro Leu Ala Leu Asp Tyr Thr Ser Ala Ser Arg
100 105 110
Asp Thr Ser Ala Val Phe Asp Ala Ser Arg Gly Ser Ile Ser Pro Ala
115 120 125
Ala Arg Tyr Ala Ala Met Glu Lys Ala Asn Val Ser Asn Glu Leu Gly
130 135 140
Phe Val Gly Gly Ile Glu Ser Thr Asn Gln Tyr Tyr Gln His Asp His
145 150 155 160
His Gln Asn Arg Ala Thr Glu Arg Ala Gly Ile Leu Ser Pro Gly Pro
165 170 175
Ala Ser Leu Pro Gln Ile Ser Pro Asp Phe Phe Ser Thr Val Gly Gly
180 185 190
Ser Asp Pro Gln Gly Phe Ser Ser Phe Phe Asn Asp Phe Ser Ser Ile
195 200 205
Leu Gln Ala Thr Pro Thr Ile Pro Ser Pro Ser Ser Met Asp Leu Phe
210 215 220
Thr Asn Phe Phe Asp Cys
225 230
<210> 3
<211> 32
<212> DNA
<213> 人工合成
<400> 3
gctctagacg ggatccatgg ataataaatc tc 32
<210> 4
<211> 29
<212> DNA
<213> 人工合成
<400> 4
aactgcaggc gacctaacaa tcaaaaaaa 29
- 还没有人留言评论。精彩留言会获得点赞!