一种植物根际盐碱土中木霉菌的快速分离方法与流程
本发明涉及微生物分离领域,特别地,涉及一种植物根际盐碱土中木霉菌的快速分离方法。
背景技术:
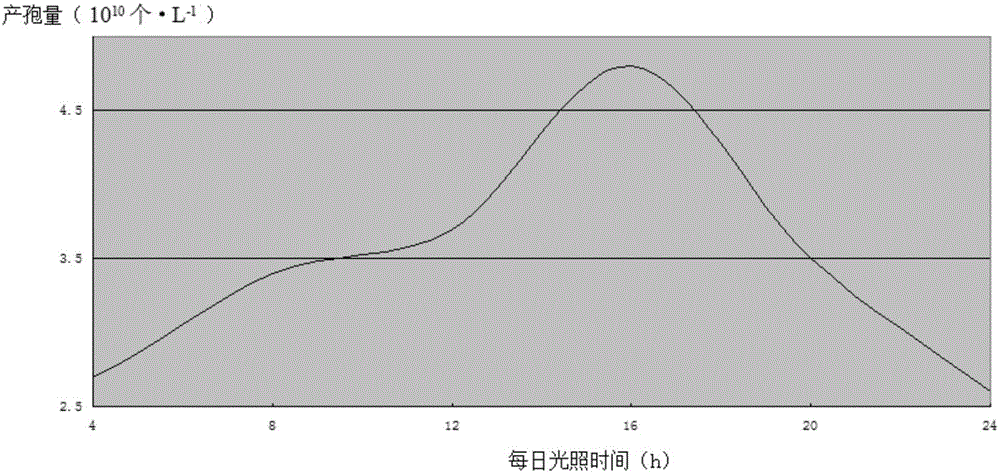
:木霉菌属真菌界,半知菌门,丝孢纲,丝孢目,丛梗孢科,木霉属,广泛存在于不同环境条件下的土壤中。自19世纪中叶,人类对木霉菌已有了初步的认识,但直到上世纪60年代木霉菌的分类地位才得以确定。大多数木霉菌可产生多种对植物病原真菌、细菌及昆虫具有拮抗作用的生物活性物质,比如细胞壁降解酶类和次级代谢产物,并能提高农作物的抗逆性,促进植物生长和提高农产品产量,因此被广泛用于生物防治、生物肥料及土壤改良剂。由于化学农药对环境的负面影响较为严重,所以对环境较为友好的生物农药木霉菌受到了广泛的关注。中国发明专利CN104946543A公开了一种植物根际木霉菌分离方法,该方法可在植物根系及根际土壤中分离出多种木霉菌,分离速度快、效率高,保证多样性鉴定的需求,免去单孢分离的步骤。但是该方法未针对盐碱土的特殊条件做进一步的研究,其部分提取条件不适用于盐碱土中木霉菌的快速分离。本发明鉴于植物根际盐碱土中木霉菌群落密度低、种类多样性少、分离方法难度大、分离速度和效率低、分离获得的木霉菌种类单一等问题,进而研发一种适合于植物根际盐碱土中木霉菌快速分离技术。技术实现要素:本发明目的在于提供一种植物根际盐碱土中木霉菌的快速分离方法,以解决技术问题。一种植物根际盐碱土中木霉菌的快速分离方法,包括以下步骤:A、取土样:将表层干土去除,取0-20cm土层土壤,置于室温风干,并经网孔为1mm的筛子进行过筛处理;然后根据采集土壤的所属区域、土壤质地、作物和环境条件等对土样进行分类和编号,并对不同编号土样pH进行测定;B、配制土壤稀释液:准确称取待测盐碱土样l0g,放入装有90mL无菌水的150mL三角瓶中,并加入10个玻璃珠置于25℃摇床上130-160rpm振荡1.5-2.5h,使土壤中的微生物均匀分散,然后静置20-30s,即为10倍土壤稀释液,再依此稀释为100和1000倍土壤稀释液备用;C、土壤稀释液中木霉菌的分离:采用“涂布法”将不同稀释倍数的土壤稀释液分别接种于PDA培养基进行分离培养;然后,将制备好的不同稀释倍数土壤稀释液分别吸取200uL均匀涂布于PDA培养基,并置于超净工作台风干150-200s,待风干后置于25℃和16/8h光照和黑暗条件下培养;培养3天后分别记录接种不同稀释倍数土壤稀释液后每个培养基中木霉菌的菌落数量,并计算每份土样中木霉菌的分离效率,每份土样共设置3个处理,每个处理6个重复;D、木霉菌纯化:培养3天后,将培养基中菌落形态类似于木霉菌的菌落分别用接种针挑出接种于PDA培养基进行纯化培养,每个菌落6个重复;待菌落培养产孢后(5天左右),用直径为0.5cm灭菌的打孔器制取木霉菌株的菌饼接种于PDA培养基进行二次纯化培养,每个菌落6次重复;二次纯化培养2天后开始记录每个菌落的形态特征,并每隔一天记录一次,同时用数码相机对其拍照记录菌落的形态特征;6天后,转接于斜面培养基4℃保存备用。优选的,所述的步骤C中的PDA培养基中含有0.05-0.15%农用链霉素。优选的,所述的步骤C中,采用1000倍土壤稀释液。本发明具有以下有益效果:本发明的植物根际盐碱土中木霉菌的快速分离方法,主要通过植物根际盐碱土壤采集和取样方法;采集后土壤处理和土壤稀释液的制备;分离培养基的筛选和改良;分离菌株活化、培养和鉴定等技术的发明,以及不同土壤稀释液中木霉菌的分离菌落数量的测定,研发获得植物根际盐碱土中木霉菌快速分离技术。该技术可显著提高盐碱土中木霉菌的分离效率、分离速度、种类多样性,以及1000倍土壤稀释液可作为最佳的稀释浓度用于植物根际盐碱土中木霉菌快速分离,同时该方法简单、方便、易行。本研究可用于不同生境土壤和不同种类植物根际土壤中木霉菌的分离,进而解决了盐碱土中木霉菌分离效率低和分离技术难度大等问题,加快了木霉菌资源收集进度。除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将对本发明作进一步详细的说明。附图说明图1:每日光照时间与产孢量的正态分布图。具体实施方式以下对本发明的实施例进行详细说明,但是本发明可以根据权利要求限定和覆盖的多种不同方式实施。以甘肃省张掖等地植物(辣椒、杨树、玉米、棉花、西瓜和向日葵)根际周围2cm盐碱土壤作为供试土样。实施例1一种植物根际盐碱土中木霉菌的快速分离方法,包括以下步骤:A、取土样:将表层干土去除,取0-20cm土层土壤,置于室温风干,并经网孔为1mm的筛子进行过筛处理;然后根据采集土壤的所属区域、土壤质地、作物和环境条件等对土样进行分类和编号,并对不同编号土样pH进行测定;B、配制土壤稀释液:准确称取待测盐碱土样l0g,放入装有90mL无菌水的150mL三角瓶中,并加入10个玻璃珠置于25℃摇床上150rpm振荡2h,使土壤中的微生物均匀分散,然后静置25s,即为10倍土壤稀释液,再依此稀释为1000倍土壤稀释液备用;C、土壤稀释液中木霉菌的分离:采用“涂布法”将不同稀释倍数的土壤稀释液分别接种于PDA培养基进行分离培养;然后,将制备好的不同稀释倍数土壤稀释液分别吸取200uL均匀涂布于PDA培养基,并置于超净工作台风干180s,待风干后置于25℃和16/8h光照和黑暗条件下培养;培养3天后分别记录接种不同稀释倍数土壤稀释液后每个培养基中木霉菌的菌落数量,并计算每份土样中木霉菌的分离效率,每份土样共设置3个处理,每个处理6个重复;D、木霉菌纯化:培养3天后,将培养基中菌落形态类似于木霉菌的菌落分别用接种针挑出接种于PDA培养基进行纯化培养,每个菌落6个重复;待菌落培养产孢后,用直径为0.5cm灭菌的打孔器制取木霉菌株的菌饼接种于PDA培养基进行二次纯化培养,每个菌落6次重复;二次纯化培养2天后开始记录每个菌落的形态特征,并每隔一天记录一次,同时用数码相机对其拍照记录菌落的形态特征;6天后,转接于斜面培养基4℃保存备用。所述的步骤C中的PDA培养基中含有0.1%农用链霉素。实施例2一种植物根际盐碱土中木霉菌的快速分离方法,包括以下步骤:A、取土样:将表层干土去除,取0-20cm土层土壤,置于室温风干,并经网孔为1mm的筛子进行过筛处理;然后根据采集土壤的所属区域、土壤质地、作物和环境条件等对土样进行分类和编号,并对不同编号土样pH进行测定;B、配制土壤稀释液:准确称取待测盐碱土样l0g,放入装有90mL无菌水的150mL三角瓶中,并加入10个玻璃珠置于25℃摇床上130rpm振荡2.5h,使土壤中的微生物均匀分散,然后静置20s,即为10倍土壤稀释液,再依此稀释为1000倍土壤稀释液备用;C、土壤稀释液中木霉菌的分离:采用“涂布法”将不同稀释倍数的土壤稀释液分别接种于PDA培养基进行分离培养;然后,将制备好的不同稀释倍数土壤稀释液分别吸取200uL均匀涂布于PDA培养基,并置于超净工作台风干150s,待风干后置于25℃和16/8h光照和黑暗条件下培养;培养3天后分别记录接种不同稀释倍数土壤稀释液后每个培养基中木霉菌的菌落数量,并计算每份土样中木霉菌的分离效率,每份土样共设置3个处理,每个处理6个重复;D、木霉菌纯化:培养3天后,将培养基中菌落形态类似于木霉菌的菌落分别用接种针挑出接种于PDA培养基进行纯化培养,每个菌落6个重复;待菌落培养产孢后,用直径为0.5cm灭菌的打孔器制取木霉菌株的菌饼接种于PDA培养基进行二次纯化培养,每个菌落6次重复;二次纯化培养2天后开始记录每个菌落的形态特征,并每隔一天记录一次,同时用数码相机对其拍照记录菌落的形态特征;6天后,转接于斜面培养基4℃保存备用。所述的步骤C中的PDA培养基中含有0.15%农用链霉素。实施例3一种植物根际盐碱土中木霉菌的快速分离方法,包括以下步骤:A、取土样:将表层干土去除,取0-20cm土层土壤,置于室温风干,并经网孔为1mm的筛子进行过筛处理;然后根据采集土壤的所属区域、土壤质地、作物和环境条件等对土样进行分类和编号,并对不同编号土样pH进行测定;B、配制土壤稀释液:准确称取待测盐碱土样l0g,放入装有90mL无菌水的150mL三角瓶中,并加入10个玻璃珠置于25℃摇床上160rpm振荡1.5h,使土壤中的微生物均匀分散,然后静置20s,即为10倍土壤稀释液,再依此稀释为100倍土壤稀释液备用;C、土壤稀释液中木霉菌的分离:采用“涂布法”将不同稀释倍数的土壤稀释液分别接种于PDA培养基进行分离培养;然后,将制备好的不同稀释倍数土壤稀释液分别吸取200uL均匀涂布于PDA培养基,并置于超净工作台风干200s,待风干后置于25℃和16/8h光照和黑暗条件下培养;培养3天后分别记录接种不同稀释倍数土壤稀释液后每个培养基中木霉菌的菌落数量,并计算每份土样中木霉菌的分离效率,每份土样共设置3个处理,每个处理6个重复;D、木霉菌纯化:培养3天后,将培养基中菌落形态类似于木霉菌的菌落分别用接种针挑出接种于PDA培养基进行纯化培养,每个菌落6个重复;待菌落培养产孢后,用直径为0.5cm灭菌的打孔器制取木霉菌株的菌饼接种于PDA培养基进行二次纯化培养,每个菌落6次重复;二次纯化培养2天后开始记录每个菌落的形态特征,并每隔一天记录一次,同时用数码相机对其拍照记录菌落的形态特征;6天后,转接于斜面培养基4℃保存备用。所述的步骤C中的PDA培养基中含有0.05%农用链霉素。将本发明的分离方法与中国发明专利CN104946543A公开的一种植物根际木霉菌分离方法中实施例的方法进行对比,以甘肃省张掖等地植物辣椒根际周围2cm盐碱土壤作为供试土样,进行木霉菌分离,得到如下对比数据。区别实施例1CN104946543A稀释液的稀释倍数100075PDA培养基中抗生素链霉素氯霉素每日光照时间16/8h光照和黑暗无处理由于盐碱地的条件与CN104946543A的条件不同,将实施例1中的稀释液的稀释倍数调整为75倍,甚至调整到200倍,培养基中的菌落仍没有分散,不容易区分,故采用1000倍的稀释倍数。PDA培养基中抗生素调整为氯霉素,抑制细菌生长的效果基本相同,只是为了降低成本、采购方便,实施例中采用了农用链霉素。以下对光照条件对木霉菌分离的产孢量做图,得到光照条件与木霉菌分离的产孢量成正态分布关系,在16/8h光照和黑暗条件下,产孢量得到峰值(4.80(1010个·L-1)),具体参见图1。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1