用于检测PRRSV和PEDV双重RT‑PCR的方法及引物与流程
本发明属于生物领域,具体地说,涉及一种用于检测PRRSV和PEDV双重RT-PCR的方法及引物。
背景技术:
猪繁殖与呼吸综合征是由猪繁殖与综合征病毒(Porcine reproductive and respiratory syndrome vires,PRRSV)引起的猪的一种高度接触性传染病,我国俗称猪“蓝耳病”。PRRSV具有宿主专一性,仅感染猪,引起母猪繁殖障碍,仔猪呼吸系统疾病。PRRS1996年在我国首发,2001年我国爆发普通蓝耳病,而后继续发展成2006年的高致病性蓝耳病大流行。PRRS对我国养猪业带来巨大威胁,造成严重经济损失。猪流行性腹泻病(porcine epidemic diarrhea,PED)是危害我国养猪业的另一种高度接触性病毒传染病。1980年,我国首次出现猪流行性腹泻的相关报道,而后多省不断有流行性腹泻的发生,2010年,猪流行性腹泻再次在我国大规模爆发。近年来,猪流行性腹泻的流行趋势逐渐扩大,季节性越来越不明显。猪感染流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)可感染各品种、各年龄段的猪,发病猪表现为食欲饮欲下降、呕吐、急性腹泻、脱水,哺乳仔猪消化系统尚未发育完全,一但发病,死亡率可达100%。
PRRSV和PEDV均为常见的RNA病毒,近年来二者呈现出混合感染的特点。当发生PRRSV和PEDV的交叉感染时,根据流行病学和临床症状很难对其进行确诊,实验室检测技术是确诊二者混合感染的有效手段。目前实验室最常用的方法是PCR方法。单一的PCR方法只能对单一病原进行检测,一但发生混合感染,继续使用单一PCR方法进行疫病检测就会出现操作复杂、检测时间长、实验成本增加等缺点。多重PCR方法能同时对多种病原体做出快速、准确的鉴别诊断,经济、快捷、系统,在混合感染的确诊上具有明显优越性和极高的使用价值。目前,实际生产中常出现PRRSV和PEDV混合感染的情况,但却缺少能同时对这两种病毒进行检测的PCR方法。
目前,在临床检测中有分别针对PRRSV和PEDV的单一RT-PCR方法,该技术能快速准确地对这两种病毒进行确诊。2000年,娄高明,李雪梅等(娄高明,李雪梅,殷震.猪繁殖与呼吸道综合征诊断方法的研究进展[J].中国兽医杂志,1998,02:38-41.)针对PRRSV的ORF7基因设计了一对特异性引物,建立了猪繁殖与综合征RT-PCR的诊断方法,该方法能特异性扩增出433bp(欧洲株)和468bp(美洲株)的目的片段,对临床上快速、准确地检测PRRSV有极大意义。吴玉璐,程群(吴玉璐,程群,虞凌雪,侯怡轩,王康,刘光清,童光志,周艳君.猪流行性腹泻病毒RT-PCR鉴别诊断方法的建立[J].中国农业科学,2013,20:4370-4377.)于2013年建了猪流行性腹泻病毒的RT-PCR检测方法。其根据猪流行性腹泻病毒ORF3基因设计了特异性引物,能对自然感染毒株基因扩增出片段约300bp,弱毒株疫苗则能扩增出约250bp的片段。PEDV的RT-PCR检测方法的建立为猪流行性腹泻病的疫情诊断和流行病学监测提供了一种特异、快速的检测方法。
PRRSV和PEDV的单一RT-PCR方法只能对固定的病毒进行检测,不能同时对两种病毒进行检测。当发生PRRSV和PEDV混合感染时,再使用单一的RT-PCR方法对其进行检测将暴露出操作复杂、检测时间长、实验成本增加等缺点。在实际生产中常出现PRRSV和PEDV混合感染的情况,但却缺少能同时对这两种病毒进行检测的RT-PCR方法。本发明针对PRRSV的ORF7基因和PEDV的S基因,分别设计特异性引物,通过对反应体系中各组分的优化,实现了两种病毒在同一反应体系中的同时扩增。本研究建立的双重RT-PCR方法能快速有效地对PRRSV和PEDV进行诊断,对实际生产有重要意义。
技术实现要素:
有鉴于此,本发明针对上述的问题,提供了一种用于检测PRRSV和PEDV双重RT-PCR的方法及引物。引物包括PRRSV引物对和PEDV引物对;PRRSV引物对包括引物PRRSV-P1和引物PRRSV-P2,所述PEDV引物对包括引物PEDV-P1和引物PEDV-P2;所述引物PRRSV-P1、引物PRRSV-P2、引物PEDV-P1和引物PEDV-P2的核苷酸序列分别如SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3和SEQ ID NO.4所示。
进一步地,PRRSV引物对用于检测PRRSV,所述PEDV引物对用于检测PEDV。
本发明公开了一种用于检测PRRSV和PEDV双重RT-PCR的方法,包括以下步骤:
1)提取待测样品中病毒RNA;
2)将步骤1)得到的RNA反转录为cDNA;
3)将步骤2)得到的cDNA进行PCR扩增,回收目的片段克隆到pMD19-T载体,转入DH5α中,筛选,摇菌,抽提质粒;
4)将步骤3)得到的阳性质粒针对其中目的基因进行PCR扩增;
5)对扩增产物测序,以确定其中是否含有目的基因;
其中所述PRRSV目的基因是PRRSV的ORF7基因,所述PEDV目的基因是PEDV的S基因。
进一步地,步骤1)中提取待测样品中病毒RNA具体为:将待测样品组织多点取样约5g,剪碎,液氮充分研磨,加入生理盐水稀释做10倍稀释,-20℃反复冻融3次,5000r/min离心5分钟,取上清置于DEPC水预处理过的EP管保存,备用,用TRIZOL法抽提病毒RNA。
进一步地,步骤3)中用于PCR扩增的引物是引物PEDV-P1、引物PEDV-P2、引物PEDV-P1和引物PEDV-P2;所述引物PEDV-P1、引物PEDV-P2、引物PEDV-P1和引物PEDV-P2的核苷酸序列分别如SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3和SEQ ID NO.4所示。
进一步地,步骤3)中的PCR扩增中PCR反应体系为25μL,其中引物PRRSV-P1、引物PRRSV-P2、引物PEDV-P1和引物PEDV-P2各1ul,PRRSV和PEDV阳性模板各1μL,10×Raction Buffer(Mg2+plus)2μL,dNTP Mix 1.5μL,Taq DNA聚合酶0.2μL。
进一步地,RT-PCR扩增的退火温度为52.4℃。
进一步地,步骤3)中的PCR扩增中PCR反应条件为:95℃5min;95℃30s,52℃30s,72℃30s,35个循环;72℃延伸7min,4℃保存备用。
与现有技术相比,本发明可以获得包括以下技术效果:
本发明针对PRRSV的ORF7基因和猪流行性腹泻病毒的S基因,分别设计特异性引物,在同一反应体系实现了两种病毒的同时扩增,能快速简便地对两种病毒进行检测,对实际生产有重要意义。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
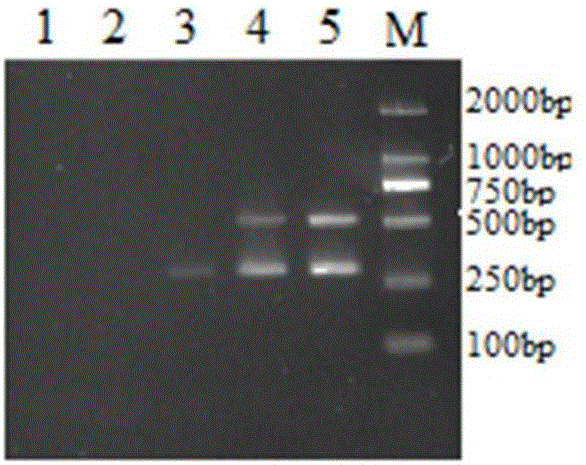
图1是本发明不同缓冲液的RT-PCR扩增结果,其中,M:DNA分子质量标准;1:阴性对照;2:无Mg2+的缓冲液(含10×Reaction Buffer Mg2+free、dNTP Mix、Taq DNA聚合酶);3:含Mg2+的缓冲液(含10×Reaction Buffer Mg2+plus、dNTP Mix、Taq DNA聚合酶)4:PEDV;5:PRRSV;
图2是本发明双重RT-PCR Mg2+的优化结果,其中,M:DNA分子质量标准;1:0.5μL;2:1μL;3:1.5μL;4:2μL;5:2.5μL;
图3是本发明双重RT-PCR Taq DNA聚合酶的优化结果;其中,M:DNA分子质量标准;1:0.1μL;2:0.2μL;3:0.3μL;4:0.4μL;5:0.5μL;
图4是本发明双重RT-PCR dNTPMix的优化结果;其中,M:DNA分子质量标准;1:0.5μL;2:1μL;3:1.5μL;4:2μL;5:2.5μL;6:3μL;7:3.5μL;
图5是本发明双重RT-PCR引物的优化结果,其中,M:DNA分子质量标准;1:0.4μL;2:0.8μL;3:1.2μL;4:1.6μL;5:2μL;6:2.4μL;
图6是本发明双重RT-PCR退火温度的优化结果,其中,M:DNA分子质量标准;1.:58.2℃;2:56.3℃;3:54.4℃;4:51.6℃;5:49.3℃;6:48℃;
图7是本发明双重RT-PCR特异性测试结果,其中,M:DNA分子质量标准;1:PEDV、PRRSV混合模板;2:PRRSV;3:PEDV;4:TGEV;5:CSFV;6:JEV;7:RV;8:大肠杆菌;9:阴性对照;
图8是本发明双重RT-PCR灵敏性测试结果,其中,M:DNA分子质量标准;1~6:模板的稀释度分别为10-6、10-5、10-4、10-3、10-2、10-1;
图9是本发明双重RT-PCR重复性测试结果,其中,M:DNA分子质量标准;1~8为同一模板的8次扩增结果。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1
猪繁殖与呼吸综合征病毒和流行性腹泻病毒双重RT-PCR检测方法的构建
1.材料来源及处理
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪繁殖与综合征病毒(Porcine reproductive and respiratory syndrome vires,PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、乙型脑炎病毒(Japanese encephalitis virus,JEV)、轮状病毒(Rotavirus,RV)、PRRSV和PEDV混合感染病料,大肠杆菌均由四川农业大学动物医学院生物技术中心保存。疑似感染PRRSV和PEDV的临床样品均来自四川省成都市周边猪场。将筛选的阳性样品组织多点取样约1g,剪碎,液氮充分研磨,加入生理盐水稀释做10倍稀释,-20℃反复冻融3次,5000r/min离心5分钟,取上清置于DEPC(diethyl pyrocarbonate,焦碳酸二乙酯)水预处理过的EP管保存,备用。
2模板的制备及引物的合成
2.1模板的制备
RNA的抽提:TRIZOL法抽提;分别抽提TGEV、PEDV、PRRSV、CSFV、JEV、RV的总RNA,-70℃超低温冰箱保存备用。RNA抽提使用的耗材均由DEPC水预处理。
cDNA的制备:抽取的总RNA分别经反转录试剂盒转录成cDNA(体系和程序如表1):
表1:反转录体系
反应程序:37℃15分钟,85℃5秒,16℃保存。反转录后的cDNA保存于-20℃备用。
阳性质粒的制备:DNA凝胶回收试剂盒回收目的片段,克隆到pMD18-T载体,转入DH5α中,筛选,摇菌,质粒提取试剂盒提取阳性质粒,-20℃保存备用。
2.2引物设计及合成
根据GenBank中发布的猪繁殖与呼吸综合征病毒的ORF7序列(登录号:KJ850329.1、EF473139.1、DQ379481.1等)、猪流行性腹泻病毒的S基因(登录号:KF484746.1、KF484740.1、KF484733.1等)为模板,运用引物软件Primer Primier 5.0对这两种病毒的模板基因进行比较分析,分别设计特异性引物,通过NCBI BLAST对引物进行预测,最终确定了2对引物(如表2),最终能扩增出300bp(PRRSV)和578bp(PEDV)的特异性片段。引物经生工生物工程(上海)股份有限公司合成。
表2:引物
3双重RT-PCR检测方法的建立
3.1分别从缓冲液的选择、Taq DNA聚合酶、dNTP Mix、引物和退火温度五点进行优化,筛选出最适合PRRSV和PEDV双重RT-PCR的反应体系。
3.1.1缓冲液的选择与优化
模板、引物的浓度和量一定,控制缓冲液中Mg2+量,逐步筛选最适合双重RT-PCR目的条带扩增的缓冲液。两组缓冲液为10×Reaction Buffer(Mg2+plus)和10×Reaction Buffer(Mg2+free)。选择适宜的缓冲液,调整镁离子量(0.5、1、1.5、2.0、2.5μL)。反应体系采用25μL,反应程序:95℃5min;95℃30s,52.1℃30s,72℃30s,35个循环;72℃延伸7min,4℃保存备用。PCR产物经1%琼脂糖凝胶电泳,根据电泳结果筛选最优的Mg2+用量。
3.1.2 Taq DNA聚合酶与dNTP Mix的优化
在缓冲液中Mg2+用量优化结果的基础上优化Taq DNA聚合酶与dNTP Mix的用量。保证模板和引物一定,分别改变Taq DNA聚合酶与dNTP Mix用量,设计梯度为Taq DNA聚合酶(0.1、0.2、0.3、0.4、0.5μL),dNTP Mix(1、1.5、2、2.5、3μL),反应程序:95℃5min;95℃30s,52.4℃30s,72℃30s,35个循环;72℃延伸7min,4℃保存备用。PCR产物经1%琼脂糖凝胶电泳,根据电泳结果筛选最优的Taq DNA聚合酶与dNTP Mix的用量。
3.1.3引物与退火温度的优化
在最优Mg2+、Taq DNA聚合酶和dNTP Mix用量的前提下,在25μL反应体积中加入两种病毒的模板各1μL,分别改变引物量与退火温度,以筛选最优引物量与退火温度。最优退火温度的筛选:固定引物量,设计退火温度的梯度(48~58.2℃);最优引物量的筛选:将退火温度固定为52.4℃,设计引物量梯度(0.4、0.8、1.2、1.6、2μL)。反应程序同上,PCR产物经1%琼脂糖凝胶电泳,挑选最清晰明亮的条带所对应的引物与退火温度。
3.2特异性测试
结合以上的优化结果用CSFV、TGEV、JEV、RV、PEDV、PRRSV的阳性模板和大肠杆菌进行PCR扩增,同时设计一PEDV和PRRSV的混合阳性模板进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳,以测试建立所建立的双重RT-PCR的特异性。
3.3灵敏性测试
PEDV和PRRSV的阳性重组质粒经核酸蛋白仪测定浓度,分别对其进行稀释,稀释倍数从10倍至60倍共6个浓度梯度。在以上优化的反应体系中加入同等稀释梯度的PEDV和PRRSV阳性模板各1μL进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳,以测定本方法的灵敏性。
3.4重复性测试
用建立的双重RT-PCR方法对同一阳性模板重复检测,重复次数为8次,以验证本方法的重复性。
3.5双重RT-PCR和单一RT-PCR的临床应用与分析比较
用优化后的反应体系对30份临床可疑样品进行PEDV和PRRSV的双重RT-PCR检测,记录检测结果与检出率,并与二者的单一RT-PCR检测结果、检出率进行对比分析。
3.6双重RT-PCR扩增片段的基因序列验证
对双重RT-PCR扩增的目的片段进行序列测定,测序结果通过NCBI BLAST与预测的目的条带序列进行比较分析。
4结果与分析
4.1缓冲液的优化
分别用两种缓冲液进行PCR扩增,结果表明,最好的双重RT-PCR缓冲液为含Mg2+的缓冲液(图1),且Mg2+最佳用量为2.5μL(图2)。
4.2 Taq DNA聚合酶与dNTP Mix用量的优化
如图3和图4所示,在25μL的反应体系中,当Taq DNA聚合酶和dNTP Mix的用量分别为0.4μL和1μL时扩增的条带最清晰。
4.3引物与退火温度的优化
如图5和图6所示,引物(10μmol/L)用量为1.2μL,退火温度为56.3℃时,扩增条带最为清晰。
4.4特异性测试
用本实验建立的双重RT-PCR对不同阳性病料进行检测,如图7所示,本方法具有良好的特异性。
4.5灵敏性测试
如图8所示,本方法建立的双重RT-PCR对PEDV和PRRSV的最低检出率为1.49×105copies/μL,具有良好的灵敏性。
4.6重复性测试
如图9所示,应用双重RT-PCR方法对同一阳性模板进行检测,8次检测结果均一致(图9),表明本法有良好的重复性。
4.7优化后的反应体系
优化后的反转录反应体系(25uL)如表3所示:
表3优化后的反转录反应体系(25uL)
4.8双重RT-PCR和单一RT-PCR临床应用分析
运用本法和单一RT-PCR分别对30份临床样品进行检测,检测结果如下表(表4):
表4:双重RT-PCR和单一RT-PCR对临床病料检测结果比较
4.8双重RT-PCR扩增片段的基因序列验证
扩增产物测序后,经NCBI BLAST比较分析,结果显示:PRRSV的扩增序列与参考毒株(EU880436.2)的同源性为99%,PEDV的扩增序列与参考毒株(KU664503)的同源性为99%。分析结果证实本法能成功扩增PEDV和PRRSV的目的片段,同时证明本法有良好的特异性,对临床检测有积极意义。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
SEQUENCE LISTING
<110> 四川农业大学
<120> 用于检测PRRSV和PEDV双重RT-PCR的方法及引物
<130> 2016
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> 人工序列
<400> 1
tctggctttg agttgtat 18
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<400> 2
ctgaatgtcc ttggttgg 18
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<400> 3
gagagtgacg ggttttac 18
<210> 4
<211> 18
<212> DNA
<213> 人工序列
<400> 4
gttttccacc acagttga 18
- 还没有人留言评论。精彩留言会获得点赞!