用于检测人类CYP2D6基因多态性的核酸、试剂盒及方法与流程
本发明属于生物技术领域,具体涉及一种用于检测人类CYP2D6基因多态性的核酸、试剂盒及方法。
背景技术:
CYP2D6是CYP酶家族中的重要成员之一,该基因位于22q13.1,含有9个外显子和8个内含子,总长为7kb左右,是一个完整的功能性基因。研究表明,肝脏中CYP2D6只占2-9%,但却参与20%~30%药物的代谢,包括抗抑郁药、抗心律失常药、抗精神病药、镇痛药等。CYP2D6具有广泛的基因多态性,目前已经报道的有100多种基因变异,如单一碱基的突变、缺失或插入和大片段的缺失。这些基因变异可引起酶活性和数量的差异,从而导致药物代谢个体差异的产生。CYP2D6的代谢表型可分为超快代谢型(UMs)、快代谢型(EMs)、中等代谢型(IMs)、慢代谢型(PMs)。
他莫昔芬也叫枸橼酸他莫昔芬(tamoxifen),为一种选择性雌激素受体调节剂(SERM)。这种药物结构类似雌激素,能模拟雌激素的作用,与雌激素受体结合形成稳定的复合物,并转运入核内,阻止染色体基因开放,从而使癌细胞的生长和发育受到抑制,是目前治疗某些乳腺癌和卵巢癌以及乳腺增生的有效药物之一。他莫昔芬口服后主要在肝内代谢,主要代谢物为N-去甲基三苯氧胺和4-羟基三苯氧胺,与雌激素受体的亲和力和抑制癌细胞增值的能力比他莫昔芬高至少100倍。
近年来,为提高他莫昔芬临床应用的安全性和有效性,国内外学者对他莫昔芬药效的影响因素进行了大量研究,相关研究结果表明药物代谢相关基因的多态性是引起个体药效差异的重要原因之一。他莫西芬作为无活性的前药,在体内主要由CYP2D6催化形成有活性的化学成分Endoxifen,发挥药物疗效,因此CYP2D6基因多态性导致的酶活性改变将直接影响他莫西芬用药效果。所以CYP2D6基因的分型检测对于临床他莫西芬用药指导有重要意义。
CYP2D6基因多态性在不同种族人群中的分布频率具有较大的差异,东方人群中突变频率较高的是CYP2D6*10和CYP2D6*14基因多态性。CYP2D6*10在东方人群中分布频率高达40%~49.5%,CYP2D6*14为东方人特有的等位基因,分布频率约为1%-2%,这两种基因型是造成东方人CYP2D6酶慢代谢型和弱代谢型的主要原因。因此,综合检测CYP2D6*10和CYP2D6*14基因多态性可以筛选那些在更能在TAM治疗中受益的患者,这对于临床个体化化疗方案的制定具有重要意义。
目前,CYP2D6基因多态性检测的主要方法有:测序法、芯片法和溶解曲线法。测序法是基因多态性检测最常见的方法,也是基因多态性位点检测的金标准,尽管该方法具有高通量、多位点的优势,但该方法同时存在操作繁琐、灵敏度低、样品易污染,导致假阳性结果,及仪器成本高等问题。芯片法需先进行PCR扩增,之后将含有目的SNP位点的PCR产物与突变探针、野生探针杂交,通过比较两个探针杂交的信号强度判断样品基因型。该方法操作过程繁琐,无法实现批量化和自动化,且结果不易判读,假阳性概率高。对于溶解曲线法,不管是染料溶解曲线还是探针溶解曲线法,都无法有效区分同一位点的多种突变类型。液相芯片法操作过程复杂,且容易污染,假阳性率高。
技术实现要素:
为克服现有技术检测技术的不足,本发明的目的是提供一组用于检测CYP2D6基因多态性的核酸。本发明的另一个目的是提供一种用于检测CYP2D6基因多态性的试剂盒及其检测方法。
为实现上述目的,本发明采用以下技术方案:
一组用于检测CYP2D6基因多态性的核酸,该核酸包括CYP2D6*10基因和CYP2D6*14基因多态性的检测引物及检测探针,其中,所述CYP2D6*10基因多态性的检测引物和检测探针包括针对C100T位点的核苷酸序列如SEQ ID No.1所示的C100T野生型上游引物1W-F、如SEQ ID No.2所示的C100T突变型上游引物1M-F和如SEQ ID No.3所示的C100T公用下游引物1C-R,和核苷酸序列如SEQ ID No.4所示的C100T检测探针1P;
及针对G4268C位点的核苷酸序列如SEQ ID No.5所示的G4268C野生型上游引物2W-F、如SEQ ID No.6所示的G4268C突变型上游引物2M-F和如SEQ ID No.7所示的G4268C公用下游引物2C-R,及核苷酸序列如SEQ ID No.8所示的G4268C检测探针2P;
所述CYP2D6*14基因多态性的检测引物和检测探针包括核苷酸序列如SEQ ID No.9所示的G1758A野生型上游引物3W-F、如SEQ ID No.10所示的G1758A突变型上游引物3M-F和如SEQ ID No.11所示的G1758A公用下游引物3C-R,和核苷酸序列如SEQ ID No.12所示的G1758A检测探针3P。
如上所述的核酸,优选地,所述核酸还包括内部质控,其包括质控引物对和质控探针,所述质控引物对的核苷酸序列如SEQ ID No.13和SEQ ID No.14所示,所述质控探针的核苷酸序列如SEQ ID No.15所示。
如上所述的核酸,优选地,所述核酸还包括CYP2D6*10基因C100T位点、G4268C位点和CYP2D6*14基因G1758A位点对应的野生型阳性对照物、突变型阳性对照物及质控阳性对照物,其中,所述C100T位点的野生型阳性对照物含有如SEQ ID No.16所示的核苷酸序列,所述C100T位点的突变型阳性对照物含有如SEQ ID No.17所示的核苷酸序列,所述G4268C位点的野生型阳性对照物含有如SEQ ID No.18所示的核苷酸序列,所述G4268C位点的突变型阳性对照物含有如SEQ ID No.19所示的核苷酸序列,所述G1758A位点的野生型阳性对照物含有如SEQ ID No.20所示的核苷酸序列,所述G1758A位点的突变型阳性对照物含有如SEQ ID No.21所示的核苷酸序列,所述质控阳性对照物含有如SEQ ID No.22所示的核苷酸序列。
一种用于快速检测CYP2D6基因多态性的试剂盒,该试剂盒包括如上所述的核酸,其中,各基因的所述检测探针的5'端连接荧光基团,3'端连接淬灭基团。
如上所述的试剂盒,优选地,试剂盒还包括10×PCR缓冲液、DNA聚合酶、dNTPs、矿物油、阴性对照物:无核酸酶水。
如上所述的试剂盒,优选地,所述荧光基团为FAM、JOE、CY3、HEX中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
如上所述试剂盒的使用方法,该方法包括以下步骤:
(1)待测样本基因组DNA的提取;
(2)PCR反应液配制:每多态性位点分别配制突变型检测体系和野生型检测体系;分别向所述突变型检测体系和所述野生型检测体系中加入同一样本DNA,短暂离心,混合均匀;
(3)荧光定量PCR检测:将配制好的PCR体系放入荧光PCR仪器中,进行荧光定量PCR扩增检测;
(4)结果判读:根据突变型检测体系的Ct值与野生型检测体系的Ct值的差△Ct对样品的基因型进行判读,若△Ct<-3,则该样本该基因位点基因型为突变型;若-3≤△Ct≤3,则该样本该基因位点基因型为杂合型;若△Ct>3,则该样本该基因位点基因型为野生型。
如上所述的使用方法,优选地,步骤(2)中,所述实时荧光PCR扩增的反应程序为:
第一阶段:95℃5min;
第二阶段:95℃5s,58℃30s,10个循环;
第三阶段:95℃5s,58℃30s,72℃30s,35个循环;
信号收集:第三阶段72℃时收集荧光信号。
如上所述的使用方法,优选地,在步骤(2)中,所述野生型检测体系和所述突变型检测体系中还包括有作为内部质控的质控引物对和质控探针,所述质控探针的5'端连接有不同于任一检测探针的荧光基团。
如上所述的使用方法,优选地,各基因的所述检测探针的5'端连接FAM,3'端连接MGB,所述质控探针的5'端连接JOE,3'端连接BHQ1。
如上所述的使用方法,优选地,在所述步骤(4)中,检测样本的所述内部质控的JOE信号应有典型的“S”型扩增曲线,且Ct值在12~30之间,再确定所述样本DNA的基因型;否则应重新进行检测。
如上所述的使用方法,优选地,在步骤(2)中,还设有阳性对照和阴性对照,所述阳性对照为以各基因对应的野生型阳性对照物和突变型阳性对照物、及质控阳性对照物为模板,进行所述野生型检测体系和突变型检测体系的实时荧光PCR扩增;所述阴性对照为以水为模板,进行所述野生型检测体系和突变型检测体系的实时荧光PCR扩增;
在步骤(4)中,各基因的所述阳性对照的野生型反应体系和突变型反应体系应有有典型的“S”型扩增曲线,且Ct值≤30;所述阴性对照的各基因的野生型检测体系和突变型检测体系的应无扩增曲线和Ct值,符合要求;否则,应重新进行检测。
本发明提供了一组用于快速检测CYP2D6基因位点多态性的核酸,同时建立了一种比较高效、灵敏的CYP2D6基因多态性位点的检测试剂盒及快速检测方法。具体实现对CYP2D6*10基因C100T和G4268C、CYP2D6*14基因G1758A的位点多态性进行检测,其检测试剂盒,使用方便,操作简便,自动化程度高,大大简化了操作过程,并减少了在操作过程的污染,检测效果好,具有高灵敏度、高特异性、高准确度、高精确度的特点。提供的检测方法采用完全闭管操作,操作简单、方便快捷、通过直接探测PCR过程中荧光信号值的获得检测的结果,不需要PCR后处理或电泳检测,克服了常规PCR技术的易污染、出现假阳性,能有效避免非特异性扩增难题,并且适合大批量样本的检测。
本发明提供的检测试剂盒及方法,用于检测CYP2D6基因多态性位点时,为了避免漏检、及初步判断样本DNA量是否在允许范围内,设有内部质控,为了判断检测体系是否正常,还设有阴性对照和检测引物的阳性对照;为了避免假阴性及漏检,设有野生型、突变型和内部质控的阳性对照,其阳性对照检测呈阳性结果,说明检测体系没有问题,不会出现假阴性结果及漏检,如阳性对照检测呈阴性结果,说明检测体系有问题,或试剂已经失效,应重新配置体系进行检测;为了避免假阳性及漏检,设有阴性对照,其阴性对照检测呈阴性结果,说明检测体系没有问题,不会出现假阳性结果及漏检,如阴性对照检测呈阳性结果,说明检测体系有问题,已被污染,应重新配置体系进行检测;本发明提供检测试剂盒及方法设计严谨,有效避免漏检、错检的可能。
本发明设计的引物和探针序列灵敏度高,可以准确检出低至1ng的基因组DNA,特异性强,只能特异性扩增目标片段,无非特异性扩增;本发明所提供的检测方法与测序法100%吻合;本发明方法能够准确区分各种基因型,且结果直观、易判读,本发明所提供的检测方法能在90分钟内完成检测,所需时间远低于测序法,特别适合临床用药诊断;本发明试剂盒和检测方法适用于ABI7500、罗氏LC480、Bio-Rad CFX96等荧光定量PCR仪,适用性好。
附图说明
图1、图2和图3为实施例4中EDTA抗凝全血提取的基因组DNA样本(样本1)的扩增曲线。
图4、图5和图6为实施例4中口腔拭子提取的基因组DNA样本(样本2)的扩增曲线。
图7、图8和图9为本发明优选的试剂盒检测灵敏度的扩增曲线。
图10、图11和图12本发明优选的试剂盒检测精密度的扩增曲线。
图13、图14和图15本发明优选的试剂盒检测特异性的扩增曲线。
具体实施方式
以下结合具体实例对本发明做进一步详细说明,并非对本发明的限定,本发明的实施方式并不限于此,本发明提供的核苷酸序列的互补序列也可实现本发明,如无特殊说明,所用试剂为常规试剂,因此凡依照本公开内容所作出的本领域的等同替换,均属于本发明的保护范围。
实施例1引物、探针、验证模板设计
根据NCBI dbSNP数据库(https://www.ncbi.nlm.nih.gov/SNP/)公布的CYP2D6*10和CYP2D6*14序列信息,分别针对这CYP2D6基因的2种等位基因如表1,设计多态性位点的检测引物和探针,经过筛选、优化、大量试验验证获得引物和探针序列具体如下:
(1)用于CYP2D6*10SNP位点基因多态性检测的引物和探针:
C100T野生型等位基因上游引物(1W-F):
5'-CGCCAACGCTGGGCTGCACGCTAC-3'(SEQ ID NO.1),
C100T突变型等位基因上游引物(1M-F):
5'-CGCCAACGCTGGGCTGCACGCTAT-3'(SEQ ID NO.2),
C100T等位基因公用下游引物(1C-R):
5'-CCTCAGGACCTCTGCCGCCCTCC-3'(SEQ ID NO.3),
C100T等位基因特异性探针(1P):
5'-TGTTCTGGAAGTCCACATGCAGCA-3'(SEQ ID NO.4);
G4268C野生型等位基因上游引物(2W-F):
5'-TGTCTTTGCT TTCCTGGTGAG-3'(SEQ ID NO.5);
G4268C突变型等位基因上游引物(2W-F):
5'-TGTCTTTGCT TTCCTGGTGAC-3'(SEQ ID NO.6);
G4268C等位基因公用下游引物(2C-R):
5'-GTGAGCAGGGGACCCGAGTTGG-3'(SEQ ID NO.7);
G4268C等位基因特异性探针(2P):
5'-GGCTGGGGACTAGGTACCCCATT-3'(SEQ ID NO.8);
(2)用于CYP2D6*10SNP位点基因多态性检测的引物和探针:
G1758A野生型等位基因上游引物(3W-F):
5'-TGCCCTTCTGCCCATCACCCACG-3'(SEQ ID NO.9);
G1758A突变型等位基因上游引物(3M-F):
5'-TGCCCTTCTGCCCATCACCCACA-3'(SEQ ID NO.10);
G1758A等位基因公用下游引物(3C-R):
5'-CGCGAGCAGAGGCGCTTCTCCGT-3'(SEQ ID NO.11);
G1758A等位基因特异性探针(3P):
5'-CTCCTCGGTCACCCACTGCTCCAGCGACTTC-3'(SEQ ID NO.12)。
表1.CYP2D6基因2种等位基因
野生型上游引物与下游引物扩增的PCR产物可作为野生型阳性模板,突变型上游引物与公共下游引物扩增的PCR产物可作为突变型阳性模板,各基因的多态性位点对应的野生型阳性对照物、突变型阳性对照物如下CYP2D6*10基因C100T位点的野生型阳性对照物含有如SEQ ID No.16所示的核苷酸序列,C100T位点的突变型阳性对照物含有如SEQ ID No.17所示的核苷酸序列,CYP2D6*10基因的G4268C位点的野生型阳性对照物含有如SEQ ID No.18所示的核苷酸序列,G4268C位点的突变型阳性对照物含有如SEQ ID No.19所示的核苷酸序列,CYP2D6*14基因的G1758A位点的野生型阳性对照物含有如SEQ ID No.20所示的核苷酸序列,G1758A位点的突变型阳性对照物含有如SEQ ID No.21所示的核苷酸序列。
SEQ ID No.16:
5’-CGCCAACGCTGGGCTGCACGCTACCCACCAGGCCCCCTGCCACTGCCCGGGCTGGGCAACCTGCTGCATGTGGACTTCCAGAACACACCATACTGCTTCGACCAGGTGAGGGAGGAGGTCCTGGAGGGCGGCAGAGGTCCTGAGG-3’
SEQ ID No.17:
5’-CGCCAACGCTGGGCTGCACGCTATCCACCAGGCCCCCTGCCACTGCCCGGGCTGGGCAACCTGCTGCATGTGGACTTCCAGAACACACCATACTGCTTCGACCAGGTGAGGGAGGAGGTCCTGGAGGGCGGCAGAGGTCCTGAGG-3’
SEQ ID No.18:
5’-TGTCTTTGCTTTCCTGGTGAGCCCATCCCCCTATGAGCTTTGTGCTGTGCCCCGCTAGAATGGGGTACCTAGTCCCCAGCCTGCTCCCTAGCCAGAGGCTCTAATGTACAATAAAGCAATGTGGTAGTTCCAACTCGGGTCCCCTGCTCAC-3’
SEQ ID No.19:
5’-TGTCTTTGCTTTCCTGGTGACCCCATCCCCCTATGAGCTTTGTGCTGTGCCCCGCTAGAAT GGGGTACCTAGTCCCCAGCCTGCTCCCTAGCCAGAGGCTCTAATGTACAATAAAGCAATG TGGTAGTTCCAACTCGGGTCCCCTGCTCAC-3’
SEQ ID No.20:
5’-TGCCCTTCTGCCCATCACCCACGGGAGTGGTTGGCGAAGGCGGCACAAAGGCAGGCGGCCTCCTCGGTCACCCACTGCTCCAGCGACTTCTTG CCCAGGCCCAAGTTGCGCAAGGTGGAGACGGAGAAGCGCCTCTGCTCGCG-3’
SEQ ID No.21:
5’-TGCCCTTCTGCCCATCACCCACAGGAGTGGTTGGCGAAGGCGGCACAAAGGCAGGCGGCCTCCTCGGTCACCCACTGCTCCAGCGACTTCTTG CCCAGGCCCAAGTTGCGCAAGGTGGAGACGGAGAAGCGCCTCTGCTCGCG-3’
进一步,为了对实时荧光PCR反应体系和实验操作过程进行内部质控,同时检测样本的质量,避免漏加检测样本,根据人类看家基因GAPDH(NC_000012.12)的序列,设计了作为内部质控的一对质控引物对和质控探针,要求该内部质控不仅可以作为试剂盒的质控,还可以作为样本DNA的质控,保证提取出来的DNA包含基因,可以排除其他序列的非特异交叉反应,同时它也不会对各基因多态性的野生型与突变性的目的基因及引物对和检测探针产生交叉反应,确保试剂盒的准确性。通过对内部质控的质控引物对、质控探针的筛选和体系优化,建立了实时荧光PCR内部质控检测体系,优选地,质控引物对(R-F、R-R)、质控探针(RP)如下:
内控上游引物(R-F):5'-CATCAAGAAGGTGGTGAAGCAG-3'(SEQ ID NO.13),
内控下游引物(R-R):5'-TGTCGCTGTTGAAGTCAGAGGA-3'(SEQ ID NO.14),
内控探针(RP):5'-TGGTGCTCAGTGTAGCCCAGGATGC-3'(SEQ ID NO.15)。
作为内部质控的质控引物对进行PCR扩增时,其扩增序列的大小为98bp。将扩增序列作为内部质控阳性对照物,即包含如SEQ ID No.22所示序列,作为验证是否漏加检测样品的质控阳性对照物,
SEQ ID No.22:
5’-CATCAAGAAGGTGGTGAAGCAGGCGTCGGAGGGCCCCCTCAAGGGCATCCTGGGCTACACTGAGCACCAGGTGGTCTCCTCTGACTTCAACAGCGACA-3’
作为试剂盒特异性验证进行PCR扩增时,选择人类基因组ABCB1基因,位于7号染色体上,其C3435T基因多态性也与阿片类药物个体化用药密切相关。为试剂盒有无交叉反应验证所需,其质粒序列如SEQ ID No.23所示序列,长度为100bp。
SEQ ID No.23:
5’-TGGAGACAACAGCCGGGTGGTGTCACAGGAAGAGATCGTGAGGGCAGCAAAGGAGGCCAACATACATGCCTTCATCGAGTCACTGCCTAATGTAAGTCTC-3’。
实施例2用于检测CYP2D6基因多态性位点的试剂盒
用于快速检测CYP2D6基因多态性位点的实时荧光PCR试剂盒包括以下成分:如实施例1中所述的各基因的引物、检测探针、野生型阳性对照物、突变型阳性对照物、各基因的检测探针的5'端连接荧光基团,3'端连接淬灭基团;其中,荧光基团为FAM、JOE、CY3、HEX中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
为了避免漏检,错检,还包括:作为内部质控的质控引物对、质控探针和质控阳性对照物,序列如实施例1中所述,且质控探针的荧光基团不同于检测探针的荧光基团。
为了防止反应体系在PCR扩增过程中挥发,影响检测效果,试剂盒还包括有矿物油。
为了便于反应体系的配置,试剂盒还包括10×PCR缓冲液、DNA聚合酶、dNTPs、阴性对照物:无核酸酶水。其中DNA聚合酶可采用Taqman Master Mix全称TaqMan Real-Time PCR Master Mixes,购自Thermo Fisher Scientific(赛默飞世尔科技公司);10×PCR buffer(Mg2+Plus)采用TaKaRa宝生物工程(大连)有限公司,也可应用市场上其他公司的缓冲液与DNA聚合酶。
实施例3检测试剂盒的制备
本实施例的试剂盒是在实施例2的基础上,制备成可以直接加入检测样品后进行检测的试剂盒,由CYP2D6 6联PCR反应条以及CYP2D6阳性对照组成,试剂盒中各管中的成分见表2。
表2 试剂盒组成
Taqman Master Mix的全称为TaqMan Real-Time PCR Master Mixes,购自Thermo Fisher Scientific(赛默飞世尔科技公司);10×PCR buffer(Mg2+Plus)采用TaKaRa宝生物工程(大连)有限公司,也可应用市场上其他公司的缓冲液与DNA聚合酶。
实施例4本发明试剂盒的使用方法
本实施例中收集正常人EDTA抗凝全血样本(由武大人民医院提供)和口腔拭子样本(由同济医院提供)各一例,并从中提取基因组DNA,用CYP2D6基因多态性检测试剂盒检测待测样本中CYP2D6基因突变状态。具体步骤如下:
1、临床样本DNA的提取
参照天根生化科技有限公司血液基因组DNA提取试剂盒和口腔拭子基因组DNA提取试剂盒说明,获得样品基因组DNA。DNA提取完毕后用Nanodrop 2000超微量分光光度计对样品DNA进行浓度测定,样本DNA浓度应在20ng/μL~200ng/μL为宜,且OD260/OD280在1.65~1.80之间。
2、PCR反应体系配制
应用本发明实施例3制备的试剂盒对检测样品的DNA模板,进行CYP2D6*10基因的C100T位点、CYP2D6*10基因的G4268C位点、CYP2D6*14基因的G1758A位点多态性实时荧光PCR扩增检测。
其中,每个多态性检测位点分别包括突变型检测体系和野生型检测体系,具体地,各检测体系配置可将见表3和表4,其中各基因的检测探针的5'端连接FAM,3'端连接MGB,所述质控探针的5'端连接JOE,3'端连接BHQ1。以上检测体系配制完成后分别分装到PCR反应管中,向以上PCR反应管中分别加入2.0μL同一样本DNA,短暂离心数秒,使PCR反应体系混合均匀。
表3 CYP2D6*10荧光定量PCR反应体系
表4 CYP2D6*14荧光定量PCR反应体系
3、荧光PCR检测
将配置好的PCR体系放入ABI7500荧光PCR仪器中,进行荧光PCR扩增检测。反应条件为:
第一阶段:95℃预变性5min;
第二阶段:95℃20s,58℃30s,10个循环;
第三阶段:95℃20s,58℃30s(收集FAM和JOE信号),35个循环。
PCR程序结束后,自动设置基线和阈值线,得到样本的Ct值。
4、结果判读
NTC和阳性对照分析:正常情况下NTC反应孔应无扩增曲线和Ct值,否则,说明可能存在操作污染,此时,应排除污染来源后重新开始实验;阳性对照反应孔应有典型的“S”型扩增曲线,且Ct值≤30,否则,说明PCR反应体系可能出现异常,影响了扩增效率。
内控分析:一般地,内控JOE信号应有典型的“S”型扩增曲线,且Ct值在12~30之间。若Ct值≤12,表明所加样本DNA浓度过高,应酌情减少DNA上样量;若Ct≥30,表明所加样本DNA拷贝数偏低或者样本DNA中可能存在PCR抑制剂;若内控JOE信号无扩增曲线,可能存在样本DNA漏加,应重新开始实验。
样本基因型分析:在NTC(阴性对照)、阳性对照和内控JOE信号均正常的前提下,根据突变型检测体系Ct值与野生型检测体系Ct值的差(△Ct)对样品的基因型进行判读(见表5)。针对任意一个多态性检测位点,若△Ct<-3,则该样本该基因位点基因型为突变型;若-3≤△Ct≥3,则该样本该基因位点基因型为杂合型;若△Ct>3,则该样本该基因位点基因型为野生型。
表5 CYP2D6基因三个多态性位点基因型结果判定
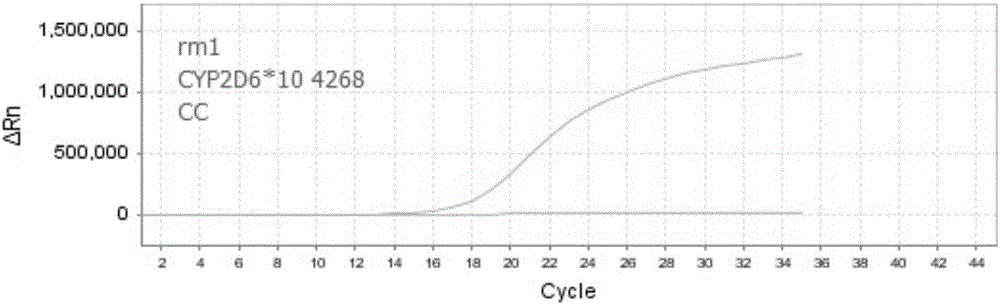
本实施例中EDTA抗凝全血提取的基因组DNA样本(样本1标记为rm1)的扩增曲线见图1、图2和图3,基因多态性见表6。
本实施例中口腔拭子提取的基因组DNA样本(样本2标记为rm2)的扩增曲线见图4、图5和图6,基因多态性见表6。
表6 样本检测结果
说明:EDTA抗凝血提取的基因组DNA和口腔拭子提取的基因组DNA用本发明的试剂盒检测的结果和sanger测序的结果完全一致,试剂盒准确度高,适应样本广。Sanger测序法是临床检验上普遍使用的金标准检测方法。
实施例5:本发明试剂盒的性能分析实验
CYP2D6重组质粒购自南京金斯瑞生物科技有限公司,以现有基因工程技术人工合成的CYP2D6*10基因C100T多态性位点含有SEQ ID NO:16所示序列为野生型质粒,含有SEQ ID NO:17所示序列为突变型质粒;CYP2D6*10基因G4268C多态性位点含有SEQ ID NO:18所示序列为野生型质粒,含有SEQ ID NO:19所示序列为突变型质粒;CYP2D6*14基因的G1758A多态性位点含有SEQ ID NO:20所示序列为野生型质粒,含有SEQ ID NO:21所示序列为突变型质粒;人工合成含有SEQ ID NO:22所示序列为内控质粒。各质粒干粉用TE(10mmol/L,PH8.0)复溶,定量后稀释。
(1)灵敏度
分别取三种基因位点的2×101copies/μL的野生型质粒与内控质粒1:1混合,配置成终浓度为10copies/μL的CYP2D6野生型参考品(编号为:CY100W-1、CY4268W-1、CY1758W-1);分别取三种基因位点的2×101copies/μL的突变型质粒与内控质粒1:1混合,配置成终浓度为10copies/μL的CYP2D6突变型参考品(编号为:CY100M-1、CY4268M-1、CY1758M-1);分别取三种基因位点的取2×101copies/μL的野生型质粒、突变型质粒、内控质粒1:1:2体积比混合,配置成终浓度为10copies/μL的CYP2D6杂合型参考品(编号为:CY100WM-1、CY4268WM-1、CY1758WM-1)。以这三种参考品为模板,采用实施例4中荧光定量PCR方法进行扩增,扩增图结果见图7、图8、图9。检测结果表明,本发明的荧光PCR方法特异性强,灵敏度高,10copies/μL浓度的DNA模板均可检出。
(2)精密度
分别取三种基因位点的6×103copies/μL的野生型质粒、突变型质粒、内控质粒1:1:2体积比混合,配置成终浓度为3×103copies/μL的CYP2D6杂合参考品(编号为:CY100WM-2、CY4268WM-2、CY1758WM-2)。以这三种参考品为模板,采用实施例4中荧光定量PCR方法进行扩增,扩增图结果见图10、图11、图12。结果表明本发明的实时荧光PCR扩增方法重复性好(20次重复实验结果稳定,CV<5%)。
(3)特异性
ABCB1质粒人工合成于南京金斯瑞生物科技有限公司。以现有基因工程技术人工合成的含有SEQ ID NO:23所示序列ABCB1基因质粒,分别取6×104copies/μL的CYP2D6的野生型质粒和ABCB1基因质粒与内控质粒1:1混合,配置成终浓度为3×104copies/μL的野生型参考品(样品编号为:CY100W-3、CY4268W-3、CY1758W-3、ABW-3),检测体系编号记为CYP2D6W-3;取上述两个基因的6×104copies/μL突变型质粒和内控质粒1:1混合,配置成终浓度为3×104copies/μL的突变型参考品(编号为:CY100M-3、CY4268M-3、CY1758M-3、ABM-3),检测体系编号记为CYP2D6M3;分别取三种基因位点的野生型质粒、突变型质粒、ABCB1基因质粒和内控质粒,配置成终浓度为3×104copies/μL的CYP2D6杂合型参考品(编号为:CY100WM-3、CY4268WM-3、CY1758WM-3、ABWM-3),检测体系编号记为CYP2D6M3。以上述三种参考品为模板,用本发明实施例3制备的试剂盒对进行实时荧光PCR扩增检测,扩增图见图13、图14、图15。结果表明,本发明的荧光PCR方法特异性强,ABCB1基因和CYP2D6基因之间无交叉反应,3×104copies/μL浓度的ABCB1基因各反应体系中均不能检出,表明本发明设计的各基因位点的引物对、探针的特异性好。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉海吉力生物科技有限公司
<120> 用于检测人类CYP2D6基因多态性的核酸、试剂盒及方法
<130>
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 人工合成
<400> 1
cgccaacgct gggctgcacg ctac 24
<210> 2
<211> 24
<212> DNA
<213> 人工合成
<400> 2
cgccaacgct gggctgcacg ctat 24
<210> 3
<211> 23
<212> DNA
<213> 人工合成
<400> 3
cctcaggacc tctgccgccc tcc 23
<210> 4
<211> 24
<212> DNA
<213> 人工合成
<400> 4
tgttctggaa gtccacatgc agca 24
<210> 5
<211> 21
<212> DNA
<213> 人工合成
<400> 5
tgtctttgct ttcctggtga g 21
<210> 6
<211> 21
<212> DNA
<213> 人工合成
<400> 6
tgtctttgct ttcctggtga c 21
<210> 7
<211> 22
<212> DNA
<213> 人工合成
<400> 7
gtgagcaggg gacccgagtt gg 22
<210> 8
<211> 23
<212> DNA
<213> 人工合成
<400> 8
ggctggggac taggtacccc att 23
<210> 9
<211> 23
<212> DNA
<213> 人工合成
<400> 9
tgcccttctg cccatcaccc acg 23
<210> 10
<211> 23
<212> DNA
<213> 人工合成
<400> 10
tgcccttctg cccatcaccc aca 23
<210> 11
<211> 23
<212> DNA
<213> 人工合成
<400> 11
cgcgagcaga ggcgcttctc cgt 23
<210> 12
<211> 31
<212> DNA
<213> 人工合成
<400> 12
ctcctcggtc acccactgct ccagcgactt c 31
<210> 13
<211> 22
<212> DNA
<213> 人工合成
<400> 13
catcaagaag gtggtgaagc ag 22
<210> 14
<211> 22
<212> DNA
<213> 人工合成
<400> 14
tgtcgctgtt gaagtcagag ga 22
<210> 15
<211> 25
<212> DNA
<213> 人工合成
<400> 15
tggtgctcag tgtagcccag gatgc 25
<210> 16
<211> 145
<212> DNA
<213> 人工合成
<400> 16
cgccaacgct gggctgcacg ctacccacca ggccccctgc cactgcccgg gctgggcaac 60
ctgctgcatg tggacttcca gaacacacca tactgcttcg accaggtgag ggaggaggtc 120
ctggagggcg gcagaggtcc tgagg 145
<210> 17
<211> 145
<212> DNA
<213> 人工合成
<400> 17
cgccaacgct gggctgcacg ctatccacca ggccccctgc cactgcccgg gctgggcaac 60
ctgctgcatg tggacttcca gaacacacca tactgcttcg accaggtgag ggaggaggtc 120
ctggagggcg gcagaggtcc tgagg 145
<210> 18
<211> 151
<212> DNA
<213> 人工合成
<400> 18
tgtctttgct ttcctggtga gcccatcccc ctatgagctt tgtgctgtgc cccgctagaa 60
tggggtacct agtccccagc ctgctcccta gccagaggct ctaatgtaca ataaagcaat 120
gtggtagttc caactcgggt cccctgctca c 151
<210> 19
<211> 151
<212> DNA
<213> 人工合成
<400> 19
tgtctttgct ttcctggtga ccccatcccc ctatgagctt tgtgctgtgc cccgctagaa 60
tggggtacct agtccccagc ctgctcccta gccagaggct ctaatgtaca ataaagcaat 120
gtggtagttc caactcgggt cccctgctca c 151
<210> 20
<211> 143
<212> DNA
<213> 人工合成
<400> 20
tgcccttctg cccatcaccc acgggagtgg ttggcgaagg cggcacaaag gcaggcggcc 60
tcctcggtca cccactgctc cagcgacttc ttgcccaggc ccaagttgcg caaggtggag 120
acggagaagc gcctctgctc gcg 143
<210> 21
<211> 143
<212> DNA
<213> 人工合成
<400> 21
tgcccttctg cccatcaccc acaggagtgg ttggcgaagg cggcacaaag gcaggcggcc 60
tcctcggtca cccactgctc cagcgacttc ttgcccaggc ccaagttgcg caaggtggag 120
acggagaagc gcctctgctc gcg 143
<210> 22
<211> 98
<212> DNA
<213> 人工合成
<400> 22
catcaagaag gtggtgaagc aggcgtcgga gggccccctc aagggcatcc tgggctacac 60
tgagcaccag gtggtctcct ctgacttcaa cagcgaca 98
<210> 23
<211> 100
<212> DNA
<213> 人工合成
<400> 23
tggagacaac agccgggtgg tgtcacagga agagatcgtg agggcagcaa aggaggccaa 60
catacatgcc ttcatcgagt cactgcctaa tgtaagtctc 100
- 还没有人留言评论。精彩留言会获得点赞!
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 人PLIN1基因rs2289487位点多态性检测方法及试剂盒的制作方法
- 测定人NEFM基因rs12515位点多态性的方法及试剂盒的制作方法
- 一种人TERF1基因rs3863242位点多态性检测技术的制作方法
- 测定人CCNH基因rs3093816位点多态性的方法及试剂盒的制作方法
- 测定人NEFL基因rs2979704位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs854560位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs662位点多态性的方法及试剂盒的制作方法
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 用于检测人类CYP2D6基因多态性的核酸、试剂盒及方法与流程
- 单核苷酸多态性位点rs2523607在筛查疱疹样皮炎患者中的应用的制作方法与工艺
- 核苷酸多态性检测方法与流程
- 单核苷酸多态性rs146466242在筛查麻风患者中的应用的制作方法与工艺
- 基于信号谱差异的混合样本单核苷酸多态性的检测方法与流程
- 一种检测牛PCAF基因单核苷酸多态性的RFLP方法及试剂盒与流程
- 秦川牛microRNA‑320a‑1基因单核苷酸多态性的检测方法及其应用与流程
- 单核苷酸多态性rs76418789在筛查麻风患者中的应用的制作方法与工艺
- 判定rs4676410和rs2531875单核苷酸多态性与AS之间相关性的方法与流程
- 一种可视化检测基因序列中单核苷酸多态性位点的反向探针、试剂盒及其检测方法与流程