预示间充质干细胞定向分化潜能的标志物、试剂及试剂盒的制作方法
本发明属于干细胞领域,涉及预示间充质干细胞定向分化潜能的标志物、试剂及试剂盒。
背景技术:
间充质干细胞(mesenchymal stem cells,MSCs)是一种多潜能成体干细胞,在人体发生、发育过程中存在于许多种组织中。20世纪70年代中期,Friedenstein等人[Friedenstein A J,Gorskaja J F,Kulagina N N.Fibroblast precursors in normal and irradiated mouse hematopoietic organs.Exp Hematol,1976,4(5):267-274]从骨髓中获得了少数能贴壁生长的细胞,这些细胞能分化为成骨或软骨样的沉着物,该发现被认为首次证实了MSCs的存在。目前,已经从成人的多种间充质组织中分离得到MSCs,这些细胞在体外可以扩增并且可以分化为骨、软骨、骨髓基质、肌腱、韧带、脂肪等多种结缔组织细胞,以及骨骼肌细胞、神经细胞和神经胶质细胞等等[Reyes M,Lund T,Lenvik T,et al.Purification and ex vivo expansion ofpostnatal human marrow mesodermal progenitor cells.Blood,2001,98:2615-2625]。而且,不论是自体的还是同种异源的MSCs一般都不会引起宿主的免疫反应[Barry F P,Murphy J M.Mesenchymal stem cells:clinical applications and biological characterization.Int J Biochem Cell Biol,2004,36(4):568-584]。因此,MSCs可以作为组织工程的种子细胞,用于组织构建以治疗一些机体无法自然修复的组织细胞损伤,有着良好的临床应用前景。
MSCs的分化潜能有大量研究报道。一方面,体外实验显示在特定培养条件下,MSCs可分化为中胚层起源的成骨细胞、软骨细胞、脂肪细胞、骨骼肌细胞、心肌细胞;内胚层起源的肝细胞、胰岛β细胞;外胚层起源的视网膜细胞、神经细胞和神经胶质细胞等。另一方面,动物实验和临床表明,将全骨髓或初步纯化的骨髓MSCs移植入损伤或转基因动物及病人体内,骨髓干细胞可迁移并分化为骨骼肌细胞、心肌细胞、肝细胞、胆管细胞、表皮细胞、消化管细胞、肺泡细胞、胰岛β细胞、肾细胞、神经细胞和神经胶质细胞等[Grove J E,Bruscia E,Krause D S.Plasticity ofbone marrow-derived stem cells.Stem Cells,2004,22(4):487-500]。
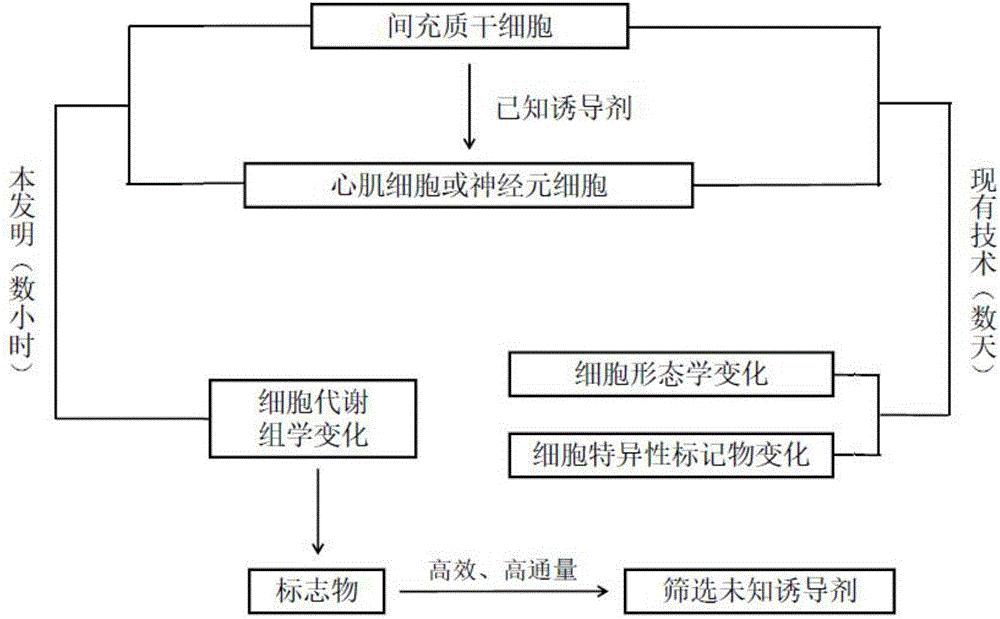
由于MSCs的增殖能力和定向诱导分化潜能,使其在矫形外科、心血管和神经系统等疾病的治疗中均显示出良好的应用前景。研究者试图筛选出能体外诱导MSCs定向分化的诱导试剂,以有效控制MSCs的分化方向,获得目标细胞或组织。目前,通常是用待筛选试剂对MSCs体外处理后,培养若干天,通过鉴别培养出的细胞是否具有靶细胞的生物学特点,确定该试剂是否具有诱导MSCs定向分化为目标细胞的能力。这种方法的缺点在于筛选时间长,筛选效率低,不适合高通量筛选。
细胞代谢组学可鉴定生化反应的产物-内源性小分子,揭示一个活细胞中所运转的不同通路之间的联系,并可反映和评价健康和病理机体之间的生化差异,反过来可为药物干预提供一个方向。细胞代谢组学分析可定性、定量地描述胞内调控的最终产物,这些产物是生物系统对遗传因素或外界环境改变的最终应答。细胞代谢组学研究表明,在强大的细胞代谢网络中,生化途径的能动行为可由一个高度互联的调节系统来控制。目前细胞代谢组学已经在多种领域得到应用,如毒理学[Predicting human developmental toxicity ofpharmaceuticals using human embryonic stem cells and metabolomics,Toxicol Appl Pharmacol.2010;247(1):18-27]、药效评价[Metabolic profiling of HepG2cells incubated with S(-)and R(+)enantiomers of anti-coagulating drug warfarin.Metabolomics,2011,7(3):353-362]、细胞培养监测[Metabolomics:a valuable tool for stem cell monitoring in regenerative medicine.Journal of the Royal Society Interface,2012,9(73):1713-24]、新药研究[Pharmacometabolomics of docetaxel-treated human MCF7breast cancer cells provides evidence of varying cellular responses at high and low doses.Breast Cancer Research and Treatment,2010,120(3):613-626]、生物制药生产[LC-MS-based metabolic characterization of high monoclonal antibody-producing Chinese hamster ovary cells.Biotechnology and Bioengineering,2012,109(12):3103–3111]等。与其他方法相比,体外细胞代谢组学表现出更多的优势,如容易控制实验变化、高度重现性、低成本、结果更易解释等。
如果能通过细胞代谢组学的方法发现MSCs在诱导分化前、后胞内代谢物的差异,寻找到可以预测MSCs定向分化潜能的标志物,就有可能在MSCs经诱导试剂处理后迅速得知该诱导试剂的定向诱导效果,而不用培养数天后通过细胞生物学特点才能得出结论,必然可以提高筛选定向分化诱导试剂的效率,实现高通量筛选。
技术实现要素:
本发明旨在提供一种预示间充质干细胞定向分化潜能的标志物、试剂及试剂盒,以即时预测经定向诱导处理的MSCs是否具备定向分化为目标细胞的能力,不用培养数天后通过细胞生物学特点才能得出结论,进而提高筛选定向分化诱导试剂的效率,实现高通量筛选。
技术方案公布如下:
一组用于预示间充质干细胞定向分化为心肌样细胞的潜能的标志物,由α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸组成。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种用于预示间充质干细胞定向分化为心肌样细胞的潜能的试剂,含有上述的标志物。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种用于预示间充质干细胞定向分化为心肌样细胞的潜能的试剂盒,含有上述的标志物。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种筛选能诱导间充质干细胞分化为心肌样细胞的诱导剂的方法:测定该诱导剂诱导处理后的间充质干细胞中α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸的含量,并与未经诱导处理的间充质干细胞比较,需同时满足α-酮戊二酸上调≥4.3倍、磷酸二羟丙酮上调≥3.6倍、天冬酰胺上调≥1.7倍、花生四烯酸上调≥2.1倍。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一组用于预示间充质干细胞定向分化为神经元样细胞的潜能的标志物,由苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸组成。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种用于预示间充质干细胞定向分化为神经元样细胞的潜能的试剂,含有上述的标志物。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种用于预示间充质干细胞定向分化为神经元样细胞的潜能的试剂盒,含有上述标志物。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
一种筛选能诱导间充质干细胞分化为神经元样细胞的诱导剂的方法:测定该诱导剂诱导处理后的间充质干细胞中苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸的含量,并与未经诱导处理的间充质干细胞比较,需同时满足苯丙氨酸上调≥3.7倍、半胱氨酸上调≥3.2倍、磷酸烯醇式丙酮酸上调≥2.5倍、草酰乙酸上调≥3.4倍。
进一步地,所述间充质干细胞为骨髓间充质干细胞。
发明效果:
本发明创造提供的标志物α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸可以联合作为预示骨髓间充质干细胞BMSCs定向分化为心肌细胞的潜能的标志物,准确性高,效率高;本发明标志物苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸可以联合作为预示骨髓间充质干细胞BMSCs定向分化为神经元样细胞的潜能的标志物,准确性高,效率高。
附图说明
图1为本发明标志物发现和验证方法逻辑框图。
具体实施方式
下面结合具体实施例介绍本发明的技术方案。下述实施例中未特别强调的实验材料均为常规实验材料,无特别要求,都是本领域技术人员容易获得的常规材料。
实施例1:预示骨髓间充质干细胞BMSCs定向分化为心肌细胞的潜能的标志物发现
一、实验依据(诱导剂:5-氮杂胞苷、血管紧张素Ⅱ、二甲基亚砜)
5-氮杂胞苷[李雪等,5-氮杂胞苷诱导大鼠骨髓间充质干细胞分化为心肌细胞的实验研究,心脏杂志2004,15(6)]、血管紧张素Ⅱ[石静宝等,不同浓度血管紧张素Ⅱ诱导骨髓间充质干细胞向心肌细胞的定向分化,中国组织工程研究第18卷第50期]、二甲基亚砜[孙龙云,二甲基亚砜诱导骨髓间充质干细胞向心肌细胞的分化,中国组织工程研究第20卷第1期]是本领域公认的可以诱导骨髓间充质干细胞BMSCs定向分化为心肌细胞的诱导剂。因此,本实施例选择这三种物质作为诱导剂,通过细胞代谢组学的方法测定BMSCs诱导前后的差异代谢物,寻找可以预示骨髓间充质干细胞BMSCs定向分化为心肌细胞的潜能的标志物。
二、实验方法
1、BMSCs的分离培养
将大鼠移至无菌操作间内,用无菌器械剥离出四肢长骨,保留骨骺端。用含有双抗(青霉素105U/L,链霉素100mg/L)的D-Hank’s液冲洗大鼠长骨两次。另取一套无菌器械去除长骨骨骺端显露骨髓腔,以IMDM培养基(含体积分数10%胎牛血清)反复冲洗骨髓腔,收集冲洗液经无菌滤膜过滤,取一滴细胞悬液加入10μL 0.04%锥虫蓝混匀,血细胞计数板计数活细胞,然后调整接种细胞浓度为1×104L-1,接种于无菌培养瓶中,置于37℃、体积分数5%CO2的恒温培养箱中培养。12h后半量换液,轻柔操作,仔细观察细胞贴壁情况,至24h完全更换培养基。此后每隔2d换液,当贴壁细胞均匀铺满瓶底90%时,即进行传代。
2、BMSCs的分组和体外诱导
A:5-氮杂胞苷体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加10μmol/L诱导剂5-氮杂胞苷的5-氮杂胞苷诱导组和不加诱导剂的空白对照A组。5-氮杂胞苷诱导组、空白对照A组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养4周,用于传统指标的观察,以确保5-氮杂胞苷可以成功诱导骨髓间充质干细胞分化为心肌样细胞。剩余20个重复分别编号为5-AT 1~20和Blank A 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
B:血管紧张素Ⅱ体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加0.2μmol/L诱导剂血管紧张素Ⅱ的血管紧张素Ⅱ诱导组和不加诱导剂的空白对照B组。血管紧张素Ⅱ诱导组、空白对照B组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养4周,用于传统指标的观察,以确保血管紧张素Ⅱ可以成功诱导骨髓间充质干细胞分化为心肌样细胞。剩余20个重复分别编号为ANT 1~20和Blank B 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
C:二甲基亚砜体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加1.0%诱导剂二甲基亚砜的二甲基亚砜诱导组和不加诱导剂的空白对照C组。二甲基亚砜诱导组、空白对照C组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养4周,用于传统指标的观察,以确保二甲基亚砜可以成功诱导骨髓间充质干细胞分化为心肌样细胞。剩余20个重复分别编号为DMSO 1~20和Blank C 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
训练集:5-AT 1~20和Blank A 1~20、ANT 1~20和Blank B 1~20、DMSO 1~20和Blank C1~20共同组成训练集。
3、细胞样品的取出和前处理
各诱导组和空白组诱导培养24h后将细胞消化制成不含诱导剂的单细胞悬液,调整细胞浓度为1×106个/mL,转到冻存管中(每管1.5mL),加入100μL血清和100μLDMSO,最终放在-80℃冰箱保存。
将冻存在-80℃的细胞样品取出来,迅速放在37℃温水中恒温解冻,25℃条件下3000rpm离心5min;将上清的培养基去掉,沉淀加入1mL的PBS溶液摇晃润洗30s使之悬浮,同样采取上述条件离心后,弃去上清液;上述沉淀再次加入1.5mL的PBS摇晃30s悬浮后,再经过上述条件离心后,去掉上清PBS溶液;加入-80℃甲醇0.5mL,对细胞样品进行破碎提取;将样品放在-80℃冰箱30min,取出使之溶化,置超声仪中超声1min;再于4℃条件10000rpm离心10min,取上清,氮气常温吹干样品,置-80℃冰箱保存;进样前30min将样品取出,以100μL的10%乙腈复溶后,4℃条件10000rpm离心10min,取上清进样分析。
4、细胞样品LC-MS分析条件
色谱系统:Waters Acquity HPLC/Q-TOF;
色谱柱:Phenomenex Luna C18(4.6mm×150mm×3μm);
流动相:A相为水(含5mM己胺,乙酸调节pH至5.5);B相为乙腈-水(乙腈和水体积比为8:2;水中含20mM乙酸铵,氨水调节pH至8.5);
梯度条件:0-20min,10-25%B;20-35min,25-95%B;35-40min,95%B;40-45min,95-10%B;45-50min,10%B;
流速:0.8mL/min;柱温:35℃;
MS条件:Q-TOF/MS ESI离子源,负离子模式,扫描范围m/z 50-1500;毛细管电压3.0kV,锥孔电压35kV,离子源温度100℃,干燥气温度为350℃,流速800L/h,锥孔气流量50L/h。
5、诱导组与空白对照组差异代谢物的筛选
定性分析。将LC-MS得到的数据导入SIMCA软件(version 13.0.2,Umetrics)进行多元统计分析。通过建立OPLS-DA模型,寻找诱导组(包括样品5-AT 1~20、ANT 1~20和DMSO1~20,共60个样品)和空白对照组(包括样品Blank A 1~20、Blank B 1~20和Blank C 1~20,共60个样品)之间代谢轮廓贡献较大(VIP>1.0且p<0.01)的代谢物,然后将这些代谢物的分子量数据提交至在线数据库KEGG(http://wwwkeg.com)、METLIN(http://www.metlin.scipps.edu)、HMDB(http://www.hmdb.ca)搜寻,解析化合物质谱,对化合物进行结构鉴定,最终通过这些化合物标准品确证差异代谢物的结构。
定量分析。通过Q-q-Q质谱对差异代谢物定量分析,统计诱导组中差异代谢物相对于空白对照组的变化倍数。
6、用测试集验证标志物
测试集样品的制备:按照训练集样品的制备方法,制备测试集样品,包括诱导组5-AT31~90、ANT 31~90、DMSO 31~90和空白对照组Blank A 31~90、Blank B 31~90和Blank C31~90,共180个诱导样品和180个空白对照样品。
用上述差异代谢物区分诱导样品和空白样品的能力,得到可以用于区分诱导样品和空白对照样品进而用于预示骨髓间充质干细胞定向分化为心肌细胞的潜能的标志物。
三、实验结果
1、原代骨髓间充质干细胞形态
骨髓悬液中原代细胞呈悬浮状态,大小不一,数目较多,并混有大量红细胞;接种24h后,可见有少部分细胞贴壁,多呈类圆形或纺锤形,换液后去除未贴壁的细胞。此后每隔2d换液,贴壁细胞逐渐伸出突起,呈扁平三角形或多边形,核大而饱满。10d后细胞胞体呈现典型的成纤维细胞状,核圆形或椭圆形,位于细胞中心,多数细胞排布规则呈放射状生长。14d左右细胞集落融合超过90%时即可传代。传代后的细胞生长迅速,排列较为一致。
2、体外诱导四周后形态学和标记物变化
2.1形态学变化
第2代骨髓间充质干细胞经5-氮杂胞苷、血管紧张素Ⅱ、二甲基亚砜诱导后,细胞形态渐渐出现与空白对照A、B、C组不同的形态。各诱导组的骨髓间充质干细胞诱导7d时形态转变成类长柱形,28d时细胞体积变小,细胞呈片状生长,排列一致,呈心肌样特征。对照组未见类似上述改变,随换液和传代次数增多,对照组中细胞大部分为梭形。
2.2免疫细胞化学变化
各诱导组的骨髓间充质干细胞诱导28d时,心肌特异性标记物cTnT、cTnI均呈阳性表达,空白对照A、B、C组心肌特异性标记物cTnT、cTnI均呈阴性表达。
各组心肌特异性抗原阳性细胞百分比见下表。
结果表明,5-氮杂胞苷、血管紧张素Ⅱ、二甲基亚砜可以有效诱导骨髓间充质干细胞体外分化成心肌细胞,为有效诱导剂。
3、诱导组与空白对照组差异代谢物的筛选
通过定性和定量结果发现:与空白对照组相比,诱导组中α-酮戊二酸上调4.3~4.9倍,磷酸二羟丙酮上调3.6~4.4倍,天冬酰胺上调1.7~2.4倍,花生四烯酸上调2.1~2.7倍。
4、测试集验证结果
从测试集中,随机选择30个空白对照样品,测定其中α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸的含量各自取均值作为空白参考值。其余测试集样品随机分析,且分析人员不知道其分析的样品是诱导样品还是空白对照样品,如果该样品与空白参考值相比同时符合下述条件即归为诱导样品,否则为空白对照样品:α-酮戊二酸上调≥4.3倍、磷酸二羟丙酮上调≥3.6倍、天冬酰胺上调≥1.7倍、花生四烯酸上调≥2.1倍。
结果发现,该方法准确性非常高,能准确区分150个样品为诱导样品还是空白对照样品,准确率100%,证明α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸可以联合作为预示骨髓间充质干细胞BMSCs定向分化为心肌细胞的潜能的标志物。
该实施例表明:α-酮戊二酸、磷酸二羟丙酮、天冬酰胺和花生四烯酸联合预示价值非常高,可以作为预示BMSCs定向分化为心肌细胞的潜能的标志物,用于高通量筛选可以诱导BMSCs定向分化为心肌细胞的诱导剂,效率高,不需等待数周才能获知诱导结果。
发明人还考察了BMSCs不同培养基(含15%胎牛血清的DMEM培养液)对标志物结果的影响,结果证明不同培养基并不影响上述结果。
实施例2:预示骨髓间充质干细胞BMSCs定向分化为神经细胞的潜能的标志物发现
一、实验依据(诱导剂:红景天苷、全反式维甲酸、甲钴胺)
红景天苷[张全伟等,红景天苷体外诱导大鼠骨髓间充质干细胞分化为神经元样细胞,中国组织工程研究第16卷第14期]、全反式维甲酸[张全伟等,红景天苷体外诱导大鼠骨髓间充质干细胞分化为神经元样细胞,中国组织工程研究第16卷第14期]、甲钴胺[羊明智等,甲钴胺体外诱导大鼠骨髓间充质干细胞向神经元样细胞分化,中国组织工程研究第17卷第32期]是本领域公认的可以诱导骨髓间充质干细胞BMSCs定向分化为神经元细胞的诱导剂。因此,本实施例选择这三种物质作为诱导剂,通过细胞代谢组学的方法测定BMSCs诱导前后的差异代谢物,寻找可以预示BMSCs定向分化为神经元样细胞的潜能的标志物。
二、实验方法
1、BMSCs的分离培养
将大鼠移至无菌操作间内,用无菌器械剥离出四肢长骨,保留骨骺端。用含有双抗(青霉素105U/L,链霉素100mg/L)的D-Hank’s液冲洗大鼠长骨两次。另取一套无菌器械去除长骨骨骺端显露骨髓腔,以IMDM培养基(含体积分数10%胎牛血清)反复冲洗骨髓腔,收集冲洗液经无菌滤膜过滤,取一滴细胞悬液加入10μL 0.04%锥虫蓝混匀,血细胞计数板计数活细胞,然后调整接种细胞浓度为1×104L-1,接种于无菌培养瓶中,置于37℃、体积分数5%CO2的恒温培养箱中培养。12h后半量换液,轻柔操作,仔细观察细胞贴壁情况,至24h完全更换培养基。此后每隔2d换液,当贴壁细胞均匀铺满瓶底90%时,即进行传代。
2、BMSCs的分组和体外诱导
A:红景天苷体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加20mg/L诱导剂红景天苷的红景天苷诱导组和不加诱导剂的空白对照D组。红景天苷诱导组、空白对照D组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养6天,用于传统指标的观察,以确保红景天苷可以成功诱导骨髓间充质干细胞分化为神经元样细胞。剩余20个重复分别编号为HJTG 1~20和Blank D 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
B:全反式维甲酸体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加5μg/L诱导剂维甲酸的维甲酸诱导组和不加诱导剂的空白对照E组。维甲酸诱导组、空白对照E组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养6天,用于传统指标的观察,以确保维甲酸可以成功诱导骨髓间充质干细胞分化为神经元样细胞。剩余20个重复分别编号为WJS 1~20和Blank E 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
C:甲钴胺体外诱导。将生长良好、形态均一的第2代大鼠骨髓间充质干细胞培养48h后,去除培养基,PBS洗涤2次以除净残余生长培养基,分为添加100mg/L诱导剂甲钴胺的甲钴胺诱导组和不加诱导剂的空白对照F组。甲钴胺诱导组、空白对照F组分别设23个重复,其中3个重复诱导24h后,去除诱导培养基,加入不含诱导剂的普通培养基继续培养6天,用于传统指标的观察,以确保甲钴胺可以成功诱导骨髓间充质干细胞分化为神经元样细胞。剩余20个重复分别编号为JKA 1~20和Blank F 1~20,诱导培养24h后对细胞进行处理用于代谢分析,处理及分析方法见下。
训练集:HJTG 1~20和Blank D 1~20、WJS 1~20和Blank E 1~20、JKA 1~20和Blank F 1~20共同组成训练集。
3、细胞样品的取出和前处理
各诱导组和空白组诱导培养24h后将细胞消化制成不含诱导剂的单细胞悬液,调整细胞浓度为1×106个/mL,转到冻存管中(每管1.5mL),加入100μL血清和100μLDMSO,最终放在-80℃冰箱保存。
将冻存在-80℃的细胞样品取出来,迅速放在37℃温水中恒温解冻,25℃条件下3000rpm离心5min;将上清的培养基去掉,沉淀加入1mL的PBS溶液摇晃润洗30s使之悬浮,同样采取上述条件离心后,弃去上清液;上述沉淀再次加入1.5mL的PBS摇晃30s悬浮后,再经过上述条件离心后,去掉上清PBS溶液;加入-80℃甲醇0.5mL,对细胞样品进行破碎提取;将样品放在-80℃冰箱30min,取出使之溶化,置超声仪中超声1min;再于4℃条件10000rpm离心10min,取上清,氮气常温吹干样品,置-80℃冰箱保存;进样前30min将样品取出,以100μL的10%乙腈复溶后,4℃条件10000rpm离心10min,取上清进样分析。
4、细胞样品LC-MS分析条件
色谱系统:Waters Acquity HPLC/Q-TOF;
色谱柱:Phenomenex Luna C18(4.6mm×150mm×3μm);
流动相:A相为水(含5mM己胺,乙酸调节pH至5.5);B相为乙腈-水(乙腈和水体积比为8:2;水中含20mM乙酸铵,氨水调节pH至8.5);
梯度条件:0-20min,10-25%B;20-35min,25-95%B;35-40min,95%B;40-45min,95-10%B;45-50min,10%B;
流速:0.8mL/min;柱温:35℃;
MS条件:Q-TOF/MS ESI离子源,负离子模式,扫描范围m/z 50-1500;毛细管电压3.0kV,锥孔电压35kV,离子源温度100℃,干燥气温度为350℃,流速800L/h,锥孔气流量50L/h。
5、诱导组与空白对照组差异代谢物的筛选
定性分析。将LC-MS得到的数据导入SIMCA软件(version 13.0.2,Umetrics)进行多元统计分析。通过建立OPLS-DA模型,寻找诱导组(包括样品HJTG 1~20、WJS 1~20和JKA1~20,共60个样品)和空白对照组(包括样品Blank D 1~20、Blank E 1~20和Blank F 1~20,共60个样品)之间代谢轮廓贡献较大(VIP>1.0且p<0.01)的代谢物,然后将这些代谢物的分子量数据提交至在线数据库KEGG(http://wwwkeg.com)、METLIN(http://www.metlin.scipps.edu)、HMDB(http://www.hmdb.ca)搜寻,解析化合物质谱,对化合物进行结构鉴定,最终通过这些化合物标准品确证差异代谢物的结构。
定量分析。通过Q-q-Q质谱对差异代谢物定量分析,统计诱导组中上述差异代谢物相对于空白对照组的变化倍数。
6、用测试集验证标志物
测试集样品的制备:按照训练集样品的制备方法,制备测试集样品,包括诱导组HJTG31~90、WJS 31~90、JKA 31~90和空白对照组Blank D 31~90、Blank E 31~90和Blank F 31~90,共180个诱导样品和180个空白对照样品。
用上述差异代谢物区分诱导样品和空白样品的能力,得到可以用于区分诱导样品和空白样品进而用于预示骨髓间充质干细胞定向分化为神经元样细胞的潜能的标志物。
三、实验结果
1、原代骨髓间充质干细胞形态
骨髓悬液中原代细胞呈悬浮状态,大小不一,数目较多,并混有大量红细胞;接种24h后,可见有少部分细胞贴壁,多呈类圆形或纺锤形,换液后去除未贴壁的细胞。此后每隔2d换液,贴壁细胞逐渐伸出突起,呈扁平三角形或多边形,核大而饱满。10d后细胞胞体呈现典型的成纤维细胞状,核圆形或椭圆形,位于细胞中心,多数细胞排布规则呈放射状生长。14d左右细胞集落融合超过90%时即可传代。传代后的细胞生长迅速,排列较为一致。
2、体外诱导四周后形态学和标记物变化
2.1形态学变化
利用免疫荧光法标记细胞骨架β-Tubulin观察诱导前后细胞的形态结构。第2代骨髓间充质干细胞经红景天苷、全反式维甲酸、甲钴胺诱导后,细胞形态渐渐出现与空白对照D、E、F组不同的形态。空白对照组BMSCs形态多呈多角形或纺锤形,红景天苷、全反式维甲酸、甲钴胺诱导12h时可见部分细胞胞体变大,有突起形成,24h后大多数细胞胞体普遍增大、可见2个以上不等的突起形成,诱导6d后形成典型的神经样细胞,胞体变小、突起细长。
2.2免疫细胞化学变化
各诱导组的骨髓间充质干细胞诱导6d时,神经细胞特异性标志分子NSE和β-Tubulin均呈阳性表达,空白对照D、E、F组NSE和β-Tubulin均呈阴性表达。阳性率见下表。
结果表明,红景天苷、全反式维甲酸、甲钴胺可以有效诱导骨髓间充质干细胞体外分化成神经元样细胞,为有效诱导剂。
3、诱导组与空白对照组差异代谢物的筛选
通过定性和定量结果发现:与空白对照组相比,诱导组中苯丙氨酸上调3.7~4.3倍,半胱氨酸上调3.2~3.9倍,磷酸烯醇式丙酮酸上调2.5~2.9倍,草酰乙酸上调3.4~3.8倍。
4、测试集验证结果
从测试集中,选择30个空白对照样品,测定其中苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸的含量各自取均值作为空白参考值。其余测试集样品随机分析,且分析人员不知道其分析的样品是诱导样品还是空白对照样品,如果该样品与空白参考值相比同时符合下述条件即归为诱导样品,否则为空白对照样品:苯丙氨酸上调≥3.7倍、半胱氨酸上调≥3.2倍、磷酸烯醇式丙酮酸上调≥2.5倍、草酰乙酸上调≥3.4倍。
结果发现,该方法准确性非常高,能准确区分150个样品为诱导样品还是空白对照样品,准确率100%,苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸可以联合作为预示骨髓间充质干细胞BMSCs定向分化为神经元样细胞的潜能的标志物。
该实施例表明:苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸联合预示价值非常高,可以作为预示BMSCs定向分化为神经元样细胞的潜能的标志物,用于高通量筛选可以诱导BMSCs定向分化为神经细胞的诱导剂,效率高,不需等待数天才能获知诱导结果。
发明人还考察了BMSCs不同培养基(含15%胎牛血清的DMEM培养液)对标志物结果的影响,结果证明不同培养基并不影响上述结果。
上述具体实施例仅用于解释本发明的技术方案,本领域技术人员应当明白,本发明的保护范围并不受限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!