一种用于检测D型流感病毒的荧光PCR引物和探针及检测方法与流程
本发明涉及分子检测技术领域,具体涉及一种用于检测D型流感病毒的荧光PCR引物和探针及检测方法。
背景技术:
流行性感冒(简称流感)是由流感病毒感染引起的急性呼吸道传染病,它发病率高、传染性强、潜伏期短,对人群尤其是儿童、老年人及机体免疫力低下的易患人群造成很大的危害。该病症状可累及全身,主要表现为急性高热、全身疼痛、显著乏力和轻度的呼吸道症状,可引起严重的并发症导致死亡。20世纪以来全球至少有4次流感大流行[雷达,等,2009;宋乐,江晓静,2014]。流感属于乙类传染性,其致病因子流感病毒(Influenza virus)属于正粘病毒科(Orthomyxoviridae),是一种带包膜并且分节段的单负链RNA病毒(候文郁,等,2014)。根据流感病毒的NP蛋白和M蛋白的抗原性质不同,可将流感病毒分为甲(A)、乙(B)、丙(C)三型。甲型流感病毒的传染性、致病性和变异性都明显高于其他两种血清型,能引起世界性流感大流行(许沙沙,等,2015);乙型流感病毒常引起局部暴发,不引起世界性流感大流行;丙型流感病毒主要以散在形式出现,侵袭婴幼儿,一般不引起流行(KAITLIN RL,et a1.2013)。
流感病毒的检测方法包括分离培养法、免疫学检测和分子生物学检测。分离培养法是一种基于细胞病变的检测方法,有TCID50的测定和空斑实验,是流感病毒滴度测定的常规实验方法,TClD50实验测得结果的主观性较强,结果不够精确;空斑实验是病毒学中一种比较准确的定量方法,但实验操作的熟练程度要求较高,以上两种方法比较费时费力,且我国大部分实验室达不到重大传染病病毒分离培养要求,因而实验室通常采用免疫学检测与核酸检测法进行诊断(苏明权,等,2011)。免疫学检测方法包括血凝(HA)与血凝抑制(HI)试验、免疫荧光(IF)技术和酶联免疫吸附试验(ELISA)。免疫学检测方法具有特异性强,敏感性高,适应面广,方法简便快速,制样简单等特点,但存在操作费时且敏感性较差的问题(Brittain-long R,et a1.2008)。在血凝(HA)与血凝抑制(HI)试验中,红细胞浓度、稀释液、反应的温度、加抗原与加红细胞之间的时间间隔及结果的判定标准均会影响试验结果,而且HI试验需预处理血清中的非特异性血凝抑制因子,其缺点是存在一定的假阳性。免疫荧光技术的非特异性染色问题也尚未完全解决,结果判定的客观性不足,技术程序也还比较复杂。与免疫荧光相似,ELISA检测过程中,同样会出现假阳性。分子生物学检测是业内公认灵敏度和特异度最好的一种检测方法。该方法是在PCR原理的基础上,先后建立了多种PCR相关检测方法,最常用的如逆转录PCR(RT-PCR)、实时荧光PCR以及新型的环介导等温扩增技术(RT-LAMP)技术。本研究利用荧光RT-PCR反应的快速、灵敏及污染性小等特点,建立了基于TaqMan探针的多重荧光RT-PCR检测方法,期望在D型流感病毒的检测中发挥作用。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种用于检测D型流感病毒的荧光PCR引物和探针及检测方法。
本发明的目的是通过以下技术方案来实现的:
一种用于检测D型流感病毒的荧光PCR引物和探针,包括一组用于检测D型流感病毒的检测引物和探针,具体如下:
F-primer:GAGAAACCAGCTTACTGCC(SEQ NO.1),
R-primer:CTCATCTCTAGATTCCGCAT(SEQ NO.2),
Probe:FAM-ATGACCCAGAGAAGTCAGTACGA-BHQ1(SEQ NO.3)。
一种用于检测D型流感病毒的荧光PCR试剂盒,包括上述的引物和探针。
一种D型流感病毒的荧光PCR检测方法,它包括以下步骤:
S1.提取待检测样品的RNA,并以此为模板RNA;
S2.以权利要求1所述的引物和探针进行RT-PCR反应;
S3.根据扩增曲线,对照阳性标准品和阴性标准品的扩增结果,判断样品是否为D型流感病毒。
进一步地,所述RT-PCR反应体系为总体积为25μL,其中上游、下游引物10μmol/L各1.0μL,探针10μmol/L 0.5μL,模板RNA 5.0μL,最后补水至25μL;将加入反应液的PCR管5000r/min离心30s后放入检测仪器,反应程序设置:第一阶段:42℃10min,95℃3min;第二阶段:95℃30s,45℃30s,72℃30s,5个循环;第三阶段:95℃15s,55℃40s,40个循环,在55℃40s收集荧光信号。
本发明的有益效果是:本发明根据GenBank中公布的A型、B型、C型和D型流感病毒的NS基因序列,进行多序列比对之后,使用分子生物学软件Oligo7.0在D型流感病毒基因的保守区设计一套特异性的引物和探针,通过RT-PCR反应,实现检测方法简单,检测迅速,便捷的定量检测,同时灵敏度试验显示最低能够检测到10个拷贝。
附图说明
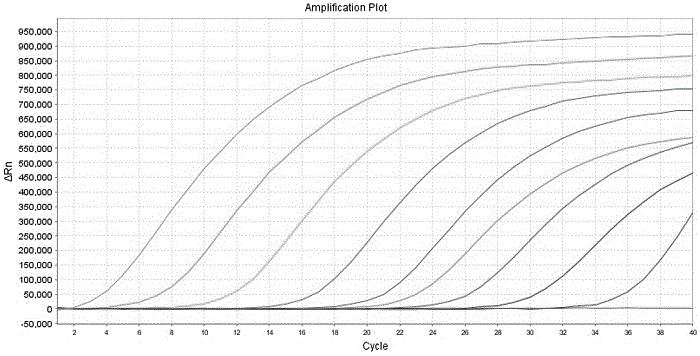
图1为本发明RT-PCR体系鉴定结果;
图2为本发明RT-PCR灵敏度鉴定结果;
图3为本发明RT-PCR特异性鉴定结果(由左向右为109-101)。
具体实施方式
下面结合具体实施例进一步详细描述本发明的技术方案,但本发明的保护范围不局限于以下所述。
试验例
A型流感灭活病毒7株,分别为H1N1、H3N2、H5N1、H5N2、H6N2、H7N9和H9N2;B型流感病毒RNA 21份,均存放于-80℃冰箱保藏,C型和D型流感病毒NS基因克隆质粒各1份,根据美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)上公布的C型和D型流感病毒非结构蛋白(NS)序列全基因合成并克隆到PES载体上。
病毒RNA柱式提取试剂盒为北京森康公司产品,RNA体系反应液TaKaRa One step PrimeScriptTM RT-PCR Kit,为TaKaRa公司产品。
根据GenBank中公布的A型、B型、C型和D型流感病毒的NS基因序列,进行多序列比对之后,使用分子生物学软件Oligo7.0在D型流感病毒基因的保守区设计一套特异性的引物、探针,由上海辉睿生物科技有限公司合成。引物、探针用DEPC水稀释成100pmol/μL溶液,-20℃保存备用。引物序列见表1。
表1 D型流感病毒引物、探针序列
RNA提取方法分别按照RNA提取试剂盒说明书的要求进行,获得的模板的260/280比值应在1.8~2.0之间才说明提取的RNA适合做后续的扩增反应。
以样品RNA和质粒为模板进行荧光反转录PCR(reverse transcription PCR,RT-PCR)扩增。PCR反应体系总体积为25μL,按照TaKaRa反应试剂盒RR064A的说明书配制,其中上游、下游引物10μmol/L各1.0μL,探针10μmol/L 0.5μL,RNA模版5.0μL,最后补水至25μL。将加入反应液的PCR管5000r/min离心30s后放入检测仪器,反应程序设置:第一阶段:42℃10min,95℃3min;第二阶段:95℃30s,45℃30s,72℃30s,5个循环;第三阶段:95℃15s,55℃40s(收集荧光信号),40个循环,检测结果如图1。
方法灵敏度试验:将合成D型流感病毒重组质粒作为阳性标准品。用紫外分光光度计测定质粒浓度,根据阿伏伽德罗常数换算为目的基因的拷贝数,以10倍梯度稀释至10拷贝/μL,对梯度稀释的阳性对照进行荧光RT-PCR反应检测;
将浓度为109至101的9个梯度的阳性标准品使用上述的反应体系和反应条件进荧光RT-PCR扩增,以验证建立方法的灵敏度,检测结果如图2。
方法特异性试验:将样品RNA和质粒作为模板,使用上述的反应体系和反应条件进行荧光RT-PCR扩增扩增,以验证所建立方法的特异性,检测结果如图3。
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
SEQUENCE LISTING
<110> 珠海出入境检验检疫局检验检疫技术中心
<120> 一种用于检测D型流感病毒的荧光PCR引物和探针及检测方法
<130> 2016
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> DNA
<213> 人工序列
<400> 1
GAGAAACCAG CTTACTGCC 19
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
CTCATCTCTA GATTCCGCAT 20
<210> 3
<211> 23
<212> DNA
<213> 人工序列
<400> 3
ATGACCCAGA GAAGTCAGTA CGA 23
- 还没有人留言评论。精彩留言会获得点赞!