一种水溶性的生物硫醇双光子荧光探针及其制备方法和应用与流程
本发明涉及一种水溶性的生物硫醇双光子荧光探针及其制备方法和应用,属于有机小分子荧光探针领域。
背景技术:
半胱氨酸(Cys)、同型半胱氨酸(Hcy)、谷胱甘肽(GSH)是细胞内非常重要的三种小分子生物硫醇,维持着生命体的各项生理平衡。当人体内生物硫醇的含量异常时,会导致人体出现各种疾病,例如升至缓慢、神经性中毒、心血管疾病、器官衰竭等。所以,快速、定量的检测出人体内生物硫醇的含量具有重要意义。
相比于传统的检测方法,光谱法检测具有操作方便、成本低、空间分辨率高等优点,而且随着光学成像技术的发展,荧光检测法已做到在细胞、组织以及活体中的实时监控,在生物领域发挥着重要的作用。而且双光子技术相比于单光子技术,可以减弱光漂白和光毒性,减小样品的检测背景,提高信噪比,能够更好的得到样品的立体成像。但是,目前报道了许多生物硫醇探针,基于不同的荧光团,利用不同的反应机理识别三种生物硫醇。但是,硫化氢具有相似巯基结构,而且具有更强的亲核性,一直存在着干扰生物硫醇检测的问题。因此,研发出在复杂生物环境中特异性检测生物硫醇的生物荧光传感器是必不可少的。
技术实现要素:
针对目前有机小分子荧光探针在生物硫醇的检测中所面临的问题,本发明通过分子设计,合成出一种水溶性的生物硫醇双光子荧光探针,该探针可以用于水环境和生物环境中生物硫醇的传感检测。
本发明还提供了上述荧光探针的制备方法和应用。
本发明采用以下技术方案:
一种水溶性的生物硫醇双光子荧光探针,其结构式如式(I)所示:
上述的水溶性生物硫醇双光子荧光探针的制备方法,它包括如下步骤:
(1)将1mmol化合物1与1.2mmol 6-羟基萘醛(化合物2)在氮气氛围下加至反应瓶中,然后将0.5mL冰醋酸和30mL乙醇一次加至上述反应器中,于氮气氛围下在加热回流6h后,点板检测反应完全,反应液冷至室温,析出沉淀,抽滤,得到粗产品,用无水乙醇重结晶,得到红色产物NBI;
(2)将1mol化合物NBI和0.5mL三乙胺溶解在干燥的20mL二氯甲烷中,冰浴条件下,逐滴滴入3mmol丙烯酰氯的二氯甲烷溶液,冰浴下反应1h后,室温反应2h停止反应,有机相用二次水洗三次,干燥,抽滤,减压浓缩,粗产品通过柱色谱分离即得到目标探针化合物。
所述步骤(2)中柱色谱分离提纯所用洗脱剂配比为CH2Cl2:MeOH=25:1。
本发明探针分子的合成路线如下所示:
本发明所述的双光子荧光探针的应用,该荧光探针可用于水环境和生物体系中生物硫醇的传感检测;所述传感检测包含荧光检测、细胞成像和组织成像检测。
本发明的优点:(1)该探针的合成方法简单,识别硫醇迅速;(2)本发明通过荧光光谱检测实现了生物硫醇的定量检测,且不受性质相似的硫化氢分子的干扰;(3)该探针具有双光子荧光性质,能够实现生物细胞内的双光子成像以及肝脏和肿瘤组织成像。因此,本发明是一种简单,快速,灵敏的生物硫醇特异性检测试剂,在生物分子检测领域具有广阔的应用前景。其性能将在实施例中结合附图给予详细说明。
附图说明
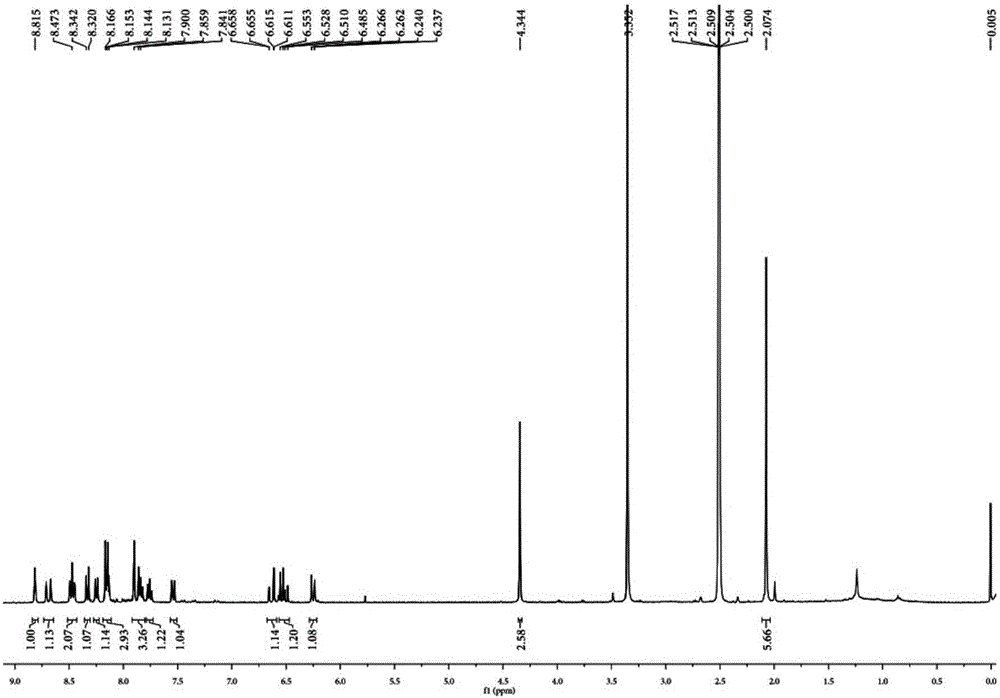
图1为探针ANBI的核磁氢谱图。
图2为探针ANBI的PBS缓冲液的溶液加入多种硫醇的荧光发射图谱。
图3为探针ANBI的PBS缓冲液的溶液加入多种分析物的荧光发射柱状图谱。
图4为探针ANBI的PBS缓冲液的溶液随半胱氨酸的加入量逐渐增大的荧光变化图。
图5为探针ANBI在HeLa细胞内的单光子荧光成像图和双光子荧光成像图。a-d为HeLa细胞用5.0μM探针ANBI孵育后的成像图,e-h为HeLa细胞先用500μM N-乙基马来酰亚胺(NEM)孵育,再用5.0μM探针ANBI孵育后的成像图。其中,a,e为明场下细胞图,b,f为单光子激发波长(λex=488nm)下细胞成像图,c为a-b的叠加图,g为e-f的叠加图,d,h为双光子激发波长(λex=780nm)下的细胞成像图。
图6为探针ANBI在小鼠肝脏中的单光子荧光成像图和双光子荧光成像图,其中(a)单光子荧光成像图;(b)单光子荧光成像三维图;(c)双光子荧光成像图;(d)双光子荧光成像三维图。
图7为探针ANBI在肿瘤中的单光子荧光成像图和双光子荧光成像图,其中(a)单光子荧光成像图;(b)单光子荧光成像三维图;(c)双光子荧光成像图;(d)双光子荧光成像三维图。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制,实施例中化合物的号码对于上述方案中化合物的号码。
实施例1
探针化合物ABNI的合成:
将化合物1(1mmol,0.172g)与化合物2(1.2mmol,0.421g)在氮气氛围下加至反应瓶中,然后将冰醋酸(0.5mL)和乙醇(30mL)一次加至上述反应器中,于氮气氛围下在加热回流6h后,点板检测反应完全。反应液冷至室温,析出沉淀,抽滤,得到粗产品,用无水乙醇重结晶,得到红色产物NBI,产率为75%。1H NMR(400MHz,DMSO-d6):δ=10.45(s,1H,-OH),8.63(d,J=13.7Hz,2H),8.46(d,J=8.4Hz,1H),8.31(d,J=8.9Hz,2H),8.23(d,J=8.1Hz,1H),8.12(d,J=9.0Hz,1H),7.94(d,J=8.8Hz,1H),7.89(d,J=8.8Hz,1H),7.83(t,J=7.2Hz,1H),7.74(dd,J=15.6and 7.8Hz,2H),7.28-7.19(m,2H),4.30(s,3H),2.06(s,6H).13C NMR(100MHz,DMSO-d6):δ=182.72,159.09,153.06,139.97,138.32,137.79,135.12,133.59,131.94,131.30,130.51,129.83,128.88,127.72,127.68,12.53,127.16,124.96,123.64,120.37,113.75,111.51,109.99,54.09,35.39,25.75.HRMS:m/z[M+H]+calcd for[C27H24NO]+378.1858,found 378.1858.
将化合物NBI(1mol)和0.5mL三乙胺溶解在干燥的二氯甲烷(20mL)中。冰浴条件下,逐滴滴入丙烯酰氯(3mmol)的二氯甲烷溶液。冰浴下反应1h后,室温反应2h停止反应。有机相用二次水洗三次,干燥,抽滤,减压浓缩。粗产品通过柱色谱层析提纯,洗脱剂为CH2Cl2:MeOH=25:1,得到暗红色固体即为目标探针产物ANBI,产率41%。1H NMR(400MHz,DMSO-d6):δ=8.81(s,1H),8.69(d,J=16.5Hz,1H),8.47(t,J=8.3Hz,2H),8.33(d,J=8.9Hz,1H),8.25(d,J=8.2Hz,1H),8.15(dd,J=8.9,5.1Hz,3H),7.82-7.90(m,3H),7.76(t,J=7.6Hz,1H),7.54(dd,J=8.8and 2.3Hz,1H),6.63(dd,J=17.3and 1.4Hz,1H),6.52(dd,J=17.3and 10.2Hz,1H),6.25(dd,J=10.2and 1.4Hz,1H),4.34(s,3H),2.07(s,6H).13C NMR(100MHz,DMSO-d6):δ182.93,164.66,151.98,150.62,139.94,138.77,135.95,134.65,134.04,133.76,132.76,131.40,131.26,130.53,129.10,129.95,127.99,127.77,127.11,125.40,123.76,123.38,119.52,113.87,113.59,54.37,35.67,25.50.HRMS:m/z[M+H]+calcd for[C30H26NO]+432.1964,found 432.1957.
实施例2
探针ANBI在PBS缓冲溶液中的光谱测试:
取实施例1制备的探针ANBI溶于DMSO中,制成1mM的储备液。从储备液中取出30μL加入到5mL的离心管当中,用PBS缓冲溶液(0.1mol/L,pH=7.2)稀释至3mL,加入不同分析物Cys、GSH、H2S,在激发波长470nm下测量其荧光性质,结果如图2所示。图2可以看出,对于Cys、GSH生物硫醇能够引起荧光的增强,而H2S只能使荧光淬灭完全。这表明该探针的选择性较好,能够抵抗硫化氢对生物硫醇检测的干扰。
为进一步说明本发明探针的选择性和抗干扰能力,本发明还研究了该探针在加入多种不同分析物(Cys,GSH,Alanine,Arginine,Aspartic acid,Glutamic acid,Histidine,Phenylalanine,Serine,Threonine,Tryptophan and Valine,K+,Ca2+,Na+,Fe3+,Zn2+,H2O2)和不同当量的半胱氨酸标准溶液时的荧光性质,结果如图3和图4所示。图3表示探针与多种被检测物在最大发射波长590nm处强度,由结果可以看出,该探针在多种被检测物中的选择性和抗干扰能力均较好。图4显示,随着半胱氨酸加入量的增加,荧光逐渐增强,因而该探针可以实现半胱氨酸的定量检测,最低检测限可达到0.38μM。
实施例3
细胞内荧光成像测试:
在37℃条件下,将HeLa细胞在加入5.0μM的探针ANBI的细胞培养液中培养20min,PBS缓冲溶液洗涤三次后,置于共聚焦荧光显微镜下分别进行单光子(λex=488nm)荧光成像和双光子(λex=780nm)荧光成像,结果如图5a-d所示。其中,对比实验是将HeLa细胞先用500μM N-乙基马来酰亚胺(NEM)孵育20min,再加入5.0μM的探针ANBI的细胞培养液培养20min,PBS缓冲溶液洗涤三次后,置于共聚焦荧光显微镜下进行单光子(λex=488nm)荧光成像和双光子(λex=780nm)荧光成像。
图5中,a-d为HeLa细胞用5.0μM探针ANBI孵育后的成像图,e-h为HeLa细胞先用500μM N-乙基马来酰亚胺(NEM)孵育,再用5.0μM探针ANBI孵育后的成像图。其中,a,e为明场下细胞图,b,f为单光子激发波长(λex=488nm)下细胞成像图,c为a-b的叠加图,g为e-f的叠加图,d,h为双光子激发波长(λex=780nm)下的细胞成像图。图5的红色荧光显示,探针ANBI渗透进细胞内,在单双光子激发下都呈现红色荧光。对照实验中,利用NEM处理生物细胞HeLa即是将细胞内生物硫醇进行清除的过程,然后再加入探针ANBI之后,通过图5中的结果可以看出无法实现细胞发光,这充分说明生物硫醇是引起细胞发光的唯一原因,因而可以利用该探针对细胞内的生物硫醇进行定性或定量检测。
实施例4
组织成像实验:
用20μM的探针ANBI孵育小鼠肝脏和肿瘤组织20min,PBS缓冲溶液洗涤三次后,置于共聚焦荧光显微镜下进行单光子(λex=488nm)荧光成像和双光子(λex=780nm)荧光成像。图6为小鼠肝脏成像,图7为肿瘤组织成像,其中(a)单光子荧光成像图;(b)单光子荧光成像三维图;(c)双光子荧光成像图;(d)双光子荧光成像三维图。图5-6的荧光成像图显示,探针可以达到肝脏的85μm深度,即使对于难于渗透的肿瘤细胞,依然能达到50μm的深度。
- 还没有人留言评论。精彩留言会获得点赞!