一种不对称1,2,4‑三唑类衍生物的合成方法与流程
本发明属于有机合成领域,具体涉及一种不对称1,2,4-三唑类衍生物的合成方法。
背景技术:
三唑类化合物因具有良好的生物活性而得到广泛的关注和应用,已发现了许多唑类的杀虫剂、杀菌剂、除草剂和药物等,具有重要的应用价值。近三十年来,三唑类衍生物以其高效、低毒、广普、具有植物生物调节功能等优点,成为人们最为关注的抗真菌感染药物类型,显示出了三唑类化合物,在医药领域的巨大开发价值和潜在的宽广应用。
三唑类化合物作为药物广泛应用于临床,是目前药物研究开发的重点领域之一。三唑类化合物作为药物在整个医药领域的研究与开发近况,包括抗真菌、抗细菌、抗结核、抗癌、抗病毒、抗炎镇痛、抗惊厥等。目前含三唑类结构的药物已得到普遍的应用,并已开发出相应药品如:具有消炎杀菌效果的氟康唑,伏立康唑等,结构式如下。
1,2,4-三唑类衍生物的合成、生物活性具有重要意义。文献中报道过的合成1,2,4-三唑类类化合物的方法主要有以下几种:
(一)以腈和酰肼类化合物在微波条件下反应合成3,5-二取代-1,2,4-三唑.
这种方法使用了微波条件,虽较为简便但工业上实施较困难,而且产率不高。
(二)用3,5-二芳基-1,2,4-三唑通过使用脒或亚氨酸酯作为底物,铜催化的多米诺亲核取代反应/氧化环化简便合成。
该反应用铜作催化剂,同时加入了配体和氧化剂,但产率依然较低,而且只适用于自身偶联的产物。
(三)以腈为原料通过合成中间产物胺肟,然后再与腈反应合成不对称1,2,4-三唑。
第一步,在空气的氛围下,加入1.5当量的腈和1.6当量的盐酸羟胺,再加入2当量的三乙胺作为碱。以无水叔丁醇作为溶剂,与80℃下反应18小时。
第二步,加入1当量腈,0.2当量的Cu(OAc)2作为催化剂和3当量的Cs2CO3作为碱,以DMSO作为溶剂与120℃下反应24小时。
该反应虽然实现的不对称三唑的合成,但不够全面且反应产率普遍偏低。
(四)2014年Beifuss课题组利用铜催化亲和取代/氧化环化合成3,5-二取代的1,2,4-三唑。
该方法是以Cu(OTf)2作催化,NaHCO3为碱,邻菲啰啉作配体再加入K3[Fe(CN)6]置于空气中反应得到产物。该方法存在不足之处是条件比较繁琐,产率不高。
(五)2014年赵培青课题组利用可循环使用的多组分的催化剂在空气中催化合成1,2,4-三唑类化合物。
该方法可在不需要配体,碱和添加剂的条件下进行,但是产率不高。
综上所述,现有技术合成1,2,4-三唑类化合物的方法很多,但是这些方法有些需要经过复杂的合成步骤且副反应较多和产率比较低;有些使用高毒性的底物或有机溶剂易造成环境污染;有些使用贵金属钯等为催化剂,成本较为昂贵,不适用于工业生产等缺点。因此,提供一种合成1,2,4-三唑类化合物的新型的绿色合成方法很有必要。
技术实现要素:
为解决现有技术中存在的不存,本申请提供了一种不对称1,2,4-三唑类衍生物的合成方法,利用空气为氧化剂,氧化铜催化脒与偕胺肟间接反应,该方法原料易得,效率高,使用广泛。
本发明提供了的一种不对称1,2,4-三唑类衍生物的合成方法,包括以下步骤:
A、将脒类化合物盐酸盐、偕胺肟类化合物、催化剂、碱混合后,加入有机溶剂,搅拌条件下,加热反应,得到产物;
B、所得产物干燥、分离纯化得到不对称1,2,4-三唑类衍生物。
步骤A中脒类化合物盐酸盐、偕胺肟类化合物、催化剂、碱的摩尔比为1:1.2:0.1-0.2:1.5-2.5;
步骤A中所述脒类化合物盐酸盐结构式为其中R1为H、Br、CF3、CH3。
步骤A中所述偕胺肟类化合物的结构式为其中R2为H、OCH3、Cl、CH3、F或Br。
步骤A中所述有机溶剂选自二甲基亚砜DMSO;脒类化合物盐酸盐在溶剂的浓度为0.16-0.2mol/L;
步骤A中所述催化剂为氧化铜或醋酸铜;所述碱为碳酸钾、碳酸钠或磷酸钾;
所述加热反应是指在100℃-120℃的条件下空气中反应18-24h;
所述脒类化合物盐酸盐结构式为所述偕胺肟类化合物的结构式为其中R2为H、Cl、CH3、Br时,步骤B所得不对称1,2,4-三唑类衍生物的结构通式为:R2为H、CH3、Cl、Br。
所述脒类化合物盐酸盐结构式为其中R1为H、Br、CF3、CH3,所述偕胺肟类化合物的结构式为其中R2为H、OCH3、Cl、CH3、F、Br时,步骤B所得不对称1,2,4-三唑类衍生物的结构通式为:
式中,R1为H、Br、CH3、CF3;R2为H、OCH3、Cl、CH3、F、Br。
步骤B具体为:所得产物用乙酸乙酯萃取后,用无水硫酸钠干燥,然后减压浓缩,得粗产物,以体积比为石油醚:乙酸乙酯=5:1的混合溶剂为展开剂,通过柱层析分离得到不对称1,2,4-三唑类衍生物。
本发明通过脒类盐酸盐与偕胺肟反应合成不对称1,2,4-三唑衍生物,首先脒类盐酸盐在碱性条件下脱去盐酸,然后再在催化剂的作用下与偕胺肟反应,先后再脱去一份子的水和氨气最终达到目的产物。
与现有技术相比,本发明方法有以下优点:(1)在空气气氛中进行,成本低;(2)没有使用贵金属,强碱和有机氧化剂,而是利用商品化氧化铜作催化剂,节约成本;(3)利用胺和腈为反应原料,原料易得;(4)该合成方法效率高,使用范围广,适合多种底物反应。
附图说明
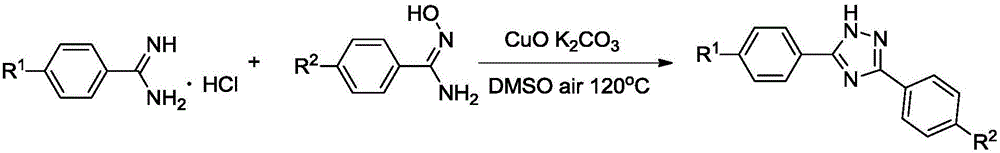
图1为脒类化合物盐酸盐与偕胺肟的反应方程式;
式中,R1为H、Br、CF3、CH3;R2为H、CH3、Cl、F、OCH3;
图2a为实施例1制备的5-(4-氯苯基)-3-(对甲苯基)-1H-1,2,4-三唑的1H NMR。
图2b为实施例1制备的5-(4-氯苯基)-3-(对甲苯基)-1H-1,2,4-三唑的13C NMR。
图3a为实施例2制备的5-(4-氯苯基)-3-(对溴苯基)-1H-1,2,4-三唑的 1H NMR。
图3b为实施例2制备的5-(4-氯苯基)-3-(对溴苯基)-1H-1,2,4-三唑的 13C NMR。
图4a为实施例3制备的5-(4-(三氟甲基)苯基)-3-(对溴苯基)-1H-1,2,4-三唑的1H NMR。
图4b为实施例3制备的5-(4-(三氟甲基)苯基)-3-(对溴苯基)-1H-1,2,4-三唑的 13C NMR。
图5a为实施例4制备的5-(4-(甲基)苯基)-3-(苯基)-1H-1,2,4-三唑的1H NMR。
图5b为实施例4制备的5-(4-(甲基)苯基)-3-(苯基)-1H-1,2,4-三唑的 13C NMR。
图6a为实施例5制备的5-(对氯苯基)-3-(苯基)-1H-1,2,4-三唑的1H NMR。
图6b为实施例5制备的5-(对氯甲基)苯基)-3-(苯基)-1H-1,2,4-三唑的13C NMR。
图7a为实施例6制备的5-(对溴苯基)-3-(苯基)-1H-1,2,4-三唑的1H NMR。
图7b为实施例6制备的5-(对溴苯基)-3-(苯基)-1H-1,2,4-三唑的13C NMR。
图8a为实施例7制备的5-(对溴苯基)-3-甲基-1H-1,2,4-三唑的1H NMR。
图8b为实施例7制备的5-(对溴苯基)-3-甲基-1H-1,2,4-三唑的13C NMR。
图9a为实施例8制备的5-(对甲基苯基)-3-甲基-1H-1,2,4-三唑的1H NMR。
图9b为实施例8制备的5-(对甲基苯基)-3-甲基-1H-1,2,4-三唑的13C NMR。
具体实施方式
实施例1
一种5-(4-氯苯基)-3–(对甲苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol对甲基苄脒盐酸盐和0.6mmol 4-氯-N-羟基苯羧酰亚胺于反应管中,再往其加入0.05mmol CuO,1.0mmol K2CO3以及3mL DMSO,在110℃空气中下搅拌反应24小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体,即5-(4-氯苯基)-3-(对甲苯基)-1H-1,2,4-三唑,产率80%,熔点为254℃。
1H NMR(300MHz,DMSO-d6)δ14.51(s,1H),8.08-8.05(d,J=9.0Hz,2H),7.96-7.93(d,J=9.0Hz,2H),7.57-7.55(d,J=6.0Hz,2H),7.34-7.7.31(d,J=9.0Hz,2H),2.35(s,3H);
13C NMR(125MHz,DMSO)δ159.4,140.4,134.8,130.3,130.2,129.9,129.8,128.6,128.5,126.9,126.8,21.8;
实施例2
一种5-(4-氯苯基)-3–(对溴苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol对溴苄脒盐酸盐和0.6mmol 4-氯-N-羟基苯羧酰亚胺于反应管中,再往其加入0.07mmol CuO,0.8mmol K2CO3以及3mL DMSO,在120℃下搅拌反应24小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(4-氯苯基)-3-(对溴苯基)-1H-1,2,4-三唑,产率63.7%,熔点为276℃。
1H NMR(300MHz,DMSO)δ14.66(s,1H),8.07-8.04(d,J=9.0Hz,2H),8.00-7.98(d,J=6.0Hz,2H),7.73-7.70(d,J=9.0Hz,2H),7.59-7.57(d,J=6.0Hz,2H);
13C NMR(125MHz,DMSO)δ158.6,135.2,132.8,129.9,128.8 128.6,123.9;
实施例3
一种5-(4–(三氟甲基)苯基)-3-(对溴苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol对三氟甲基苄脒盐酸盐和0.6mmol 4-溴-N-羟基苯羧酰亚胺于反应管中,再往其加入0.05mmol醋酸铜,1.0mmol K2CO3以及2.5mL DMSO,在100℃下搅拌反应24小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(4-(三氟甲基)苯基)-3-(对溴苯基)-1H-1,2,4-三唑,产率56.9%,熔点为247℃。
1H NMR(300MHz,DMSO)δ14.79(s,1H),8.27(d,2H),8.07-8.05(d,J=6.0Hz,2H),7.89(d,2H),7.60(d,2H);
13C NMR(125MHz,DMSO)δ158.3,134.1,132.8,132.8,130.3(q,J=31.2Hz),1128.9,128.8,125.0(q,J=270.0Hz),127.5,126.8,124.2;
实施例4
一种5-(4-(甲基)苯基)-3-(苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol对甲基苄脒盐酸盐和0.6mmol N-羟基苯羧酰亚胺于反应管中,再往其加入0.05mmol CuO,1.0mmol Na2CO3以及3mL DMSO,在110℃下搅拌反应18小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(4-(甲基)苯基)-3-(苯基)-1H-1,2,4-三唑,产率90%,熔点为187-188℃。
1H NMR(300MHz,DMSO)δ14.38(s,1H),8.07-8.04(d,J=9.0Hz,2H),7.96-7.94(d,J=4.0Hz,2H),7.52-7.48(m,3H),7.33-7.31(d,J=4.0Hz,2H),2.35(d,3H);
13C NMR(125MHz,DMSO)δ159.36,140.15,130.31,129.70,126.84,21.80;
实施例5
一种5-(对氯苯基)-3-(苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol苄脒盐酸盐和0.6mmol 4-氯-N-羟基苯羧酰亚胺于反应管中,再往其加入0.06mmol CuO,1.2mmol K2CO3以及3mL DMSO,在110℃下搅拌反应20小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(对氯苯基)-3-(苯基)-1H-1,2,4-三唑,产率75%,熔点为230-231℃。
1H NMR(300MHz,DMSO)δ14.60(s,1H),8.09-8.06(d,J=9.0Hz,4H),7.59-7.50(m,5H);
13C NMR(125MHz,DMSO)δ158.83,134.95,130.68,129.80,128.58,126.93;
实施例6
一种5-(对溴苯基)-3-(苯基)-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol对溴苄脒盐酸盐和0.6mmol N-羟基苯羧酰亚胺于反应管中,再往其加入0.05mmol CuO,1.0mmol磷酸钾以及3mL DMSO,在120℃下搅拌反应23小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(对溴苯基)-3-(苯基)-1H-1,2,4-三唑,产率72%,熔点为230-231℃。
1H NMR(300MHz,DMSO)δ14.59(s,1H),8.06-8.04(d,J=6.0Hz,2H),8.01-7.98(m,2H),7.71(s,2H),7.52(s,3H);
13C NMR(125MHz,DMSO)δ157.86,132.81,132.74,130.72,129.81,128.85,128.81,126.93,123.61;
实施例7
一种5-(对溴苯基)-3-甲基-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol乙脒盐酸盐和0.6mmol 4-溴-N-羟基苯羧酰亚胺于反应管中,再往其加入0.1mmol CuO,1.0mmol K2CO3以及3mL DMSO,在120℃下搅拌反应24小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(对溴苯基)-3-甲基-1H-1,2,4-三唑,产率58%,熔点为178-179℃。
1H NMR(300MHz,DMSO)δ14.08-13.67(d,1H),7.89-7.73(m,2H),7.57-7.55(d,J=6.0Hz,2H),2.23-2.24(d,3H);
13C NMR(125MHz,DMSO)δ160.82,154.59,132.46,132.08,131.69,130.46,128,48,122.74,12.49;
实施例8
一种5-(对甲基苯基)-3-甲基-1H-1,2,4-三唑的合成,包括以下步骤:
A、取0.5mmol乙脒盐酸盐和0.6mmol 4-甲基-N-羟基苯羧酰亚胺于反应管中,再往其加入0.08mmol CuO,1.25mmol K2CO3以及3mL DMSO,在110℃下搅拌反应24小时;
B、将产物用乙酸乙酯进行萃取,无水硫酸钠干燥,减压浓缩,得粗产物,将粗产物用硅胶柱层析(溶剂体积比为石油醚:乙酸乙酯=5:1)纯化得白色固体即5-(对甲基苯基)-3-甲基-1H-1,2,4-三唑,产率70%,熔点为155-156℃。
1H NMR(300MHz,DMSO)δ13.88-13.50(d,1H),7.80-7.77(d,J=9.0Hz,2H),7.25-7.15(m,2H),2.31(d,3H),2.25(d,3H);
13C NMR(125MHz,DMSO)δ161.73,154.16,132.46,138.84,130.38,130.00,129.79,126.46,21.75,12.48;
以上所述仅是本发明的优选实施方式,应当指出:对于本领域的技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰,都应当视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!