一种Teixobactin类似物及其制备方法和应用与流程
本发明涉及生物医药领域,具体涉及TEIXOBACTIN类似物及其制备方法和应用。
背景技术:
Teixobactin是2015年美国科学家通过iChip技术发现的一种新型抗菌化合物。该化合物杀死小鼠机体中某些细菌的速度与现存抗生素的速度相当,而且无毒副作用,安全有效。最关键的是,Teixobactin主要通过破坏细菌的细胞壁来消灭细菌,不会诱发细菌耐药性的产生。然而,通过iChip技术分离、筛选Teixobactin需要相当长的时间,工艺复杂,迅速开展其相关药效学的评估具有很大的困难。因此发展一种高效、简单、快速合成Teixobactin类似物的方法,得到一系列具有优良生物活性的Teixobactin结构类似物是本发明要解决的技术问题。
在现有技术1中,Teixobactin是由Kim Lewis研究组通过iChip技术对未培养的土壤细菌进行原位培养,分离得到的。然而,采用天然产物的分离技术,其工艺复杂,需要耗费较长的时间,并且不适合快速地开发相关的衍生物并考察其药效学活性。
在现有技术2中,李学臣等将在固相上合成的线性六肽与环五肽,通过Ser/Thr连接,得到Teixobactin。但该方法涉及液相合成方式,因此合成步骤较多,涉及多种保护基的脱保护。
在现有技术3中,Richard J.Payne等以HMPB-NovaPEG树脂为固相载体,选择碳端的D-Thr和氮端的Ala作为环化位点,先合成FmocSer(tBu)-D-Thr(OH)-Resin,然后在树枝上进行Alloc-Ile-OH与D-Thr的酯化,随后在Ser的氮端进行侧链延伸,然后在Ile的氮端依次连接L-allo-End、Ala,最后将线性肽从树脂上切割下来,进行液相关环,最终脱保护,得到Teixobactin。
在现有技术4中,Fernando Albericio等以2-Cl-Trt树脂为固相载体,将Teixobactin中的非天然氨基酸L-allo-End用L-Arg替代,选择碳端的Ala和氮段的Arg作为环化位点,先合成线性四肽FmocIle-Ser(tBu)-D-Thr(OH)-Ala-Resin,然后在树枝上进行Alloc-Ile-OH与D-Thr的酯化,酯化后脱掉Ile的Alloc保护基将Alloc-Arg(Pbf)-OH与Ile连接,随后脱掉侧链Ile的Fmoc保护基对其进行延伸,最后将线性肽从树脂上切割下来,进行液相关环,最终脱保护,得到Teixobactin的几个类似物。
在现有技术5中,Ishwar Singh等以2-Cl-Trt树脂为固相载体,将Teixobactin中非天然氨基酸L-allo-End用L-Arg替代,选择碳端的Ala和氮段的Arg作为环化位点,先将Teixobactin中成环的四个氨基酸连接在树脂上得到TrtArg(Pbf)-Ile-O-D-Thr(NH2)-Ala-Resin,然后在D-Thr的氮端进行侧链延伸,最后将线性肽从树脂上切割下来,进行液相关环,最终脱保护,得到Teixobactin的两个类似物。
然而现有技术3、4、5中,虽然通过Fmoc-固相合成策略能够高效地合成直链肽,然而这些合成策略中除了使用Fmoc和酸敏感的保护基外,还使用了Alloc保护基,合成过程中涉及Alloc保护的氨基酸的合成,现有技术5中还涉及保护基团的转变,使合成过程变得复杂。
在现有技术6中,James S.Nowick等以2-Cl-Trt树脂为固相载体,将Teixobactin中非天然氨基酸L-allo-End用L-Arg替代,选择碳端的Arg和氮段的Ile作为环化位点,先合成线性10肽BocN-Me-D-Phe-Ile-Ser(tBu)-D-Gln(Trt)-D-allo-Ile-Ile-Ser(tBu)-D-Thr(OH)-Ala-Arg(Pbf)-Resin,然后在树枝上进行Fmoc-Ile-OH与D-Thr的酯化,最后将线性肽从树脂上切割下来,进行液相关环,最终脱保护,得到Teixobactin的两个类似物。
在现有技术7中,D.Srinivasa Reddy通过液相合成方法合成了Teixobactin的四环片段。
现有技术7中,以液相合成方法合成了Teixobactin的四环片段,该方法合成步骤多,效率低。
技术实现要素:
为实现上述目的,本发明提供一种Teixobactin类似物的制备方法。该方法包括以下步骤:(1)通过固相策略合成环化前体;(2)用醋酸铜/吡啶处理树脂,滤除树脂后,粗产物用半制备液相色谱仪纯化,得到环化体;(3)在溶液中进行脱保护;(4)蒸除溶剂,用半制备液相色谱仪纯化,收集产物,冷冻干燥。
具体地,本发明提供了一种Teixobactin类似物的制备方法,其包括以下步骤:
1)在具有氨基的基团或肼基团的固相合成树脂上依次偶联6-12个(优选7、8、9、10或11个)氨基酸,得到直链肽AA1-AA2-……-AAn-1-AAn-固相合成树脂;其中,AAn-1选自侧链具有羟基的氨基酸;
2)AAn-1的侧链上缩合偶联2个氨基酸,得到前体AA1-AA2-……-AAn-1(OCOAAi-AAii)-AAn-固相合成树脂;
3)裂解固相合成树脂,并将AAii与AAn进行缩合偶联,获得环合产物;
可选地,4)脱除环合产物上的侧链保护基。
进一步地,步骤1)中的偶联包括以下步骤:
步骤A)脱除N末端氨基酸或固相合成树脂上的N基保护基;
步骤B)缩合偶联氨基酸;
可选地,步骤C)检测反应是否完全。
进一步地,步骤1)中偶联的氨基酸除AAn-1外,其余氨基酸为侧链被保护氨基酸。
本发明所用的N基保护基选自Fmoc、Z、Boc、Alloc中的一种或多种;N基保护基的脱除试剂选自弱碱性试剂,优选选自哌啶、乙二胺、吗啡啉中的一种或多种。
进一步地,步骤C)中检测反应完全的方法选自四氯苯醌法、茚三酮法、三硝基苯磺酸法中的一种或多种的组合。
本发明中氨基酸缩合偶联形成酰胺键所用的偶联活化剂选自HATU、DCC、DIC、HBTU、HOAt、HOBt、PyBOP、BTC中的一种或多种组合,将氨基酸转化成活泼中间体。
本发明所用的固相合成树脂选自肼树脂、TCP树脂以及切除树脂后末端为羧基的树脂。
进一步地,步骤2)中AAi的羧基与AAn-1的侧链羟基形成酯键。
进一步地,步骤2)中形成酯键的缩合剂选自DCC、DIC、HATU、HBTU、HOAt、HOBt、PyBOP、BTC中的一种或多种组合。
进一步地,步骤3)环化反应中AAii的氨基与An的羧基进行环化偶联形成酰胺键。
进一步地,步骤3)的环化方法为醋酸铜法、NBS法或空气加热法。
优选地,步骤3)的环化条件选自吡啶/醋酸铜。更优选在待环合物中加入无水DMF、吡啶和醋酸铜,共同反应至反应完全。
更优选地,环化反应完成后还包括将环化产物纯化的步骤。
步骤4)中,选择本领域常规的脱除氨基酸侧链保护的条件进行侧链保护基的脱除,优选为TFA、TIS、苯酚中的一种或多种的溶液;更优选为TFA/TIS/H2O,(v∶v∶v,95/2.5/2.5)。
优选地,步骤1)中AA1缩合至直链肽后不脱除N基保护基。
进一步地,AA1选自D-N-Me-Phe,或D-N-Me2-Phe。步骤1)中AA1偶联的方法为缩合偶联Fmoc-D-N-Me-Phe-OH,随后脱掉Fmoc,所得产物在CH3CN/H2O(3∶1)中溶胀后,加入NaBH3CN溶液,随后加入甲醛溶液,反应液的pH调至5-7,至反应完全;或
AA1偶联的方法为缩合偶联Boc-D-N-Me-Phe-OH,不脱除Boc保护直接进入步骤2),
本发明所采用的氨基酸选自甘氨酸、丙氨酸、丝氨酸、天冬氨酸、天冬酰胺、谷氨酸、谷氨酰胺、脯氨酸、精氨酸、组氨酸、酪氨酸、胱氨酸、赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、别异亮氨酸、亮氨酸、缬氨酸、N-Me-Phe、N-Me2-Phe。优选地,上述氨基酸为L构型或D构型。
本发明另一方面提供了一种Teixobactin类似物,其结构如式I或2所示。
其中,A选自-N(CH3)2、-NHCH3或-NH2;
R1、R4、R7或R10独立地选自-H、-CH3、-CH-(CH3)2、-CH2-CH(CH3)2、-CH(CH3)-CH2-CH3、-CH2-C6H5、-CH2-C6H4-OH、-CH2-COOH、-CH2-CONH2、-(CH2)2-COOH、-(CH2)2-CONH2、(CH2)4-NH2、-(CH2)-S-CH3、-CH2-OH、CH(CH3)-OH、CH2-SH、
优选地,R1选自-CH2-C6H5,-CH2-C6H4-OH、-CH2-CH(CH3)2、-CH(CH3)-CH2-CH3中的一种,
R4选自-CH2-CONH2、-(CH2)2-CONH2、(CH2)4-NH2、中的一种,
R7选自-CH2-OH、-H、-CH3、-CH2-C6H4-OH、-CH2-C6H4-OH中的一种,
R10选自-(CH2)2-CONH2、-CH2-CONH2、(CH2)4-NH2、中的一种。
更优选为如式1a-1i所示。
本发明再一个方面提供了前述所示Teixobactin类似物在抑制微生物的药物中的用途;所述微生物优选为细菌、真菌或病毒;更优选为细菌。
本发明能够以简单廉价的氨基酸为原料,简单、快速的制备该类化合物,并且采用肼树脂作为固相载体,能够在树脂上直接关环得到环化产物,减少合成步骤;并且该方法能够用于放大生产,提供足量的化合物以供相关的药效学、药代学研究,以及未来在抗菌药物方面的应用。
附图说明
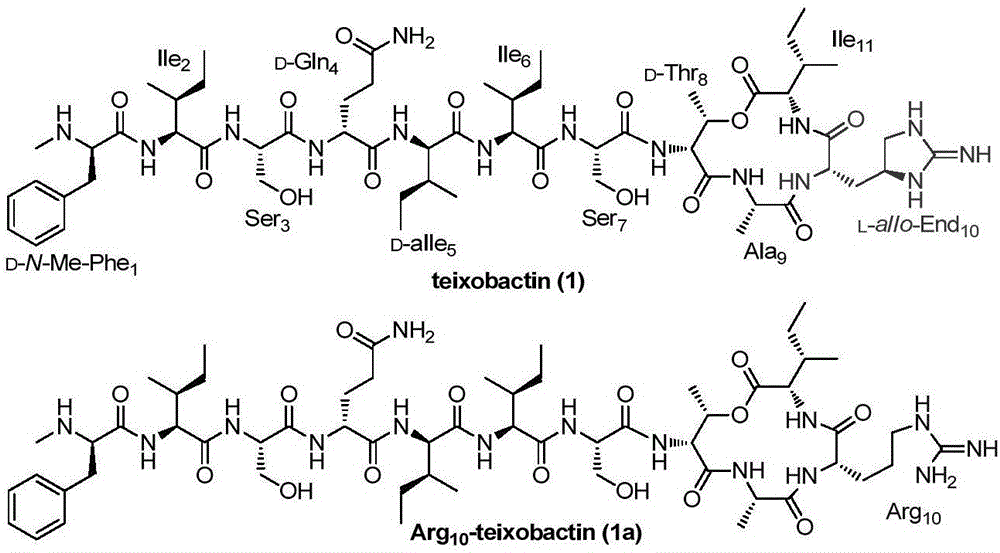
图1:Teixobactin和Arg10-teixobactin(1a)的结构示意图;
图2:Arg10-teixobactin(1a)的1H-NMR图;
图3:Arg10-teixobactin(1a)的HRMS图;
图4:Lys10-teixobactin(1b)的1H-NMR图;
图5:Lys10-teixobactin(1b)的HRMS图;
图6:His10-teixobactin(1c)的1H-NMR图;
图7:His10-teixobactin(1c)的HRMS图;
图8:Ala7-Arg10-teixobactin(1d)的1H-NMR图;
图9:Ala7-Arg10-teixobactin(1d)的HRMS图;
图10:D-Asn4-Arg10-teixobactin(1e)的1H-NMR图;
图11:D-Asn4-Arg10-teixobactin(1e)的HRMS图;
图12:D-Arg4-Arg10-teixobactin(1f)的1H-NMR图;
图13:D-Arg4-Arg10-teixobactin(1f)的HRMS图;
图14:D-Phe1-Arg10-teixobactin(1g)的1H-NMR图;
图15:D-Phe1-Arg10-teixobactin(1g)的HRMS图;
图16:D-Me2Phe1-Arg10-teixobactin(1h)的1H-NMR图;
图17:D-Me2Phe1-Arg10-teixobactin(1h)的HRMS图;
图18:D-Tyr1-Arg10-teixobactin(1i)的1H-NMR图;
图19:D-Tyr1-Arg10-teixobactin(1i)的HRMS图。
具体实施方式
实施例1化合物1a的制备方法
(1)直链肽的制备:
于一个50mL的固相反应器中加入肼树脂(0.61mmol/g,800mg,0.488mmol)及CH2Cl2(3ml),溶胀树脂30min。抽除CH2Cl2,用20%哌啶/DMF溶液(3ml)脱除Fmoc保护基,10min后,用DMF(4x3mL)洗涤树脂,再用无水DMF(2x3mL)洗涤树脂,备用。同时将Fmoc-Ala-OH((76mg,0.244mmol)和HATU(91mg,0.23mmol)溶于无水DMF(2ml),向该溶液中加入DIEA(120μL,0.732mmol),混匀,将该反应液转移到脱除Fmoc的肼树脂中,N2鼓泡混匀,缩合反应2h。抽除反应液,用DMF(4x3mL)洗涤树脂,再用无水DMF(3mL)洗涤树脂。向树脂中加入特戊酸酐(186μL,0.96mmol)和DIEA(500μL,2.88mmol)的DMF(2mL)溶液,反应15min,抽除反应液,用DMF(4x3mL)洗涤树脂,得到树脂的取代度为0.30mmol/g(800mg,0.24mmol,1eq.)。
随后以缩合方式(步骤A-D)依次偶联D-Thr、Ser(tBu)、Ile、D-allo-Ile、D-Gln(Trt)、Ser(tBu)、Ile、Boc-D-N-Me-Phe,获得直链肽:Boc-D-N-Me-Phe-Ile-Ser(tBu)-D-Gln(Trt)–D-alle-Ile-Ser(tBu)-D-Thr-Ala固相合成树脂。
步骤A:Fmoc脱保护
20%哌啶/DMF溶液(3ml)加入树脂中,鼓气5min,抽去溶剂,再加入20%哌啶/DMF溶液(3ml)加入树,鼓气5min,抽去溶剂,用DMF(4x3mL)洗涤树脂,再用无水DMF(2x3mL)洗涤树脂。
步骤B:氨基酸的偶联
Fmoc-Xaa-OH(或Boc-D-N-Me-Phe-OH)(4.0eq.)和HATU(4.0eq.)溶于无水DMF(2ml),向该溶液中加入DIEA(12eq.),混匀,将该反应液转移到脱除Fmoc的肼树脂中,N2鼓泡混匀,缩合反应0.5h(茚三酮试剂检测至反应完全)。抽除反应液,用DMF(4x3mL)洗涤树脂。
步骤C:茚三酮检测
偶联反应时,取出少量树脂,DMF洗两遍,加入两滴茚三酮检测液(茚三酮15g,乙酸3ml,正丁醇100ml),90℃加热3min,树脂不发生颜色变化表明反应完全。树脂变蓝表明存在初级氨。
步骤D:四氯苯醌检测
取出少量树脂,DMF洗两遍,加入两滴2%乙醛/DMF溶液和两滴2%四氯苯醌/DMF溶液,室温保持5min,树脂由绿变蓝表明存在二级氨。
(2)前体的制备:
Fmoc-Ile-OH与步骤1所得直链肽酯化:将Fmoc-Ile-OH(20eq.)溶于CH2Cl2/DMF(2ml,v/v:1∶1),加入DCC(10eq.),冰浴下搅拌1h,然后在室温搅拌反应1h。将直链肽2转入EP管中,将反应液离心去除沉淀,将上清加入到直链肽2中,加入DMAP(10eq.),振荡反应,缩合反应2h。抽除反应液,用DMF(4x3mL)洗涤树脂,再用无水DMF(2x3mL)洗涤树脂。该过程重复一次。获得Boc-D-N-Me-Phe-Ile-Ser(tBu)-D-Gln(Trt)-D-alle-Ile-Ser(tBu)-D-Thr(O-CO-Ile-N-Fmoc)-Ala固相合成树脂。
酯化后,Fmoc-Arg(Pbf)-OH(4.0eq.)和HATU(4.0eq.)溶于无水DMF(2ml),向该溶液中加入DIEA(12eq.),混匀,将该反应液转移到前步获得的脱除Fmoc的Boc-D-N-Me-Phe-Ile-Ser(tBu)-D-Gln(Trt)-D-alle-Ile-Ser(tBu)-D-Thr(O-CO-Ile-NH2)-Ala固相合成树脂,N2鼓泡混匀,缩合反应0.5h(茚三酮试剂检测至反应完全)。抽除反应液,用DMF(4x3mL)洗涤树脂,获得前体3。
(3)环化
用CH2Cl2(2x3ml)洗涤树脂,抽除CH2Cl2,树脂中加入无水DMF,吡啶,醋酸铜,过夜震荡,然后用半制备型HPLC纯化,收集产物,冷冻干燥,得到环化产物。
(4)终产物Arg10-teixobactin的制备
将TFA/TIS/H2O,95/2.5/2.5加入得到的环化产物中,搅拌1h,然后用半制备型HPLC纯化,收集产物,冷冻干燥,得到化合物1a(Arg10-teixobactin)。
1H NMR(DMSO-d6,400MHz):δ0.52-0.66(m,6H),0.66-0.92(m,19H),0.99-1.23(m,7H),1.24-1.60(m,9H),1.60-1.96(m,7H),2.01-2.14(m,2H),2.46(s,3H),2.90-3.01(m,1H),3.05-3.20(m,4H),3.50-3.80(m,4H),3.89-3.98(m,1H),3.98-4.07(m,1H),4.10-4.24(m,3H),4.24-4.44(m,5H),4.52-4.65(s,1H),4.92-5.08(m,1H),5.20-5.43(m,2H),6.71-6.86(s,1H),7.13-7.38(m,5H),7.50-7.80(m,6H),7.82-8.15(m,5H),8.40-8.55(m,2H),8.89-9.17(m,2H)ppm;
HRMS(ESI)m/z:calcd for C58H98N15O15[M+H]+1244.7367,found 1244.7368.
实施例2化合物1b的制备方法
实施例2的制备方法与实施例1相同,区别仅在于在第2步中,以Fmoc-Lys(Boc)-OH替换Fmoc-Arg(Pbf)-OH。其他步骤相同。
Lys10-teixobactin(1b):1H NMR(DMSO-d6,400MHz):δ0.52-0.64(m,6H),0.68-0.97(m,19H),0.97-1.20(m,7H),1.20-1.47(m,8H),1.47-1.95(m,10H),1.95-2.19(m,2H),2.46(s,3H),2.62-2.89(m,2H),2.89-3.01(m,1H),3.02-3.18(m,1H),3.49-3.78(m,4H),3.87-4.08(m,2H),4.08-4.50(m,9H),4.50-4.70(s,1H),4.87-5.13(s,1H),5.20-5.45(m,2H),6.70-6.88(s,1H),7.11-7.38(m,5H),7.50-7.85(m,6H),7.88-8.20(m,5H),8.30-8.59(m,2H),8.92-9.30(m,2H)ppm;HRMS(ESI)m/z:calcd for C58H98N13O15[M+H]+1216.7305,found 1216.7280.
实施例3化合物1c的制备方法
实施例3的制备方法与实施例1相同,区别仅在于在第2步中,以Fmoc-His(Trt)-OH替换Fmoc-Arg(Pbf)-OH。其他步骤相同。
His10-teixobactin(1c):1H NMR(DMSO-d6,400MHz):δ0.50-0.69(m,6H),0.69-0.91(m,16H),0.95-1.35(m,11H),1.35-1.59(m,3H),1.61-2.00(m,5H),1.95-2.20(m,2H),2.46(s,3H),2.90-3.20(m,4H),3.49-3.77(m,5H),3.82-3.92(m,1H),3.95-4.03(m,1H),4.09-4.28(m,3H),4.28-4.43(m,3H),4.51-4.78(m,2H),4.90-5.10(m,1H),5.15-5.40(m,2H),6.71-6.85(m,1H),7.15-7.37(m,5H),7.70-7.90(m,2H),7.90-8.19(m,5H),8.32-8.57(m,2H),8.87-8.79(s,1H)ppm;HRMS(ESI)m/z:calcd for C58H92N14O15[M+H]+1225.6945,found 1225.6944.
实施例4化合物1d的制备方法
实施例4的制备方法与实施例1相同,区别仅在于在第1步中,将第一个偶联的Fmoc-Ser(tBu)-OH替换为Fmoc-Ala-OH。其他步骤相同。
Ala7-Arg10-teixobactin(1d):1H NMR(DMSO-d6,400MHz):δ0.65-0.88(m,7H),0.88-1.05(m,16H),1.05-1.42(m,11H),1.40-1.76(m,12H),1.76-2.24(m,9H),2.27-2.39(m,2H),2.69(s,3H),3.05-3.15(m,1H),3.17-3.30(m,3H),3.70-3.87(m,2H),4.00-4.34(m,8H),4.37-4.47(m,2H),4.49-4.60(m,1H),4.71-4.85(m,1H),5.52-5.62(m,1H),7.73-7.61(m,5H),8.09-8.30(m,3H),8.35-8.54(m,3H)ppm;HRMS(ESI)m/z:calcd for C58H98N15O114[M+H]+1228.7418,found 1228.7411.
实施例5化合物1e的制备方法
实施例5的制备方法与实施例1相同,区别仅在于在第1步中,以Fmoc-D-Asn(Trt)-OH替换Fmoc-D-Gln(Trt)-OH。其他步骤相同。
D-Asn4-Arg10-teixobactin(1e):1H NMR(DMSO-d6,400MHz):δ0.58-0.67(m,7H),0.67-0.90(m,21H),0.99-1.20(m,8H),1.20-1.30(m,2H),1.30-1.60(m,11H),1.65-1.89(m,5H),2.30-2.62(m,10H),2.85-3.02(m,1H),3.02-3.21(m,4H),3.48-3.62(m,2H),3.62-3.79(m,2H),3.85-4.00(m,1H),4.00-4.10(m,1H),4.10-4.26(m,3H),4.26-4.40(m,4H),4.50-4.67(m,1H),4.82-5.10(s,1H),5.18-5.40(m,2H),6.75-6.69(s,2H),7.19-7.37(m,5H),7.40-7.59(m,2H),7.60-7.69(m,2H),7.69-7.80(m,1H),7.95-8.30(m,4H),8.35-8.60(m,2H),8.90-9.25(m,2H)ppm;HRMS(ESI)m/z:calcd for C57H96N15O15[M+H]+1230.7210,found 1230.7219.
实施例6化合物1f的制备方法
实施例6的制备方法与实施例1相同,区别仅在于在第1步中,以Fmoc-D-Arg(Pbf)-OH替换Fmoc-D-Gln(Trt)-OH。其他步骤相同。
D-Arg4-Arg10-teixobactin(1f):1H NMR(DMSO-d6,400MHz):δ0.52-0.69(m,6H),0.74-0.91(m,19H),0.95-1.20(m,7H),1.25-1.59(m,12H),1.59-1.73(m,3H),1.73-1.90(m,3H),2.46(s,3H),2.90-3.00(m,1H),3.00-3.20(m,5H),3.50-3.62(m,2H),3.62-3.80(m,2H),3.83-3.99(m,1H),3.99-4.10(m,1H),4.10-4.42(m,8H),4.55-4.65(m,1H),4.95-5.07(br s,1H),5.20-5.45(m,2H),6.73-7.11(m,4H),7.11-7.38(m,5H),7.50-7.66(m,2H),7.70-7.82(m,2H),7.90-8.05(m,2H),8.05-8.55(m,3H),8.92-9.25(m,1H)ppm;HRMS(ESI)m/z:calcd for C59H102N17O14[M+H]+1272.7792,found 1272.7782.
实施例7化合物1g的制备方法
实施例7的制备方法与实施例1相同,区别仅在于在第1步中,以Boc-D-Phe-OH替换Boc-D-N-Me-Phe-OH。其他步骤相同。
D-Phe1-Arg10-teixobactin(1g):1H NMR(DMSO-d6,400MHz):δ0.60-0.80(m,23H),1.00-1.55(m,18H),1.55-1.91(m,9H),1.95-2.16(m,3H),2.87-3.20(m,6H),3.50-3.83(m,8H),3.90-4.07(m,2H),4.11-4.40(m,8H),4.50-4.68(s,1H),4.97-5.08(m,1H),5.19-5.40(m,2H),6.74-6.90(s,2H),7.20-7.40(m,6H),7.54-7.85(m,4H),7.88-8.30(m,8H),8.38-8.48(s,1H),8.50-8.60(d,1H)pm;HRMS(ESI)m/z:calcd for C57H96N15O15[M+H]+1230.7210,found 1230.7190.
实施例8化合物1h的制备方法
实施例8的制备方法与实施例1相同,区别在于在第1步中,以Fmoc-D-N-Me-Phe-OH替换Boc-D-N-Me-Phe-OH。Fmoc-D-N-Me-Phe-OH偶联至树脂后,脱除Fmoc,直肽链D-N-Me-Phe-Ile-Ser(tBu)-D-Gln(Trt)–D-alle-Ile-Ser(tBu)-D-Thr(OH)-Ala-固相合成树脂在CH3CN/H2O(3∶1)中溶胀15min,抽去溶剂,加入NaBH3CN(302mg,4.8mmol,20eq.)的CH3CN/H2O溶液(3∶1,2ml),随后加入30%的甲醛溶液(1.5ml,12mmol,50eq.),反应液的pH至用乙酸调至5-7,反应1-2h,直至四氯苯醌检测呈阴性,得到D-N-Me2-Phe-Ile-Ser(tBu)–D-Gln(Trt)–D-alle-Ile-Ser(tBu)-D-Thr(OH)-Ala-固相合成树脂。其余步骤与制备1a的方法相同。
D-Me2Phe1-Arg10-teixobactin(1h):1H NMR(DMSO-d6,400MHz):δ0.42-0.70(m,7H),0.70-0.98(m,20H),1.00-1.20(m,8H),1.20-1.55(m,2H),1.55-1.90(m,3H),1.95-2.17(m,3H),2.67-3.04(m,2H),3.04-3.20(m,4H),3.47-3.80(m,10H),3.88-4.09(m,1H),4.09-4.40(m,4H),4.50-4.66(s,2H),4.90-5.04(s,2H),5.15-5.41(m,1H),6.70-6.95(s,1H),7.10-7.37(m,3H),7.50-7.81(m,4H),7.84-8.18(m,1H),8.32-8.58(s,1H),10.03-10.32(d,2H)ppm;HRMS(ESI)m/z:calcd for C59H100N15O15[M+H]+1258.7523,found 1258.7512.
实施例9化合物1i的制备方法
实施例9的制备方法与实施例1相同,区别仅在于在第1步中,将偶联Boc-D-N-Me-Phe的步骤替换为偶联Boc-D-Tyr(tBu)-OH,其他步骤相同。
D-Tyr1-Arg10-teixobactin(1i):1H NMR(DMSO-d6,400MHz):δ0.70-0.95(m,24H),1.02-1.20(m,6H),1.20-1.56(m,11H),1.56-1.95(m,9H),1.96-2.17(m,3H),2.73-2.89(m,1.5H),2.89-3.00(m,1.5H),3.06-3.20(m,3H),3.50-3.80(m,5H),3.90-4.15(m,3H),4.15-4.23(m,1H),4.23-4.42(m,6H),4.50-4.65(s,1H),4.92-5.08(s,1H),5.15-5.40(m,2H),6.63-6.78(d,2H),6.78-6.84(s,1H),7.03-7.12(d,3H),7.20-7.30(s,2H),7.55-7.83(m,5H),7.90-8.15(m,7H),8.15-8.29(d,1H),8.38-8.49(s,1H),8.49-8.57(d,1H),9.31-9.40(s,1H)ppm;HRMS(ESI)m/z:calcd for C57H96N15O16[M+H]+1246.7159,found 1246.7161.
实施例10抑菌试验
以Meropenem对革兰氏阳性菌Bacillus subtilis ATCC 6633的抑制活性作为阳性对照(最小抑制浓度为0.25μg/ml),Teixobactin类似物Arg10-teixobactin(1a)、Lys10-teixobactin(1b)、His10-teixobactin(1c)、Ala7-Arg10-teixobactin(1d)、D-Asn4-Arg10-teixobactin(1e)、D-Arg4-Arg10-teixobactin(1f)、D-Phe1-Arg10-teixobactin(1g)、D-Me2Phe1-Arg10-teixobactin(1h)对革兰氏阳性菌Staphylococcus aureus ATCC 29213的最小抑制浓度分别为2,2,8,32,2,2,2,32μg/ml,对Bacillus subtilis ATCC 6633的最小抑制浓度分别为0.25,0.5,2,8、0.5、1、0.5、8μg/ml。而这些类似物对革兰氏阴性菌Escherichiacoli ATCC 25922几乎没有抑制活性。而D-Tyr1-Arg10-teixobactin(1i)对革兰氏阳性菌或革兰氏阴性菌均没有抑制活性。
- 还没有人留言评论。精彩留言会获得点赞!
- 应用于水稻白叶枯病菌检测的探针和引物序列的制作方法
- 转Xa21基因水稻或其制品检测用引物和探针、试剂盒及方法
- 水稻细胞色素p450基因专用引物辅助鉴别植物培养基质中除草剂的残留的制作方法
- 水稻细胞色素p450基因专用引物辅助鉴定植物培养基质中除草剂的残留的制作方法
- 水稻细胞色素p450基因引物辅助鉴定植物培养基质中除草剂的残留的制作方法
- 水稻细胞色素p450基因引物辅助鉴别植物培养基质中除草剂残留的制作方法
- 水稻细胞色素p450基因引物辅助鉴别植物培养基质中除草剂的残留的制作方法
- 用于鉴别水稻籼亚种生态型的引物组合物及其应用的制作方法
- 用于鉴别水稻粳亚种生态型的引物组合物及其应用的制作方法
- 检测水稻香味等位基因的分子标记的引物和方法